Способ получения средства, обладающего тиреотропной активностью
Иллюстрации
Показать всеИзобретение относится к способу получения средства, обладающего тиреотропной активностью. Указанный способ характеризуется тем, что проводят трехкратную экстракцию растительного материала при температуре 70°C при отношении 1 мас. ч. сырья: 5 об. ч экстрагента. При этом первую и вторую экстракцию выполняют 50%-ным спиртом этиловым в течение 60 мин, а третью экстракцию – водой, очищенной в течение 30 минут, затем объединенные извлечения фильтруют, упаривают, очищают сепарированием, доупаривают и высушивают в вакуум-сушильном аппарате. В качестве растительного материала используют компоненты в соотношении, мас. ч.: корневища и корни лапчатки белой - 50, плоды боярышника - 15, корневища с корнями валерианы - 35, измельченные до 2 мм. Изобретение обеспечивает более высокий выход экстрактивных веществ и более выраженную тиреотропную активность полученного средства по сравнению с аналогом. 11 табл., 1 пр.
Реферат
Изобретение относится к области фармации и касается способа получения средства, обладающего тиреотропной активностью.
Фармакотерапия заболеваний щитовидной железы в настоящее время является актуальной проблемой медицинской науки и практического здравоохранения. В наибольшей степени на частоту тиреоидной патологии влияет потребление йода населением. Значительная часть населения России проживает на территориях с недостатком йода в почве, воде, воздухе, продуктах питания и др. [2, 9, 13].
По данным ВОЗ заболеваниями щитовидной железы страдает более 200 млн. человек. За последние 5 лет абсолютный прирост числа вновь выявленных заболеваний в экономически развитых странах составил 51,8% среди женщин и 16,7% среди мужчин. Также идет тенденция увеличения числа больных не только с доброкачественными узловыми образованиями или нарушениями функции щитовидной железы, но и злокачественными опухолями. При этом в эндемичных по зобу регионах, где проживает около одной третьей населения, эти показатели превышают 50%. Консервативное лечение, связанное с применением тиреостатических препаратов, способствует неуправляемому течению заболевания с периодами спонтанных ремиссий и рецидивов, а также сопровождается высокой частотой развития побочных эффектов. Поэтому средства растительного происхождения, обладающие полифункциональностью фармакологического действия, одновременно воздействующие на все напряженные и нарушенные звенья метаболизма, наилучшим образом относятся к перспективным лекарственным средствам [8].
Разработан способ получения экстракта сухого из растительной трехкомпонентной композиции, содержащей корневища с корнями лапчатки белой, плодов боярышника, корневищ с корнями валерианы.
Ранее исследовалась тиреотропная активность средства «Тиреонорм», также состоящего из,мас.ч.: корневищ и корней лапчатки белой - 50, плодов боярышника -15, корневищ с корнями валерианы - 35 при экспериментальном гипертиреозе. Сухой экстракт получали путем трехкратной экстракции 40% спиртом этиловым, с последующей фильтрацией и сушкой в вакуумно-сушильном шкафу при температуре 50-60 градусов. Этот препарат получен без учета максимального извлечения биологически активных веществ [3].
Задачей данного технического решения является разработка способа получения фитопрепарата из данной композиции с более выраженной тиреотропной активностью за счет повышении выхода экстрактивных веществ, биологически активных веществ.
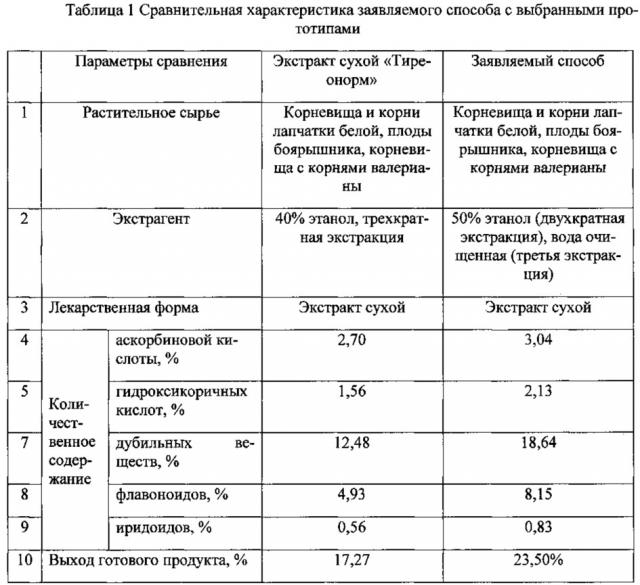
Технический результат достигается тем, что растительный материал, измельченный до 2 мм, экстрагируют трехкратно при отношении 1 мас. ч. сырья : 5 об. ч экстрагента, первый и второй контакты фаз 50%-ным этиловым спиртом в течение 60 мин, третий контакт фаз водой очищенной в течение 30 минут, далее объединенные извлечения фильтруют, упаривают, очищают сепарированием, доупаривают, затем высушивают в вакуум-сушильном аппарате. Исходная растительная композиция содержит следующие компоненты в соотношении, мас. ч: корневища и корни лапчатки белой - 50, плоды боярышника - 15, корневища с корнями валерианы - 35. Выход готового продукта составляет 23,50% от массы растительного материала. Предложенный способ получения позволяет получить конечный продукт постоянного состава, содержащий наибольшее количество биологически активных веществ (табл. 1). Полученное нами средство представляет собой аморфный порошок коричневого цвета со специфическим запахом, потеря в массе при высушивании не более 4%, обладающее выраженной тиреотропной активностью.
Изучен качественный химический состав заявленного средства на наличие следующих биологически активных веществ [4].
Дубильные вещества:
1) Реакция на дубильные вещества с 1%-ным раствором желатина. К 2-3 мл водно-спиртового раствора экстракта прибавляем 2 мл 1%-ного раствора желатина в 10%-ном растворе натрия хлорида. Появляется хлопьевидный осадок, растворимый в избытке желатина;
2) Реакция с 10%-ным раствором среднего ацетата свинца (одновременно добавляют 10%-ный раствор уксусной кислоты). Образуется белый осадок, не растворимый в уксусной кислоте, который доказывает присутствие дубильных веществ гидролизуемой группы;
3) Реакция с железоаммонийными квасцами. Появляется черно-синее окрашивание, свидетельствующее о наличие дубильных веществ гидролизуемой группы.
Флавоноиды:
1) Цианидиновая проба (проба Синода): к водно-спиртовому раствору экстракта добавляют несколько капель концентрируемой хлористоводородной кислоты и 20-30 мг порошка магния. Появлялось желто-оранжевое окрашивание.
2) С 1-2%-ным спиртовым раствором алюминия хлорида появляется желтое или желто-зеленое окрашивание.
Углеводы:
1) Реакция Молиша. В пробирку берут 1 мл водно-спиртового раствора заявленного средства, добавляют 2 капли 10%-ного спиртового раствора α-нафтола и по стенке пробирки приливают осторожно, без встряхивания, 2 мл концентрированной серной кислоты. Серная кислота опускается на дно пробирки, и на границе двух жидкостей образуется кольцо красно-фиолетового цвета.
2) Нафторезорциновая проба (проба Толленса): к 5-6 мл водно-спиртового раствора экстракта прибавляют 1 мл 1%-ного спиртового раствора нафторезорцина и 1 мл концентрированной соляной кислоты. Смесь осторожно нагревают до кипения и кипятят 1 мин. Охлаждают и взбалтывают с эфиром. Эфирный слой окрашивается в фиолетовый цвет.
Аминокислоты:
Реакция с нингидрином: к 1-2 мл водно-спиртового раствора экстракта приливают 3-4 капли 1%-ного раствора нингидрина в 95%-ном растворе ацетона. Раствор перемешивают и ставят в водяную баню при 70°C на несколько минут, появляется сине-фиолетовое окрашивание.
Аскорбиновая кислота:
Реакция с раствором 2,6-дихлорфенолиндофенолятом натрия. К 1 мл водно-спиртового раствора экстракта прибавляют 1 мл 0,02%-ного раствора 2,6-дихлорфенолиндофенол. Происходит обесцвечивание раствора.
Сапонины:
Готовят водный раствор экстракта (1:10).
1) Взяли 2 пробирки, в одну из них налили 5 мл 0,1 н. хлористоводородной кислоты, в другую - 0,1н. едкого натра. Затем в обе пробирки добавили по 2-3 капли водного раствора экстракта, затем сильно встряхивали, в обеих пробирках образовалась пена, равная по объему и стойкости (сапонины тритерпенового типа).
2) К 2 мл водного настоя прибавили капель среднего ацетата свинца, образовался осадок.
Количественное определение биологически активных веществ в заявленном экстракте сухом «Тиреонорме».
Определение содержания кислоты аскорбиновой
Около 0,15 (точная навеска) экстракта сухого помещали в мерную колбу вместимостью 50 мл, прибавляли 30 мл воды очищенной и встряхивали до растворения экстракта, затем доводили водой очищенной до метки. Содержимое колбы фильтровали через бумажный фильтр в сухую колбу, отбрасывая первые 10 мл фильтрата (раствор А).
1 мл раствора A помещают в колбу для титрования вместимостью 50 мл, прибавляют 1 мл 2% раствора соляной кислоты, 25 мл воды очищенной и титруют из пипетки свежеприготовленным 0,001 М раствором 2,6-дихлорфенолиндофенолята натрия до появления слабо-розового окрашивания, устойчивого в течение 60 с. Содержание аскорбиновой кислоты в % вычисляют по формуле:
где 0,000088 - количество аскорбиновой кислоты, соответствующее 1 мл раствора 2,6-дихлорфенолиндофенолята натрия (0,01 моль/л), г; V - объем раствора 2,6-дихлорфенолиндофенолята натрия (0,001 моль/л), пошедшего на титрование, мл; а - масса навески, г; W - потеря в массе при высушивании, % [12].
Содержание аскорбиновой кислоты в заявленном экстракте сухом составляет 3,04%.
Определение содержания суммы гидроксикоричных кислот
Около 0.015 г (точная навеска) экстракта сухого помещали в колбу со шлифом вместимостью 100 мл, прибавляли 60 мл 70% спирта этилового и встряхивали до растворения экстракта, затем доводили до метки 70% спиртом этиловым.
2 мл полученного раствора помещали в мерную колбу вместимостью 25 мл. Объем раствора доводили 96% спиртом до метки. Оптическую плотность полученного раствора измеряли на спектрофотометре при длине волны 328±2 нм в кювете с толщиной слоя 10 мм относительно 96% этанола.
Содержание суммы гидроксикоричных кислот в процентах (X) в пересчете на кислоту хлорогеновую и абсолютно сухое сырье вычисляли по формуле:
,
где
Ax - оптическая плотность испытуемого раствора; a - масса навески, г; W - влажность, %.
Содержание суммы гидроксикоричных кислот в заявленном экстракте сухом составляет 2,13% [12].
Определение содержания дубильных веществ
Около 0,15 г (точная навеска) экстракта сухого помещали в мерную колбу вместимостью 100 мл, прибавляли 50 мл 40% спирта этилового и взбалтывали до растворения экстракта. Объем раствора доводили 40% спиртом этиловым до метки (раствор А).
5 мл раствора A помещали в мерную колбу вместимостью 50 мл, и объем раствора доводили до метки спиртом этиловым 70% и перемешивали (раствор Б).
Оптическую плотность раствора Б измеряли на спектрофотометре при длине волны 276 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали 70% спирт этиловый. Параллельно измеряли оптическую плотность раствора РСО кислоты галловой.
Приготовление РСО кислоты галловой
Около 0,05 г (точная навеска) кислоты галловой помещали в мерную колбу вместимостью 100 мл, прибавляли 50 мл 70% спирта этилового и перемешивали до растворения, затем объем раствора доводили до метки 70% спиртом этиловым. 2 мл полученного раствора помещали в мерную колбу вместимостью 100 мл и доводили объем раствора тем же растворителем до метки.
Содержание дубильных веществ в пересчете на кислоту галловую и абсолютно сухое сырье в процентах (X) вычисляли по формуле:
,
D - оптическая плотность испытуемого раствора; D0 - оптическая плотность раствора CO кислоты галловой; m - масса навески, г; m0 - масса навески CO кислоты галловой, г; W - влажность, % [10].
Содержание дубильных веществ в заявленном средстве составляет 18,64%.
Определение содержания флавоноидов
Около 0,15 г (точная навеска) экстракта сухого помещали в мерную колбу вместимостью 100 мл, прибавляли 50 мл 40% спирта этилового и встряхивали до растворения экстракта, добавляли 40% спирт этиловый до метки.
2 мл полученного раствора помещали в мерную колбу вместимостью 25 мл, прибавляли 2 мл 3% спиртовой раствор алюминия хлорида и доводили объем раствора до метки 40% спиртом (раствор А). В качестве раствора сравнения использовали раствор, приготовленный в тех же условиях, но без добавления алюминия хлорида (раствор сравнения А). Измерения оптической плотности проводили на спектрофотометре при длине волны 400 нм, через 30 мин после приготовления всех растворов.
Параллельно измеряем оптическую плотность раствора ГСО лютеолин-7-гликозид. Раствор ГСО лютеолин-7-гликозид готовили по следующей методике: около 0,0025 г (точная навеска) лютеолин-7-гликозида помещали в мерную колбу на 50 мл, растворяли в 30 мл 40% спирта при нагревании на водяной бане. После охлаждения до комнатной температуры доводили объем 40% спиртом этиловым до метки (раствор A лютеолин-7-гликозид). 1 мл раствора A лютеолин-7-гликозид помещали в мерную колбу на 25 мл, прибавляли 1 мл 3% спиртового раствора алюминия хлорид и доводили объем раствора 40% спиртом (испытуемый раствор Б лютеолин-7-гликозид). В качестве раствора сравнения использовали раствор, состоящий из 1 мл раствора лютеолин-7-гликозид, помещенный в мерную колбу на 25 мл и доведенный 40% спиртом до метки (раствор сравнения Б лютеолин-7-гликозид).
Содержание суммы флавоноидов в пересчете на лютеолин-7-гликозид и абсолютно сухое сырье в % (X) вычисляли по формуле:
,
D - оптическая плотность испытуемого раствора; Do - оптическая плотность раствора ГСО лютеолин-7-гликозид; mo - масса ГСО лютеолин-7-гликозид, г; m - масса новески, г; W - влажность, % [5].
Содержание суммы флавоноидов в пересчете на лютеолин-7-гликозид в заявленном экстракте сухом составляло 8,15%.
Определение содержания иридоидов
Около 0,15 г (точная навеска) экстракта сухого помещали в мерную колбу объемом 100 мл, прибавляли 40 мл смеси хлороформ - этанол 95% (5:1), закрывали пробкой и взбалтывали на вибрационном аппарате в течение 45 мин.
20 мл полученного раствора помещали в колбу объемом 100 мл, прибавляли 10 мл воды и упаривали под вакуумом при температуре 40-50°C до водного остатка. Водный раствор фильтровали через бумажный фильтр, смоченный водой, в мерную колбу вместимостью 10 мл, при необходимости доводили объем раствора до метки, перемешивали (раствор А).
5 мл раствора A переносили в мерную колбу вместимостью 25 мл, прибавляли 5 мл щелочного раствора гидроксиламина и оставляли на 20 мин. Через 20 мин добавляли 10 мл 1 М раствора кислоты хлороводородной и 5 мл 1% раствора хлорида железа (III) в 0,1 М растворе хлороводородной кислоты, перемешивали (раствор Б).
После перемешивания измеряли оптическую плотность раствора Б на спектрофотометре при длине волны 512 нм в кювете с толщиной слоя 1 см.
В качестве раствора сравнения использовали смесь из 5 мл раствора A, 5 мл воды, 10 мл 1 М раствора кислоты хлороводородной и 5 мл 1% раствора хлорида окисного железа в 0,1 М растворе хлороводородной (X) кислоты.
Содержание суммы иридоидов в пересчете на гарпагид и абсолютно сухое сырье (в %) вычисляли по формуле
,
где A - оптическая плотность испытуемого раствора; m - масса навески, г; W - влажность, %; 56 - удельный показатель поглощения продуктов реакции гарпагида с гидроксиламином и хлоридом железа (III) [5].
Содержание иридоидов в заявленном экстракте сухом 0,36%. Предлагаемый способ получения достаточно прост, не требует сложной схемы очистки, позволяет получить продукт постоянного состава. Технология получения может быть внедрена на предприятиях по выпуску лекарственных препаратов.
Изучены влияние состава и природы экстрагента, его соотношение с сырьем, температурного режима, степени измельчения сырья, продолжительности и кратности числа экстракций на выход экстрактивных веществ из исследуемого растительного сбора. Количественная оценка велась по методике Государственной фармакопеи 13 изд. [16].
Подбор оптимального экстрагента является одним из основных моментов при получении извлечений. Для подбора типа экстрагента изучены процессы экстрагирования сырья водой, этиловым спиртом различной концентрации: 20, 40, 50, 60, 70, 95 (Табл. 2).
Как видно из таблицы 1, вода очищенная и 50%-ный спирт этиловый являются экстрагентами, извлекающими больше экстрактивных веществ.
Известно, что размер частиц сырья обуславливает полноту и скорость перехода в раствор экстрагируемых веществ. Растительная смесь представляет собой порошок неоднородных частиц - кусочков корней и кусочков плодов. Проверена зависимость извлечения суммы экстрактивных веществ из исходного сбора от степени его измельчения. Сырье подвергалось измельчению до диаметра частиц 0,5; 1; 2; 3; 4; 5 мм (Табл. 3).
Оптимальная степень измельчения для сырья является размер частиц 2 мм. Дальнейшее уменьшение размера частиц приводит к затруднению процесса фильтрации, а увеличение размера частиц ведет к уменьшению выхода суммы экстрактивных веществ.
Подобрано оптимальное соотношение сырье: экстрагент для однократного залива сырья (табл. 4).
При соотношении сырья и экстрагента 1:5 наступает равновесное состояние. Дальнейшее увеличение соотношения нецелесообразно ввиду незначительного повышения выхода действующих веществ, а также увеличения расхода экстрагента.
Установлено, что увеличение температуры экстракции положительно влияет на ход процесса экстракции (Табл. 5).
Равновесная температура экстракции 70°C. Использование высоких температур увеличивает энергозатратность производства готового продукта, поэтому для интенсификации процесса экстракции и рационального использования сырья можно дополнительно использовать перемешивание и оптимизировать время и кратность экстракции. Для этого проводили экстракцию измельченного сырья 50%-ным спиртом в соотношении 1:5 на водяной бане при 70°C при постоянном перемешивании с обратным холодильником. Через заданные промежутки времени (30, 60, 90, 120 мин) извлечения фильтровали (1-й контакт фаз), определяя содержание суммы экстрактивных веществ. Аналогичным образом проводили две последующие экстракции отжатого шрота при том же промежутке времени, подавая каждый раз 50%-ный спирт этиловый или воду очищенную в количестве, равном объему слитого извлечения (второй и третий контакты фаз), анализировали полученные извлечения на содержание суммы экстрактивных веществ. Экспериментальные данные свидетельствуют, что равновесное состояние наступает при первом и втором контактах фаз через 60 мин, при третьем контакте фаз через 30 мин (табл. 6), в качестве экстрагента мы рекомендуем использовать при 1-м и 2-м контакте фаз - 50% этанол, при 3-м контакте фаз - воду очищенную.
В течение 1-го контакта фаз экстрагируется около 60-70% экстрактивных веществ, 2-й контакт обеспечивает выход 25-30%, и 3-й контакт - 10-15%. Таким образом, трехкратная экстракция обеспечивает полное истощение растительной композиции. В целях ускорения экстракционного процесса экстракционный баллон периодически встряхиваем, так как перемешивание ведет к обновлению поверхности контактирующих фаз и к увеличению движущей силы процесса.
Все подобранные оптимальные параметры процесса экстракции были положены в основу первой серии балансовых загрузок, на основании которой разработана технологическая схема получения экстракта сухого из растительной композиции.
Способ получения иллюстрируется следующим примером.
Измельченные и просеянные корневища и корни лапчатки белой - 50,0; плоды боярышника - 15,0; корневища с корнями валерианы - 35,0 загружают в экстрактор, туда же подают 500,0 мл 50% спирта этилового, экстракцию проводят при температуре 70°C в течение 60 минут. По окончании экстракции получают первый водно-этанольный экстракт в количестве 260,0 мл (плотность 0,960 г/см3). Полученный шрот экстрагируют повторно 50% этиловым спиртом при температуре 70°C в течение 60 минут еще два раза, подавая в экстрактор 260 мл 50% этилового спирта. После экстракции получают 240 мл извлечения, плотность которого равна 0,948. Затем проводим третью экстракцию водой очищенной при температуре 70°C в течение 30 минут, в результате которой получают извлечение объемом 220 мл плотностью 0,977. Первое, второе и третье извлечения последовательно, по мере их получения, фильтруют через серошинельное сукно в сборник и упаривают до 1/3 первоначального объема. Концентрированный экстракт очищают сепарированием, далее полученное извлечение сгущают до 1/5 объема и сушат в вакуумной сушилке при температуре 60°C в течение 12 часов и измельчают на мельнице. Получают 23,50 г готового продукта, что составляет 23.5% от веса исходной растительной композиции. Сухой экстракт представляет собой мелкодисперсный порошок коричневого цвета со специфическим запахом. Гигроскопичен, слегка комкуется. Содержание влаги - 1,25%.
Исследование влияния заявленного средства на содержание тиреоидных гормонов при экспериментальном гипертиреозе.
Эксперименты проведены на половозрелых крысах линии Вистар массой 180-200 г. Модель экспериментального гипертиреоза воспроизводили путем перорального введения «Тиреотома» (Берлин-Хеми, Германия), содержащего 40 мг левотироксина (T4) и 10 мг лиотиронина (T3) [1, 7]. Тиреотом вводили крысам в виде водной взвеси перорально ежедневно (за 30 минут до кормления) в течение 6 недель в еженедельно возрастающих дозах: 25, 50,100, 150, 200 мкг/кг. По истечении 6 недель для подтверждения развития тиреотоксикоза определяли уровень тиреоидных гормонов в крови животных.
После этого крыс разделили на 3 группы: контрольная, опытная 1 и опытная 2. Крысам контрольной группы внутрижелудочно вводили дистиллированную воду в объеме 1 мл/100 г на протяжении 4-х недель 1 раз в день за 30 минут до кормления. Крысам опытной группы 1 внутрижелудочно вводили водный раствор заявленного средства в экспериментально-терапевтической дозе 100 мг/кг в объеме 1 мл/100 г в аналогичном режиме. Крысам опытной группы 2 вводили «Тиреонорм» [3] в дозе 100 мг/кг в аналогичном режиме.
Влияние средств на функциональное состояние щитовидной железы оценивали радиоиммунологическим методом с использованием γ-счетчика фирмы «LKB» (Швеция). Для этого в сыворотке крови определяли содержание тиреоидных гормонов (трийодтиронина - T3 и тироксина - T4), а также тиреотропного гормона (ТТГ) с использованием наборов «Total T4 RIA KIT; Total Т3 RIA KIT; Total ТТГ RIA КIТ» фирмы «Immunotech, Веkman» (Чехия). Полученные данные приведены в таблице 6.
Установлено, что 6-недельное введение «Тиреотома» сопровождается развитием экспериментального тиреотоксикоза, о чем свидетельствует двукратное повышение уровня тиреоидных гормонов в сыворотке крови крыс контрольной группы по сравнению с уровнем физиологической нормы (табл. 7).
Курсовое введение заявленного средства на фоне экспериментального тиреотоксикоза сопровождалось выраженным снижением уровня тиреоидных гормонов T3 и T4 соответственно на 52 и 33% по сравнению с аналогичными данными крыс контрольной группы. Одновременно отмечалось повышение содержания тиреотропного гормона практически до уровня физиологической нормы. При этом эффективность заявленного средства по уровню трийодтиронина, являющегося наиболее значимым маркером тиреотоксикоза, превосходила таковую у «Тиреонорма».
Влияние заявленного средства на обмен веществ и состояние сердечно-сосудистой системы белых крыс при экспериментальном гипертиреозе.
Эксперименты проведены на половозрелых крысах линии Вистар массой 180-200 г. Модель экспериментального гипертиреоза и схема эксперимента описана выше. Для оценки влияния заявленного средства на обмен веществ в сыворотке крови определяли содержание общего белка, глюкозы, холестерина и общего билирубина с использованием биохимического анализатора «Sapphire» (Япония), а также определяли влияние испытуемого фитосредства на массу тела животных. Для определения влияния средства на функциональное состояние сердечно-сосудистой системы оценивали частоту сердечных сокращений (ЧСС), уровень систолического артериального давления (САД), а также биоэлектрическую активность миокарда животных. Измерение величины САД осуществляли на ненаркотизированных животных с использованием метода фотоплетизмографии на кардиомониторе для определения витальных функций «СМ-42115» (Польша). Электрокардиограмму регистрировали у крыс во втором стандартном отведении у наркотизированных гексеналом животных (39 мг/кг внутрибрюшинно). Оценивали частоту сердечных сокращений в 1 минуту (ЧСС), продолжительность зубцов P и T, интервалов R-R, QRS, Р-Q, а также вольтаж зубцов P и R. Полученные данные приведены в таблицах 8-11.
Установлено, что развитие тиреотоксикоза сопровождается существенными нарушениями обмена веществ (табл. 8). Курсового введение заявленного средства оказывало выраженное нормализующее влияние на показатели белкового, углеводного и липидного обмена. Так у крыс, получавших испытуемое средство, содержание общего белка в сыворотке крови повысилось на 32%, холестерина - на 80%, а концентрация глюкозы уменьшилась на 37% по сравнению с аналогичными показателями животных контрольной группы контрольной группой. «Тиронорм» оказывал аналогичное фармакологическое действие.
Показано, что повышение скорости обмена веществ и теплопродукции при тиреотоксикозе приводит к повышению основного обмена, в результате чего масса тела животных снижается (табл. 9).
Так у крыс контрольной группы отмечается снижение массы тела на 24% по сравнению с интакными крысами. На фоне курсового введения испытуемого средства снижение массы тела было не столь значимым, как в контроле: в среднем масса тела крыс, получавших заявленное средство, была на 27% выше, чем у животных контрольной группы. Эффективность заявленного средства по данному показателю была несколько выше, чем у крыс, получавших «Тиреонорм».
Как следует из данных, приведенных в таблицах 10-11, повышение уровня тиреоидных гормонов вызывает существенные нарушения со стороны сердечно-сосудистой системы в виде повышения частоты сердечных сокращений, повышения систолического артериального давления, а также изменения параметров биоэлектрической активности миокарда.
Курсовое введение заявленное средства в дозе 100 мг/кг сопровождается нормализацией указанных показателей: частота сердечных сокращений и артериального давления снижаются соответственно на 20 и 15% по сравнению с аналогичными данными у крыс контрольной группы и приближаются к уровню физиологической нормы. При этом эффективность испытуемого средства была аналогичной таковой у препарата сравнения «Тиреонорма».
Из данных приведенных в таблице 10 следует, что развитие гипертиреоза сопровождается некоторыми метаболическими изменениями в миокарде: в виде укорочения PQ, сужение QRS, незначительное смещение интервала ST по отношению к изолинии, остальные параметры биоэлектрической активности находятся в пределах физиологической нормы. Курсовое введение заявленного средства в указанной дозе обнаруживает тенденцию к нормализации указанных показателей.
Влияние заявленное средства на интенсивность процессов свободнорадикального окисления и состояние антиоксидантной системы белых крыс при экспериментальном гипертиреозе
Эксперименты проведены на половозрелых крысах линии Вистар массой 180-200 г. Модель экспериментального гипертиреоза и схема эксперимента описаны выше. Интенсивность процессов свободнорадикального окисления (СРО) и состояние антиоксидантной системы оценивали по содержанию малонового диальдегида (МДА) в гомогенате печени [11]; активности супероксиддисмутазы (СОД) [14], каталазы [6], содержанию восстановленного глутатиона [15] в сыворотке крови. Полученные данные приведены в таблице 11.
Как следует из данных, приведенных в таблице 11, развитие тиреотоксикоза сопровождается индукцией процессов свободнорадикального окисления липидов (СРО) со снижением мощности системы антиоксидантной защиты организма. Установлено, что курсовое введение животным заявленного средства оказывало выраженное антиоксидантное действие, о чем свидетельствует снижение концентрации МДА на 40%, повышение содержания восстановленного глутатиона на 46%, а также повышение активности каталазы и супероксиддисмутазы соответственно на 64 и в 3,4 раза по сравнению с аналогичными показателями животных контрольной группы. Установлено, что заявленное средство оказывало более выраженное антиоксидантное действие по сравнению с препаратом сравнения «Тиреонормом».
Таким образом результаты проведенного исследования свидетельствуют, что курсовое введение заявленного средства, полученного на основе растительной композиции (корневищ и корней лапчатки белой, плодов боярышника, корневищ с корнями валерианы) в экспериментально-терапевтической дозе на фоне экспериментального тиреотоксикоза оказывает выраженное фармакотерапевтическое действие, на что указывает снижение уровня тиреоидных гормонов T3 и T4 с одновременным повышением содержания тиреотропного гормона в сыворотке крови крыс опытной группы. На фоне нормализации концентрации тиреоидных гормонов отмечается стабилизация обмена веществ: белкового, углеводного и липидного, сопровождаемая повышением массы тела животных. Наряду с этим на фоне курсового введения заявленного средства отмечается уменьшение выраженности патологических изменений со стороны сердечно-сосудистой системы. Установлено, что курсовое введение экстракта на фоне экспериментального тиреотоксикоза оказывает антиоксидантное действие и повышает активность эндогенной антиоксидантной системы.
Источники информации
1. Айвазова А.С. Изучение тиреотропных свойств зюзника европейского: автореф. дис. канд. биол. наук: 14.03.06 // А.С. Айвазова - М. - 2008. - 20 с.
2. Велданова М.В., Скальный А.В. Технология неинвазивной оценки индивидуального йодного статуса человека // Технологии живых систем. - 2009. - №1. - С. 16-17.
3. Водопьянова A.M. Фармакологическая коррекция тиреотоксикоза комплексным растительным средством «Тиреонорм»: автореф. дис. канд. мед. наук: 14.03.06 // А.М. Водопьянова - Улан-Удэ. - 2012. - 20 с.
4. Гринкевич Н.И. Химический анализ лекарственных растений / Н.И. Гринкевич, Л.Н. Сафронич. - М.: Высшая школа, 1983. - 176 с.
5. Иванова Л.Р., Бутенко Л.И., Лигай Л.В., Сбежнева В.Г. Определение иридоидов в траве татарника колючего // Химия растительного сырья. - 2010. - №4. - С. 131-133.
6. Королюк М.А., Иванова Л.И., Майорова И.Г. и др. Методы определения активности каталазы // Лабор. Дело. - 1988. - №1. - С. 16-19).
7. Машковский М.Д. Лекарственные средства. – М.: Новая Волна, 2012. - С. 1216).
8. Николаев С.М. Системная фитофармакология - основа рациональной фитофармакологии и фитофармакопрофилактики заболеваний / С.М. Николаев // Вестник БГУ. - 2011. - №12. - С. 3-5).
9. Петунина Н.А. Болезни щитовидной железы / Н.А. Петунина. - М.: ГЭО-ТАР-МЕДИА, 2011. - 216 с.
10. Разоронова К.Н., Жохова Е.В., Ирза А.Е., Коледенкова К.Д. Количественное определение дубильных веществ спектрофотометрическим методом в траве и корневищах с корнями герани лесной, герани луговой и герани болотной // Современная медицина и фармацевтика: анализ и перспективы развития: Материалы II межд. научно-практ. конф. - М.: Спутник, 2012. С. 144-152.
11. Стальная И.Д. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты / И.Д. Стальная, Т.Г. Гаришвили // Современные методы в биохимии. - М., - 1977. - С. 66-68.
12. Тринеева О.В., Сафонова И.И., Сафонов Е.Ф. Сливкин А.И. Органические кислоты в плодах облепихи крушиновидной / О.В. Тринеева, И.И. Сафонова, Е.Ф. Сафонов, А.И. Сливкин // Фармация. - 2013. - №7. - С. 7-10.
13. Трошина Е.А. Заболевания связанные с дефицитом йода: Уроки истории и время принятия решений / Е.А. Трошина // Пробл. эндокринол. - 2011. - Т. 57, №1. - С. 60-66.
14. Чевари С. Роль супероксиддисмутазы в окислительных процессах клетки и метод определения ее в биологических материалах / С. Чевари, И. Чаба, Й. Секкей // Лаб. дело. - 1985. - №11. - С. 678-681).
15. Anderson М.Е. Glutathion: chemical, biochemical and medicinal aspects. Pt.A. - N.Y. -1989. - P. 333-405.
16. http://www.garant.ru/products/ipo/prime/doc/71143758/#1000
Способ получения средства, обладающего тиреотропной активностью, отличающийся тем, что для экстракции растительного материала используют трехкратную экстракцию при температуре 70°C при отношении 1 мас. ч. сырья: 5 об. ч экстрагента, первая и вторая экстракция выполняется 50%-ным спиртом этиловым в течение 60 мин, третья экстракция - водой очищенной в течение 30 минут, в качестве растительного материала используют компоненты в соотношении, мас. ч.: корневища и корни лапчатки белой - 50, плоды боярышника - 15, корневища с корнями валерианы - 35, измельченные до 2 мм, далее объединенные извлечения фильтруют, упаривают, очищают сепарированием, доупаривают, затем высушивают в вакуум-сушильном аппарате.