Клетки и способ для получения рамнолипидов
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Представлена бактериальная клетка, которая способна образовывать по меньшей мере один рамнолипид и генетически модифицированная таким образом, что по сравнению с ее диким типом она имеет повышенную активность двух ферментов Е1 и Е2 или трех ферментов Е1, Е2 и Е3 и по меньшей мере одного фермента Е8, который катализирует экспорт рамнолипидов из клетки в окружающую среду, при этом фермент Е1 способен катализировать превращение 3-гидроксиалканоил-АСР через 3-гидроксиалканоил-3-гидроксиалкановую кислоту АСР в гидроксиалканоил-3-гидроксиалкановую кислоту, фермент Е2 представляет собой рамнозилтрансферазу I, а фермент Е3 – рамнозилтрансферазу II. Представлен способ получения рамнолипидов с использованием указанной клетки. Группа изобретений позволяет повысить образование рамнолипидов. 2 н. и 10 з.п. ф-лы, 5 табл., 3 ил., 28 пр.
Реферат
Область изобретения
Настоящее изобретение относится к клеткам и нуклеиновым кислотам, а также к их применению для получения рамнолипидов, и к способу получения рамнолипидов.
Уровень техники
Поверхностно-активные вещества в настоящее время по существу получают на основе базы из петрохимического сырья. Применение поверхностно активных веществ на основе возобновляемого сырья является подходящей альтернативой по причине предсказуемой нехватки петрохимического сырья и возрастающей потребности в продуктах на основе возобновляемого сырья или биоразлагаемых продуктах.
Рамнолипиды состоят из одного (монорамнозиллипид) или двух остатков рамнозы (дирамнозиллипид) и одного или двух остатков 3-гидрокси жирной кислоты (смотрите Handbook of Hydrocarbon and Lipid Microbiology, 2010, Seiten 3037-51). Они имеют поверхностно-активные свойства, которые необходимы для всех видов применения в качестве поверхностно-активного вещества (siehe Leitermann et al., 2009).
Эти липиды в настоящее время получают, применяя изоляты различных патогенных бактерий немутантного типа человека и животных, в частности представителей рода (смотрите Handbook of Hydrocarbon and Lipid Microbiology, 2010, Seiten 3037-51). На самом деле эти организмы для получения способны вызывать заболевания, уменьшающие приемлемость для потребителя получаемых обычным образом рамнолипидов в значительной степени. Более того, более высокие требования безопасности приводят также к повышению затрат на производство из-за увеличения капитальных расходов и возможности дополнительных стадий обработки.
Хотя в некоторой степени высокие титры продукта, а также пространство-время и/или выходы углерода могут быть достигнуты с помощью этих организмов для получения, это требует применение растительных масел в качестве единственного или сосубстратов (смотрите Handbook of Hydrocarbon and Lipid Microbiology, 2010, Seiten 3037-51). Растительные масла, однако, являются сравнительно дорогостоящим сырьем по сравнению с другими источниками углерода, таким как, например, глюкоза, сахароза или полисахариды, такие как, например, крахмал, целлюлоза и гем и целлюлоза, глицерин, СО, CO2 или CH4. Более того, рамнолипиды сами по себе отличаются их поверхностно-активным характером, состоящим в том, что они склонны к бурному пенообразованию в ходе ферментационных процессов. Это происходит, в частности, когда применяются липофильные субстраты. Эта проблема заметно уменьшается при применении водорастворимых субстратов, таких как например, глюкоза, сахароза, полисахариды (крахмал, целлюлоза, гем и целлюлоза) или глицерин.
Наконец, на свойства рамнолипидов, получаемых из изолятов немутантного типа, можно влиять лишь в ограниченной степени. До настоящего времени влияние осуществлялось исключительно через оптимизацию управления процессом (значение рН, подача кислорода, состав среды, стратегия подпитки, подача азота, температура, выбор субстрата и т.д.). Однако было бы желательно очень специфично влиять на определенные свойства продукта, такие как, например, соотношение различных видов рамнолипидов (число остатков рамнозы и 3-гидроксижирной кислоты) или длина цепи и степень насыщенности остатков 3-гидроксижирной кислоты, чтобы контролировать свойства продукта, важные для применения.
Рамнолипиды, если они применяются в большей степени в качестве поверхностно-активных веществ для ухода за домом, очищения, косметических средств, технологии производства пищевых продуктов, фармацевтических средств, защиты растений и других применений, должны применяться конкурентоспособным образом с применяемыми на сегодняшний день поверхностно-активными веществами. Имеется большой объем химических средств, которые могут быть получены с очень низкими затратами, без очевидного риска для здоровья потребителя и с ясно определенными и модулируемыми характеристиками продукта. Поэтом должна быть возможность получения рамнолипидов с таким низкими затратами, как только это возможно, без риска для здоровья потребителя и с определенными свойствами, настолько, насколько это возможно.
Хотя рамнолипиды уже были получены в организмах GRAS (в общем безопасные) с применением обычных источников углерода, таких как, например, глюкоза или глицерин, в этом случае получали исключительно монорамнозиллипиды (Ochsner et at. Appl. Environ. Microbiol. 1995. 61(9):3503-3506).
С другой стороны Cha et al. в Bioresour Technol. 2008. 99(7):2192-9 описали получение монорамнозиллипидов из соевого масла в Р. putida путем введения генов Gene rhIA и rhIB из Pseudomonas aeruginosa.
Поэтому возросла потребность в не дорогостоящем и безопасном с точки зрения здоровья получении моно- и дирамнозиллипидов, имеющих определенные и модулируемые свойства. Эта модуляция может осуществляться, например, посредством сбалансированной подачи отдельных ферментных активностей, которые уменьшают обогащение монорамнозиллипидами. Такая модуляция, однако, может также осуществляться, например, посредством применения ферментов, имеющих определенные свойства, например, в отношении специфичности к субстрату, и, таким образом, например, меняется длина цепи гидроксижирных кислот, включенных в рамнолипиды. Поэтому задачей настоящего изобретения является обеспечение возможности получения рамнолипидов из легко доступных источников углерода, с применением безопасных хозяев для получения.
Описание изобретения
Неожиданно было обнаружено, что клетки и способы, описанные ниже, в которых эти клетки применяются, вносят вклад в решение поставленной задачи настоящего изобретения.
Поэтому настоящее изобретение относится к клеткам, которые способны формировать рамнолипиды и по сравнению с их немутированным типом имеют по меньшей мере одну повышенную активность генного продукта гомологов генных продуктов rhIA, rhIB и rhIC.
Настоящее изобретение, кроме того, относится к способу получения рамнолипидов с применением вышеупомянутых клеток в качества биокатализатора и простых источников углерода.
Преимуществом настоящего изобретения является то, что могут применяться организмы, которые являются непатогенными и простыми для применения.
Другим преимуществом настоящего изобретения является то, что применение масла или сосубстрата является необязательным.
Другим преимуществом является то, что с помощью настоящего изобретения могут быть получены рамнолипиды, имеющие определенные и модулируемые свойства.
Другое преимущество настоящего изобретения состоит в том, что могут быть получены дирамнозиллипиды.
Другое преимущество состоит в том, что могут быть получены рамнолипиды с более высоким пространство-временем и выходом углерода, чем при применении клеток без повышения их активностей.
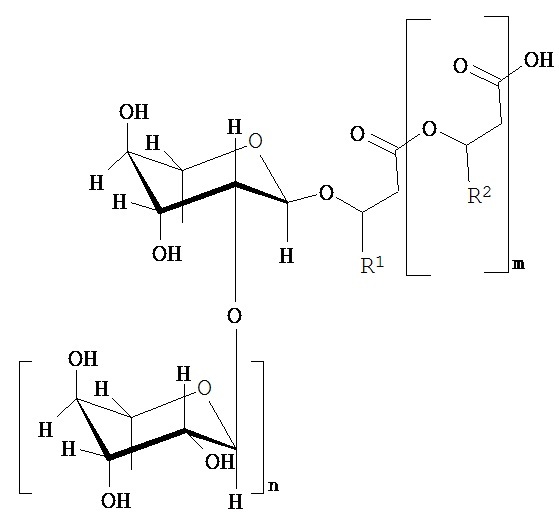
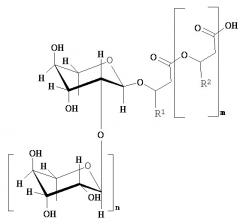
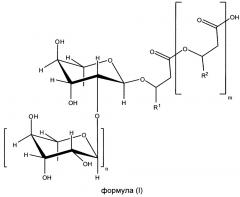
Вклад в достижение поставленной в начале задачи, может быть сделан клеткой, предпочтительно выделенной клеткой, которая способна образовывать по меньшей мере один рамнолипид общей формулы (I) или его соли,
где
m равно 2, 1 или 0, в частности 1 или 0,
n равно 1 или 0, в частности 1,
R1 и R2 независимо друг от друга представляют собой идентичные или различные органические радикалы, имеющие от 2 до 24, предпочтительно от 5 до 13 атомов углерода, в частности необязательно разветвленный, необязательно замещенный, в частности гидрокси-замещенный, необязательно ненасыщенный, в частности, моно-, ди- или триненасыщенный, алкильный радикал, предпочтительно выбранный из группы, состоящей из пентенила, гептенила, ноненила, ундеценила и тридеценила и (СН2)0-СН3со=1-23, предпочтительно 4-12,
отличающейся тем, что она была генетически модифицирована таким образом, что, по сравнению с немутированным типом, она имеет повышенную активность по меньшей мере одного из ферментов E1, E2 и Е3, где фермент E1 способен катализировать превращение 3-гидроксиалканоил-АСР через 3-гидроксиалканоил-3-гидроксиалкановую кислоту-АСР в гидроксиалканоил-3-гидроксиалкановую кислоту, фермент Е2 представляет собой рамнозилтрансферазу I и способен катализировать превращение dTDP-рамнозы и 3-гидроксиалканоил-3-гидроксиалканоата в α-L-рамнопиранозил-3-гидроксиалканоил-3-гидроксиалканоат, и фермент Е3 представляет собой рамнозилтрансферазу II и способен катализировать превращение dTDP-рамнозы и α-L-рамнопиранозил-3-гидроксиалканоил-3-гидроксиалканоат в α-L-рамнопиранозил-(1-2)-α-L-рамнопиранозил-3-гидроксиалканоил-3-гидроксиалканоат, где эти ферменты E1, Е2 и Е3 предпочтительно выбираются из группы, состоящей из
по меньшей мере одного фермента E1, выбранного из:
фермент E1a, имеющий полипептидную последовательность Seq ID №2 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №2 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №2, где ферментативная активность фермента E1a, как понимается, означает способность предпочтительно превращать 3-гидроксидеканоил-АСР через 3-гидроксидеканоил-3-гидроксидекановой кислоты-АСР в гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E1b, имеющий полипептидную последовательность Seq ID №18 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №18 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №18, где ферментативная активность фермента E1b, как понимается, означает способность предпочтительно превращать 3-гидрокситетрадеканоил-АСР через 3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту-АСР в гидрокситетрадеканоил-3-гидрокситетрадека новую кислоту,
фермент E1c, имеющий полипептидную последовательность Seq ID №78 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №78 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №78, где ферментативная активность фермента E1c, как понимается, означает способность предпочтительно превращать 3-гидрокситетрадеканоил-АСР через 3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту-АСР в гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту,
фермент E1d, имеющий полипептидную последовательность Seq ID №80 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №80 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №80, где ферментативная активность фермента Е1d, как понимается, означает способность предпочтительно превращать 3-гидрокситетрадеканоил-АСР через 3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту-АСР в гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту, и
фермент E1e, имеющий полипептидную последовательность Seq ID №82 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №82 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №82, где ферментативная активность фермента E1e, как понимается, означает способность предпочтительно превращать 3-гидрокситетрадеканоил-АСР через 3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту-АСР в гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту,
по меньшей мере одного фермента Е2 с полипептидной последовательностью, выбранного из:
фермент Е2а, имеющий полипептидную последовательность Seq ID №4 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №4 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №4, где ферментативная активность фермента Е2а, как понимается, означает способность предпочтительно превращать dTDP-рамнозу и 3-гидроксидеканоил-3-гидроксиддекановую кислоту в α-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E2b, имеющий полипептидную последовательность Seq ID №20 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №20 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №20, где ферментативная активность фермента E2b, как понимается, означает способность предпочтительно превращать dTDP-рамнозу и 3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту в α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту,
фермент Е2с, имеющий полипептидную последовательность Seq ID №84 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №84 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №84, где ферментативная активность фермента Е2с, как понимается, означает способность предпочтительно превращать dTDP-рамнозу и 3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту в α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту,
фермент E2d, имеющий полипептидную последовательность Seq ID №86 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №86 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №86, где ферментативная активность фермента Е2d, как понимается, означает способность предпочтительно превращать dTDP-рамнозу и 3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту в α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту, и фермент Е2е, имеющий полипептидную последовательность Seq ID №88 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №88 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №88, где ферментативная активность фермента Е2е, как понимается, означает способность предпочтительно превращать dTDP-рамнозу и 3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту в α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту, и
по меньшей мере одного фермента Е3, выбранного из:
фермент Е3а, имеющий полипептидную последовательность Seq ID №6 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №6 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №6, где ферментативная активность фермента Е3а, как понимается, означает способность предпочтительно превращать dTDP-рамнозу и α-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту в α-L-рамнопиранозил-(1-2)-α-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту, фермент E3b, имеющий полипептидную последовательность Seq ID №22 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №22 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №22, где ферментативная активность фермента E3b, как понимается, означает способность предпочтительно превращать dTDP-рамнозу и α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту в α-L-рамнопиранозил-(1-2)-α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту,
фермент Е3с, имеющий полипептидную последовательность Seq ID №90 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №90 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 90% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №90, где ферментативная активность фермента Е3с, как понимается, означает способность предпочтительно превращать dTDP-рамнозу и α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту в α-L-рамнопиранозил-(1-2)-α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту, и
фермент E3d, имеющий полипептидную последовательность Seq ID №92 или имеющий полипептидную последовательность, в которой до 25%, предпочтительно до 20%, особенно предпочтительно до 15%, особенно до 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков модифицированы по сравнению со ссылочной последовательностью Seq ID №92 посредством делеции, инсерции, замещения или их комбинации, и который все еще имеет по меньшей мере 10%, предпочтительно 50%, особенно предпочтительно 80%, особенно более чем 92% от ферментативной активности фермента, имеющего ссылочную последовательность Seq ID №92, где ферментативная активность фермента E3, как понимается, означает способность предпочтительно превращать dTDP-рамнозу и α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту в α-L-рамнопиранозил-(1-2)-α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановую кислоту.
Для общего сведения смотрите Фиг.1.
Термин "немутантный тип" клетки согласно настоящему изобретению означает клетку, геном которой находится в том состоянии, в котором он сформировался естественным образом в ходе эволюции. Этот термин применяется как в отношении клетки в целом, так и в отношении отдельных генов. Термин "немутантный тип" поэтому в частности не включает те клетки или те гены, генные последовательности которых были модифицированы по меньшей мере частично с помощью рекомбинантных способов.
Термин "рамнолипид", как понимается, в контексте настоящего изобретения означает соединение общей формулы (I) или его соли.
Очевидно, что активности, указанные выше для ферментов E1a-E3b являются лишь конкретными примерами из широкого спектра активностей вышеуказанных ферментов; соответствующая упомянутая активность является такой, для которой надежный способ измерения доступен в случае данного фермента. Таким образом, очевидно, что фермент, который имеет субстрат с неразветвленными насыщенными С10-алкильными радикалами, даже, хотя необязательно, при пониженной активности будет превращать эти субстраты, которые содержат С6- или С16-алкильные радикалы, которые при необходимости могут быть разветвленными или ненасыщенными.
Термин "повышенная активность фермента", как понимается, предпочтительно означает повышенную внутриклеточную активность.
Описанные варианты выполнения настоящего изобретения для повышения ферментативной активности в летках, применяются как для повышения активности ферментов E1-Е3, так и для всех далее упомянутых ферментов, активность которых может при необходимости быть повышена.
На самом деле, повышение ферментативной активности может быть достигнуто повышением числа копий генной последовательности или генных последовательностей, которые кодируют фермент, с применением сильного промотора или улучшенного сайта связывания рибосом, уменьшая негативную регуляцию генной экспрессии, например, посредством регуляторов транскрипции, или усиливая положительную регуляцию генной экспрессии, модифицируя использование кодона гена, различными путями повышая период полураспада мРНК или фермента, модифицируя регуляцию экспрессии гена или применяя ген или аллель, которые кодируют соответствующий фермент, имеющий повышенную активность, или при необходимости комбинируя эти средства. Согласно настоящему изобретению получают генетически модифицированные клетки, например, посредством трансформации, трансдукции, конъюгации или комбинации этих способов, применяя вектор, который содержит желательный ген, аллель этого гена или их части и при необходимости содержит промотор, делающий возможной экспрессию гена. Гетерологичная экспрессия, в частности, достигается интеграцией гена или аллелей в хромосому клетки или экстрахромосомно реплицирующийся вектор.
B DE-A-10031999 приводится общий обзор возможностей повышения ферментативной активности в клетках, как показано в качестве примера на пируват карбоксилазе, указанный документ включен в настоящую заявку в качестве ссылки, и его содержание в отношении возможностей повышения ферментативной активности в клетках, формирует часть описания настоящего изобретения.
Экспрессия ферментов или генов, указанных выше и далее, определяется с помощью одно- и двухмерного гелевого разделения белков и последующей оптической идентификации концентрации белка в геле, с применением соответствующего аналитического программного обеспечения. Если повышение ферментативной активности основывается исключительно на повышении экспрессии соответствующего гена, количественное определение повышения ферментативной активности может быть определено простым образом путем сравнения одно- или двухмерных разделений белков между клеткой немутантного типа и генетически модифицированной клеткой. Обычный способ получения белковых гелей в случае коринеформных бактерий и для идентификации белков представляет собой методику, описанную Hermann et al. (Electrophoresis, 22: 1712.23 (2001)). Концентрация белка может быть проанализирована подобным образом с помощью Вестерн-блот гибридизации с применением антитела, специфичного для определяемого белка (Sambrook et al., Molecular Cloning: a laboratory manual, 2nd Ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. USA, 1989) и последующего оптического анализа с применением соответствующего программного обеспечения для определения концентрации (Lohaus und Meyer (1989) Biospektrum, 5: 32-39; Lottspeich (1999) Angewandte Chemie 111: 2630-2647). Активность ДНК-связывающих белков может быть измерена посредством анализа сдвига полосы ДНК (также называется задержкой в геле) (Wilson et al. (2001) Journal of Bacteriology, 183: 2151-2155). Действие ДНК-связывающих белков на экспрессию других генов может быть обнаружено различными хорошо описанными способами анализа репортерного гена (Sambrook et al., Molecular Cloning: a laboratory manual, 2nd Ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. USA, 1989). Внутриклеточные ферментативные активности могут быть определены в соответствии с различными описанными способами (Donahue et al. (2000) Journal of Bacteriology 182 (19): 5624-5627; Ray et al. (2000) Journal of Bacteriology 182 (8): 2277-2284; Freedberg et al. (1973) Journal of Bacteriology 115 (3): 816-823). Если в следующих вариантах выполнения настоящего изобретения не указано практических способов определения активности определенного фермента, определения повышения ферментативной активности, а также определения уменьшения ферментативной активности, они предпочтительно осуществляются с помощью способов, описанных в Hermann et al., Electophoresis, 22: 1712-23 (2001), Lohaus et al., Biospektrum 5 32-39 (1998), Lottspeich, Angewandte Chemie 111: 2630-2647 (1999) и Wilson et al., Journal of Bacteriology 183: 2151-2155 (2001).
Если повышение ферментативной активности сопровождается мутацией эндогенного гена, такие мутации могут быть получены случайным образом, либо обычными способами, такими как, например, УФ-облучение, или с помощью мутагенных химических веществ, или селективно посредством способов генной инженерии, как например делеция (делеции), инсерция (инсерции) и/или нуклеотидный обмен (обмены). Модифицированные клетки получают с помощью этих мутаций. Особенно предпочтительными мутантами ферментов являются, в частности, также те ферменты, которые более не ингибируются обратной связью, продуктом или субстратом, или ингибируются по меньшей мере в меньшей степени по сравнению с ферментом немутантного типа.
Если повышение ферментативной активности сопровождается повышением синтеза фермента, число копий соответствующих генов увеличивается, или промотор и область регуляции или сайт связывания рибосом, который расположен в 3’-5’ направлении выше структурного гена, являются мутированными. Экспрессионные кассеты, которые встраиваются в 3’-5’ направлении выше структурного гена действуют таким же образом. Кроме того, посредством индуцируемых промоторов возможно повысить экспрессию в любой желательный момент времени. Кроме того, однако, также "энхансеры" могут играть роль регуляторных последовательностей для гена фермента, которые подобным образом приводят к повышенной генной экспрессии посредством улучшенного взаимодействия между РНК-полимеразой и ДНК. В результате пролонгации периода полураспада мРНК экспрессия подобным образом улучшается. Кроме того, путем предотвращения разложения ферментного белка ферментативная активность подобным образом повышается. Гены или генные конструкции присутствуют либо в плазмидах, имеющих различное число копий или интегрированных и амплифицированных в хромосоме. Кроме того, сверхэкспрессия упомянутых генов может быть достигнута посредством модификации состава среды и управления культурой. Специалист в данной области техники найдет руководство для этого, среди прочего, в Martin et al. (Bio/Technology 5, 137-146 (1987)), в Guerrero et al. (Gene 138, 35-41 (1994)), Tsuchiya und Morinaga (Bio/Technology 6, 428-430 (1988)), в Eikmanns et al. (Gene 102, 93-98 (1991)), в ЕР-А-0 472 869, в US 4,601,893, в Schwarzer und Puhler (Bionechnology 9, 84-87 (1991), в Reinscheid et al. (Applied and Environmental Microbiology 60, 126-132 (1994)), в LaBarre et al. (Journal of Bacteriology 175, 1001-1007 (1993)), в WO-A-96/15246, в Malumbres et al. (Gene 134, 15-24 (1993)), в JP-A-10-229891, в Jensen und Hammer (Biotechnology and Bioengineering 58, 191-195 (1998)) и в известных учебниках по генетике и молекулярной биологии. Средства, описанные выше, образом, подобным мутациям, приводят к генетически модифицированным клеткам.
Эписомальные плазмиды, например, применяются для повышения экспрессии соответствующих генов. Подходящие плазмиды или вектора, в принципе, представляют собой все варианты, доступные для этой цели специалистам в данной области техники. Такие плазмиды и вектора могут быть получены, например, у компаний Novagen, Promega, New England Biolabs, Clontech или Gibco BRL Другие предпочтительные плазмиды и вектора могут быть обнаружены в: Glover, D. М. (1985) DNA cloning: a practical approach, Vol.l-lll, IRL Press Ltd., Oxford; Rodriguez, R.L. und Denhardt, D. Т (eds) (1988) Vectors: a survey of molecular cloning vectors and their uses, 179-204, Butterworth, Stoneham; Goeddel, D. V. (1990) Systems for heterologous gene expression, Methods Enzymol. 185, 3-7; Sambrook, J.; Fritsch, E.F. und Maniatis, T. (1989), Molecular cloning: a laboratory manual, 2nd ed., Cold Spring Harbor Laboratory Press, New York.
Плазмидный вектор, который содержит ген, подлежащий амплификации, затем превращается в желательный штамм посредством конъюгации или трансформации. Способ конъюгации описывается, например, в Schafer et al., Applied and Environmental Microbiology 60: 756-759 (1994). Способ трансформации описывается, например, в Thierbach et al., Applied Microbiology and Biotechnology 29: 356-362 (1988), Dunican und Shivnan, Bio/Technology 7: 1067-1070 (1989) и Tauch et al., FEMS Microbiology Letters 123: 343-347 (1994). После гомологической рекомбинации посредством события „cross-over", полученный штамм содержит по меньшей мере две копии рассматриваемого.
Под выражением, применяемым выше и в следующих вариантах выполнения настоящего изобретения "активность фермента Ех повышенная по сравнению с его немутантным типом" предпочтительно всегда понимается активность соответствующего фермента Ех, повышенная по меньшей мере в 2 раза, особенно предпочтительно по меньшей мере в 10 раз, более предпочтительно по меньшей мере в 100 раз, еще более предпочтительно в 1.000 раз и по меньшей мере предпочтительно в 10.000 раз. Кроме того, клетка согласно настоящему изобретению, которая имеет "повышенную активность фермента Ех по сравнению с его немутантным типом", в частности также содержит клетку, немутантный тип которой не имеет активности или имеет по меньшей мере не обнаруживаемую активность этого фермента Ех и который показывает обнаруживаемую активность этого фермента Ех только после повышения ферментативной активности, например, посредством сверхэкспрессии. В этом контексте термин "сверхэкспрессия" или выражение, применяемое в следующих вариантах выполнения настоящего изобретения "повышенная экспрессия", также охватывает случай, когда сходная клетка, например, клетка немутантного типа, не показывает экспрессию или по меньшей мере не показывает обнаруживаемую экспрессию, и обнаруживаемый синтез фермента Ех индуцируется только рекомбинантными способами.
Изменения аминокислотных остатков данной полипептидной последовательности, которые не приводят к существенным изменениям свойств и функции данного полипептида, известны специалистам в данной области техники. Таким образом, например, консервативные аминокислоты могут взаимно заменяться; примерами таких подходящих аминокислотных замещений являются: Ala на Ser; Arg на Lys; Asn на Gln или His; Asp на Glu; Cys на Ser; Gln на Asn; Glu на Asp; Gly на Pro; His на Asn или Gln; Ile на Leu или Val; Leu на Met или Val; Lys на Arg или Gln или Glu; Met на Leu или Ile; Phe на Met или Leu или Tyr; Ser на Thr; Thr на Ser; Trp на Tyr; Tyr на Trp или Phe; Val на Ile или Leu. Подобным образом известно, что изменения, особенно на N- или С-концах полипептида, в виде, например, аминокислотных вставок или делеций, часто не оказывают существенного влияния на функцию полипептида.
Активность фермента может быть определена путем разрушения клеток, которые содержат эту активность, образом, известным специалистам в данной области техники, например, с помощью шаровой мельницы, френч-пресса или ультразвукового дезинтегратора, и последующего разделения клеток, остатков клеток и средств разделения, как например, стеклянные шарики, путем центрифугирования в течение 10 минут при 13.000 оборотах в минуту и 4°С. Применяя полученный свободный от клеток неочищенный экстракт затем может быть осуществлен ферментный анализ с последующим LC-ESI-MS обнаружением продуктов. Альтернативно, фермент может быть обогащен образом, известным специалистам в данной области техники, хроматографическими способами (как например, аффинная хроматография на основе никель-нитрилтриуксусной кислоты, аффинной хроматографии на основе стрептавидина, хроматографии на основе гель-фильтрации и ион-обменной хроматографии), или еще очищен до гомогенности.
Активность фермента Е1 затем определяется с применением образцов, описанных как получено выше, следующим образом: Стандартный образец содержит 100 мкМ Е. coli АСР, 1 мМ β-Меркаптоэтанола, 200 мкМ малонил-коэнзима А, 40 мкМ октанил-коэнзима А (для E1a) или додеканоил-коэнзима А (для E1b), 100 мкМ NADPH, 2 мкг Е. coli FabD, 2 мкг Mycobacterium tuberculosis FabH, 1 мкг Е. coli FabG, 0,1 М натрий-фосфатного буфера, рН 7,0, и 5 мкг фермента E1 с конечным объемом 120 мкл. АСР, β-меркаптоэтаноли натрий-фосфатный буфер проинкубировали в течение 30 минут при 37°С, чтобы полностью восстановить АСР. Реакцию запустили добавлением фермента E1. Реакцию остановили, применяя 2 мл воды, которая была подкислена с помощью HCl до рН 2,0, и затем дважды экстрагировали 2 мл хлороформ/метанол (2:1 (об.:об.)). Разделение фаз осуществили с помощью центрифугирования (16.100 g, 5 минут, комнатная температура). Нижнюю органическую фазу удалили, испарение завершили в вакуумной центрифуге, и остаток растворили в 50 мкл этанола. Нерастворившиеся составляющие осадили с помощью центрифугирования (16.100 g, 5 минут, комнатная температура), и образец проанализировали посредством LC-ESI-MS. Идентификацию продуктов осуществили с помощью анализа соответствующих массовых следов и MS2-спектра.
Активность фермента Е2 затем определяется с применением образцов, описанных как получено выше, следующим образом: стандартный образец может состоять из 185 мкл 10 мМ Tris-HCl (рН 7,5), 10 мкл 125 мМ dTDP-рамнозы и 50 мкл неочищенного экстракта белка (около 1 мг общего белка) или очищенного белка в растворе (5 мкг очищенного белка). Реакцию запустили добавлением 10 мкл 10 мМ этанольного раствора 3-гидроксидеканоил-3-гидроксидекановой кислоты (для Е2а) или 3-гидрокситетрадеканоил-3-гидрокситетрадекановой кислоты (для E2b) и инкубировали в течение 1 часа при 30°С при перемешивании (600 оборотов в минуту). Затем реакционную смесь обработали 1 мл ацетона. Нерастворившиеся составляющие осадили с помощью центрифугирования (16.100 g, 5 минут, комнатная температура), и образец проанализировали посредством LC-ESI-MS. Идентификацию продуктов осуществили с помощью анализа соответствующих массовых следов и MS2-спектра.
Активность фермента Е3 затем определяется с применением образцов, описанных как получено выше, следующим образом: стандартный образец может состоять из 185 мкл 10 мМ Tris-HCl (pH 7,5), 10 мкл 125 мМ dTDP-рамнозы и 50 мкл неочищенного экстракта белка (около 1 мг общего белка) или очищенного белка в растворе (5 мкг очищенного белка). Реакцию запустили добавлением 10 мкл 10 мМ этанольного раствора α-L-рамнопиранозил-3-гидроксидеканоил-3-гидрокси декановой кислоты (для Е3а) или α-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокси тетрадекановой кислоты (для E3b) и инкубировали в течение 1 часа при 30°С при перемешивании (600 оборотов в минуту). Затем реакционную смесь обработали 1 мл ацетона. Нерастворившиеся составляющие осадили с помощью центрифугирования (16.100 g, 5 минут, комнатная температура), и образец проанализировали посредством LC-ESI-MS. Идентификацию продуктов осущес