Схема приема лидокаина для применения в продолжительном лечении боли в мочевом пузыре и раздражения при мочеиспускании
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к урологии, и может быть использована для лечения боли в мочевом пузыре и/или симптомов раздражения при мочеиспускании. Предложен способ лечения боли в мочевом пузыре и/или симптомов раздражения при мочеиспускании, включающий непрерывное введение лидокаина в мочевой пузырь пациента на протяжении периода лечения 24 часа или дольше в среднем терапевтически эффективном количестве от приблизительно 10 мг до приблизительно 30 мг лидокаина в расчете на свободное основание (FBE, free base equivalent) для достижения терапевтического эффекта, который сохраняется после окончания периода лечения. Предложен также способ лечения боли в мочевом пузыре и/или симптомов раздражения при мочеиспускании, включающий постоянное введение анестезирующего или болеутоляющего средства в мочевой пузырь пациента на протяжении периода лечения 24 часа или дольше в количестве, эффективном для достижения терапевтического эффекта, который сохраняется после окончания периода лечения. Также предложен способ лечения боли в мочевом пузыре и/или симптомов раздражения при мочеиспускании, включающий постоянное введение в мочевой пузырь пациента на протяжении периода лечения по меньшей мере 24 часа анестезирующего или болеутоляющего средства в количестве, эффективном для достижения измеримой концентрации средства в плазме у пациента, непрерывно на протяжении периода лечения. Также предложено устройство для доставки лекарственного средства для применения при лечении боли в мочевом пузыре и/или симптомов раздражения при мочеиспускании, содержащее эластичный корпус устройства, задающий просвет резервуара для лекарственного средства, содержащего полезную нагрузку лидокаина. При этом корпус устройства выполнен с возможностью непрерывного контролируемого высвобождения лидокаина в мочевой пузырь пациента на протяжении периода лечения по меньшей мере 24 часа при среднем количестве от приблизительно 5 мг до приблизительно 30 мг лидокаина (FBE) в день на протяжении периода лечения. Изобретения обеспечивают эффективное лечение боли в мочевом пузыре и/или симптомов раздражения при мочеиспускании при снижении побочных эффектов терапии для обеспечения продолжительного терапевтического эффекта, который сохраняется по меньшей мере 14 дней после периода активного лечения за счёт предложенного режима внутрипузырного введения препарата. 4 н. и 19 з.п. ф-лы, 56 ил., 6 табл., 3 пр.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка на патент испрашивает приоритет предварительной заявки на патент США №61/431334, поданной 10 января 2011 года, и предварительной заявки на патент США №61/551923, поданной 26 октября 2011 года, которые включены в данный документ посредством ссылки во всей их полноте.
Предпосылки
Настоящее раскрытие в целом относится к области способов и систем для лечения боли в мочевом пузыре и симптомов раздражения при мочеиспускании, в частности, но без ограничений, к системам и способам, при которых применяют локальное, внутрипузырное введение лекарственного средства, такого как лидокаин, в мочевой пузырь, и конкретнее к способам и системам для продолжительного эффекта лечения.
Интерстициальный цистит (IC) - это урологическое состояние, характеризующееся болью, повышенной частотой мочеиспускания и сильной потребностью в мочеиспускании. Данное состояние также может включать различные степени недержания мочи и сексуальной дисфункции. IC и синдром болезненного мочевого пузыря (PBS) включают пациентов с болью при мочеиспускании, не связанной с другими причинами, такими как инфекция или мочевые камни, и по оценкам ими поражено только в США приблизительно 3-8 миллионов человек, большинство из которых - женщины (Berry 2009). IC - это серьезное состояние с нереализованными медицинскими потребностями.
Также существует необходимость лечить боль в мочевом пузыре и симптомы раздражения при мочеиспускании у пациентов, не страдающих IC. Примеры таких пациентов, не страдающих IC, включают пациентов с мочеточниковыми стентами или состояниями болезненного мочевого пузыря.
К современным способам лечения боли в мочевом пузыре относятся пероральные лекарственные препараты, такие как антимускариновые средства, альфа-блокаторы, трициклические антидепрессанты, SSRI, элмирон и габапентин. Эти лекарственные средства могут оказаться неэффективными для некоторых пациентов. К тому же, эти пероральные лекарственные средства принимаются систематически, что может вызвать нежелательные побочные эффекты, и можно не достичь терапевтически эффективных уровней в мочевом пузыре при допустимых уровнях в плазме.
Еще один современный способ лечения включает инстилляцию раствора лекарственного средства (например, лидокаина) непосредственно в мочевой пузырь. Также известны инсталляции растворов других лекарственных средств, таких как диметилсульфоксида (DMSO), антимускариновых средств, гепарина. Другой пригодной процедурой является гидродистенция. Как было показано, ни один из этих способов лечения не имел значительной эффективности или не обеспечивал продолжительный терапевтический эффект.
За последние годы провели ряд исследований процедур инстилляции с помощью лидокаина. Nickel с соавт., BJU International, 103:910-918 (2008), раскрывает исследование, в котором исследовали пациентов с IC и PBS рандомизированным, плацебо-контролируемым, двойным слепым способом, оценивая влияние 5 ежедневных инстилляции подщелоченного раствора лидокаина (200 мг) на показатели эффективности касательно боли в мочевом пузыре и симптомов раздражения при мочеиспускании в день 8 (через три дня после окончания лечения) и в день 15 (через десять дней после окончания лечения). По одному показателю эффективности, по которому наблюдали улучшение в день 8 (индекс симптомов интерстициального цистита или ICSI), в день 15 продолжительное улучшение не наблюдали. По другим показателям эффективности (боль в мочевом пузыре, сильная потребность в мочеиспускании, частота мочеиспускания) при определении либо в день 8 и день 15 (боль в мочевом пузыре), либо только в день 15 (сильная потребность в мочеиспускании, частота мочеиспускания), не наблюдали улучшения после лечения. По одному показателю эффективности, называемому индексом проблем интерстициального цистита (ICPI), наблюдали улучшение как в день 8, так и в день 15, но в день 15 эффект несколько уменьшился. На основании полученных результатов можно предположить, что инстилляции лидокаина в мочевой пузырь, даже при введении по сжатому графику ежедневной инстилляции, не смогли показать продолжительный эффект лечения дольше 10 дней после лечения.
Parsons, Urology 65(1):45-48 (2005), раскрывает исследование, в котором пациентов с IC лечили инсталляциями подщелоченного лидокаина и гепарина в мочевой пузырь в качестве однократного лечения в течение часа, а затем в течение 48 часов оценивали длительность эффекта. В статье описывается, что у 94% пациентов было облегчение через 20 минут после инсталляции, у 50% - через 4 часа и у 3 из 28 пациентов (фигура 1) или ~10% - через 48 часов, указывая на снижение эффекта с течением времени. Кроме того, у ряда пациентов, которым назначали три инсталляции в неделю в течение двух недель, через 48 часов после последней терапии оценивали длительность эффекта; у 80% отметили облегчение симптомов; дальнейшее наблюдение не предусмотрено. На основании полученных результатов можно предположить, что длительность эффекта лечения при однократной инстилляции лидокаина составляет приблизительно 10% через 48 часов.
Henry с соавт., J Urology 165:1900-03 (2001), раскрывает исследование, в котором инстилляции лидокаина проводили как у здоровых добровольцев (для фармакокинетеческих целей), так и у пациентов, страдающих IC. Оценки боли после однократной инстилляции лидокаина показали, что длительность эффекта составляет приблизительно 24 часа: средний показатель боли до лечения был 6,0. Сразу же после лечения он снизился до 1,8. На следующий день средний показатель боли увеличился до 3,7. После второй инстилляции он снова уменьшился до 1,2. Эти результаты подтверждают результаты, представленные в публикациях Parsons и Nickel, на основании которых можно предположить, что длительность эффекта лечения с помощью внутрипузырных растворов лидокаина составляет от 24 до 48 часов.
Желательно было бы обеспечить усовершенствованные способы лечения пациентов, страдающих от боли в мочевом пузыре и симптомов раздражения при мочеиспускании. В частности, желательно было бы обеспечить средства для обеспечения продолжительного эффекта лечения в течение нескольких дней или недель или дольше после периода активного лечения.
Краткое описание
Обеспечиваются усовершенствованные способы лечения пациента с болью в мочевом пузыре и/или симптомами раздражения при мочеиспускании. В одном варианте осуществления способ включает непрерывное введение лидокаина или другого анестезирующего средства в мочевой пузырь пациента на протяжении периода лечения 24 часа или дольше в количестве, эффективном для достижения терапевтического эффекта, который сохраняется после окончания периода лечения, поскольку было обнаружено, что продолжительный эффект лечения боли в мочевом пузыре и симптомов раздражения при мочеиспускании после окончания периода активного лечения может быть достигнут в результате обеспечения непрерывного внутрипузырного лечения лидокаином. В принципе можно применять любые средства доставки лидокаина в мочевой пузырь, если только они непрерывно на протяжении периода лечения 24 часа или дольше обеспечивают терапевтически эффективные количества лидокаина в мочевом пузыре. Непрерывное лечение лидокаином в течение многих дней также эффективно для нормализации нарушений слизистой оболочки мочевого пузыря (признаков патологии или воспаления). Данный способ лечения не только предусматривает ослабление боли у пациента и снижение сильной потребности в мочеиспускании на протяжении периода лечения, но также, к удивлению, предусматривает длительный благоприятный эффект после окончания лечения. С другой стороны предусматривается способ лечения пациента с болью в мочевом пузыре и/или симптомами раздражения при мочеиспускании, который включает введение пациенту лидокаина в количестве, эффективном для достижения измеримой концентрации лидокаина в плазме пациента, непрерывно на протяжении периода лечения по меньшей мере 24 часа.
Краткое описание графических материалов
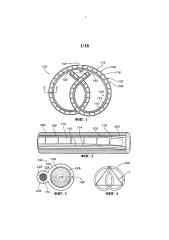
На ФИГ.1 представлен вид сверху варианта осуществления устройства для доставки лекарственного средства.
На ФИГ.2 представлен вид сверху устройства для доставки лекарственного средства, показанного на ФИГ.1, иллюстрирующий устройство для доставки лекарственного средства внутри инструмента для размещения.
На ФИГ.3 представлено поперечное сечение устройства для доставки лекарственного средства, показанного на ФИГ.1, выполненное вдоль линии 3-3 на ФИГ.1.
На ФИГ.4 представлено изображение, показывающее размер варианта осуществления устройства для доставки лекарственного средства по сравнению с приблизительным размером области треугольника мочевого пузыря.
На ФИГ.5 проиллюстрированы примеры форм для удерживающего каркаса устройства для доставки лекарственного средства.
На ФИГ.6 проиллюстрированы примеры конфигураций устройств для доставки лекарственных средств, имеющих по меньшей мере одну дозу доставляемого лекарственного средства и элемент, являющийся удерживающим каркасом.
На ФИГ.7 проиллюстрирован способ имплантации устройства для доставки лекарственного средства.
На ФИГ.8 представлен сагиттальный разрез пациента мужского пола, иллюстрирующий устройство для доставки лекарственного средства, выходящее из инструмента для размещения в мочевом пузыре пациента.
На ФИГ.9 представлен детальный вид поперечного сечения варианта осуществления устройства для доставки лекарственного средства.
На ФИГ.10 представлен детальный вид поперечного сечения другого варианта осуществления устройства для доставки лекарственного средства.
На ФИГ.11-14 представлены графики, показывающие различные показатели улучшения исходных значений, полученные с помощью варианта осуществления устройства для доставки лекарственного средства.
На ФИГ.15-19 представлены графики, показывающие различные показатели индексов, полученные с помощью варианта осуществления устройства для доставки лекарственного средства.
На ФИГ.20 представлен график, показывающий суммарное высвобождение лидокаина на протяжении периода лечения согласно одному варианту осуществления.
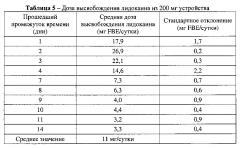
На ФИГ.21 представлен график, показывающий дозу высвобождения лидокаина согласно одному варианту осуществления.
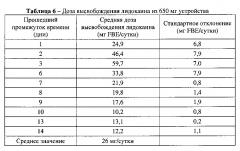
На ФИГ.22 представлен график, показывающий суммарное высвобождение лидокаина на протяжении периода лечения согласно одному варианту осуществления.
На ФИГ.23 представлен график, показывающий высвобождение лидокаина согласно одному варианту осуществления.
Подробное описание
Было обнаружено, что продолжительный эффект лечения боли в мочевом пузыре и симптомов раздражения при мочеиспускании может быть достигнут путем обеспечения непрерывного внутрипузырного лечения лидокаином (или другим аналогом кокаина, или другим анестезирующим средством) на протяжении 24 часов или дольше. В принципе могут применяться любые средства доставки лидокаина в мочевой пузырь, если только непрерывно на протяжении периода лечения 24 часа или дольше в мочевом пузыре обеспечиваются терапевтически эффективные количества лидокаина. Непрерывное лечение лидокаином в течение многих дней также эффективно для нормализации нарушений слизистой оболочки мочевого пузыря (признаков патологии или воспаления). Данный способ лечения не только предусматривает ослабление боли у пациента и снижение сильной потребности в мочеиспускании на протяжении периода лечения, но также, к удивлению, предусматривает длительный благоприятный эффект после окончания лечения.
Как используется в данном документе, выражение «непрерывный» или «непрерывно» в отношении влияния введения пациенту терапевтически эффективных количеств лекарственного средства для лечения включает постоянное или непрерывное высвобождение или периодическое высвобождение при условии поддержания ненулевого уровня лидокаина или другого анестезирующего средства в плазме на протяжении периода лечения, например, по меньшей мере 24 часов. Как используется в данном документе, «ненулевой уровень в плазме» и «измеримая концентрация в плазме» относятся к нижнему пределу обнаружения с применением биоаналитического способа ВЭЖХ, известного в данной области техники.
Как используется в данном документе, «количество, эффективное для достижения терапевтического эффекта, который сохраняется после окончания периода лечения», «продолжительный эффект лечения» или «продолжительный терапевтический эффект» относятся к и включают по меньшей мере 20% улучшение или снижение исходных значений по меньшей мере в один из следующих 7 или более дней после окончания периода лечения: исходный показатель боли в мочевом пузыре, исходный показатель сильной потребности в мочеиспускании мочевого пузыря или количество пациентов, оценивающих свои симптомы как «незначительное улучшение» или «заметное улучшение» в тесте для оценки общего ответа (GRA). В некоторых вариантах осуществления может быть достигнуто по меньшей мере 35% снижение исходного показателя боли в мочевом пузыре через 7 или более дней после окончания периода лечения. В одном варианте осуществления может быть достигнуто по меньшей мере 40% снижение исходного показателя боли в мочевом пузыре через 7 или более дней после окончания периода лечения. В другом варианте осуществления может быть достигнуто по меньшей мере 45% снижение исходного показателя боли в мочевом пузыре через 7 или более дней после окончания периода лечения. В еще одном варианте осуществления может быть достигнуто по меньшей мере 50% снижение исходного показателя боли в мочевом пузыре через 7 или больше дней после окончания периода лечения.
В некоторых вариантах осуществления может быть достигнуто по меньшей мере 45% снижение исходного показателя сильной потребности в мочеиспускании мочевого пузыря через 7 или более дней после окончания периода лечения. В одном варианте осуществления может быть достигнуто по меньшей мере 50% снижение исходного показателя сильной потребности в мочеиспускании мочевого пузыря через 7 или более дней после окончания периода лечения. В другом варианте осуществления может быть достигнуто по меньшей мере 55% снижение исходного показателя сильной потребности в мочеиспускании мочевого пузыря через 7 или более дней после окончания периода лечения. В еще одном варианте осуществления может быть достигнуто по меньшей мере 60% снижение исходного показателя сильной потребности в мочеиспускании мочевого пузыря через 7 или более дней после окончания периода лечения.
В некоторых вариантах осуществления по меньшей мере 35% пациентов оценивают свои симптомы в ходе GRA-теста как «незначительно ослабленные» или «заметно ослабленные» через 7 или более дней после окончания периода лечения. В одном варианте осуществления по меньшей мере 40% пациентов оценивают свои симптомы в ходе GRA-теста как «незначительно улучшенные» или «заметно улучшенные» через 7 или более дней после окончания периода лечения. В другом варианте осуществления по меньшей мере 45% пациентов оценивают свои симптомы в ходе GRA-теста как «незначительно ослабленные» или «заметно ослабленные» через 7 или более дней после окончания периода лечения. В еще одном варианте осуществления по меньшей мере 50% пациентов оценивают свои симптомы в ходе GRA-теста как «незначительно ослабленные» или «заметно ослабленные» через 7 или более дней после окончания периода лечения.
В одном варианте осуществления непрерывное лечение может обеспечиваться размещением устройства для доставки лекарственного средства в мочевом пузыре пациента, которое может непрерывно высвобождать лидокаин в мочевом пузыре на протяжении периода больше одного дня, например, от 2 до 28 дней, от 3 до 21 дня или от 10 до 14 дней. В одном варианте осуществления способ включает высвобождение среднего количества лидокаина (FBE) от приблизительно 10 мг до приблизительно 15 мг в день (например, приблизительно 11 мг, приблизительно 12 мг в день) на протяжении периода лечения 14 дней.
В каждой конкретной разновидности данного варианта осуществления суммарное количество лидокаина (FBE), непрерывно высвобождаемого на протяжении периода 14 дней, составляет приблизительно 130 мг. В одном варианте осуществления доза высвобождаемого лидокаина (FBE) в мочевой пузырь из устройства на протяжении этого периода составляет от 15 мг до 30 мг в день в течение первых 1-4 дней, а затем уменьшается, например, до дозы от 15 мг до 3 мг в день на протяжении оставшегося периода активного лечения. В конце периода лечения устройство можно извлечь из мочевого пузыря.
В одном варианте осуществления, в котором вводится лидокаин, измеримая концентрация лидокаина в плазме во время максимального выделения лидокаина в мочевой пузырь не превышает 65 нг/мл, например, в случае устройства с 650 мг лидокаина, описанного в Примере 2 ниже. В случае устройств с меньшей полезной нагрузкой или систем, высвобождающих меньшую дозу лидокаина, измеримая концентрация лидокаина в плазме во время максимального выделения лидокаина может быть даже ниже, например, не больше 50 нг/мл, 40 нг/мл, 25 нг/мл или 15 нг/мл.
В другом варианте осуществления непрерывное лечение может включать закачивание раствора лидокаина в мочевой пузырь через уретральный катетер непрерывный или пульсирующим способом на протяжении периода лечения. Следует отметить, что однократная инстилляция (болюс) лидокаина в день вряд ли обеспечит непрерывное лечение на протяжении 24-часового периода, поскольку, вероятно, весь неабсорбированный лидокаин пациента выведется при мочеиспускании до конца периода. В еще одном варианте осуществления возможно локальное применение обволакивающего средства к стенки мочевого пузыря, в котором обволакивающее средство включает лидокаин и один или несколько материалов-наполнителей, которые способствуют прилипанию обволакивающего средства к стенке мочевого пузыря, и обеспечивается непрерывное контролируемое высвобождение лидокаина на протяжении периода лечения.
В некоторых вариантах осуществления обволакивающее средство представляет собой мукоадгезивный состав. Примеры мукоадгезивных составов включают без ограничения гели, мази, кремы, пленки, эмульсионные гели, таблетки, полимеры или их комбинацию. Полимеры мукоадгезивного состава могут включать гидрогели или гидрофильные полимеры, поликарбофил (т.е. карбополы и т.п.), хитозан, поливинилпирролидон (PVP), лектин, полиэтиленгликолированные полимеры, виды целлюлозы или их комбинацию. Подходящие виды целлюлозы включают метилцеллюлозу (MC), карбоксиметилцеллюлозу (CMC), гидроксипропилцеллюлозу (HPC) или их комбинации.
В некоторых вариантах осуществления обволакивающее средство представляет собой усилитель проникновения или может его содержать. Неограничивающие примеры усилителей проникновения включают диметилсульфоксид (DMSO), карбоксиметилцеллюлозу натрия (NaCMC), липиды, поверхностно-активные вещества или их комбинации.
В других вариантах осуществления способ может включать высвобождение или закачивание большего или меньшего суммарного количества лидокаина на протяжении периода лечения.
Также предусматривается, что местная система продолжительного высвобождения, такая как трансдермальный пластырь, может применяться для непрерывной доставки лидокаина или другого анестезирующего средства, в определенную область или системно, в организм человека, нуждающегося в лечении IC и/или раздражения при мочеиспускании, в течение 24 часов или дольше для достижения продолжительного эффекта лечения.
Устройства и способы, раскрытые в данном документе, основаны на устройствах и способах, описанных в заявке США №12/825215, поданной 28 июня 2010 года (ТВ 101); заявке США №12/825238, поданной 28 июня 2010 года (ТВ 102); заявке США №12/851494, поданной 5 августа 2010 года (ТВ 108); и заявке США №12/972364, поданной 17 декабря 2010 года (ТВ 112), которые включены в данный документ посредством ссылки.
Термин «пациент» относится к людям, будь то мужчина или женщина, взрослый или ребенок, и может дополнительно включать других млекопитающих, например, из областей ветеринарии или животноводства.
Имплантируемое устройство для доставки лекарственного средства
Вариант осуществления устройства для доставки лекарственного средства 100 проиллюстрирован на ФИГ.1. Устройство 100 включает элемент, являющийся резервуаром для лекарственного средства, 102 и элемент, являющийся удерживающим каркасом, 104. На ФИГ.1 устройство 100 показано в относительно расширенной форме, подходящей для удерживания в организме, а на ФИГ.2 устройство 100 показано в относительно более плоской форме для размещения в канале 200 инструмента для размещения, такого как цистоскоп или другой катетер. После размещения в организме устройство 100 может принимать относительно расширенную форму для удерживания устройства для доставки лекарственного средства в полости тела или просвете.
В целях данного раскрытия такие термины, как «относительно расширенная форма», «относительно более широкая форма» или «форма для удерживания», как правило, означают любую форму, подходящую для удерживания устройства в заданном месте имплантации, включая без ограничений форму «кренделя», показанную на ФИГ.1, которая подходит для удерживания устройства в мочевом пузыре. Аналогичным образом такие термины, как «относительно более плоская форма» или «форма для размещения», как правило, означают любую форму, подходящую для размещения устройства для доставки лекарственного средства в организме, в том числе линейную или продолговатую форму, показанную на ФИГ.2, которая подходит для размещения устройства в рабочем канале катетера, цистоскопа или другого инструмента для размещения, установленного в полости трубчатого органа организма, такого как мочеиспускательный канал. В вариантах осуществления устройство для доставки лекарственного средства может естественным путем принимать относительно расширенную форму и может деформироваться, либо вручную, либо с помощью внешнего приспособления, в относительно более плоскую форму для введения в организм. После размещения устройство может самопроизвольно или естественным путем вернуться в первоначальную, относительно расширенную форму для удерживания в организме.
В проиллюстрированном варианте осуществления элементы, являющиеся резервуаром для лекарственного средства и удерживающим каркасом, 102, 104 устройства для доставки лекарственного средства 100 выровнены в продольном направлении и соединенные друг с другом по всей их длине, хотя возможны и другие конфигурации. Например, элемент, являющийся резервуаром для лекарственного средства, 102 может быть присоединенным к элементу, являющемуся удерживающим каркасом, 104 в отдельных точках или же может быть обособленным от элемента, являющегося удерживающим каркасом, 104 или находиться на расстоянии от него.
В частности, устройство для доставки лекарственного средства 100 включает эластичный или гибкий корпус устройства 106, который задает просвет резервуара для лекарственного средства 108 и просвет удерживающего каркаса 110. Просвет резервуара для лекарственного средства 108 предназначен для размещения лекарственного состава, такого как ряд твердых таблеток лекарственного средства 112, с образованием элемента, являющегося резервуаром для лекарственного средства 102. Просвет удерживающего каркаса 110 предназначен для размещения удерживающего каркаса 114 с образованием элемента, являющегося удерживающим каркасом, 104. Проиллюстрированные просветы 108, 110 отделены друг от друга, хотя возможны и другие конфигурации.
Как показано на поперечном сечении ФИГ.3, корпус устройства 106 включает трубку или стенку 122, которая задает просвет резервуара для лекарственного средства 108, и трубку или стенку 124, которая задает просвет удерживающего каркаса 110. Трубки 122, 124 и просветы 108, 110 могут быть по сути цилиндрическими, при этом просвет резервуара для лекарственного средства 108 имеет относительно больший диаметр, чем просвет удерживающего каркаса 110, хотя можно выбрать и другие конфигурации, например, на основе количества доставляемого лекарственного средства, диаметра удерживающего каркаса и обстоятельств размещения, таких как внутренний диаметр инструмента для размещения. Корпус устройства 106 может быть сформирован как единое целое, например, формованием или выдавливанием, хотя возможно и отдельное создание и сборка трубок 122, 124. Стенка 124, которая задает просвет удерживающего каркаса 110, может простираться на всю длину стенки 122, которая задает просвет резервуара для лекарственного средства 108, так что просвет удерживающего каркаса 110 имеет ту же длину, что и просвет резервуара для лекарственного средства 108, как и показано, хотя в других вариантах осуществления одна стенка может быть короче другой стенки. Дополнительно, в проиллюстрированном варианте осуществления две стенки 122, 124 присоединены вдоль всей длины устройства, хотя может применяться прерывистое соединение.
В стенке 124 можно сделать отверстие 118, которое задает просвет резервуара для лекарственного средства 108. Отверстие 118 может обеспечить проход для высвобождения лекарственного средства из просвета резервуара для лекарственного средства 108, как дополнительно описано ниже. Однако в некоторых вариантах осуществления отверстие 118 может и не делаться.
Как показано на ФИГ.1, просвет резервуара для лекарственного средства 108 заполнен рядом единиц лекарственного средства 112, расположенных последовательно. Например, может быть загружено от приблизительно 10 до приблизительно 100 единиц лекарственного средства 112, а именно от приблизительно 30 до приблизительно 70 единиц лекарственного средства 112 или, более точно, от приблизительно 50 до 60 единиц лекарственного средства 112. Однако может использоваться любое количество единиц лекарственного средства. Просвет резервуара для лекарственного средства 108 включает вход 130 и выход 132, которые показаны в виде относительно круглых отверстий на противоположных концах просвета резервуара для лекарственного средства 108. Вход 130 позволяет расположить единицы лекарственного средства 112 в просвете резервуара для лекарственного средства 108 во время загрузки и сборки устройства, а именно с помощью потока сжатого газа, при этом выход 132 обеспечивает истечение потока сжатого газа для выпуска из просвета резервуара для лекарственного средства 108. После загрузки единиц лекарственного средства 112 по меньшей мере двумя концевыми заглушками 120 закрывают вход 130 и выход 132. Концевые заглушки 120 могут представлять собой цилиндрические заглушки, вставленные во вход 130 и выход 132, при этом каждая имеет немного больший наружный диаметр, чем внутренний диаметр просвета резервуара для лекарственного средства 108, так что заглушки сильно закрывают вход 130 и выход 132 и плотно удерживаются на своем месте. В некоторых случаях можно расположить ряд концевых заглушек 120 на входе 130 и выходе 132. Концевыми заглушками 120 могут служить силиконовые заглушки. Также могут использоваться не концевые заглушки 120, при этом вход 130 и выход 132 можно закрыть с помощью материала, например клеящего вещества, который помещают в просвет резервуара для лекарственного средства 108 в поддающейся обработке форме, и он затвердевает там.
В некоторых вариантах осуществления таблетки лекарственного средства 112 могут заполнять не весь просвет резервуара для лекарственного средства 108. В таких вариантах осуществления может использоваться наполнитель для заполнения оставшегося пространства просвета резервуара для лекарственного средства 108. Например, лекарственные таблетки 112 могут загружаться в центральную часть просвета резервуара для лекарственного средства 108, а наполнитель может загружаться в оставшиеся концевые участки просвета резервуара для лекарственного средства 108. Наполнителем можно заполнять концевые участки просвета резервуара для лекарственного средства 108 после заполнения просвета таблетками лекарственного средства 112. Наполнителем может служить полимерный материал. Полимерный материал можно помещать в просвет резервуара для лекарственного средства 108 в поддающейся обработке форме, и он может затвердевать там. Подходящие полимерные материалы могут затвердевать при комнатной температуре или в ответ на внешний раздражитель, такой как тепло. В некоторых случаях наполнитель может закрывать вход 130 и выход 132, при этом могут обеспечиваться, а могут и не обеспечиваться концевые заглушки 120. Наполнителем также может служить ряд концевых заглушек 120, вставленных в концевые участки просвета резервуара для лекарственного средства 108.
После загрузки единиц лекарственного средства 112 между соседними единицами лекарственного средства 112 могут образоваться пустоты 116 или дыры. Пустоты или дыры 116 могут служить в качестве выступов, которые содействуют деформации или перемещению устройства 100, при этом позволяя отдельным единицам лекарственного средства 112 сохранять свою твердую форму во время хранения и размещения. Таким образом, устройство для доставки лекарственного средства 100 может быть относительно гибким или деформируемым, несмотря на заполнение твердым лекарственным средством, так как каждая единица лекарственного средства 112 может перемещаться относительно соседних единиц лекарственного средства 112. По всей длине просвета резервуара для лекарственного средства 108 устройства единицы лекарственного средства 112 могут иметь одинаковый состав или могут различаться по составу, а в некоторых случаях единицы лекарственного средства 112 разных составов могут находиться в отдельных резервуарах, которые разделены либо в продольном направлении, либо радиально по всей длине просвета резервуара для лекарственного средства 108.
В просвет удерживающего каркаса 110 помещается удерживающий каркас 114, которым может выступать упругая проволока. Удерживающий каркас 110 можно выполнить с возможностью самопроизвольного возвращения до формы для удерживания, такой как проиллюстрированная форма «кренделя» или другая свернутая форма. В частности, удерживающий каркас 114 может удерживать устройство 100 в организме, например, в мочевом пузыре. Например, удерживающий каркас 114 может иметь предел упругости и модуль упругости, что позволяет вводить устройство 100 в организм в относительно более плоской форме, позволяет устройству 100 возвращать относительно расширенную форму, оказавшись в организме, и не позволяет устройству принимать относительно более плоскую форму в организме в ответ на действие предполагаемых сил, таких как гидродинамические силы, связанные с сокращением мышцы-сжимателя и мочеиспусканием. Таким образом, после имплантации устройство 100 может удерживаться в организме, ограничивая или предотвращая случайный выброс.
Материал, применяемый для создания корпуса устройства 106, может быть эластичным или гибким для обеспечения перемещения устройства 100 между формами для размещения и удерживания. Если устройство находится в форме для удерживания, элемент, являющийся удерживающим каркасом, 104 может стремиться лечь внутри элемента, являющегося резервуаром для лекарственного средства, 102, как и показано, хотя в других случаях элемент, являющийся удерживающим каркасом, 104 может быть размещен внутри, снаружи, над или под элементом, являющимся резервуаром для лекарственного средства, 102. Гибкий материал также позволяет корпусу устройства 106 выгнуться наружу или расшириться по окружности в ответ на поток сжатого газа через просвет резервуара для лекарственного средства 108 во время наполнения лекарственным средством, как описано ниже. Материал, применяемый для создания корпуса устройства 106, также может быть водопроницаемым или пористым, чтобы растворяющая жидкость могла проникнуть в элемент, являющийся резервуаром для лекарственного средства, 102 для растворения единиц лекарственного средства 112 после имплантации устройства. Например, может применяться силикон или другой биологически совместимый эластомерный материал.
В одном варианте осуществления, в котором устройство для доставки лекарственного средства 100 предназначено для имплантации в мочевой пузырь, устройство для доставки лекарственного средства 100 предназначено для введения в мочевой пузырь (и необязательно для извлечения из мочевого пузыря) через мочеиспускательный канал цистоскопически. Таким образом, устройство выбирается по величине и форме для прохождения по узкому трубчатому каналу инструмента для размещения, такого как катетер или цистоскоп.
В одном варианте осуществления, в котором устройство для доставки лекарственного средства предназначено для имплантации в мочевой пузырь, устройство для доставки лекарственного средства предназначено для введения в мочевой пузырь через мочеиспускательный канал цистоскопически. Таким образом, устройство выбирается по величине и форме для прохождения по узкому трубчатому каналу инструмента для размещения, такого как катетер или цистоскоп.
Обычно цистоскоп для взрослого человека имеет наружный диаметр от приблизительно 5 до 7 мм, при этом рабочий канал имеет внутренний диаметр от приблизительно 2,4 мм до приблизительно 2,6 мм. В других вариантах осуществления цистоскоп имеет рабочий канал с большим внутренним диметром, например, внутренним диаметром 4 мм или более. Таким образом, устройство может быть относительно небольшим по размеру. Например, если устройство упруго деформировано до относительно более плоской формы, то устройство для взрослого пациента может иметь общий наружный диаметр, составляющий приблизительно 3,75 мм или меньше, например, приблизительно 2,6 мм или меньше. Для пациентов детского возраста предусмотрены меньшие размеры устройства. Наряду с возможностью введения, относительно небольшой размер устройства может также уменьшить дискомфорт пациента и повреждение мочевого пузыря.
Общая конфигурация устройства преимущественно предназначена для гарантии того, что устройство приемлемо для пациента, при его размещении in vivo, как описано в опубликованной заявке на патент США №2011/0152839 A1, Cima с соавт., которая включена в данный документ посредством ссылки. Геометрическая форма устройства может быть изготовлена в соответствии с требованиями заказчика для не допущения или сведения к минимуму действия нежелательных контактных сил или давлений, связанных с ощущением сильной потребности в мочеиспускании. Внутри трехмерного пространства, занятого устройством в форме для удерживания, максимальный размер устройства в любом направлении составляет менее 10 см, приблизительный диаметр мочевого пузыря при его наполнении. В некоторых вариантах осуществления максимальный размер устройства в любом направлении может быть менее чем приблизительно 9 см, например, приблизительно 8 см, 7 см, 6 см, 5 см, 4,5 см, 4 см, 3,5 см, 3 см, 2,5 см или меньше. В отдельных вариантах осуществления максимальный размер устройства в любом направлении составляет менее чем приблизительно 7 см, например, приблизительно 6 см, 5 см, 4,5 см, 4 см, 3,5 см, 3 см, 2,5 см или меньше. В предпочтительных вариантах осуществления максимальный размер устройства в любом направлении составляет менее чем приблизительно 6 см или меньше.
В частности, трехмерное пространство, занятое устройством, задается тремя перпендикулярными направлениями. Вдоль одного из этих направлений устройство имеет свой максимальный размер, а вдоль двух других направлений устройство может иметь меньшие размеры. Например, меньшие размеры в двух других направлениях могут быть меньше приблизительно 4 см, например, приблизительно 3,5 см, 3 см или меньше. В предпочтительном варианте осуществления устройство имеет размер по меньшей мере в одном из этих направлений, составляющий менее 3 см.
Общая форма устройства может позволять устройству переориентироваться в мочевом пузыре для уменьшения его соприкосновения или контакта со стенкой мочевого пузыря. Например, общая внешняя форма устройства может быть изогнутой, и все или большинство внешних или выступающих поверхностей устройства могут быть в значительной степени закруглены. Устройство также может быть в значительной степени лишено острых краев, а его внешние поверхности могут изготавливаться из материала, который испытывает уменьшенное зацепление при силах трени