Антитела, которые специфично связывают альфа-токсин staphylococcus aureus, и способы их применения
Иллюстрации
Показать всеИзобретение относится к биохимии. Описано выделенное антитело или его антигенсвязывающий фрагмент. Антитело или его антигенсвязывающий фрагмент иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus и включают CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78; CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4; CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74. Также описаны набор и композиция для предупреждения, лечения или контроля пневмонии у субъекта и способ предупреждения или лечения пневмонии у субъекта. Изобретение расширяет арсенал средств для лечения пневмонии. 7 н. и 5 з.п. ф-лы, 27 ил., 11 табл., 14 пр.
Реферат
Область техники, к которой относится изобретение
Технология в части относится к антителам и в определенных вариантах осуществления к антителам, которые специфично связываются с альфа-токсином Staphylococcus aureus.
Уровень техники
Staphylococcus aureus представляет собой грамположительную, факультативно аэробную, образующую скопления кокковую бактерию, которая обычно колонизирует нос и кожу здоровых людей. Примерно 20-30% населения колонизированы S. aureus в любое время. Бактерии Staphylococcus aureus, иногда также называемые "staph", "Staph, aureus" или "S. aureus", считаются условно-патогенными микроорганизмами, которые вызывают незначительные инфекции (например, гнойнички, фурункулы) и системные инфекции.
Слизистый и эпидермальный барьеры (кожа) в норме защищают от инфекций S. aureus. Нарушение этих естественных барьеров в результате повреждений (например, ожогов, травмы, хирургических вмешательств и подобного) резко повышает риск инфекции. Заболевания, которые подвергают опасности иммунную систему (например, диабет, терминальная стадия почечной недостаточности, рак и подобное), также повышают риск инфицирования. Оппортунистические инфекции S. aureus могут стать серьезными, вызывающими ряд заболеваний или состояний, неограничивающие примеры которых включают бактериемию, флегмону, инфекции века, пищевое отравление, инфекции суставов, кожные инфекции, синдром ошпаренной кожи, синдром токсического шока, пневмонию, остеомиелит, эндокардит, менингит и абсцедирование.
S. aureus может также вызывать инфекцию и заболевание у животных. Например, S. aureus часто связан с коровьим маститом.
S. aureus экспрессирует ряд факторов вирулентности, включая капсулярные полисахариды и белковые токсины. Одним фактором вирулентности, часто связанным с инфекцией S. aureus, который является главным цитотоксическим агентом, является альфа-токсин (также известный как альфа-гемолизин или HIa), порообразующий и гемолитический экзопротеин, продуцируемый наиболее патогенными штаммами S. aureus. Токсин образует гептамерные поры в мембранах чувствительных клеток, таких как лейкоциты, тромбоциты, эритроциты, моноциты периферической крови, макрофаги, кератиноциты, фибробласты и эндотелиальные клетки. Образование пор альфа-токсина часто ведет к дисфункции или лизису клетки.
Краткое описание раскрытия
В определенных вариантах осуществления предлагается очищенное или выделенное антитело или его антигенсвязывающий фрагмент, причем антитело или фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus. Выражения "полипептид альфа-токсина", "мономер альфа-токсина" и "олигомеры альфа-токсина (например, гептамер)" называются в данном документе как "AT", "мономер AT" и "олигомер AT", соответственно. Выражение "вариабельный участок тяжелой цепи" называется "VH". Выражение "вариабельный участок легкой цепи" называется "VL".
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, включает (a) CDR1 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 7, 10, 13 или 69 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; (b) CDR2 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 8, 11, 14, 17, 70 или 75 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; и (c) CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VH, CDR2 VH и CDR3 VH, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO 7, 8 и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76 или SEQ ID NO: 69, 70 и 71 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к ним.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, включают (a) CDR1 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 1 или 4 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; (b) CDR2 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 2, 5, 73 или 77 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; и (c) CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 1, 2 и 3; SEQ ID NO: 4, 5 и 6; SEQ ID NO: 1, 2 и 64; SEQ ID NO: 1, 2 и 68; SEQ ID NO: 1, 73 и 74 или SEQ ID NO: 1, 77 и 74 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к ним.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, содержит CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к: (a) CDR1 VH, содержащему аминокислотную последовательность SEQ ID NO: 7,10, 13 или 69; (b) CDR2 VH, содержащему аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; (c) CDR3 VH, содержащему аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78; (d) CDR1 VL, содержащему аминокислотную последовательность SEQ ID NO: 1 или 4; (e) CDR2 VL, содержащему аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (f) CDR3 VL, содержащему аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 7, 8, 9, 1, 2 и 3; SEQ ID NO: 10, 11, 12, 1, 2 и 3; SEQ ID NO: 13, 14, 15, 4, 5 и 6; SEQ ID NO: 7, 17, 18, 1, 2 и 3; SEQ ID NO: 7, 8, 16, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 64; SEQ ID NO: 7, 8, 66, 1, 2 и 64; SEQ ID NO: 7, 8, 67, 1, 2 и 68; SEQ ID NO: 7, 8, 67, 1, 2 и 64; SEQ ID NO: 7, 8, 78, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1,2 и 68; SEQ ID NO: 69, 70, 71, 1, 2 и 68; SEQ ID NO: 7, 8, 72, 1, 73 и 74; SEQ ID NO: 69, 75, 71, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 77 и 74; SEQ ID NO: 69, 70, 71, 1, 77 и 74 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к ним.
В некоторых вариантах осуществления предлагается композиция, которая содержит выделенное антитело или его антигенсвязывающий фрагмент, которые (i) включают VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, где три CDR VH-домена цепи включают (a) CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; (b) CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; и (c) CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78. В конкретных вариантах осуществления CDR1 VH, CDR2 VH и CDR3 VH соответствуют SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO 7, 8, и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76; или SEQ ID NO: 69, 70 и 71.
В определенных вариантах осуществления также предлагается композиция, которая содержит выделенное антитело или его антигенсвязывающий фрагмент, которые (i) включают VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, где три CDR VL-домена цепи включают (a) CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4; (b) CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (c) CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74. В конкретных вариантах осуществления CDR1 VL, CDR2 VL и CDR3 VL соответствуют SEQ ID NO: 1, 2 и 3; SEQ ID NO: 4, 5 и 6; SEQ ID NO: 1, 2 и 64; SEQ ID NO: 1, 2 и 68; SEQ ID NO: 1, 73 и 74; или SEQ ID NO: 1, 77 и 74.
В некоторых вариантах осуществления также предлагаются композиции, которые включают выделенное антитело или его антигенсвязывающий фрагмент, которые (i) иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, (ii) содержат вариабельный домен тяжелой цепи, который по меньшей мере на 90% идентичен аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и (iii) содержат вариабельный домен легкой цепи, который по меньшей мере на 90% идентичен аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи с SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62 и вариабельный домен легкой цепи с SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат VH и VL, где каждый из VH и VL идентичен или каждый из VH и VL по меньшей мере на 90%, 95% или 98% идентичен аминокислотным последовательностям VH и VL SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
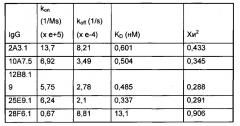
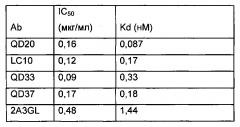
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и характеризуется одной или несколькими характеристиками, выбранными из группы, состоящей из: (а) константы аффинности (KD) приблизительно 13 нМ или менее в отношении полипептида альфа-токсина Staphylococcus aureus; (b) ингибирования олигомеризации полипептида альфа-токсина Staphylococcus aureus по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%; и (c) снижения лизиса A549 (легочный эпителий) или ТНР-1 (моноциты) и лизиса эритроцитов по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%, где выделенное антитело или антигенсвязывающий фрагмент и токсин S. aureus присутствуют в молярном отношении приблизительно 1:1.
В некоторых вариантах осуществления эритроцит представляет собой клетку из крови. В определенных вариантах осуществления клеткой из крови является красное кровяное тельце. В некоторых вариантах осуществления лизис определяют с помощью in vitro анализа образования гемолитических бляшек. В других вариантах осуществления лизис определяют с помощью in vitro анализа высвобождения лактатдегидрогеназы. Эти анализы дополнительно описаны ниже, или их может провести в установленном порядке специалист в данной области техники.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент включает диагностическое средство. В определенных вариантах осуществления диагностическое средство включает визуализирующее средство. Диагностическое средство в некоторых вариантах осуществления включает детектируемую метку. В определенных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент связаны с диагностическим средством посредством линкера.
В некоторых вариантах осуществления полипептид альфа-токсина Staphylococcus aureus является нативным полипептидом токсина. Полипептид альфа-токсина Staphylococcus aureus в некоторых вариантах осуществления включает одну или несколько аминокислотных делеций, присоединений и/или замен (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 аминокислотных вставок, делеций и/или замен) по отношению к нативному полипептиду токсина. В некоторых вариантах осуществления полипептид альфа-токсина Staphylococcus aureus является рекомбинантным белком. В определенных вариантах осуществления полипептид альфа-токсина Staphylococcus aureus включает аминокислотную последовательность SEQ ID NO: 39 или ее фрагменты. В некоторых других вариантах осуществления полипептид альфа-токсина Staphylococcus aureus является аттенуированной формой полипептида, как например, H35L, в котором гистидин в положении 35 полипептида дикого типа замещен лейцином, например, как представлено в SEQ ID NO: 40.
В определенных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и включает CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или его антигенсвязывающий фрагмент нейтрализует полипептид альфа-токсина Staphylococcus aureus. В некоторых вариантах осуществления выделенное антитело или антигенсвязывающий фрагмент выделенного антитела иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и включает CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или включающую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или его антигенсвязывающий фрагмент нейтрализует полипептид альфа-токсина Staphylococcus aureus.
В определенных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и включает CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или включающую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или его антигенсвязывающий фрагмент ингибирует олигомеризацию полипептида альфа-токсина Staphylococcus aureus. В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и включает CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или включающую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или его антигенсвязывающий фрагмент ингибирует олигомеризацию полипептида альфа-токсина Staphylococcus aureus. В определенных вариантах осуществления ингибирование олигомеризации определяют с помощью in vitro анализа связывания и электрофоретической подвижности.
Также в данном документе предлагаются наборы, включающие (а) композицию, содержащую выделенное антитело или его антигенсвязывающий фрагмент, и (b) инструкции по применению композиции или указания для получения инструкций по применению композиции. В некоторых вариантах осуществления антитело в композиции связано с твердой подложкой. В определенных вариантах осуществления твердая подложка представляет собой гранулу, и в некоторых вариантах осуществления гранула представляет собой гранулу сефарозы. В некоторых вариантах осуществления инструкции по применению включают одно или несколько полипептидов выделения, очистки, детекции и количественного определения альфа-токсина Staphylococcus aureus.
В определенных вариантах осуществления набор включает буфер и мембрану, подходящие для вестерн-блоттинга. В некоторых вариантах осуществления набор включает загрузочный буфер и элюирующий буфер. В определенных вариантах осуществления набор включает буфер, подходящий для твердофазного иммуноферментного анализа (ELISA).
Также в данном документе предлагается способ предупреждения, лечения или контроля пневмонии у субъекта, включающий: введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, нуждающемуся в этом субъекту в количестве, эффективном для предупреждения, лечения или контроля пневмонии.
В некоторых вариантах осуществления с помощью данного способа предупреждают пневмонию. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с линейным или конформационным эпитопом, который содержит один или несколько остатков, или часть или фрагмент из аминокислот 1-293 или из аминокислот 51-293 полипептида стафилококкового альфа-токсина. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, где антитело или антигенсвязывающий фрагмент имеет контактирующие остатки в T261, T163, N264, K266 и K271 из SEQ ID NO: 39. В дополнительных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывает фрагмент альфа-токсина, где антитело или антигенсвязывающий фрагмент имеет дополнительные контактирующие остатки в N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191 и R200 из SEQ ID NO: 39.
В определенных вариантах осуществления антитело или антигенсвязывающий фрагмент имеет контактирующие остатки в N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191, R200, T261, T163, N264, K266 и K271 из SEQ ID NO: 39. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 261-272 из SEQ ID NO: 39. В дополнительных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 248-277 из SEQ ID NO: 39. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 173-201 из SEQ ID NO: 39, и фрагментом, содержащим аминокислоты 261-272 из SEQ ID NO: 39, или с фрагментом, содержащим аминокислоты 173-201 из SEQ ID NO: 39, и фрагментом, содержащим аминокислоты 248-277 из SEQ ID NO: 39.
В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, где антитело или антигенсвязывающий фрагмент имеет контактирующие остатки в T261, T163, N264, K266 и K271 из SEQ ID NO: 40. В дополнительных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывает фрагмент альфа-токсина, где антитело или антигенсвязывающий фрагмент имеет дополнительные контактирующие остатки в N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191 и R200 из SEQ ID NO: 40.
В определенных вариантах осуществления антитело или антигенсвязывающий фрагмент имеет контактирующие остатки в N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191, R200, T261, T163, N264, K266 и K271 из SEQ ID NO: 40. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 261-272 в SEQ ID NO: 40. В дополнительных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 248-277 в SEQ ID NO: 40. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 173-201 в SEQ ID NO: 40, и фрагментом, содержащим аминокислоты 261-272 в SEQ ID NO: 40.
В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим (1) аминокислоты 261-272, (2) аминокислоты 248-277 или (3) аминокислоты 173-201 и 261-272 полипептида стафилококкового альфа-токсина или варианта полипептида стафилококкового альфа-токсина, где аминокислоты 261-272, аминокислоты 248-277 или аминокислоты 173-201 соответствуют такой же аминокислотной последовательности, как и у соответствующего участка в SEQ ID NO: 39, или содержат замены в пределах фрагмента с соответствующим участком в SEQ ID NO: 39, где замены не изменяют способность антитела или его антигенсвязывающего фрагмента связываться с полипептидом альфа-токсина.
В некоторых вариантах осуществления предлагается способ предупреждения, лечения или контроля состояния, вызванного кожной инфекцией у субъекта, который включает: введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus согласно настоящему изобретению, нуждающемуся в этом субъекте в количестве, эффективном для предупреждения, лечения или контроля состояния, вызванного кожной инфекцией. В определенных вариантах осуществления состоянием, вызванным кожной инфекцией, является дерматонекроз. В некоторых вариантах осуществления состояние, вызванное кожной инфекцией, включает инфицирование кожи Staphylococcus aureus. В определенных вариантах осуществления с помощью способа предупреждают состояние, вызванное кожной инфекцией.
В некоторых вариантах осуществления обеспечен способ предупреждения, лечения или контроля состояния, связанного с инфекцией Staphylococcus aureus, который включает: введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, который иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus, согласно настоящему изобретению, нуждающемуся в этом субъекту, в количестве, эффективном для снижения олигомеризации полипептида токсина. В определенных вариантах осуществления с помощью способа предупреждают состояние, связанное с инфекцией Staphylococcus aureus.
В некоторых вариантах осуществления предлагается способ предупреждения, лечения или контроля инфекции S. aureus, связанной с лечением диализом, хирургическим вмешательством с высоким риском, пневмонией, ИВЛ-ассоциированной пневмонией (VAP) или повторным инфицированием после предшествующей выписки из больницы при предыдущем лечении или хирургическом вмешательстве, который включает введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, нуждающемуся в этом субъекту.
В некоторых вариантах осуществления также предлагается способ предупреждения, лечения или контроля состояния, связанного с инфекцией Staphylococcus aureus, который включает введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, нуждающемуся в этом субъекту в количестве, эффективном для снижения клеточного лизиса. В определенных вариантах осуществления с помощью способа предупреждают состояние, связанное с инфекцией Staphylococcus aureus. В некоторых вариантах осуществления клетка представляет собой эритроцит из крови или легкого.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с линейным или конформационным эпитопом, который содержит один или несколько остатков. В определенных вариантах осуществления композиция, вводимая субъекту, соответствует любой из композиций, описанных в данном документе.
В определенных вариантах осуществления также предлагается способ, который включает: введение композиции, описанной в данном документе, в клетки; и детекцию наличия, отсутствия или величины биологического эффекта, связанного с введением композиции в клетки. В некоторых вариантах осуществления также предлагается способ, который включает: введение композиции, описанной в данном документе, субъекту; и детекцию наличия, отсутствия или величины биологического эффекта у субъекта, связанного с введением композиции. В определенных вариантах осуществления также предлагается способ, который включает: введение композиции, описанной в данном документе, субъекту; и отслеживание состояния субъекта.
В некоторых вариантах осуществления также предлагается способ нейтрализации полипептида альфа-токсина Staphylococcus aureus путем введения нуждающемуся в этом субъекту эффективного количества любой из композиций, описанных в данном документе, для нейтрализации полипептида токсина.
В определенных вариантах осуществления также предлагается способ предупреждения, лечения или контроля состояния, опосредованного инфекцией Staphylococcus aureus, у нуждающегося в этом субъекта, причем способ включает введение субъекту эффективного количества любой из композиций, описанных в данном документе, для предупреждения, лечения или контроля состояния. В некоторых вариантах осуществления также предлагается способ лечения, предупреждения или облегчения симптомов расстройства, опосредованного альфа-токсином Staphylococcus aureus, у нуждающегося в этом субъекта, включающий введение эффективного количества любой из композиций, описанных в данном документе, субъекту для лечения, предупреждения или ослабления симптомов.
В определенных вариантах осуществления также предлагается способ диагностики состояния, опосредованного альфа-токсином Staphylococcus aureus, у субъекта, который включает отбор субъекта, нуждающегося в диагностике, и введение субъекту эффективной для диагностики дозы любой из композиций, описанных в данном документе. В некоторых вариантах осуществления субъектом является домашнее животное, и в определенных вариантах осуществления субъектом является человека.
Определенные варианты осуществления описаны дополнительно в следующем описании, примерах, формуле изобретения и графических материалах.
Краткое описание графических материалов
Графические материалы иллюстрируют в данном документе варианты осуществления и являются неограничивающими. Для ясности и простоты иллюстрации графические материалы выполнены без масштабирования, и в некоторых случаях различные виды могут быть показаны преувеличенными или укрупненными для облегчения понимания конкретных вариантов осуществления.
На фигурах 1A и 1B графически проиллюстрировано выраженное в процентах ингибирование лизиса красных кровяных телец антителами к альфа-токсину. Результаты и подробности эксперимента описаны в Примере 3.
На фигурах 2A и 2B графически проиллюстрировано выраженное в процентах ингибирование лизиса A549 и ТНР-1 клеток человека антителами к альфа-токсину. Результаты и подробности эксперимента описаны в Примере 3.
На фигурах 3А и 3В проиллюстрированы результаты пассивной иммунизации ингибирующими mAb к альфа-токсину S. aureus в модели дерматонекроза. Группы из 5 BALB/c мышей подвергали пассивной иммунизации 5 мг/кг ингибирующих mAb, и затем инфицировали S. aureus Wood, и размер пораженных участков отслеживали в течение 6 суток. На фигуре 3A показаны фотографии размера пораженных участков через 6 суток после инфицирования. На фигуре 3B графически проиллюстрировано снижение размера пораженных участков за время течения инфекции. Результаты и подробности эксперимента описаны в Примере 4.
На фигурах 4-7 графически проиллюстрирована выживаемость мышей, подвергшихся пассивной иммунизации различными mAb, описанными в данном документе, в модели пневмонии. На фигуре 4 проиллюстрированы результаты на C57BL/6J мышах, подвергшихся пассивной иммунизации 5, 15 и 45 мг/кг очищенного 12B8.19 за 24 часа до инфицирования S. aureus USA300 (3×108 КОЕ).
На фигуре 5 проиллюстрированы результаты на C57BL/6J мышах, подвергшихся пассивной иммунизации 5, 15 и 45 мг/кг очищенного 2A3.1 за 24 часа до инфицирования S. aureus USA300 (3×108 КОЕ).
На фигуре 6 проиллюстрированы результаты на C57BL/6J мышах, подвергшихся пассивной иммунизации 5, 15 и 45 мг/кг очищенного 28F6.1 за 24 часа до инфицирования S. aureus USA300 (3×108 КОЕ).
На фигуре 7 проиллюстрированы результаты на C57BL/6J мышах, подвергшихся пассивной иммунизации 5, 15 и 45 мг/кг очищенного 10A7.5 за 24 часа до инфицирования S. aureus USA300 (3×108 КОЕ). Результаты и подробности эксперимента описаны в Примере 5.
На фигурах 8A и 8B графически проиллюстрировано распределение бактерий в легком (фигура 8A) и почке (фигура 8B) у мышей, подвергшихся пассивной иммунизации полностью человеческим вариантом mAb 2A3.1 (например, 2A3hu) или изотипическим контролем (R347). C57BL/6J мыши подвергались пассивной иммунизации 2A3hu (15 мг/кг) за 24 часа до инфицирования USA300. Также собирали образцы для измерения уровней цитокинов и для гистопатологического анализа. Результаты и подробности эксперимента описаны в Примере 5.
На фигуре 9 графически проиллюстрировано снижение продукции воспалительных цитокинов после пассивной иммунизации mAb 2A3hu. Обведенные кругами результаты получены в момент времени 24 часа. Результаты и подробности эксперимента описаны в Примере 6.
На фигуре 10 показаны иллюстративные фотографии результатов гистологического исследования легкого у мышей, обработанных контролем R347 (смотри верхнюю и нижнюю фотографии в левой части фигуры 10) или обработанных 2A3hu (смотри верхнюю и нижнюю фотографии в правой части фигуры 10). Результаты и подробности эксперимента описаны в Примере 6.
На фигуре 11 графически проиллюстрировано, что mAb к AT (альфа-токсин S. aureus), описанные в данном документе, не ингибируют связывание нативного альфа-токсина (nAT) с рецепторами, присутствующими на "тенях" эритроцитов кролика. Результаты и подробности эксперимента описаны в Примере 8.
На фигуре 12 показаны иллюстративные результаты вестерн-блоттинга, демонстрирующие ингибирование образования гептамера антителами, описанными в данном документе. Результаты и подробности эксперимента описаны в Примере 8.
На фигурах 13A и 13B продемонстрированы иллюстративные результаты вестерн-блоттинга, подтверждающие ингибирование олигомеризации mAb к AT, описанными в данном документе, и, кроме того, проиллюстрировано, что ингибирование можно оценить с помощью титрования. Результаты и подробности эксперимента описаны в Примере 8.
На фигурах 14-16 графически проиллюстрирована активность полностью человеческих антител к AT в анализах ингибирования клеточного лизиса. Полностью человеческие варианты IgG антител к AT проявляют активность, подобную соответствующим химерным IgG антителам к AT. Ингибирующую активность полностью человеческих IgG антител сравнивали с химерными IgG антителами при лизисе RBC (красное кровяное тельце) кролика (фигура 14), лизисе А549 клеток (фигура 15) и лизисе ТНР-1 клеток (фигура 16). Результаты и подробности эксперимента описаны в Примере 9.
На фигуре 17, A и B графически проиллюстрировано снижение размера пораженных участков за время течения инфекции после пассивной иммунизации ингибирующими mAb QD20, QD37, LC10, QD33, 2A3 к альфа-токсину S. aureus и контрольным R347 в модели дерматонекроза. Группы из 5 BALB/c мышей подвергали пассивной иммунизации 1 мг/кг (фиг. 17, A) и 0,5 мг/кг (фиг. 17, B) указанных ингибирующих mAb, и затем инфицировали S. aureus Wood, и размер пораженных участков отслеживали в течение 6 суток.
На фигуре 18 графически проиллюстрирована выживаемость мышей, подвергшихся пассивной иммунизации mAb QD20, QD37, LC10, QD33, 2А3 и контрольным R347 в модели пневмонии. Мышей подвергали пассивной иммунизации 5 мг/кг очищенного mAb за 24 часа до инфицирования S. aureus USA300 (~2×108 КОЕ).
На фигуре 19 графически изображена характеристика связывания LC10 YTE с альфа-токсином и LukF-PV с использованием ELISA. Бактериальным лизатом, содержащим меченный His альфа-токсин или LukF-PV, покрывали поверхность 96-луночного планшета. LC10 YTE или мышиные mAb к His добавляли в лунки с покрытием и инкубировали в течение 1 часа. Уровни экспрессии альфа-токсина и LukF-PV были подобны показанным по сигналам связывания mAb к His, тогда как только LC10 YTE в значительной степени связывался с альфа-токсином, а не LukF-PV.
На фигуре 20 показаны выравнивания последовательностей белков альфа-токсина и LukF-PV. Альфа-токсин характеризуется 25% идентичностью аминокислотной последовательности с LukF-PV (номер доступа B1Q018 в UniProtKB/TrEMBL). Нумерация аминокислот основывается на зрелых белках. Выравнивание проводили с использованием способа Clustal W. Сегмент аа 248-277 выделен подчеркиванием.
На фигуре 21 изображены в виде рисунков структуры альфа-токсина. A) Изображение в виде рисунка смоделированной структуры растворимого мономера альфа-токсина. Смоделированную структуру мономера альфа-токсина построили с помощью Maestro 9.1 (Schrodinger Inc) с использованием кристаллической структуры LukF-PV в качестве шаблона (Protein Data Bank entry 1PVL) (Pedelacq, Maveyraud et al. 1999). В) Изображение в виде рисунка кристаллической структуры протомера альфа-токсина из гексамера (запись 7AHL в Protein Data Bank) (Song, Hobaugh et al. 1996). aa 101-110 показаны синим, аа 224-231 - оранжевым и аа 248-277 - красным.
Фигура 22 представляет собой ленточную диаграмму комплекса Fab LC10 YTE - α-токсина. Молекула альфа-токсина указана лентой в верхней части диаграммы. Тяжелая цепь указана темной лентой в нижней части диаграммы, и легкая цепь указана светлой лентой в нижней части диаграммы.
Фигура 23 представляет собой изображение в виде рисунка гептамерного и мономерного состояний молекулы α-токсина. a. Грибоподобная гептамерная сборка молекулы α-токсина, которая создает поры на поверхности клетки-хозяина. Области серого и черного цвета соответствуют LC10 YTE контактирующим остаткам, которые заслонены на модели. Контактирующие остатки, присутствующие в заслоненных положениях, являются устойчивыми к блокированию образования гептамера LC10. b. Наложенные структуры молекул α-токсина до (светло-серый) и после (темно-серый) образования поры.
На фигуре 24 графически представлена эффективность обработки LC10 в мышиной модели дерматонекроза. Группы из 5 Balb/C мышей подвергали пассивной иммунизации 15 мг/кг LC10 или R347, Balb/C мышей инфицировали интраназально 2×108 S. aureus Wood. Через (А) 1 час, (B) 3 часа или (C) 6 часов после инфицирования мышей затем обрабатывали любым из 5, 15 или 45 мг/кг LC10 и размер пораженных участков отслеживали в течение 6 суток. Группы из 5, которым вводили 15 мг/кг LC10 или R347 за 24 часа до контрольного заражения бактериями, включены в качестве контролей.
На фигуре 25 графически представлена эффективность обработки LC10 в мышиной модели пневмонии. Группы из 10 C57BL/6 мышей подвергали пассивной иммунизации 15 мг/кг LC10 или R347 за 24 часа до интраназального контрольного заражения 2×108 S. aureus USA300. Группы из 10 C57BL/6 мышей инфицировали интраназально 2×108 S. aureus USA300. Через (A) 1 час, (B) 3 часа или (C) 6 часов после инфицирования мышей затем обрабатывали любым из 5, 15 или 45 мг/кг LC10 и выживаемость отслеживали в течение 7 суток. Группы из 10, которым вводили 15 мг/кг LC10 или R347 за 24 часа до контрольного заражения бактериями, включены в качестве контролей.
На фигуре 26 графически представлена эффективность обработки LC10 в мышиной модели пневмонии. Группы из 10 C57BL/6 мышей инфицировали интрадермально 2×108 S. aureus USA300. Через час после инфицирования животным давали одну внутрибрюшинную инъекцию LC-10 в концентрации (A) 15 мг/кг, (B) 45 мг/кг. Когорта животных получала подкожно ванкомицин (VAN) через 1 час после инфицирования. Дополнительные обработки VAN давали BID q 12 суммарно за 6 обработок. Контрольную группу из 10 мышей обрабатывали 15 мг/кг R347 через 1 час после инфицирования. Выживаемость отслеживали в течение 7 суток.
Фигура 27 представляет собой графическое представление изоболограмного анализа синергии, где N>1: анатагонизм, N=1: аддитивный эффект, N<1: синергия.
Подробное описание
В данном документе предлагаются антитела, включающие человеческие, гуманизированные и/или химерные формы, а также их фрагменты, производные/конъюгаты и композиции, которые связываются с альфа-токсином Staphylococcus aureus. Такие антитела могут быть полезны для детекции и/или визуализации альфа-токсина и, следовательно, могут быть полезны в анализах и диагностических способах. Антитела, описанные в данном документе, также препятствуют образованию гептамера альфа-токсин, таким образом ингибируя образование активного порообразующего комплекса, и, следовательно, могут быть полезны для терапевтических и профилактических способов.
Staphylococcus aureus является повсеместно распространенным патогеном и иногда является этиологическим возбудителем ряда состояний, варьирующих по тяжести от легких до летальных. S. aureus продуцирует большое количество внеклеточных и ассоциированных с клеткой белков, многие из которых вовлечены в патогенез, как например, альфа-токсин, бета-токсин, гамма-токсин, дельта-токсин, лейкоцидин, токсин синдрома токсического шока (TSST), энеротоксины, коагулаза, белок A, фибриноген, фибронектинсвязывающий белок и подобное. Альфа-токсин (например, кодируемый геном hla) является одним из факторов вирулентности Staphylococcus aureus и продуцируется большинством патогенных штаммов S. aureus.
Инфекции S. aureus являются относительно сложными для лечения и инвазивные заболевания, и рецидив может иметь место после лечения антибиотиком. Кроме того, метициллин-резистентные штаммы S. aureus стали более распространенными в условиях больницы (например, HA-MRSA или внутрибольничный) и не в условиях больницы (например, CA-MRSA или внебольничный), дополнительно осложняя лечение инфекций S. aureus. Во многих случаях метициллин-резистентные штаммы S. aureus также являются резистентными к одному или нескольким другим антибиотикам, включая аминогликозиды, тетрациклин, хлорамфеникол, макролиды и линкозамиды.
Альфа-токсин является порообразующим токсином и обладает цитолитической, гемолитической, дермонекротической и летальной активностями у людей, а также у животных. Стафилококковый альфа-токсин секретируется в в