Связывающие молекулы, специфичные по отношению к her3, и их применения
Иллюстрации
Показать всеИзобретение относится к биохимии. Описаны антитела и их антигенсвязывающие фрагменты, которые связывают внеклеточный домен рецептора HER3 и ингибируют различные связанные с рецептором HER3 функции посредством зависимого от лиганда и/или независимого от лиганда механизмов. Также представлены композиции с увеличенным временем полужизни. Кроме того, изобретение относится к композициям и способам диагностики и лечения заболеваний, ассоциированных с опосредованной HER3 сигнальной трансдукцией. Изобретение расширяет арсенал средств диагностики и лечения заболеваний, ассоциированных с опосредованной HER3 сигнальной трансдукцией. 10 н. и 13 з.п. ф-лы, 37 ил., 7 табл., 4 пр.
Реферат
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДСТАВЛЕННЫЙ В ЭЛЕКТРОННОМ ВИДЕ
Настоящая заявка включает посредством ссылки список последовательностей, поданный с настоящей заявкой в виде текстового файла, озаглавленного «Her3-100WO1_SL», созданный 12 ноября 2012 и имеющий объем 31,3 килобайт.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям, которые специфично связываются с HER3, и к способам применения таких композиций для лечения злокачественной опухоли.
УРОВЕНЬ ТЕХНИКИ
Рецептор 3 эпидермального фактора роста человека (HER3, также называемый Erbb3) является рецепторной протеинтирозинкиназой и относится к подсемейству EGFR/HER рецепторов эпидермального фактора роста (EGFR) рецепторных протеинтирозинкиназ (RTK), состоящему из EGFR (HER1/Erbb1), HER2/Erbb2, HER3/Erbb3 и HER4/Erbb4. EGFR и HER2 относятся к наиболее хорошо установленным онкогенным RTK, участвующим в образовании опухолей в случае множества типов солидных опухолей, включая основные категории, такие как рак молочной железы, рак прямой и ободочной кишки и рак легкого. Было показано, что тирозинкиназные активности рецепторов EGFR и HER2 важны для их онкогенной активности.
Подобно прототипному EGFR, трансмембранный рецептор HER3 состоит из внеклеточного лиганд-связывающего домена (ECD), домена димеризации в пределах ECD, трансмембранного домена и внутриклеточного протеинтирозинкиназного домена (TKD) и С-концевого домена фосфорилирования (см., например, Kim et al. (1998), Biochem. J. 334, 189-195; Roepstorff et al. (2008), Histochem. Cell Biol. 129, 563-578).
Лиганд херегулин (HRG) связывается с внеклеточным доменом HER3 и активирует опосредованный рецептором сигнальный путь путем стимулирования димеризации с другими членами семейства EGFR (например, другими рецепторами HER) и трансфосфорилирования его внутриклеточного домена. Было показано, что у HER3 отсутствует определяемая тирозинкиназная активность, вероятно вследствие неконсервативной замены некоторых ключевых остатков в тирозинкиназном домене. Поэтому, как следствие киназной недостаточности, для HER3 необходимо образование гетеродимеров с другими RTK, особенно с EGFR и HER2, чтобы претерпеть фосфорилирование и стать функционально активным.
Центральная роль HER3 в онкогенезе заключается в действии в качестве поддерживающего белка для обеспечения возможности максимальной индукции пути PI3K/AKT. Было показано, что HER3 содержит кластер из шести С-концевых тирозин-содержащих мотивов, которые, при фосфорилировании, имитируют консенсусный участок связывания PI3K/p85. Следовательно, при образовании гетеродимеров с HER3 вышерасположенные онкостимуляторы, EGFR, HER2, cMET и FGFR2, могут быть наиболее эффективно сопряжены с путем PI3K/AKT. Поэтому, логично ожидать, что потеря активности HER3 может блокировать прогрессирование злокачественной опухоли в различных системах, индуцируемых дивергентными RTK. Исследования показали, что нокдаун ми-РНК HER3 в злокачественных клетках молочной железы с амплифицированным HER2 приводит к подобным антипролиферативным эффектам, как нокдаун ми-РНК HER2, что также демонстрирует острую необходимость HER3 для злокачественной опухоли.
Было обнаружено, что помимо стимулирования роста опухолей в условиях отсутствия стресса, HER3 в значительной степени вовлечен в придание терапевтической устойчивости ко многим целенаправленным лекарственным средствам, включая ингибиторы тирозинкиназ EGFR, моноклональные антитела против HER2, такие как трастузумаб, а также низкомолекулярные ингибиторы PI3K или AKT или MEK. Полученные данные дополнительно привлекают внимание к HER3 в качестве многообещающей мишени в случае злокачественной опухоли как для циторедукции первичной опухоли, так и для устранения проблем, связанных с резистентностью злокачественной опухоли, которые неизбежно возникают, несмотря на первоначальные клинические ответы.
HER3 имеет два различные пути димеризации со своими партнерами RTK: лиганд-зависимый (в присутствии HRG) или лиганд-независимый. Что касается димеров HER2-HER3, то известно, что в клетках, имеющих экспрессию HER2 от низкого до среднего уровня, HER3 может образовывать комплекс с HER2 только после связывания с лигандом; напротив, в клетках с амплифицированным HER2 (HER2 IHC 3+), они образуют спонтанные димеры без HRG (Junttila et al. (2009) Cancer Cell. 15(5): 429-40). Димеры, образованные в присутствии или отсутствие лиганда, структурно различаются, как было показано в раннем исследовании, которое продемонстрировало, что трастузумаб/герцептин® (моноклональное HER2-антитело Genentech/Roche, одобренное для лечения рака молочной железы HER2 3+) может разрушать только лиганд-независимый димер, но не лиганд-зависимый димер, в то время как пертузумаб/омнитарг® (rhuMAb 2C4, моноклональное HER2-антитело Genentech/Roche в фазе 3 испытаний) может разрушать только лиганд-зависимые димеры.
Образование димеров между членами семейства HER увеличивает потенциал для передачи сигнала от HER3 и представляет собой средства не только для многообразия сигнала, но также для усиления сигнала. Было показано, что HER3 фосфорилируется в контекстах разных клеток. Например, HER3 конститутивно фосфорилируется по остаткам тирозина в подгруппе злокачественных клеток молочной железы человека, сверхэкспрессирующих HER3 (см., например, Kraus et al. (1993) Proc. Natl. Acad. Sci. USA 90, 2900-2904; Kim et al. (1998), Biochem. J. 334, 189-195; Schaefer et al. (2004) Cancer Res. 64, 3395-3405; Schaefer et al. (2006) Neoplasia 8, 612-622). Соответственно, требуется терапия, которая эффективно препятствуют фосфорилированию HER3.
Кроме того, было обнаружено, что HER3 сверхэкспрессируется и/или сверхактивирован в некоторых типах злокачественных опухолей, таких как рак молочной железы, рак яичника, рак простаты, рак печени, рак почки и рак мочевого пузыря, рак поджелудочной железы, рак головного мозга, гемопоэтические неоплазии, ретинобластомы, меланомы, рак прямой и ободочной кишки, рак желудка, рак головы и шеи, рак легкого и т.д. (см., например, Sithanandam and Anderson (2008) Cancer Gene Ther. 15, 413-448). В общем, HER3 часто активирован в случае злокачественных опухолей, экспрессирующих EGFR, HER2, C-Met и FGFRII.
Была показана корреляция между экспрессией HER2/HER3 и прогрессированием от неинвазивной до инвазивной стадии (Alimandi et al., Oncogene 10, 1813-1821; DeFazio et al., Cancer 87, 487-498; Naidu et al., Br. J. Cancer 78, 1385-1390). Таким образом, HER3 может быть использован в качестве диагностического маркера повышенной агрессивности опухолей и низкой выживаемости. Продолжительная активация PI3K/AKT под действие HER3, как было многократно показано, обусловливает резистентность опухолей к ингибиторам EGFR/HER2.
Хотя роль HER3 в развитии и прогрессировании злокачественных опухолей была изучена (см., например, публикацию Horst с соавторами (2005) Int. J. Cancer 115, 519-527; Xue с соавторами (2006) Cancer Res., 66, 1418-1426), HER3 остается в значительной степени недооцененным в качестве мишени для клинического вмешательства. Наиболее современные способы иммунотерапии сфокусированы, в основном, на ингибировании действия HER2 и, в частности, гетеродимеризации комплексов HER2/HER3 (см., например, публикацию Sliwkowski с соавторами (1994), J. Biol. Chem. 269, 14661-14665). Таким образом, целью настоящего изобретения является предоставление улучшенных иммунотерапевтических средств, которые эффективно ингибируют HER3-опосредованную передачу клеточных сигналов, которые можно применять для диагностики, прогнозирования и лечения различных злокачественных опухолей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к связывающим анти-HER3-молекулам, например, антителам или их антигенсвязывающим фрагментам, например, моноклональным антителам, способным подавлять активность НER3 в лиганд-зависимых и независимых условиях. Напротив, другие моноклональные анти-HER3-антитела, известные в данной области (например, Ат №6 (международная патентная публикация WO 2008/100624) и U1-59 (международная патентная публикация WO 2007077028; также названные в настоящем документе AMG), могут только подавлять лиганд-зависимую активность HER3. Также раскрыты связывающие анти-HER3-молекулы с созревшей аффинностью, обладающие повышенной эффективностью и увеличенным временем полу-жизни, которые последовательно могут быть введены реже с увеличенными интервалами между дозами и в меньших объемах доз. Изобретение также относится к способам лечения заболеваний, таких как злокачественная опухоль, у человека, включающим в себя введение связывающих анти-HER3-молекул. В некоторых конкретных аспектах применяют YTE-мутантное антитело человека, являющееся производным 2C2.
Изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с эпитопом во внеклеточном домене HER3, при этом связывающая молекула специфично связывается с таким же эпитопом HER3, как и антитело или его антигенсвязывающий фрагмент, содержащий вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL) CL16 или 2C2. Также предлагается выделенная связывающая молекула или ее антигенсвязывающий фрагмент, который специфично связывается с HER3 и конкурентно ингибирует связывание HER3 антителом или его антигенсвязывающим фрагментом, содержащим VH и VL CL16 или 2C2.
Изобретение также относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VL антитела, при этом VL содержит аминокислотную последовательность:
[FW1]X1GSX2SNIGLNYVS[FW2]RNNQRPS[FW3]AAWDDX3X4X5GEX6[FW4],
где [FW1], [FW2], [FW3] и [FW4] означают каркасные области VL, и где
(a) X1 означает аминокислотные остатки аргинин (R) или серин (S),
(b) X2 означает аминокислотные остатки серин (S) или лейцин (L),
(c) X3 означает аминокислотные остатки серин (S) или глицин (G),
(d) X4 означает аминокислотные остатки лейцин (L) или пролин (P),
(e) X5 означает аминокислотные остатки аргинин (R), изолейцин (I), пролин (P) или серин (S), и
(f) X6 означает аминокислотные остатки валин (V) или аланин (A).
Кроме того, изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, которая специфически связывается с HER3, содержащей VH антитела, при этом VH содержит аминокислотную последовательность:
[FW5]YYYMQ[FW6]X7IGSSGGVTNYADSVKG[FW7]VGLGDAFDI[FW8], где [FW5], [FW6], [FW7] и [FW8] означают каркасные области VH, и где X7 означает аминокислотные остатки тирозин (Y), изолейцин (I) или валин (V).
Изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VL антитела и VH антитела, при этом VL содержит аминокислотную последовательность:
[FW1]X1GSX2SNIGLNYVS[FW2]RNNQRPS[FW3]AAWDDX3X4X5GEX6[FW4], где [FW1], [FW2], [FW3] и [FW4] означают каркасные области VL, и где
(a) X1 означает аминокислотные остатки аргинин (R) или серин (S),
(b) X2 означает аминокислотные остатки серин (S) или лейцин (L),
(c) X3 означает аминокислотные остатки серин (S) или глицин (G),
(d) X4 означает аминокислотные остатки лейцин (L) или пролин (P),
(e) X5 означает аминокислотные остатки аргинин (R), изолейцин (I), пролин (P) или серин (S), и
(f) X6 означает аминокислотные остатки валин (V) или аланин (A), и где VH содержит аминокислотную последовательность:
[FW5]YYYMQ[FW6]X7IGSSGGVTNYADSVKG[FW7]VGLGDAFDI[FW8], где [FW5], [FW6], [FW7] и [FW8] означают каркасные области VH, и где X7 означает аминокислотные остатки тирозин (Y), изолейцин (I) или валин (V).
Изобретение также относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VL антитела, при этом VL содержит аминокислотную последовательность определяющей комплементарность области 1 VL (VL-CDR1), идентичную или идентичную за исключением четырех, трех, двух или одной аминокислотной замены, последовательностям: SEQ ID NO: 18, SEQ ID NO: 19 или SEQ ID NO: 20. Также изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, которая специфически связывается с HER3, содержащей VL антитела, при этом VL содержит аминокислотную последовательность определяющей комплементарность области 2 VL (VL-CDR2), идентичную или идентичную за исключением четырех, трех, двух или одной аминокислотной замены, последовательности SEQ ID NO: 21.
Кроме того, изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащей VL антитела, при этом VL содержит аминокислотную последовательность определяющий комплементарность области 3 VL (VL-CDR3), идентичную или идентичную за исключением четырех, трех, двух или одной аминокислотной замены, последовательностям: SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29 или SEQ ID NO: 30. Также изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VH антитела, при этом VH содержит аминокислотную последовательность определяющей комплементарность области 1 VL (VH-CDR1), идентичную или идентичную, за исключением четырех, трех, двух или одной аминокислотной замены, последовательности SEQ ID NO: 31.
Кроме того, изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VH антитела, при этом VH содержит аминокислотную последовательность определяющий комплементарность области 2 (VH-CDR2), идентичную или идентичную за исключением четырех, трех, двух или одной аминокислотной замены, последовательностям: SEQ ID NO: 32, SEQ ID NO: 33 или SEQ ID NO: 34. Также изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VH антитела, при этом VH содержит аминокислотную последовательность определяющей комплементарность области-3 (VH-CDR3), идентичную или идентичную за исключением четырех, трех, двух или одной аминокислотной замены, последовательности SEQ ID NO: 35.
Изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VL антитела, при этом VL содержит аминокислотные последовательности VL-CDR1, VL-CDR2 и VL-CDR3, идентичные или идентичные за исключением четырех, трех, двух или одной аминокислотной замены в одной или нескольких VL-CDR, последовательностям: SEQ ID NO: 18, 21 и 22, SEQ ID NO: 18, 21 и 26, SEQ ID NO: 18, 21 и 27, SEQ ID NO: 20, 21 и 22, SEQ ID NO: 19, 21 и 22, SEQ ID NO: 18, 21 и 25, SEQ ID NO: 18, 21 и 28, SEQ ID NO: 18, 21 и 29, SEQ ID NO: 18, 21 и 30, SEQ ID NO: 18, 21 и 23, SEQ ID NO: 19, 21 и 23, SEQ ID NO: 20, 21 и 23, SEQ ID NO: 18, 21 и 24 или SEQ ID NO: 18, 21, и 25, соответственно. Изобретение также относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VH антитела, при этом VH содержит аминокислотные последовательности VH-CDR1, VH-CDR2 и VH-CDR3, идентичные или идентичные за исключением четырех, трех, двух или одной аминокислотной замены в одной или нескольких VH-CDR, последовательностям: SEQ ID NO: 31, 32 и 35, SEQ ID NO: 32 и 35, SEQ ID NO: 31, 33 и 35 или SEQ ID NO: 31, 34, и 35, соответственно.
Кроме того, изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VL и VH, которые включают в себя аминокислотные последовательности VL-CDR1, VL-CDR2, VL-CDR3, VH-CDR1, VH-CDR2 и VH-CDR3, идентичные или идентичные за исключением четырех, трех, двух или одной аминокислотной замены, в одной или нескольких CDR, последовательностям: SEQ ID NO: 18, 21, 22, 31, 32 и 35, SEQ ID NO: 18, 21, 26, 31, 32 и 35, SEQ ID NO: 18, 21, 27, 31, 32 и 35, SEQ ID NO: 20, 21, 22, 31, 32 и 35, SEQ ID NO: 19, 21, 22, 31, 32 и 35, SEQ ID NO: 18, 21, 25, 31, 32 и 35, SEQ ID NO: 18, 21, 28, 31, 32 и 35, SEQ ID NO: 18, 21, 29, 31, 32 и 35, SEQ ID NO: 18, 21, 30, 31, 32 и 35, SEQ ID NO: 18, 21, 23, 31, 32 и 35, SEQ ID NO: 19, 21, 23, 31, 32 и 35, SEQ ID NO: 20, 21, 23, 31, 32 и 35, SEQ ID NO: 18, 21, 24, 31, 32 и 35 или SEQ ID NO: 18, 21, 25, 31, 32 и 35, соответственно. Также предлагается выделенная связывающая молекула или ее антигенсвязывающий фрагмент, который специфично связывается с HER3, содержащий VL антитела и VH антитела, при этом VL содержит аминокислотную последовательность, по меньшей мере, приблизительно на 90-100% идентичную эталонной аминокислотной последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16 и SEQ ID NO: 17. Изобретение также относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с HER3, содержащему VL антитела и VH антитела, при этом VH содержит аминокислотную последовательность, по меньшей мере, приблизительно на 90-100% идентичную эталонной аминокислотной последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO: 2, SEQ ID NO: 12 и SEQ ID NO: 13. Кроме того, изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, который специфично связывается с HER3, при этом антитело или его антигенсвязывающий фрагмент содержит VL, содержащую последовательность, по меньшей мере, приблизительно на 90-100% идентичную эталонной аминокислотной последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16 и SEQ ID NO: 17, и при этом антитело или его антигенсвязывающий фрагмент содержит VH, содержащую последовательность, по меньшей мере, приблизительно на 90-100% идентичную эталонной аминокислотной последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO: 2, SEQ ID NO: 12 и SEQ ID NO: 13.
Изобретение также относится к выделенному антителу или его антигенсвязывающему фрагменту, который содержит VL, содержащую последовательность SEQ ID NO: 49, и VH, содержащую последовательность SEQ ID NO: 50. Кроме того, изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, который содержит VL, содержащую последовательность SEQ ID NO: 3, и VH, содержащую последовательность SEQ ID NO: 2. Также изобретение относится к выделенной связывающей молекуле или ее антигенсвязывающему фрагменту, который специфично связывается с эпитопом во внеклеточном домене HER3, содержащему последовательность VL антитела SEQ ID NO: 3, последовательность VH антитела SEQ ID NO: 2 и последовательность константной области IgG1 SEQ ID NO: 46. Также предлагается выделенная связывающая молекула или ее антигенсвязывающий фрагмент, который специфично связывается с эпитопом во внеклеточном домене HER3, состоящий из последовательности VL антитела SEQ ID NO: 3, последовательности VH антитела SEQ ID NO: 2 и последовательности константной области IgG1 SEQ ID NO: 46.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ/ФИГУР
На фиг. 1 представлена интернализация моноклональных анти-HER3-антител клона 16 в клетки KPL4, показанная в виде истощения поверхностного флуоресцирующего окрашивания. Верхняя панель показывает интернализацию в момент времени = 0. Нижние панели показывают интернализацию после 2,5 часов.
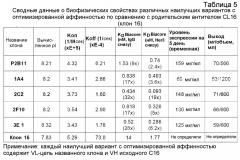
На фиг. 2А представлено множественное выравнивание последовательностей, соответствующих последовательностям VL моноклональных анти-HER3-антител клона 16 (CL16; исходный, родительский клон), клона 16 (GL; клон зародышевой линии), 5H6, 8A3, 4H6, 6E.3, 2B11, 2D1, 3A6 и 4C4. Указано положение CDR1, CDR2 и CDR3. Выделены аминокислотные остатки, которые отличаются по сравнению с антителом CL16 (GL).
На фиг. 2В представлено множественное выравнивание последовательностей, соответствующих последовательностям VН моноклональных анти-HER3-антител клона CL16 (CL16; родительский клон) и клонов 15D12.1 (также называемого 15D12.I) и 15D12.2 (также называемого 15D12.V). Указано положение CDR1, CDR2 и CDR3. Выделены аминокислотные остатки, которые отличаются по сравнению с родительским антителом CL16.
На фиг. 2С представлено множественное выравнивание последовательностей, соответствующих последовательностям VL моноклональных анти-HER3-антител клона 16 (CL16; исходный, родительский клон), CL16 (GL; клон зародышевой линии), 1A4, 2C2, 3E.1, 2F10 и 2B11. Указано положение CDR1, CDR2 и CDR3. Выделены аминокислотные остатки, которые отличаются по сравнению с антителом CL16 (GL).
На фиг. 3 показано подавление фосфорилирования HER3 (pHER3) в зависимых от лиганда клетках MCF-7, при этом HER3 активируется только экзогенным HRG (лигандом). Исследовали моноклональные анти-HER3-антитела 2C2, описанные в литературе моноклональные анти-HER3-антитела AMG и MM и контрольное антитело R347. Представлено максимальное ингибирование pHER3 в процентах и значения IC50.
На фиг. 4 показано подавление роста клеток MDA-MB-175, разработанной модели регуляции HRG по типу аутокринной петли, в которой эндогенный HRG стимулирует активность HER3 и рост клеток. Исследованы моноклональные анти-HER3-антитела 2C2, описанные в литературе моноклональные анти-HER3-антитела AMG и MM и контрольное антитело R347. Представлено максимальное ингибирование роста в процентах и значения IC50.
На фиг. 5 показано подавление роста клеток HMCB, разработанной модели регуляции РКП по типу аутокринной петли, в которой эндогенный HRG стимулирует активность HER3 и рост клеток. Исследованы моноклональные анти-HER3-антитела 2C2, описанные в литературе моноклональные анти-HER3-антитела AMG и MM и контрольное антитело. Представлены значения IC50.
На фиг. 6 показано, что 2C2 не только ингибировало рост клеток HMCB, но также подавляло фосфорилирование HER3 (pHER3) и фосфорилирование AKT (pAKT) в указанной зависимой от лиганда меланоме.
На фиг. 7 показано, что 2C2 подавляло фосфорилирование HER3 (pHER3) и фосфорилирование AKT (pAKT) в зависимых от лиганда клетках NSCLC A549.
На фиг. 8 показано подавление фосфорилирования HER3 (pHER3) в моделях на основе клеток злокачественной опухоли легкого, желудка и молочной железы. На панели А показано подавление pHER3 в линии клеток HCC827, модели NSCLC на основе мутантных EGFR-зависимых клеток, при взаимном влиянии EGFR/HER3. На панели В показано подавление pHER3 в модели NSCLC на основе EGFR-TKI-резистентных HCC827, полученных в результате долговременной обработки EGFR TKI. На панели С показано подавление pHER3 в линии клеток MKN45, модели рака желудка с амплифицированным cMET, при взаимном влиянии cMET-HER3. На панели D показано подавление рHER3 в клеточной линии Kato III, модели рака желудка с FGFR2-амплификацией, при взаимном влиянии FGFR2-HER3. На панели E показано подавление рHER3 в клеточной линии BT-474, не зависимой от лиганда модели рака молочной железы с амплифицированным HER2 (т.е. в клетках отсутствует экспрессия HRG). Исследовали моноклональные анти-HER3-антитела 2C2, описанные в литературе моноклональные анти-HER3-антитела AMG и MM и контрольное антитело R347. Представлено максимальное ингибирование pHER3 в процентах и значения IC50.
На фиг. 9 показано подавление фосфорилирования AKT (pAKT) в клеточной модели рака желудка и молочной железы. На панели A показано подавление pAKT в линии клеток MKN45. На панели B показано подавление pAKT в линии клеток Kato III. На панели С показано подавление pAKT в линии клеток BT-474, не зависимой от лиганда модели рака молочной железы с амплифицированным HER2 (т.е. в клетках отсутствует экспрессия НRG). Исследовали моноклональные анти-HER3-антитела 2C2, описанные в литературе моноклональные анти-HER3-антитела AMG и MM и контрольное антитело R347. Представлено максимальное ингибирование pAKT в процентах и значения IC50.
На фиг. 10 показано, что 2C2 подавляет передачу клеточных сигналов и пролиферацию клеток MDA-MB-361. На панели A показано, что 2C2 подавлял фосфорилирование HER3 (pHER3) в клетках MDA-MB-361 с амплифицированным HER2. На панели В показано, что 2C2 подавляет рост клеток зависимым от дозы образом. Процент ингибирования представлен для 6- и 14-дневных обработок (верхняя и нижняя панели, соответственно).
На фиг. 11 показано, что 2C2 подавляет фосфорилирование HER3 (pHER3) в клетках HARA-B, экспрессирующих высокие уровни HRG.
На фиг. 12 показано, что 2C2 и rhuMab 2C4, но не антагонисты EGFR цетуксимаб и гефитиниб, ингибируют зависимую от лиганда HRG передачу сигналов (нижняя часть панелей А и В). В верхней части панелей А и В показаны базальные клетки, SW620 (панель А, левая часть), SW480 (панель А, средняя часть), Colo205 (панель А, правая часть), LOVO (панель В, левая часть), HCT15 (панель В, средняя часть) и Caco-2 (панель В, правая часть).
На фиг. 13 показан ELISA-анализ связывания HRG-HER3, в котором измеряли прямое блокирование связывания HRG с HER3 клоном 16, описанными в литературе моноклональными анти-HER3-антителами AMG и MM, положительным контрольным блокирующим лиганд моноклональным анти-HER3-антителом и контрольным антителом R347.
На фиг. 14 показано, что 2C2 блокирует димеризацию HER2-HER3. Панель А демонстрирует анализ HRG-индуцируемой димеризации HER2-HER3, который оценивает степень образования комплекса HER2-HER3 в клетках T-47D, зависимой от лиганда модели, показывающей четкую HRG-индуцируемую ассоциацию HER2-HER3, предварительно обработанных моноклональными анти-HER3-антителами 2C2, CL16, AMG и MM. Все анти-HER3 антитела блокировали такую индуцируемую лигандом димеризацию HER2-HER3. Панель В демонстрирует анализ не зависимой от лиганда димеризации HER2-HER3, который оценивает степень образования комплекса HER2-HER3 в клетках BT-47D, предварительно обработанных 2C2 или CL16, которые блокировали такую не зависимую от лиганда димеризацию HER2-HER3.
На фиг. 15 показана интернализация и распад HER3, индуцированные 2C2. На панели А показан основанный на FACS анализ интернализации, который количественно определяет временную зависимость и степень интернализации мишени в ответ на две разные концентрации моноклонального антитела 2C2. На панели B показан распад HER3 в модельных клетках рака прямой и ободочной кишки Lovo, HCT15 и SW620, предварительно обработанных моноклональным анти-HER3-антителом 2C2 или контрольным антителом R347.
На фиг. 16 показан основанный на FACS анализ клеточного цикла, показывающий, что в клетках SkBR3, линии злокачественных клеток молочной железы с аплифицированным HER2, подобной BT-474, как герцептин® (трастузумаб), так и моноклональное антитело CL16 (родительское антитело для моноклонального антитела 2C2), вызывали задержку клеточного цикла в фазе G1. Также показаны результаты, соответствующие клеткам, обработанным контрольным антителом R347м и моноклональным анти-HER2-антителом rhuMAb 2C4 (пертузумаб/омнитарг®).
На фиг. 17 показано ингибирование индуцируемой HRG секреции VEGF анти-HER3-антителами. На панели А показаны изменения секреции VEGF в клетках злокачественной опухоли молочной железы BT-474, предварительно обработанных моноклональными анти-HER3-антителами CL16 и Merrimack MM, моноклональным анти-HER2- антителом герцептином® (трастузумабом) или контрольным антителом R347. На панели В показаны изменения секреции VEGF в модели, основанной на клетках злокачественной опухоли молочной железы MCF-7, предварительно обработанных моноклональными анти-HER3-антителами CL16 и Merrimack MM, моноклональным анти-HER2-антителом герцептином® (трастузумабом) или контрольным антителом R347.
На фиг. 18 показано, что моноклональное анти-HER3-антитело 2C2 связывается на поверхности клеток с HER3 макак-крабоедов (cyno-HER3) на клеточной поверхности, эктопически экспрессированным в клетках Ad293, и модулирует его активность. На панели А показан Вестерн-блот-анализ клеток Ad293, трансфицированных контрольным вектором (левая сторона) или вектором, экспрессирующим cyno-HER3 (правая сторона). Клетки обрабатывали 2C2 или контрольным антителом (R347) с ко-стимуляцией или без ко-стимуляции HRG и исследовали с использованием в качестве зонда антитело против HER3 (средний блот), против pHER3 (верхний блот) и против GAPDH (нижний блот). На панели В показана основанная на денситометрии количественная оценка pHER3 в верхних четырех дорожках, показанных на панели А.
На фиг. 19 показано зависимое от дозы уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании модели на основе ксенотрансплантата клеток опухоли головы и шеи FADU. На панели А показано, что введение 7 мг/кг 2C2 два раза в неделю было максимально эффективным с 99% dTGI (ингибирование роста опухоли) в данной модели. Панель В демонстрирует сильное уменьшение объема опухоли после комбинированного введения моноклонального антитела 2C2 с моноклональным анти-EGFR-антителом цетуксимабом при использовании модели на основе ксенотрансплантата клеток опухоли головы и шеи FADU. Комбинированная обработка приводила к частичной регрессии в 7 из 10 случаев и к полной регрессии в 2 из 10 случаев.
Фиг. 20 показана нелинейная фармакокинетика для 2C2 после введения однократной дозы и многократных доз 5 мг/кг или 30 мг/кг мышам, несущим опухоли. Полученные данные свидетельствуют, что мышиный HER3 служит в качестве «поглотителя» для связывания с 2C2, вводимого мышам, и что 30 мг/кг в виде однократной дозы является достаточным для насыщения поглотителя.
На фиг. 21 показан полезный противоопухолевый эффект нагрузочной дозы 10 мг/кг моноклонального антитела 2C2 при использовании модели на основе ксенотрансплантата клеток опухоли головы и шеи FADU. Введение нагрузочной дозы 2C2 для насыщения поглотителя HER3 мыши, позволяло 2C2 в дозе 3 мг/кг проявлять высокую противоопухолевую активность, в то время как 2C2 в дозе 3 мг/кг без нагрузочной дозы проявляет только умеренную активность.
На фиг. 22 показано, что обработка 2C2-YTE снижает уровни pHER3 и pAKT в экстрактах ксенотрансплантированных опухолей FADU. В данном эксперименте уровни pHER3 и pAKT были снижены на 59,5% и 51,7%, соответственно. Никакого изменения общих уровней HER3 в данном эксперименте не наблюдали.
На фиг. 23 показано зависимое от дозы уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании модели на основе ксенотрансплантатов клеток опухоли головы и шеи человека Detroit562. Панель А демонстрирует, что доза 10 мг/кг 2C2, вводимая дважды в неделю, была максимально эффективна со значением dTGI 72%. Панель В демонстрирует уменьшение объема опухоли после комбинированного введения моноклонального антитела 2C2 с моноклональным анти-EGFR-антителом цетуксимабом при использовании модели на основе ксенотрансплантатов клеток опухоли головы и шеи человека Detroit562. Комбинированная обработка приводила к частичным регрессиям в 9 из 10 случаев, в то время как цетуксимаб отдельно приводил к частичным регрессиям в 5/10 случаев. Модель на основе ксенотрансплантатов Detroit562 включает мутацию PIK3CA.
На фиг. 24 показано зависимое от дозы уменьшение объема опухоли после введения моноклонального антитела 2C2-YTE при использовании модели на основе ксенотрансплантов клеток опухоли головы и шеи человека CAL27.
На фиг. 25 показано зависимое от дозы уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании модели на основе ксенотрансплантатов NSCLC человека A549. Панель А демонстрирует, что 30 мг/кг 2C2, вводимого дважды в неделю, было максимально эффективным с dTGI 91% вплоть до последнего дня фазы обработки (день 33; после этого возобновление роста). Оба антитела 2C2-YTE и 2C2 в дозе 10 мг/кг обладали сравнимой активностью. Панель В демонстрирует уменьшение объема опухоли после комбинированного введения моноклонального антитела 2C2 с моноклональным анти-EGFR-антителом цетуксимабом при использовании модели на основе ксенотрансплантатов NSCLC человека A549. Добавление цетуксимаба к 2C2 увеличивало активность 2C2 в течение фазы обработки и задерживало возобновление роста опухоли в течение фазы возобновления роста опухоли. Модель на основе ксенотрансплантатов A549 содержит мутацию KRAS и делецию LKB-1.
На фиг. 26 показано уменьшение объема опухоли после введения моноклонального антитела 2C2-YTE при использовании модели на основе ксенотрансплантатов плоскоклеточной карциномы человека HARA-B. Доза 30 мг/кг 2C2-YTE, вводимая дважды в неделю, проявила максимальную эффективность с dTGI 64,6%. 2C2-YTE в дозе 10 мг/кг имело сравнимую активность, в то время как 2C2-YTE в дозе 3 мг/кг было неактивным.
На фиг. 27 демонстрирует зависимое от дозы уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании модели на основе ксенотрансплантатов клеток злокачественной опухоли прямой и ободочной кишки человека HT-29. Доза 30 мг/кг 2C2, вводимая дважды в неделю, проявила максимальную эффективность с dTGI 56% вплоть до последнего дня фазы обработки (день 26; после этого возобновление роста). Оба антитела 2C2-YTE и 2C2 в дозе 30 мг/кг имеют сравнимую активность. Модель на основе ксенотрансплантатов HT-29 содержит мутацию BRAF.
На фиг. 28 показано уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании модели на основе ксенотрансплантатов клеток злокачественной опухоли прямой и ободочной кишки человека HCT-116. Доза 30 мг/кг 2C2, вводимая дважды в неделю, проявила максимальную эффективность с dTGI. Оба антитела 2C2-YTE и 2C2 в дозе 10 мг/кг обладают сравнимой активностью. Модель на основе ксенотрансплантатов НCT-116 содержит мутацию KRAS.
На фиг. 29 показано уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании модели на основе ксенотрансплантатов клеток злокачественной опухоли прямой и ободочной кишки человека LOVO. Доза 30 мг/кг 2C2, вводимая дважды в неделю, проявила максимальную эффективность с dTGI 48%. Оба антитела, 2C2-YTE и 2C2, в дозе 10 мг/кг обладают сравнимой активностью. Модель на основе ксенотрансплантатов LOVO содержит мутацию KRAS.
На фиг. 30 показано уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании модели на основе ксенотрансплантатов клеток злокачественной опухоли простаты человека DU145. Доза 30 мг/кг 2C2, вводимая дважды в неделю, проявила максимальную эффективность с dTGI 77%. Модель на основе ксенотрансплантатов DU145 содержит делецию LKB-1.
На фиг. 31 показано уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании ортотопической модели на основе ксенотрансплантатов злокачественной опухоли молочной железы человека BT-474. Панель А демонстрирует, что доза 30 мг/кг 2C2, вводимая дважды в неделю, проявляла максимальную эффективность с dTGI 55%. Панель В демонстрирует уменьшение объема опухоли после комбинированного введения моноклонального антитела 2C2 с низкомолекулярным лекарственным средством лапатинибом при использовании ортотопической модели на основе ксенотрансплантатов злокачественной опухоли молочной железы человека BT-474. Добавление 2C2 к лапатинибу увеличивает активность лапатиниба в течение фазы обработки и незначительно замедляет возобновление роста опухоли в течение фазы возобновления роста опухоли. Оба антитела, 2C2-YTE и 2C2, в дозе 30 мг/кг имеют сравнимую активность в течение фазы обработки в виде монотерапевтических средств. Панель С демонстрирует уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании ортотопической модели на основе ксенотрансплантатов злокачественной опухоли молочной железы человека BT-474. Трастузумаб отдельно был очень активным в данной модели, и незначительное усиление наблюдали при добавлении 2C2 в такой модели. Модель на основе ксенотрансплантатов BT-474 содержит амплифицированный HER2 (3+, HercepTest).
На фиг. 32 показано, что обработка клоном 16 (предшественник 2C2) снижает уровни pHER3 и pAKT в экстрактах ксенотрансплантированных опухолей BT-474. В данном эксперименте уровни pHER3 и pAKT были снижены на 50% и 46,1%, соответственно. Никаких изменений общих уровней HER3 в данном эксперименте не наблюдали.
На фиг. 33 показано уменьшение объема опухоли после введения моноклонального антитела 2C2 при использовании ортотопической модели на основе ксенотрансплантатов злокачественной опухоли молочной железы человека MCF-7. Панель А демонстрирует, что доза 10 мг/кг 2C2, вводимая дважды в неделю, проявляла максимальную эффективность с dTGI 34%. Оба антитела, 2C2-YTE и 2C2, в дозе 10 мг/кг имеют сравнимую активность. Панель В демонстрирует уменьшение объема опухоли после комбинированного введения моноклонального антитела 2C2 с низкомолекулярным лекарственным средством паклитакселом при использовании ортотопической модели на основе ксенотрансплантатов злокачественной опухоли молочной железы человека MCF-7. Добавление 2C2 к паклитакселу увеличивало активность паклитаксела в течение фазы обработки. Модель на основе ксенотрансплантатов MCF-7 содержит низкие уровни HER2 (1+, HercepTest).
На фиг. 34 показано уменьшение объема опухоли после введения моноклонального антитела 2C2-YTE при использовании ортотопической модели на основе ксенотрансплантатов злокачественной опухоли молочной железы человека MDA-MB-361 (панели А-С). Добавление 2C2-YTE к моноклональному антителу трастузумабу повышало активность трастузумаба в течение фазы обработки и замедляло возобновление роста опухоли в течение фазы возобновления роста опухоли (панель А). Добавление 2C2-YTE к моноклональному антителу rhuMAb 2C4 незначительно повышало активность rhuMAb 2C4, но не замедляло возобновление роста опухолей (панель В). Добавление 2C2-YTE к низкомолекулярному лек