Модифицированные пептиды и их применение для лечения аутоиммунных заболеваний
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к иммуносупрессивным средствам, и может быть использовано для лечения системной красной волчанки (SLE). Получают пептид, состоящий из аминокислотной последовательности IHMVYSKRSGKPRGYAFIEY [SEQ ID NO: 2], в которой серин в положении 9 фосфорилирован и метионин в положении 3 окислен, или из RIHMVYSKRSGKPRGYAFIEY [SEQ ID NO: 1], в которой серин в положении 10 фосфорилирован и метионин в положении 4 окислен. Изобретение позволяет получить пептид или его соль, эффективные в лечении системной красной волчанки. 6 н. и 2 з.п. ф-лы, 6 ил., 4 табл., 4 пр.
Реферат
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[001] Настоящее изобретение относится к модифицированному пептиду и его применению для лечения аутоиммунных заболеваний.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[002] Список последовательностей, содержащий SEQ ID NO: 1-6, подан в этой заявке и, таким образом, включен посредством ссылки в полном объеме.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
[003] Аутоиммунные заболевания возникают в результате гиперактивного иммунного ответа иммунной системы на вещества и ткани, обычно присутствующие в многоклеточном организме, то есть иммунная система атакует собственные компоненты. Это может быть ограничено определенными органами или может вовлекать конкретную ткань в разных местах. Лечение аутоиммунных заболеваний обычно проводят путем иммуносупрессии - лекарственной терапии, которая снижает весь иммунный ответ.
[004] Волчанка представляет собой аутоиммунное заболевание, которое, по оценкам, поражает около 1,4 миллиона американцев, главным образом, женщин в возрасте 20-40 лет. Волчанка вовлекает в патологический процесс антитела, которые атакуют соединительную ткань. Основной формой волчанки является системная волчанка (системная красная волчанка; SLE). SLE представляет собой хроническое аутоиммунное заболевание с вполне определенными генетическими компонентами, а также компонентами среды (см., например, Hochberg М С, Dubois' Lupus Erythematosus. 5th ed., Wallace D J, Hahn В H, eds. Baltimore: Williams and Wilkins (1997); Wakeland E K, et al., Immunity 2001; 15(3):397-408; Nath S K, et al., Curr. Opin. Immunol. 2004; 16 (6):794-800; D'Cruz et al., Lancet (2007), 369:587-596). Известны различные дополнительные формы волчанки, включающие кожную красную волчанку (CLE), волчаночный нефрит (LN), психоневрологическую волчанку (NPLE) и неонатальную волчанку, но не только.
[005] В отсутствие лечения волчанка может быть смертельной, поскольку она прогрессирует от атаки на кожу и суставы до внутренних органов, включая легкие, сердце и почки (с заболеванием почек, имеющим особую важность), таким образом делая раннюю и точную диагностику и/или оценку риска развития волчанки особенно важной. Волчанка главным образом проявляется в виде серии обострений с наступающими периодами небольшого проявления болезни или без проявлений болезни. Поражение почек, определяемое по количеству белка в моче (протениурия), является одной из наиболее острых областей поражения, связанного с патогенностью при SLE, и обуславливает по меньшей мере 50% летальность и заболеваемость без какого-либо лечения.
[006] Клинически SLE представляет собой гетерогенное нарушение, характеризующееся высокоаффинными антителами (аутоАb). АутоАb играют важную роль в патогенезе SLE, и различные клинические проявления этого заболевания имеют место вследствие отложения содержащих антитела иммунных комплексов в кровеносных сосудах, что приводит к воспалению в почках, головном мозге и коже. АутоАb также оказывают прямые патогенные воздействия, которые вносят вклад в гемолитическую анемию и тромбоцитопению. SLE связана с продукцией противоядерных антител, циркулирующих иммунных комплексов и нарушением системы комплемента. Уровень заболеваемости SLE составляет примерно 1 на 700 женщин в возрасте от 20 до 60 лет в чернокожей популяции. SLE может поражать любую систему органов и может вызывать тяжелое поражение тканей. Многочисленные аутоАb различной специфичности присутствуют при SLE. У пациентов с SLE зачастую продуцируются аутоАb, имеющие анти-ДНК, анти-Ro и антитромбоцитарную специфичность и способные инициировать клинические особенности заболевания, такие как гломерулонефрит, артрит, серозит, полную предсердно-желудочковую блокаду у новорожденных и гематологические нарушения. Эти аутоАb также, возможно, связаны с нарушениями центральной нервной системы. Arbuckle et al. описали развитие аутоАb до клинического проявления SLE (Arbuckle et al. N. Engl. J. Med. 349 (16): 1526-1533 (2003)).
[007] АутоАb, распознающие РНК-связывающие белки (RBP; также называемые экстрагируемыми ядерными антигенами), впервые были охарактеризованы при SLE более 40 лет назад (Holman, Ann N Y Acad. Sci. 124(2):800-6 (1965)). Такие RBP содержат группу белков - SSA (Ro52/TRIM21 и Ro60/TROVE2), SSB (La), U1 белок малый ядерный нуклеопротеин (RNP) и белок Смита (Sm), играющих роль в процессинге РНК и биохимии. Анти-SSA- и анти-SSB IgG аутоАb обнаруживаются не только при SLE, а также при синдроме Шегрена и ревматоидном артрите. Анти-SSA аутоАb связаны с подострой кожной красной волчанкой, и с врожденной блокадой сердца и волчанкой новорожденных детей от женщин, позитивных по анти-SSA. Анти-SSB аутоАb почти всегда обнаруживаются вместе с анти-SSA аутоАb, и оба аутоантигена связаны с цитоплазматической hYPHK (Lerner et al., Science 211(4480):400-2 (1981)). Анти-Sm аутоАb являются высокоспецифичными для SLE и в основном обнаруживаются вместе с анти-RNP аутоАb. Как Sm, так и RNP белки связаны со специфичными видами snPHK в сплайсосоме ядерной РНК (Lerner et al., Proc Natl Acad Sci USA 76 (11): 5495-9 (1979)). Анти-RNP аутоАb также обнаруживаются у пациентов со смешанным заболеванием соединительных тканей. Предполагалось, что присутствие анти-RBP аутоАb может идентифицировать случаи SLE, которые демонстрируют менее длительные ответы после терапии, истощающей В-клетки (Cambridge et al., Ann Rheum Dis 67:1011-16 (2008)).
[008] В предшествующем уровне техники раскрыты лекарственные средства для лечения аутоиммунных заболеваний. Например, в обеих международных заявках WO 03/020747 и WO 03/025014 описывается фрагмент snRNP 7 0 кДа, который модифицирован фосфорилированием и/или ацетилированием для лечения таких патологий, то есть аутоиммунных заболеваний. Однако дальнейшие эксперименты показали, что пептиды, описанные в WO 03/020747 и WO 03/025014, являются относительно нестабильными и быстро выводятся при введении млекопитающим. Более того, некоторые из описанных пептидов являются неактивными.
[009] Следовательно, существует необходимость в предоставлении лучшего лечения аутоиммунных патологий.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0010] Настоящее изобретение относится к композициям и способам их применения, которые основаны на удивительном и неожиданном открытии того, что некоторые модифицированные формы белка с последовательностью SEQ ID NO: 2 являются более стабильными при введении млекопитающим. Таким образом, в одном аспекте настоящее изобретение относится к композициям, содержащим такой белок и фармацевтически приемлемый носитель.
[0011] В другом аспекте настоящее изобретение относится к фармацевтической композиции или лекарственному средству, применимым для облегчения аутоиммунных заболеваний, предпочтительно для лечения волчанки.
[0012] В дополнительном аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, предусматривающим введение эффективного количества терапевтической композиции, описанной в настоящем изобретении.
[0013] В некоторых вариантах осуществления настоящее изобретение относится к выделенному пептиду (рекомбинантному или синтезированному) или его соли, содержащему или состоящему из аминокислотной последовательности:
[0014] IHMVYSKRSGKPRGYAFIEY [SEQ ID NO: 2],
[0015] в которой серин (S) в положении 9 является фосфорилированным, а метионин (М) в положении 3 является окисленным.
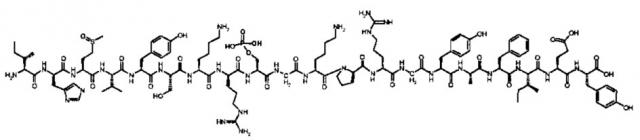
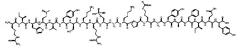
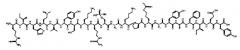
[0016] В некоторых вариантах осуществления настоящее изобретение относится к пептиду соединения I, имеющему следующую формулу:
[0017] Соединение I также может быть представлено последовательностью:
[0018] IHM(О)VYSKRS(РO3Н2)GKPRGYAFIEY [SEQ ID NO: 5],
[0019] в которой «М(O)» представляет окисленный метионин, а «S(PO3H2)» представляет фосфосерин.
[0020] Эти пептиды происходят из U1 snRNP 70 кДа белка (SEQ ID NO: 3), соответствуют области, ограниченной аминокислотным сегментом, продолжающимся от остатка 132 до остатка 151 последовательности SEQ ID NO: 3. Формально, остаток, который является фосфорилированным, соответствует аминокислоте в положении 140 от первого метионина последовательности SEQ ID NO: 3, и остаток, который является окисленным, соответствует аминокислоте в положении 134 от первого метионина последовательности SEQ ID NO: 3.
[0021] В некоторых аспектах настоящее изобретение относится к выделенному пептиду, содержащему или состоящему из аминокислотной последовательности SEQ ID NO: 1, или его соли, имеющему по меньшей мере одну пост-трансляционную модификацию, выбранную из группы, состоящей из фосфорилирования остатка серина, окисления остатка метионина и ацетилирования остатка лизина, и их сочетания. В одном из вариантов осуществления этого аспекта настоящее изобретение относится к композиции, содержащей выделенный пептид, имеющий или состоящий из аминокислотной последовательности SEQ ID NO: 1, или его соль, где пептид содержит фосфосерин в положении 10 и окисленный остаток метионина в положении 4. В некоторых дополнительных вариантах осуществления указанный пептид с последовательностью SEQ ID NO: 1 также содержит ацетилированный остаток лизина. В частности, указанный пептид последовательности SEQ ID NO: 1 содержит фосфосерин в положении 10 и окисленный остаток метионина в положении 4, и ацетилирование одного или обоих лизинов в положении 8 и 12, и, более конкретно, дополнительно содержит фосфосерин в положении 7.
[0022] В дополнительных аспектах настоящее изобретение относится к выделенному пептиду, содержащему или состоящему из аминокислотной последовательности SEQ ID NO: 2, или его соли, имеющему по меньшей мере одну пост-трансляционную модификацию, выбранную из группы, состоящей из фосфорилирования остатка серина, окисления остатка метионина и ацетилирования остатка лизина, и их сочетания. В одном из вариантов осуществления этого аспекта настоящее изобретение относится к композиции, содержащей выделенный пептид, имеющий или состоящий из аминокислотной последовательности SEQ ID NO: 2, или его соль, где указанный пептид содержит фосфосерин в положении 9 и окисленный остаток метионина в положении 3. В некоторых дополнительных вариантах осуществления пептид последовательности SEQ ID NO: 2 также содержит ацетилированный остаток лизина.
[0023] В некоторых аспектах настоящее изобретение относится к композиции, содержащей эффективное количество одного или более пептидов, как описано в настоящей заявке. В некоторых вариантах осуществления композиция дополнительно содержит фармацевтически приемлемый носитель. В дополнительном варианте осуществления настоящее изобретение относится к композиции, содержащей эффективное количество по меньшей мере одного пептида или его соли, выбранного из группы, состоящей из аминокислотной последовательности SEQ ID NO: 2, содержащей фосфосерин в положении 9 и окисленный метионин в положении 3; аминокислотной последовательности SEQ ID NO: 1, содержащей фосфосерин в положении 10 и окисленный метионин в положении 4; и сочетание обоих.
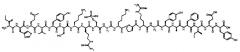
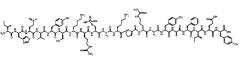
[0024] В некоторых вариантах осуществления настоящее изобретение относится к пептиду соединения II, имеющему следующую формулу:
[0025] Соединение II также может быть представлено последовательностью:
[0026] RIHM(O) VYSKRS (РO3Н2) GKPRGYAFIEY [SEQ ID NO: 4], в которой М(О) представляет окисление метионина, a S(PO3H2) представляет фосфорилирование серина.
[0028] Таким образом, настоящее изобретение относится к пептидам или их солям, содержащим или состоящим из аминокислотной последовательности, выбранной из группы, состоящей из последовательности SEQ ID NO: 4 и SEQ ID NO: 5.
[0029] Настоящее изобретение будет лучше проиллюстрировано следующими фиг. 1-6, сопровождающими описание, примерами и прилагаемой формулой изобретения, все из которых иллюстрируют различные варианты осуществления изобретения, приводимые в качестве примера, и не рассматриваются как ограничивающие изобретение.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0030] Сопровождающие чертежи, которые включены в описание и составляют его часть, иллюстрируют некоторые варианты осуществления настоящего изобретения и вместе с описанием служат для пояснения изобретения. Чертежи предназначены только для целей иллюстрации варианта осуществления изобретения и не рассматриваются как ограничивающие настоящее изобретение.
[0031] На фиг. 1 представлена стабильность пептида по изобретению при 37°С (Соединение II) по сравнению со стабильностью пептида, состоящего из последовательности SEQ ID NO: 1, в котором серин в положении 10 является фосфорилированным. На этом графике представлен процент стабильности с течением времени (выражено в днях). Кривые А-С представляют стабильность соединения II в концентрации 200, 100 и 50 мкг/мл, соответственно. Кривые D-F представляют стабильность пептида, состоящего из последовательности SEQ ID NO: 1, в котором серин в положении 10 является фосфорилированным, в концентрации 200, 100 и 50 мкг/мл, соответственно.
[0032] На фиг. 2 представлен график Каплана-Мейера, демонстрирующий суммарную частоту выживания (в процентах) с течением времени (выражено в неделях) у мышей, которым вводили NaCl (линия с кружочками), пептид, состоящий из последовательности SEQ ID NO: 1, где серин в положении 10 является фосфорилированным (линия с квадратиками), и соединение II по изобретению (линии с треугольниками).
[0033] На фиг. 3 представлены баллы протеинурии с течением времени (выражено в неделях) у мышей, которым вводили NaCl (линия с кружочками), пептид, состоящий из последовательности SEQ ID NO: 1, где серин в положении 10 является фосфорилированным (линия с квадратиками), и соединение II по изобретению (линии с треугольниками).
[0034] На фиг. 4 представлено определение повышенного содержания паренхиматозных клеток у мышей MRL/lpr. По оси Y представлено число клеток на мл крови (×106) у мышей, получавших NaCl (кружочки), пептид, состоящий из SEQ ID NO: 1, где серин в положении 10 является фосфорилированным (квадратики), и соединение II по изобретению (треугольники).
[0035] На фиг. 5 представлено определение аффинности в отношении белка HSC70 пептида, состоящего из последовательности SEQ ID NO: 1, где серин в положении 10 является фосфорилированным. Кривые соответствуют ответу Biacore с течением времени (выражено в секундах) с использованием пептида, состоящего из последовательности SEQ ID NO: 1, где серин в положении 10 является фосфорилированным, в концентрации 25 мкМ(А), 12,5 мкМ(В), 6,25 мкМ(С), 3,12 мкM(D) и 1,56 мкМ (Е).
[0036] На фиг. 6 представлено определение аффинности соединения II по настоящему изобретению для белка HSC7 0. Кривые соответствуют ответу Biacore с течением времени (выражено в секундах) с использованием соединения II в концентрации 25 мкМ(А), 12,5 мкМ(В), 6,25 мкМ(С), 3,12 мкM(D) и 1,56 мкМ(Е).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0037] Следующее подробное описание представлено для того, чтобы помочь специалистам в данной области осуществить на практике настоящее изобретение. Специалисты в данной области могут осуществить модификации и изменения в вариантах осуществления, описанных в настоящей заявке, не отклоняясь от сущности или объема настоящего изобретения. Хотя любые способы и вещества, аналогичные или эквивалентные описанным в настоящей заявке, также могут быть использованы при осуществлении на практике или тестировании настоящего изобретения, предпочтительные способы и вещества описаны сейчас. Если не определено иное, все технические и научные термины, используемые в настоящей заявке, имеют то же значение, которое обычно понимается специалистом в той области, к которой относится настоящее изобретение. Терминология, используемая в описании настоящего изобретения, предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения этого изобретения. Все публикации, патентные заявки, фигуры и другие ссылки, упомянутые в настоящем описании, специально включены посредством ссылки в полном объеме.
[0038] В контексте настоящего изобретения следующие термины могут иметь значения, данные им ниже, если не определено иное. Однако должно быть понятно, что другие значения, которые известны или понимаются специалистами в данной области, также возможны и входят в объем настоящего изобретения.
[0039] В тех случаях, когда представлен диапазон значений, следует понимать, что каждое промежуточное значение до десятых долей единицы нижнего предела, если из контекста явно не следует иное, между верхним и нижним пределом этого диапазона и любое указанное или промежуточное значение в этом указанном диапазоне входит в объем настоящего изобретения. Верхний и нижний пределы этих меньших диапазонов, которые могут независимо быть включены в меньшие диапазоны, также входят в объем настоящего изобретения, на который распространяется любой конкретно исключенный предел в установленном диапазоне. Там, где установленный диапазон включает одни или оба предела, диапазоны, исключающие любые оба из тех включенных пределов, также входят в объем настоящего изобретения.
[0040] Следует отметить, что в контексте настоящего изобретения и в прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число (т.е. ссылка на одно или более, а не одно или по меньшей мере одно) для этого грамматического объекта. В качестве примера, «элемент» означает один элемент или более чем один элемент.
[0041] Термин «примерно» в контексте настоящего изобретения вместе с численными значениями или диапазонами отражает тот факт, что существует определенный уровень отклонения, который является установленным и допустимым в данной области вследствие практических и/или теоретических ограничений. Например, минимальное отклонение является допустимым вследствие отклонений, присущих работе определенных устройств и/или проведению измерений. В соответствии с вышеизложенным, фраза «примерно», как правило, используется для обозначения значений в пределах стандартного отклонения или стандартной ошибки.
[0042] В контексте настоящего изобретения «производные» представляют собой композиции, образованные из исходных соединений либо напрямую, путем модификации, либо путем частичного замещения. В контексте настоящего изобретения «аналоги» представляют собой композиции, которые имеют структуру, аналогичную, но не идентичную исходному соединению.
[0043] Термин «эффективное количество/доза», «фармацевтически эффективное количество/доза» или «терапевтически эффективное количество/доза» может означать, но никоим образом не ограничиваться этим, что количество/доза активного фармацевтического ингредиента достаточна для профилактики, ингибирования возникновения, облегчения, задержки или лечения (облегчения симптома до некоторой степени, предпочтительно полностью) симптомов патологического состояния, нарушения или болезни. Эффективное количество зависит от типа заболевания, используемой композиции, пути введения, типа млекопитающего, подвергаемого лечению, физических характеристик конкретно рассматриваемого млекопитающего, сопутствующего лечения и других факторов, которые известны специалистам в области медицины. В основном количество активных ингредиентов от 0,1 мг/кг до 1000 мг/кг массы тела в день вводят в зависимости от эффективности действующего вещества. Токсичность и терапевтическую эффективность таких соединений можно определить с помощью стандартных фармацевтических процедур в клеточных культурах или на экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной для 50% популяции). Соотношение доз между токсическим и терапевтическим эффектами представляет собой терапевтический индекс и может быть выражено как соотношение LD50/ED50. Соединения, которые демонстрируют большие терапевтические индексы, являются предпочтительными. Хотя могут быть использованы соединения, которые проявляют токсические побочные эффекты, следует соблюдать осторожность, чтобы разработать систему доставки, которая направляет такие соединения к месту пораженной ткани, с тем, чтобы свести к минимуму возможность повреждения неинфицированных клеток и тем самым уменьшить побочные эффекты. Данные, полученные в результате анализов клеточных культур и исследований на животных, могут быть использованы при составлении интервала доз для использования у людей. Дозировка таких соединений предпочтительно находится в пределах интервала циркулирующих концентраций, который включает ED50 с небольшой токсичностью или без нее. Доза может варьировать в пределах этого интервала в зависимости от используемой лекарственной формы и используемого пути введения. Для любого соединения, используемого в способе по изобретению, терапевтически эффективную дозу первоначально можно оценить по результатам анализов клеточных культур. Доза может быть составлена на животных моделях для достижения интервала циркулирующей в плазме концентрации, который включает IC50 (то есть, концентрации тестируемого соединения, при которой достигается полумаксимальное ингибирование симптомов), как определено в клеточной культуре. Такая информация может быть использована для более точного определения используемых доз у людей. Могут быть измерены уровни в плазме, например, с помощью высокоэффективной жидкостной хроматографии.
[0044] Термин «фармакологическая композиция», «терапевтическая композиция», «терапевтический состав» или «фармацевтически приемлемый состав» может означать, но это никоим образом не ограничивается, композицию или состав, который позволяет осуществлять эффективное распределение действующего вещества, представленного в настоящем изобретении, которое находится в форме, подходящей для введения в физическое местоположение, наиболее подходящее для их желаемой активности, например, системное введение.
[0045] Термин «фармацевтически приемлемый» или «фармакологически приемлемый» может означать, но это никоим образом не ограничивается, соединения и композиции, которые не вызывают побочных, аллергических или других нежелательных реакций при введении животному или человеку должным образом.
[0046] Термин «фармацевтически приемлемый носитель» или «фармакологически приемлемый носитель» может означать, но это никоим образом не ограничивается, всевозможные растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические вещества и вещества, задерживающие абсорбцию, и подобные, совместимые с фармацевтическим введением. Подходящие носители описаны в последнем издании Remington's Pharmaceutical Sciences, стандартном справочнике в данной области, включенном в настоящее описание посредством ссылки. Предпочтительные примеры таких носителей или разбавителей включают, но не ограничиваются, воду, физиологический раствор, растворы «finger's», раствор декстрозы и 5% сывороточный альбумин человека. Могут быть использованы липосомы и неводные носители, такие как нелетучие масла. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно из уровня техники. За исключением случаев, когда любые обычные среды или агенты несовместимы с активным соединением, предусмотрено их применение в композициях. Дополнительные активные соединения также могут быть включены в композиции.
[0047] Термин «системное введение» относится к пути введения, то есть энтеральному или парентеральному, который результате приводит к системному распределению вещества, приводя к системной абсорбции или накоплению лекарственных средств в кровотоке с последующим распределением по всему организму. Подходящие формы, частично, зависят от использования или пути введения, например, перорального, чрескожного пути или введения посредством инъекции. Такие формы не должны препятствовать достижению композицией или составом клетки-мишени (то есть клетки, к которой желательна доставка отрицательно заряженного полимера). Например, фармакологические композиции, вводимые в кровоток, должны быть растворимыми. Другие факторы, известные из уровня техники, включают такие аспекты, как токсичность, и формы, которые препятствуют композиции или составу осуществлять их действие. Пути введения, которые приводят к системной абсорбции, включают, без ограничения: внутривенный, подкожный, внутрибрюшинный, ингаляционный, пероральный, внутрилегочный и внутримышечный. Было показано, что скорость вхождения лекарственного средства в кровоток зависит от молекулярной массы или размера. Применение липосомы или другого носителя лекарственного средства, содержащего соединения по настоящему изобретению, потенциально может локализовать это лекарственное средство, например, в определенных типах тканей, например, тканях ретикулоэндотелиальной системы (RES). Также можно использовать липосомный состав, который может облегчать связывание лекарственного средства с поверхностью клеток, например, лимфоцитами и макрофагами.
[0048] Термин «местное введение» относится к пути введения, при котором вещество доставляют в место, которое является подходящим или близким, например, в пределах примерно 10 см к месту повреждения или нарушения.
[0049] Термин «производные» может означать, но это никоим образом не ограничивается, химические соединения, например, нуклеиновые кислоты, нуклеотиды, полипептиды или аминокислоты, образованные из природных соединений либо напрямую, либо путем модификации, или путем частичного замещения. Термин «аналоги» может означать, но это никоим образом не ограничивается, химические соединения, например, нуклеиновые кислоты, нуклеотиды, полипептиды или аминокислоты, которые имеют структуру, аналогичную, но не идентичную природному соединению.
[0050] Термин «консервативные мутации» относится к замещению, делеции или добавлению нуклеиновых кислот, которые изменяют, добавляют или удаляют одну аминокислоту или небольшое число аминокислот в кодирующей последовательности, где изменения нуклеиновых кислот в результате приводит к замене химически сходной аминокислоты. Аминокислоты, которые могут служить в качестве консервативных аминокислотных замен друг для друга, включают следующие: основные: аргинин (R), лизин (К), гистидин (Н); кислые: аспарагиновую кислоту (D), глутаминовую кислоту (Е), аспарагин (N), глутамин (Q); гидрофильные: глицин (G), аланин (А), валин (V), лейцин (L), изолейцин (I); гидрофобные: фенилаланин (F), тирозин (Y), триптофан (W); серосодержащие: метионин (М), цистеин (С). Кроме того, последовательности, которые отличаются консервативными изменениями, в основном являются гомологичными.
[0051] Под «гомологией» подразумевается, что нуклеотидная последовательность из двух или более молекул нуклеиновых кислот или двух или более последовательностей нуклеиновых кислот или аминокислот является частично или полностью идентичной. В некоторых вариантах осуществления гомологичные последовательности нуклеиновых кислот или аминокислотные последовательности имеют 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% сходство последовательностей или идентичность нуклеиновой кислоте, кодирующей аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 1, соответственно.
[0052] «Гомологи» могут быть природными или созданы путем искусственного синтеза одной или более нуклеиновых кислот, имеющих родственные последовательности, или путем модификации одной или более нуклеиновых кислот для получения родственных нуклеиновых кислот. Нуклеиновые кислоты являются гомологичными, когда они происходят, природно или искусственно, из последовательности общего предшественника (например, ортологи или паралоги). Если гомология между двумя нуклеиновыми кислотами не описана точно, гомология может быть выведена путем сравнения нуклеиновых кислот между двумя или более последовательностями. Если последовательности демонстрируют одинаковую степень сходства последовательностей, например, примерно больше 30% на уровне первичной аминокислотной структуры, делается вывод, что у них общий предшественник. Для целей настоящего изобретения гены являются гомологичными, если последовательности нуклеиновых кислот являются достаточно сходными, чтобы допустить рекомбинацию и/или гибридизацию в условиях низкой строгости. Кроме того, полипептиды называются гомологичными, если их последовательности нуклеиновых кислот являются достаточно сходными, чтобы допустить рекомбинацию или гибридизацию в условиях низкой строгости, и, необязательно, они демонстрируют мембранную репарационную активность, и, необязательно, они могут распознаваться (например, перекрестно реагировать) антителом, специфичным в отношении эпитопа, содержащегося в пределах аминокислотной последовательности по меньшей мере одной из последовательностей SEQ ID NO: 1-6.
[0053] Термин «клетка» может означать, но это никоим образом не ограничивается, его обычный биологический смысл и не относится к целому многоклеточному организму. Клетка может, например, находиться in vivo, in vitro или ex vivo, например, в клеточной культуре или находиться в многоклеточном организме, включая, например, птиц, растения и млекопитающих, таких как люди, коровы, овцы, приматы, обезьяны, свиньи, собаки и кошки. Клетка может быть прокариотической (например, бактериальная клетка) или эукариотической (например, клеткой млекопитающих или клеткой растения).
[0054] Термин «клетка-хозяин» может означать, но это никоим образом не ограничивается, клетку, которая может быть использована для переноса гетерологичной нуклеиновой кислоты или которая экспрессирует пептид или белок, кодируемый гетерологичной нуклеиновой кислотой. Клетка-хозяин может содержать гены, которые не находятся в нативной (нерекомбинантной) форме клетки, гены, находящиеся в нативной форме клетки, где эти гены модифицированы и повторно введены в эту клетку искусственным путем, или нуклеиновую кислоту, эндогенную для этой клетки, которая была искусственно модифицирована без удаления нуклеиновой кислоты из этой клетки. Клетка-хозяин может быть эукариотической или прокариотической. Основные условия роста, необходимые для культуры бактерий, можно найти в руководствах, таких как BERGEY'S MANUAL OF SYSTEMATIC BACTERIOLOGY, Vol.1, N. R. Krieg, ed., Williams and Wilkins, Baltimore/London (1984). «Клетка-хозяин» также может представлять собой клетку, в которой эндогенные гены или промоторы, или и те, и другие, были модифицированы для продуцирования одного или более полипептидных компонентов комплекса в соответствии с настоящим изобретением.
[0055] В контексте настоящего изобретения «Р140» относится к пептиду, состоящему из аминокислотной последовательности SEQ ID NO: 1, в которой серин в положении 10 является фосфорилированным.
[0056] Термин «терапевтически эффективное количество или доза» включает дозу лекарственного средства, которая способна оказывать терапевтический эффект у пациента, нуждающегося в этом, например, терапевтически эффективным количеством лекарственного средства может быть количество, которое способно предотвращать или облегчать один или более симптомов, связанных с заболеванием или нарушением, например, повреждение ткани или заболевание или нарушение, связанное с мышцами. Точное количество может быть установлено специалистом в данной области с использованием известных методик (см., например, Lieberman, Pharmaceutical Dosage Forms (vols. 1-3, 1992); Lloyd, The Art, Science and Technology of Pharmaceutical Compounding (1999); Pickar, Dosage Calculations (1999); и Remington: The Science and Practice of Pharmacy, 20th Edition, 2003, Gennaro, Ed., Lippincott, Williams & Wilkins).
[0057] Набор представляет собой любое изделие (например, упаковку или контейнер), содержащее по меньшей мере один реагент, например зонд, для специфического определения маркера настоящего изобретения. Это изделие можно производить, распространять или продавать как единое целое для осуществления способов по настоящему изобретению. Реактивы, включенные в такой набор, содержат зонды/праймеры и/или антитела для использования при определении чувствительности и резистентности генной экспрессии. Кроме того, наборы по настоящему изобретению предпочтительно могут содержать инструкции, которые описывают подходящий анализ на определение. Такие наборы можно удобно использовать, например, в клинических условиях, для диагностики пациентов, у которых демонстрируются симптомы злокачественного заболевания, у конкретных пациентов, у которых проявляется возможное присутствие опухоли.
[0058] Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют то же значение, что и обычно понимаемое специалистом в той области, которой принадлежит настоящее изобретение. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящей заявке, включены посредством ссылки в полном объеме. В случае конфликта настоящее описание, включая определения, будет иметь преимущественную силу. Кроме того, вещества, способы и примеры являются только иллюстративными и не предназначены для ограничения.
[0059] Следующие ссылки, полное описание которых включено в настоящую заявку посредством ссылки, предоставляют специалисту общее определение многих терминов, используемых в настоящем изобретении: Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.), Springer Verlag (1991); и Hale & Marham, the Harper Collins Dictionary of Biology (1991).
[0060] Настоящее изобретение относится к композициям и способам их применения, которые основаны на удивительном и неожиданном открытии того, что определенные модифицированные формы пептида последовательности SEQ ID NO: 2 являются стабильными при введении млекопитающим. Таким образом, в одном аспекте настоящее описание относится к композициям, содержащим такие пептиды и фармацевтически приемлемый носитель.
[0061] В другом аспекте настоящее описание относится к фармацевтической композиции или лекарственному средству, применимому для облегчения аутоиммунных заболеваний, преимущественно для лечения волчанки.
[0062] В дополнительном аспекте настоящее изобретение относится к способам лечения аутоиммунного заболевания, включающим введение эффективного количества терапевтической композиции, как описано в настоящей заявке.
[0063] В некоторых вариантах осуществления настоящее изобретение относится к выделенному пептиду (рекомбинантному или синтезированному) или его соли, содержащему или состоящему из аминокислотной последовательности:
[0064] IHMVYSKRSGKPRGYAFIEY [SEQ ID NO: 2],
[0065] в которой серин (S) в положении 9 является фосфорилированным, и метионин (М) в положении 3 является окисленным.
[0066] В некоторых вариантах осуществления настоящее изобретение относится к пептиду соединения I, имеющего следующую формулу:
[0067] Соединение I также может быть представлено последовательностью:
[0068] IHM(O)VYSKRS(PO3H2)GKPRGYAFIEY [SEQ ID NO: 5],
[0069] в которой «M(O)» представляет окисленный метионин, и «S(PO3H2)» представляет фосфосерин.
[0070] Эти пептиды происходят из белка человека U1 snRNP 70 кДа (SEQ ID NO: 3) и соответствуют области, ограниченной аминокислотным сегментом, продолжающимся от остатка 132 до остатка 151 последовательности SEQ ID NO: 3. Формально, остаток, который является фосфорилированным, соответствует аминокислоте в положении 140 от первого метионина последовательности SEQ ID NO: 3, и остаток, который является окисленным, соответствует аминокислоте в положении 134 от первого метионина последовательности SEQ ID NO: 3.
[0071] В некоторых аспектах настоящее изобретение относится к выделенному пептиду, содержащему или состоящему из аминокислотной последовательности SEQ ID NO: 1, или его соли, имеющему по меньшей мере одну пост-трансляционную модификацию, выбранную из группы, состоящей из фосфорилирования остатка серина, окисления остатка метионина и ацетилирования остатка лизина, и их сочетания. В одном варианте осуществления этого аспекта настоящее изобретение относится к композиции, содержащей выделенный пептид, имеющий или состоящий из аминокислотной последовательности SEQ ID NO: 1, или его соли, где указанный пептид содержит фосфосерин в положении 10 и окисленный остаток метионина в положении 4. В некоторых дополнительных вариантах осуществления пептид последовательности SEQ ID NO: 1 также содержит ацетилированный остаток лизина.
[0072] В дополнительных аспектах настоящее описание относится к выделенному пептиду, содержащему или состоящему из аминокислотной последовательности SEQ ID NO: 2, или его соли, имеющему по меньшей мере одну пост-трансляционную модификацию, выбранную из группы, состоящей из фосфорилирования остатка серина, окисления остатка метионина и ацетилирования остатка лизина, и их сочетания. В одном варианте осуществления этого аспекта на