Производные факторов свертывания крови vii и viia, конъюгаты и комплексы, содержащие их, и их применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению производных фактора свертывания крови VII и VIIa, их конъюгатов с полимерами, способными увеличивать время полувыведения из кровотока, комплексов с ними, полученных путем связывания носителя с конъюгатом, к генам, кодирующим производные, к экспрессирующим векторам, содержащим эти гены, трансформантам с введенными экспрессирующими векторами, к способам их получения, фармацевтическим композициям и способам лечения, и может быть использовано в медицине для предупреждения или лечения гемофилии или улучшения свертываемости крови. Получают производное FVII, соединенное по своему С-концу с пептидным линкером для связи с непептидильным полимером, способным увеличивать время полувыведения FVII или FVIIa из кровотока. При этом пептидный линкер представляет собой частичную последовательность супероксиддисмутазы SOD1, ее мутированную последовательность или последовательность GGGGSC. Изобретение позволяет получить производное FVII, способное связываться с носителем, увеличивающим время полувыведения из кровотока при сохранении активности FVII. 17 н. и 25 з.п. ф-лы, 8 ил., 3 табл., 8 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к производному фактора свертывания крови VII, производному фактора свертывания крови VIIa, конъюгатам Fac VII и Fac VIIa, каждый из которых получен путем присоединения полимера, способного увеличивать время полувыведения производного из кровотока, к Fac VII и VIIa комплексам, каждый из которых получен путем присоединения носителя к конъюгату, к генам, кодирующим производные Fac VII и Fac VIIa, к экспрессирующим векторам, содержащим гены, к трансформантам с введенными экспрессирующими векторами, к способу получения производных Fac VII и Fac VIIa с использованием этих трансформантов, к способу получения конъюгата и комплекса Fac VIIa, к комплексу Fac VIIa. полученному посредством этого способа, к фармацевтической композиции для предупреждения или лечения гемофилии, содержащей это производное, конъюгат или комплекс в качестве активного ингредиента, и к фармацевтической композиции для улучшения свертывания крови, содержащей это производное, конъюгат или комплекс в качестве активного ингредиента. Кроме того, настоящее изобретение относится к способу предупреждения или лечения гемофилии или улучшения свертывания крови, включающему введение субъекту терапевтически эффективного количества композиции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В настоящее время по всему миру насчитывается 140 тысяч человек с гемофилией, при этом ежегодный прирост составляет 20%. Генетически гемофилия имеет место у одного из десяти тысяч субъектов, но диагностику или лечение осуществляют только у примерно 25% всех пациентов. На основании этиологии гемофилию в основном делят на два типа: один представляет собой гемофилию А, которая вызвана отсутствием фактора свертывания крови VII (Фактор VII, Fac VII) и составляет 80% от общего числа пациентов с гемофилией, а другой представляет собой гемофилию В, которая вызвана отсутствием фактора свертывания крови XI (Фактор XI) и составляет 20% от общего числа пациентов с гемофилией. Для лечения гемофилии осуществляют внешнее введение факторов свертывания крови, но этот способ лечения является проблематичным, так как у 10-15% всех пациентов с гемофилией А вырабатываются антитела против фактора свертывания крови и у 1-3% всех пациентов с гемофилией В вырабатываются антитела против фактора свертывания крови.
С другой стороны, Fac VII, который является причиной гемофилии А у более чем половины пациентов с гемофилией, представляет собой фермент, который продуцируется главным образом печенью, и состоит из 406 аминокислот, и включает гамма-карбоксилирование глутаминовой кислоты в положении 10, N-гликозилирование аспарагинов в положениях 145 и 322 и O-гликозилирование серинов в положениях 52 и 60. Кроме того, Fac VII имеет два EGF-подобных домена и один сериновый протеазный домен, и одноцепочечный Fac VII активируется посредством разрыва между аргинином в положении 152 и изолейцином в положении 153 с образованием двухцепочечного Fac VIIa, состоящего из легкой цепи и тяжелой цепи. Так как активированный Fac VIIa действует посредством вспомогательного механизма свертывания крови в отличие от других факторов свертывания крови, антитела не продуцируются даже при инъекции высоких доз Fac VIIa. Следовательно, его можно использовать для лечения пациентов с гемофилией А, а также пациентов, имеющих антитела против Fac VII вследствие обычной терапии, и известен как средство решения вышеописанных проблем.
Хотя антитела против Fac VIIa не продуцируются, существует другая проблема необходимости высокодозового и частого введения из-за короткого времени полувыведения из кровотока. Из-за короткого времени полувыведения Fac VIIa следует вводить 2-3 раза в сутки для лечения гемофилии, и такое частое введение также становится серьезным препятствием для профилактики гемофилии. Чтобы решить проблему короткого времени полувыведения из кровотока, в исследованиях предлагались известные способы микрокапсулирования, инкапсуляции в липосомы, а также ряд химических модификаций, но до сих пор не сообщалось об успешных результатах. В частности, были предприняты химические модификации, такие как химическая модификация остатка лизина или N-конца на поверхности Fac VIIa или присоединение к нему носителя, способного увеличивать время полувыведения из кровотока, такого как полиэтиленгликоль, альбумин, трансферрин и фрагмент иммуноглобулина, или остаток цистеина вставляют в область, которая непосредственно не влияет на активность Fac VIIa, чтобы содействовать связыванию с носителем. Однако химическая модификация остатка лизина или N-конца на поверхности Fac VIIa снижает способность Fac VIIa связываться с мембраной тромбоцита. При связывании с другим носителем, этот носитель является помехой ферментативным активностям. Введение остатка цистеина индуцирует образование неспецифической дисульфидной связи, что впоследствии ведет к уменьшению ферментативных активностей. По существу, многие исследования были осуществлены с целью разработки производных, имеющих улучшенное время полувыведения из кровотока без снижения активности Fac VIIa, но до сих пор не сообщалось об успешных результатах.
rVIIa-FP (CSL Behring), полученный посредством слияния альбумина с С-концом Fac VIIa, находится в доклинической фазе исследования и его время полувыведения из кровотока у крыс увеличено в 6,7 раз по сравнению с нативным Fac VIIa. Однако он все еще имеет очень короткое время полувыведения, составляющее 4,38 ч, и, таким образом, не подходит для лечения и профилактики гемофилии. PEGLip-FVIIa (Omri), полученный с использованием пэгилированной липосомной композиции, также находится в доклинической фазе исследования, но его время полувыведения из кровотока было только в два раза выше, чем у нативного Fac VIIa.
Два продукта, MAXY-VII (Bayer/Maxygen), полученный путем мутации домена Gla и гипергликозилирования Fac VIIa с получением пролонгированного времени полувыведения из кровотока, и NN7128 (Novo/Neose), полученный посредством 40K PEG-гликозилирования с получением пролонгированного времени полувыведения из кровотока, подвергаются клиническим исследованиям, но их время полувыведения из кровотока было только в 5 раз выше, чем время полувыведения из кровотока нативного Fac VIIa. Таким образом, они не подходят для эффективного лечения и профилактики гемофилии.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
На основании предшествующего уровня техники авторы настоящего изобретения предпринимали многочисленные попытки получить производные с улучшенным временем полувыведения из кровотока при сохранении максимальных активностей Fac VII и Fac VIIa. В результате, они обнаружили, что производное, полученное посредством слияния части последовательности SOD1 (Супероксиддисмутазы 1) с С-концом Fac VII, способно легко связываться с носителем, способным увеличивать время полувыведения из кровотока, таким как полиэтиленгликоль, альбумин, трансферрин и иммуноглобулиновый фрагмент, без снижения активности Fac VII или Fac VIIa, и, в частности, Fc-область иммуноглобулина, непептидильный полимер, и производное Fac VII или Fac VIIa сайт-специфически связывается посредством ковалентной связи для миниминизации снижения активности и для значительного увеличения времени полувыведения конъюгата из кровотока, завершая тем самым настоящее изобретение.
РЕШЕНИЕ ПРОБЛЕМЫ
Задачей настоящего изобретения является предложение производного Fac VII или его активной формы Fac VIIa, которые имеют аминокислотную последовательность фактора свертывания крови VII (Фактор VII, Fac VII) или его активной формы, фактора свертывания крови VIIa (Фактор VIIa, Fac VIIa) и пептидный линкер на С-конце.
Другая задача настоящего изобретения заключается в предложении полинуклеотида. кодирующего производное Fac VII или его активную форму Fac VIIa.
Еще одной задачей настоящего изобретения является предложение экспрессирующего вектора, содержащего полинуклеотид.
Еще одной задачей настоящего изобретения является предложение трансформанта с введенным экспрессирующим вектором.
Еще одной задачей настоящего изобретения является предложение способа получения производного Fac VII или его активной формы Fac VIIa с использованием трансформанта.
Еще одной задачей настоящего изобретения является предложение конъюгата Fac VII или его активной формы Fac VIIa, который получают путем связывания полимера, способного увеличивать время полувыведения из кровотока, с пептидным линкером производного.
Еще одной задачей настоящего изобретения является предложение комплекса Fac VII или его активной формы Fac VIIa, который получают путем связывания носителя, способного увеличивать время полувыведения из кровотока, с одним концом конъюгата.
Еще одной задачей настоящего изобретения является предложение способа получения комплекса Fac VIIa, включающего стадию активации комплекса Fac VII.
Еще одной задачей настоящего изобретения является предложение комплекса Fac VIIa, полученного посредством вышеприведенного способа.
Еще одной задачей настоящего изобретения является предложение фармацевтической композиции для предупреждения или лечения гемофилии, содержащей производное, конъюгат или комплекс в качестве активного ингредиента.
Еще одной задачей настоящего изобретения является предложение фармацевтической композиции для свертывания крови, содержащей производное, конъюгат или комплекс в качестве активного ингредиента.
Еще одной задачей настоящего изобретения является предложение способа предупреждения или лечения гемофилии, включающего стадию введения субъекту терапевтически эффективного количества фармацевтической композиции для предупреждения или лечения гемофилии.
Еще одной задачей настоящего изобретения является предложение способа повышения свертывания крови, включающего стадию введения субъекту терапевтически эффективного количества фармацевтической композиции для свертывания крови.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Производные Fac VII или Fac VIIa по настоящему изобретению способны связываться с носителем, способным улучшать время полувыведения из кровотока при сохранении активности Fac VII или Fac VIIa, и их можно широко использовать в разработке эффективного профилактического или терапевтического агента для гемофилии.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1а представлена фотография, демонстрирующая результат вестерн-блоттинга Fac VII-ATKAVC, экспрессируемого в клеточной линии 293F;
На Фиг. 1b представлена фотография, показывающая результат вестерн-блоттинга контрольной группы и FVII-GGGGSC (FVII-G4SC), экспрессируемого в клеточной линии 293F;
на Фиг. 1c представлена фотография результата вестерн-блоттинга, демонстрирующая различие молекулярной массы Fc VII-ATKAVC и Fac VII-SOD11-149, экспрессируемых в клеточной линии 293F;
на Фиг. 2 представлена фотография, показывающая результат электрофореза очищенного Fac VII-ATKAVC;
на Фиг. 3 представлена фотография, показывающая результат электрофореза конъюгата Fac VII-ATKAVC-PEG;
на Фиг. 4а представлена фотография, показывающая результат электрофореза конъюгата Fac VIIa-ATKAVC-PEG-Fc;
на Фиг. 4b представлена фотография, показывающая результат вестерн-блоттинга конъюгата Fac VIIa-ATKAVC-PEG-Fc;
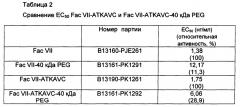
на Фиг. 5 представлен график зависимого от концентрации поглощения, демонстрирующий in vitro активность Fac VII и Fac VII-ATKAVC.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В одном аспекте для достижения вышеуказанных задач в настоящем изобретении предлагаются производные Fac VII или его активной формы Fac VIIa с аминокислотной последовательностью (SEQ ID NO: 4) фактора свертывания крови VII (Фактор VII, Fac VII) и пептидным линкером на его С-конце.
В данном контексте термин "фактор свертывания крови VII (Фактор VII, Fac VII)", который также называется проконвертин, представляет собой один из факторов, вовлеченных в свертываемость крови, имеет размер 48 кДа и кодируется геном, имеющим размер 12,8 т.п.н., преимущественно продуцируется печенью и представляет один из витамин K-зависимых белков плазмы. Известно, что Fac VII связывается с фактором свертывания крови III на поверхности внесосудистых тканей, например как предшественник сериновой протеазы и гладкомышечные клетки, опухолевые ткани или активированные лейкоциты, и таким образом активирует факторы свертывания крови IX и X, что приводит к инициации внешнего пути свертывания крови. В настоящем изобретении, Fac VII может включать нативный Fac VII, химически модифицированные производные Fac VII, которые сохраняют нормальную активность нативного Fac VII, и варианты, которые имеют по меньшей мере 80%-ную гомологию аминокислотной последовательности, предпочтительно 85%, 90% или 95%-ную гомологию аминокислотной последовательности и более предпочтительно 98% или 99% гомологию аминокислотной последовательности с нативным Fac VII при сохранении нормальной активности нативного Fac VII. Однако гомология последовательности не ограничивается вышеуказанными значениями до тех пор, пока они проявляют активность нативного Fac VII.
В данном контексте термин ʺфактор свертывания крови VIIa (Фактор VIIa, Fac VIIa)ʺ означает активную форму фактора свертывания крови VII (Фактор VII, Fac VII), и одноцепочечный Fac VII активируется в результате разрыва между аргинином в положении 152 и изолейцином в положении 153 с образованием двухцепочечного Fac VIIa, состоящего из легкой цепи и тяжелой цепи. Поскольку активированный Fac VIIa действует через вспомогательный механизм свертывания крови, в отличие от других факторов свертывания крови, антитела не продуцируются даже при инъекции высокой дозы Fac VIIa. В настоящем изобретении Fac VIIa может включать нативный Fac VIIa, химически модифицированные производные Fac VIIa, которые сохраняют нормальную активность нативного Fac VIIa и варианты, которые имеют по меньшей мере 80%-ную гомологию аминокислотной последовательности, предпочтительно 85%, 90% или 95%-ную гомологию аминокислотной последовательности и более предпочтительно 98% или 99% гомологию аминокислотной последовательности по сравнению с нативным Fac VII при сохранении нормальной активности нативного Fac VIIa. Однако гомология последовательности не ограничена вышеуказанными значениями до тех пор, пока они проявляют активность нативного Fac VII.
В данном контексте термин ʺлинкерʺ в основном относится к средству, способному соединить два разных партнера слияния (например биологические полимеры) с использованием водородной связи, электростатического взаимодействия, ван-дер-ваальсовой силы, дисульфидной связи, солевого мостика, гидрофобного взаимодействия, ковалентной связи и т.п. Предпочтительно, он может иметь по меньшей мере один цистеин, вовлеченный по меньшей мере в одну дисульфидную связь в физиологических условиях или других стандартных пептидных условиях (например в условиях очистки пептида, условиях хранения пептида). Можно использовать цистеин в качестве реакционно-способной группы, связывающей партнера слияния, а также дисульфидную связь. Кроме того, линкер обеспечивает заданный промежуток между носителями или выполняет функции шарнира, обеспечивающего гибкость или жесткость слитого белка, а также просто осуществляет функцию связывания каждого из партнеров слияния. В настоящем изобретении линкер представляет собой, но конкретно не ограничен ими, пептидный линкер, который связывает С-конец Fac VII или Fac VIIa с носителем, способным увеличивать время полувыведения из кровотока, и, предпочтительно, С-концевой остаток цистеина пептидного линкера. Предпочтительной может быть частичная последовательность (SEQ ID NO: 30) SOD1 (супероксиддисмутазы 1), более предпочтительно частичная последовательность (SEQ ID NO: 31), выбранная из области от 1 до 149 последовательности SOD1, еще более предпочтительно от 1 до 90 последовательности SOD1 (SEQ ID NO: 32), гораздо более предпочтительно от 1 до 25 последовательности SOD1 (SEQ ID NO: 33) и наиболее предпочтительно от 1 до 6 последовательности SOD1 (SEQ ID NO: 5).
В данном контексте термин ʺSOD1 (супероксиддисмутаза 1)ʺ означает фермент, который катализирует дисмутацию реактивного кислорода, супероксидного иона до кислорода и перекиси водорода и, как известно, представляет собой важную антиоксидантную защиту во всех клетках, подвергнутых воздействию кислорода. В настоящем изобретении SOD1 используется в качестве пептидного линкера, способного связывать Fac VII с носителем, способным увеличивать время полувыведения из кровотока. SOD1, обычно встречающуюся в организме, используют в качестве линкера, тем самым снижая иммуногенность линкера. VLKG (валин-лейцин-лизин-глицин) в рамках последовательности пептидного линкера SOD1 может быть заменен на сайт саморасщепления последовательности IPRI (изолейцин-пролин-аргинин-изолейцин), который узнается и расщепляется производным Fac VIIa. Благодаря такой замене на саморасщепляющуюся последовательность, область линкера, ненужная для активации, может быть удалена при помощи производного Fac VIIa при активации.
В настоящем изобретении, сайт саморасщепления представляет собой сайт, содержащий определенную последовательность, где полипептид имеет соответствующую определенную последовательность в своей собственной последовательности и узнает и расщепляет его.
В данном контексте термин ʺпроизводное Fac VIIʺ означает модифицированный Fac VII, который содержит аминокислотную последовательность, полученную путем связывания пептидного линкера с С-концом Fac VII. Производное Fac VII по настоящему изобретению означает форму до активации и превращается в производное Fac VIIa при активации посредством определенного способа. В настоящем изобретении производное Fac VII и производное Fac VIIa могут иметь одинаковое значение, за исключением конкретной стадии, например процесса получения конъюгата или тому подобного. В настоящем изобретении производное Fac VII представляет собой, но конкретно не ограничено ими, полипептид (SEQ ID NO: 9), полученный посредством связывания ATKAVC (SEQ ID NO: 5), 1-6 аминокислот из последовательности SOD1, с С-концом производного Fac VII, полипептид (SEQ ID NO: 13), полученный путем связывания GGGGSC (SEQ ID NO: 10) с С-концом производного Fac VII, полипептид (SEQ ID NO: 14), полученный путем связывания аминокислотной последовательности из 1-149 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 34), полученный путем связывания аминокислотной последовательности из 1-90 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 35), полученный путем связывания аминокислотной последовательности из 1-25 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 20), полученный путем связывания аминокислотной последовательности из 1-149 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 27), полученный путем связывания аминокислотной последовательности из 1-90 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII или полипептид (SEQ ID NO: 24). полученный путем связывания аминокислотной последовательности из 1-25 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII.
В данном контексте термин ʺпроизводное Fac VIIaʺ означает активную форму производного Fac VII, которая имеет аминокислотную последовательность, идентичную аминокислотной последовательности производного Fac VII, но активируется посредством расщепления между аминокислотами в положениях 152 и 153. В настоящем изобретении производное Fac VIIa представляет собой, но конкретно не ограничено ими, полипептид (SEQ ID NO: 9), полученный путем связывания ATKAVC (SEQ ID NO: 5), 1-6 аминокислот последовательности SOD1 с С-концом производного Fac VIIa, полипептид (SEQ ID NO: 13) полученный путем связывания GGGGSC (SEQ ID NO: 10) с С-концом производного Fac VIIa, полипептид (SEQ ID NO: 14), полученный путем связывания аминокислотной последовательности из 1-149 аминокислот последовательности SOD1 с С-концом производного Fac VIIa, полипептид (SEQ ID NO: 34), полученный путем связывания аминокислотной последовательности из 1-90 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 35) полученный путем связывания аминокислотной последовательности из 1-25 аминокислот последовательности SOD1 с С-концом производного Fac VII, полипептид (SEQ ID NO: 20), полученный путем связывания аминокислотной последовательности из 1-149 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VIIa, полипептид (SEQ ID NO: 27), полученный путем связывания аминокислотной последовательности из 1-90 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII, или полипептид (SEQ ID NO: 24), полученный путем связывания аминокислотной последовательности из 1-25 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VIIa.
Авторы настоящего изобретения исследовали характеристики активированного Fac VII и запланировали разработать производное, имеющее улучшенное время полувыведения из кровотока без снижения активности Fac VIIa. Неактивированный Fac VII представляет собой одноцепочечный Fac VII, полученный посредством соединения легкой и тяжелой цепей и открытым является только N-конец легкой цепи. Однако когда он превращается в Fac VIIa, активный сайт тяжелой цепи становится открытым при расщеплении между аргинином в положении 152 и изолейцином в положении 153, и открытый изолейцин в положении 153 становится N-концом тяжелой цепи. N-конец тяжелой и легкой цепей играет важную роль в активации Fac VIIa и, таким образом, конъюгация на N-конце может снизить активность Fac VII по сравнению с нативным Fac VII.
По этой причине авторы настоящего изобретения предлагают производное Fac VII, полученное с использованием фрагмента пептидной последовательности SOD1 в качестве линкера, где пептидный фрагмент, содержащий цистеин, не открыт структурно наружу и поэтому не включен в дисульфидную связь. Кроме того, в пептидный фрагмент, присоединенный в качестве линкера, вставлена последовательность сайта саморасщепления, которую может узнать и расщепить производное Fac VIIa и, таким образом, линкер, ненужный для активации, может быть удален. В настоящем изобретении предлагается производное Fac VII, которое имеет фрагмент, содержащий свободный цистеин пептида SOD1 на С-конце. Было обнаружено, что димерная форма производного Fac VII образуется на самом низком уровне во время инкубации, и производное Fac VII способно легко образовывать конъюгат с носителем, способным увеличивать время полувыведения из кровотока, тем самым компенсируя недостатки нативного Fac VII и производных, полученных простой вставкой цистеина в Fac VIIa.
Следовательно, конъюгат получают путем связывания с С-концом Fac VII или производного Fac VIIa по настоящему изобретению вещества, способного в значительной степени улучшать время полувыведения из кровотока с сохранением функции свертывания крови и значительно улучшать соблюдение схемы приема лекарственного средства, тем самым получая продукт, являющийся более эффективным в улучшении свертывания крови и предупреждении или лечении гемофилии, чем известные продукты.
В другом аспекте настоящего изобретения предлагает полинуклеотид, кодирующий производное Fac VII, экспрессирующий вектор, содержащий полинуклеотид, трансформант с введенным экспрессирующим вектором для экспрессии производного Fac VII, а также способ получения производного Fac VII с использованием трансформанта.
Полинуклеотид, кодирующий производное Fac VII, предложенный в настоящем изобретении, представляет собой, но конкретно не ограничен им, полинуклеотид, который получен путем связывания Fac VII-кодирующей области с областью, кодирующей пептидный линкер и, предпочтительно, полинуклеотид (SEQ ID NO: 8), кодирующий полипептид (SEQ ID NO: 9), который получен путем связывания ATKAVC (SEQ ID NO: 5) из 1-6 аминокислот последовательности SOD1 с С-концом производного Fac VII, полинуклеотид (SEQ ID NO: 12), кодирующий полипептид (SEQ ID NO: 13), который получен путем связывания GGGGSC (SEQ ID NO: 10) с С-концом производного Fac VII, полинуклеотид (SEQ ID NO: 15), кодирующий полипептид (SEQ ID NO: 14), который получен путем связывания 1-149 аминокислот последовательности SOD1 с С-концом производного Fac VII, полинуклеотид (SEQ ID NO: 21), кодирующий полипептид (SEQ ID NO: 20), который получен путем связывания 1-149 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII, полинуклеотид (SEQ ID NO: 28) кодирующий полипептид (SEQ ID NO: 27), который получен путем связывания 1-90 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII или полинуклеотид (SEQ ID NO: 25), кодирующий полипептид (SEQ ID NO: 24), который получен путем связывания 1-25 аминокислот мутантной последовательности SOD1 с С-концом производного Fac VII.
Экспрессирующий вектор, содержащий полинуклеотид, кодирующий производное Fac VII, предложенный в настоящем изобретении, представляет собой, но конкретно не ограничен им, вектор, способный к репликации и/или экспрессии полинуклеотида в эукариотических или прокариотических клетках, включая клетки млекопитающих (например клетки человека, обезьяны, кролика, крысы, хомяка, мыши и т.д.), растительные клетки, дрожжевые клетки, клетки насекомых или бактериальные клетки (например Е.coli и т.д.) и, предпочтительно, вектор, который функционально связан с подходящим промотором для экспрессии полинуклеотида в клетке-хозяине и содержит по меньшей мере один селективный маркер. Более предпочтительно, это может быть экспрессирующий вектор, полученный путем введения полинуклеотида в фаг, плазмиду, космиду, мини-хромосому, вирусный вектор или ретровирусный вектор. Наиболее предпочтительно, это может быть экспрессирующий вектор pX0GC-FVII-ATKAVC, включающий полинуклеотид, кодирующий производное Fac VII, который получен путем связывания полинуклеотида, кодирующего ATKAVC (SEQ ID NO: 5), 1-6 аминокислот последовательности SOD1 с 3'-концом гена Fac VII, экспрессирующий вектор pX0GC-FVII-GGGGSC, включающий полинуклеотид, кодирующий производное Fac VII, который получен путем связывания полинуклеотида, кодирующего GGGGSC (SEQ ID NO: 10) с 3'-концом гена Fac VII, экспрессирующий вектор pX0GC-FVII-SOD1 1-149, включающий полинуклеотид, кодирующий производное Fac VII, который получен путем связывания полинуклеотида, кодирующего аминокислотную последовательность (SEQ ID NO: 14) из 1-149 аминокислот последовательности SOD1 с 3'-концом гена Fac VII, экспрессирующий вектор pX0GC-FVII-SOD1 IPRI, включающий полинуклеотид, кодирующий производное Fac VII (SEQ ID NO: 21). который получен путем связывания полинуклеотида, кодирующего 1-149 аминокислоты мутантной последовательности SOD1 с 3'-концом гена Fac VII, экспрессирующий вектор pX0GC-FVII-SOD1 1-90 IPRI, включающий полинуклеотид, кодирующий производное Fac VII (SEQ ID NO: 28), который получен путем связывания полинуклеотида, кодирующего 1-90 аминокислоты мутантной последовательности SOD1 с 3'-концом гена Fac VII или экспрессирующий вектор pX0GC-FVII-SOD1 1-25 IPRI, включающий полинуклеотид, кодирующий производное Fac VII (SEQ ID NO: 25), который получен путем связывания полинуклеотида, кодирующего 1-25 аминокислоты мутантной последовательности SOD1 с 3'-концом гена Fac VII.
Трансформант с введенным экспрессирующим вектором, предложенный в настоящем изобретении, представляет собой, но конкретно не ограничен ими, бактериальные клетки, такие как Е.coli, Streptomyces и Salmonella typhimurium; дрожжевые клетки, такие как Pichia pastoris; клетки насекомых, такие как клетки Drosophila и Spodoptera Sf9; клетки животных, такие как СНО (клетки яичника китайского хомячка), COS (клетки почки обезьяны, трансформированные вирусом SV-40), NSO, 293, и клетки меланомы Боуэса (Bowes); или растительные клетки, которые трансформированы путем введения экспрессирующего вектора. Предпочтительно это может быть трансформант, получен путем введения экспрессирующего вектора в клеточные линии 293F или СНО, и наиболее предпочтительно HMF709, полученный путем введения экспрессирующего вектора pX0GC-FVII-ATKAVC в клеточную линию СНО.
Способ получения производного Fac VII, предложенного в настоящем изобретении, включают стадии (1) культивирования трансформанта с получением раствора культуры; и (2) выделения производного Fac VII из раствора культуры.
Способ, кроме того, включает стадию активации выделенного производного Fac VII, посредством чего получают производное Fac VIIa из полученного производного Fac VII. Способ активации такой же, как описан выше.
Авторы настоящего изобретения получили экспрессирующий вектор pX0GC-FVII-ATKAVC, включающий полинуклеотид, кодирующий производное Fac VII, который получен путем связывания полинуклеотида, кодирующего ATKAVC (SEQ ID NO: 5) из 1-6 аминокислот последовательности SOD1 с 3'-концом гена Fac VII (Пример 2-1), и экспрессирующий вектор был введен в клеточную линию 293F (Пример 3-1) или клеточную линию СНО (Пример 3-2) с получением трансформанта. Затем производное Fac VII экспрессировалось в этом трансформанте, и экспрессированное производное Fac VII подвергали очистке (Пример 4, Фиг. 2). Экспрессированное производное Fac VII активировали с получением производного Fac VIIa с последующим сравнением его активности с активностью нативного Fac VIIa (Пример 6 и Фиг. 4). В результате было обнаружено, что производное Fac VIIa, полученное из производного Fac VII по настоящему изобретению, демонстрирует активность, эквивалентную нативному Fac VIIa. Таким образом, из трансформантов, полученных посредством введения экспрессирующего вектора pX0GC-FVII-ATKAVC в СНО клетки, выбирали клон, демонстрирующий самый высокий уровень экспрессии производного Fac VII, и он были обозначен ʺHMF709ʺ и депонирован в Корейской коллекции типовых культур, Корейский исследовательский институт биологических наук и биотехнологии (111 Gwahangno, Yuseong-gu, Daejeon, Korea) под регистрационным номером ʺKCTC12022BPʺ.
В еще одном аспекте настоящего изобретения предлагается конъюгат Fac VII или его активная форма Fac VIIa, которую получают путем связывания полимера, способного увеличивать время полувыведения из кровотока, с пептидным линкером производного Fac VII.
Полимер по настоящему изобретению может представлять собой такой полимер, как полиэтиленгликоль, способный увеличивать время полувыведения из кровотока, и может быть выбран из белковых носителей, таких как фрагмент иммуноглобулина, трансферрин, антитело и альбумин.
В настоящем изобретении предлагается конъюгат, который получают путем связывания производного Fac VII с белковым носителем, используя непептидильный полимер в качестве линкера, in vitro, не используя метод генетической рекомбинации.
Непептидильный полимер по настоящему изобретению относится к непептидильному полимеру, предназначенному противостоять расщеплению различными ферментами или иммунными молекулами в крови или сыворотке. Непептидильный полимер, который не ограничивается следующими, может быть выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля-пропиленгликоля, полиоксиэтилированных полиолов, поливиниловых спиртов, полисахаридов, декстранов, поливинилэтиловых эфиров, биоразлагаемых полимеров, липидных полимеров, хитинов, гиалуроновых кислот и их комбинации. Непептидильные полимеры могут быть соединены друг с другом посредством ковалентной связи любого типа, за исключением пептидной связи. Кроме того, их производные, известные в данной области, и производные, легко получаемые любым известным в данной области способом, также входят в объем настоящего изобретения. В настоящем изобретении непептидильный полимер может быть связан с пептидным линкером производного Fac VII или производного Fac VIIa. Непептидильный полимер может быть связан с различными сайтами связывания пептидного линкера. Предпочтительно, непептидильный полимер может быть связан с С-концом пептидного линкера, присутствующего у производного Fac VII или производного Fac VIIa.
Непептидильный полимер может содержать реакционно-способную группу, которая может включать, но не ограничивается ими, альдегид, пропиональдегид, бутиральдегид, малеимид или сукцинимид (сукцинимидилпропионат, сукцинимидилкарбоксиметил, гидроксисукцинимидил или сукцинимидилкарбонат). Кроме того, непептидильный полимер может иметь одну реакционно-способную группу или две реакционно-способные группы. Если непептидильный полимер содержит две или более реакционно-способных групп, он может быть соединен с линкером производного Fac VII с помощью одной реакционно-способной группы, а также соединен с другим носителем, таким как антитела, иммуноглобулиновые фрагменты, альбумин или трансферрин, с помощью другой реакционно-способной группы. Например, когда непептидильный полимер имеет реакционно-способную альдегидную группу на одном конце и малеимидную, орто-пиридилдисульфидную или тиольную реакционно-способную группу на другом конце, неспецифическая реакция может быть минимизирована, и это является эффективным в селективном связывании производного Fac VII или производного Fac VIIa и носителя на обоих концах непептидильного полимера. Конечный продукт, полученный посредством восстановительного алкилирования, за счет альдегидной связи может быть более стабильным, чем в случае амидной связи. Кроме того, альдегидная реакционно-способная группа селективно взаимодействует с аминным концом носителя при низком рН и может образовывать ковалентную связь с остатком лизина при высоком рН, например рН 9,0.
В еще одном аспекте в настоящем изобретении предлагается комплекс Fac VII или его активной формы Fac VIIa, который получают путем соединения производного Fac VII или его активной формы Fac VIIa с Fc-областью иммуноглобулина посредством непептидильного полимера.
Комплекс Fac VII, который соединен с носителем, таким как антитело. фрагмент иммуноглобулина, альбумин и трансферрин, в частности Fc иммуноглобулина, посредством непептидильного полимера, может быть получен посредством стадий (1) ковалентного связывания непептидильного полимера, имеющего реакционно-способную группу в виде альдегида или сукцинимидного производного на его одном конце, с аминогруппой Fc иммуноглобулина; (2) извлечения конъюгата, содержащего Fc-область иммуноглобулина, ковалентно связанную с непептидильным полимером по аминогруппе, из реакционной смеси со стадии (1); (3) ковалентного связывания производного Fac VII с другим концом непептидильного полимера, имеющего малеимидную, орто-пиридилдисульфидную или тиольную реакционную группу в выделенном конъюгате, с получением комплекса Fac VII, имеющего Fc-область иммуноглобулина и производное Fac VII на каждом конце непептидильного полимера; и (4) активации конъюгата Fac VII, полученного на стадии (3), с получением комплекса Fac VII, имеющего Fac VIIa и Fc-область иммуноглобулина, связанные посредством непептидильного полимера.
Кроме того, комплекс Fac VII может быть получен посредством стадий (1) ковалентного связывания непептидильного полимера, имеющего малеимидную, орто-пиридилдисульфидную или тиольную реакционную группу на одном его конце, с С-концевой тиольной группой производного Fac VII; (2) выделения конъюгата, который включает производное Fac VII, ковалентно связанное с непептидильным полимером, из реакционной смеси со стадии (1); (3) ковалентного связывания Fc-области иммуноглобулина с другим концом непептидильного полимера, имеющего реакционно-способную группу в виде альдегида или сукцинимидного производного в выделенном конъюгате, с получением комплекса Fac VII, имеющего Fc-область иммуноглобулина и производное Fac VII на каждом конце непептидильного полимера; и (4) активации конъюгата Fac VII, полученного на стадии (3) с получением комплекса Fac VII, имеющего Fac VIIa и Fc-область иммуноглобулина, связанные посредством непептидильного полимера.
Кроме того, комплекс Fac VII можно получить посредством стадий (1) ковалентного связывания непептидильного полимера, имеющего малеимидную, орто-пиридилдисульфидную или тиольную реакционную группу на одном конце, с С-концевой тиольной группой производного Fac VIIa; (2) выделение конъюгата, который включает производное Fac VII, ковалентно связанное с непептидильным полимером, из реакционной смеси со стадии (1); и (3) ковалентное связывание Fc-области иммуноглобулина с другим концом непептидильного полимера, имеющего реакционно-способную группу в виде альдегида или сукцинимидного производного в выделенном конъюгате, с получением комплекса Fac VII, имеющего Fc-область иммуноглобулина и производное Fac VIIa на каждом конце непептидильного полимера.
С другой стороны, непептидильный полимер может включать две или три реакционно-способных концевые группы, и эти две или три реакционно-способные концевые группы могут быть одинаковыми или отличными друг от друга. Например, он может иметь малеимидную группу на одном конце и альдегидную группу, пропиональдегидную группу или бутиральдегидную группу на другом конце. Когда поли(этиленгликоль), имеющий гидроксильные реакционно-способные группы на обоих концах, используется в качестве непептидильног