Рекомбинантная плазмидная днк pdualrep2 и штамм, трансформированный ею для выявления веществ и смесей, ингибирующих биосинтез белка и/или вызывающих sos-ответ у бактерий
Иллюстрации
Показать всеИзобретение относится к биотехнологии, конкретно к методам поиска антибактериальных веществ природного и синтетического происхождения с одновременным анализом механизма их действия, и может быть использовано для идентификации соединений, ингибирующих биосинтез белка и/или вызывающих SOS-ответ у бактерий. Генетическая конструкция содержит гены двух флюоресцентных белков с различимыми спектрами флюоресценции. Экспрессия одного из генов флюоресцентных белков активируется при остановке трансляции предшествующего ему генетически модифицированного аттенюатора триптофанового оперона Escherichia coli. Экспрессия второго гена активируется при дерепрессии предшествующего ему промотора гена sulA Escherichia coli. Генетическая конструкция представляет собой плазмиду, которой трансформируют клетки бактерий Е. coli для получения штамма-репортера Е. coli ΔtolC. Полученный штамм Е. coli ΔtolC позволяет проводить высокопроизводительный анализ (скрининг) большого количества веществ или смесей для поиска среди них антибактериальных веществ, с одновременным выявлением тех из них, которые ингибируют биосинтез белка и/или вызывают SOS-ответ на повреждения ДНК. 2 н. и 3 з.п. ф-лы, 5 ил., 1 табл., 3 пр.
Реферат
Область техники
Изобретение относится к биотехнологии, белковой и генной инженерии. Сконструирована генетическая конструкция/рекомбинантная плазмидная ДНК pDualrep2, содержащая гены RFP, Katushka2S, bla кодирующие красный, дальнекрасный флюоресцентные белки и бета-лактамазу, которой можно трансформировать клетки бактерий для получения штамма-репортера. Рекомбинантный штамм позволяет проводить высокопроизводительный анализ (скрининг) большого количества веществ или смесей для поиска среди них антибактериальных веществ, с одновременным выявлением тех из них, которые ингибируют биосинтез белка и/или вызывают SOS-ответ на повреждения ДНК. Предложенная группа изобретений найдет применение в научно-исследовательских целях, а также фармацевтическими компаниями для поиска новых антибактериальных препаратов с заранее известной мишенью действия.
Уровень техники
Хотя в настоящее время на вооружении медицины стоит несколько эффективных классов антибактериальных препаратов, среди патогенных бактерий наблюдается непрерывный рост числа изолятов, устойчивых к тем или иным классам антибиотиков. Для поиска новых антибактериальных препаратов проводят высокопроизводительный скрининг как природных, так и синтетических соединений.
В настоящее время поиск антибактериальных препаратов природного происхождения проводится по традиционной схеме. Сначала широкий набор культуральных жидкостей почвенных микроорганизмов тестируется на антибактериальную активность. Затем из образцов, имеющих антибактериальную активность, выделяют активное соединение, проводят анализ его строения и только затем изучают механизм действия. Подобная схема далека от оптимальной. Наиболее трудоемкие стадии выделения и определения строения активного вещества приходится проводить для множества соединений, а изучение механизма действия приходится начинать «с чистого листа», не имея представления о том, на какой процесс может влиять данное антимикробное соединение. В случае скрининга химически синтезированных соединений отсутствуют стадии очистки и идентификации соединения, но механизм действия также приходится проводить «с чистого листа».
Для эффективного поиска антибиотиков с одновременным эффективным и дешевым определением механизма их действия необходима система автоматизации, позволяющая вместе с обнаружением антибактериальной активности сразу идентифицировать те соединения, которые действуют на определенную мишень, в данном случае, систему биосинтеза белка.
Из уровня техники известны генетические конструкции pCSS3, pPHOL и pCSS1, содержащие гены люцифераз под контролем промотора pL фага лямбда, предназначенные для выявления ингибиторов биосинтезеа белка (Lampinen, J.; Virta, М; Karp, М. Use of controlled luciferase expression to monitor chemicals affecting protein synthesis. Applied and environmental microbiology 1995, 61, 2981-2989). Недостатками указанных конструкций является то, что они неспособны отличить ингибиторы биосинтеза белка от ингибиторов других стадий экспрессии генов, например, ингибиторов биосинтеза РНК и не позволяют детектировать одновременно два механизма действия антибиотиков.
Из уровня техники известна генетическая конструкция TetLux1, содержащая ген люциферазы под контролем тетрациклинового промотора, предназначенная для выявления ингибиторов биосинтезеа РНК и белка (Galluzzi, L.; Karp, М. Amplified detection of transcriptional and translational inhibitors in bioluminescent Escherichia coli K-12. Journal of biomolecular screening 2003, 8, 340-346). Недостатками указанной конструкции является то, что она неспособна отличить ингибиторы биосинтеза белка от ингибиторов других стадий экспрессии генов, например, ингибиторов биосинтеза РНК и не позволяет детектировать одновременно два механизма действия антибиотиков.
Из уровня техники известны генетические конструкции pCSBG и pIBPBG, содержащие ген бета-галактозидазы под контролем промоторов cspA и ibpA, предназначенные для выявления ингибиторов биосинтеза белка (Bianchi, А.А.; Baneyx, F. Stress responses as a tool to detect and characterize the mode of action of antibacterial agents. Applied and environmental microbiology 1999, 65, 5023-5027). Недостатками указанных конструкций является то, что они чувствительны не только к ингибиторам биосинтеза белка, а ко всем соединениям, вызывающим в клетке реакцию на холодовой и тепловой шок, соответственно. Также они не позволяют детектировать одновременно два механизма действия антибиотиков.
Из уровня техники известны генетические конструкции ptetA-luc и ptetA-luxCDABE, содержащие гены люцифераз под контролем тетерациклин-индуцируемого промотора, предназначенные для выявления тетрациклинов (Kurittu, J.; Karp, М.; Korpela, М. Detection of tetracyclines with luminescent bacterial strains. Luminescence: the journal of biological and chemical luminescence 2000, 15, 291-297). Недостатками указанных конструкций является слишком узкая специфичность только к одной известной группе ингибиторов биосинтеза белка. Также они не позволяют детектировать одновременно два механизма действия антибиотиков.
Из уровня техники известны генетические конструкции pEBZ511, EBZ512, pEBZ514, содержащие гены люциферазы под контролем индуцируемого макролидами промотора mphA, предназначенные для выявления макролидных антибиотиков (Mohrle, V.; Stadler, М.; Eberz, G. Biosensor-guided screening for macrolides. Analytical and bioanalytical chemistry 2007, 388, 1117-1125). Недостатками указанных конструкций является слишком узкая специфичность только к одной известной группе ингибиторов биосинтеза белка и невозможность детектировать одновременно два механизма действия антибиотиков.
Из уровня техники известна генетическая конструкция pERMZα, содержащая ген бета-галактозидазы под контролем индуцируемого макролидами регуляторного элемента гена ermC, предназначенные для выявления макролидных антибиотиков (Bailey, М.; Chettiath, Т.; Mankin, A.S. Induction of erm(c) expression by noninducing antibiotics. Antimicrobial agents and chemotherapy 2008, 52, 866-874). Недостатком указанной конструкции является слишком узкая специфичность только к одной известной группе ингибиторов биосинтеза белка и невозможность детектировать одновременно два механизма действия антибиотиков.
Из уровня техники известна генетическая конструкция pRFPCER-TrpL2A, содержащая гены RFP и CER, предназначенная для выявления ингибиторов биосинтеза белка (Osterman, LA.; Prokhorova, I.V.; Sysoev, V.O.; Boykova, Y.V.; Efremenkova, O.V.; Svetlov, M.S.; Kolb, V.A.; Bogdanov, A.A.; Sergiev, P.V.; Dontsova, O.A. Attenuation-based dual-fluorescent-protein reporter for screening translation inhibitors. Antimicrobial agents and chemotherapy 2012, 56, 1774-1783). Было показано, что созданный таким образом репортер является функциональным, т.е. реагирует предсказуемым образом на изменение концентрации триптофана в среде. Замена кодонов триптофана на кодоны аланина привели к потере зависимости от концентрации триптофана.
Поскольку среди антибиотиков, повреждающих ДНК, есть клинически значимые, например, ингибиторы гиразы фторхинолоны, выявление подобных веществ было бы желательным при первичном скрининге антимикробных соединений. Использование двух разных репортеров для характеристики новых потенциальных антибиотиков потребовало бы проведения двух последовательных экспериментов, что в случае высокопроизводительного подхода двукратно увеличит расход материалов и времени. Создание одного репортера для детектирования и ингибиторов синтеза белка, и вызывающих повреждение ДНК позволило решить данную проблему.
В вышеупомянутой конструкции уже закодировано два флуоресцентных белка, экспрессия белка CER зависит от природы действующего антибиотика, в то время как экспрессия RFP постоянна. Поэтому использование этой конструкции позволяет обнаружить только антибиотики, имеющие один механизм действия. Введение промотера гена sulA перед геном RFP позволило сделать двойной репортер. Однако недостатком указанной конструкции является низкая чувствительность, не позволяющая детектировать некоторые классы ингибиторов биосинтеза белка, например тетрациклин, и невозможность детектировать одновременно два механизма действия антибиотиков. Также не оптимальным является выбор флюоресцентного белка CER, поскольку он флюоресцирует в области спектра, где высока фоновая флюоресценция среды.
Репортерные штаммы, основанные на репортерных генетических конструкциях, разработанных за рубежом (pCSS3, pPHOL, pCSS1, TetLux1, pCSBG, pIBPBG, ptetA-luc, ptetA-luxCDABE, pEBZ511, EBZ512, pEBZ514, pERMZα), не обладают либо специфичностью по отношению именно к ингибиторам биосинтеза белка, либо универсальностью по отношению к ингибиторам биосинтеза белка разных классов. Репортерный штамм, основанный на репортерной генетической конструкции, разработанной коллективом заявителей ранее, имеет меньшую чувствительность. Все известные ранее репортерные штаммы не позволяют проводить одновременную детекцию нескольких механизмов действия.
Поэтому до сих пор остается актуальной задача разработки конструкции, позволяющей одновременно детектировать как ингибиторы синтеза белка, так и вызывающих повреждение ДНК.
Раскрытие изобретения
Задачей настоящего изобретения является создание генетической конструкции, позволяющей при трансформировании ее штамма получить штамм-репортер, клетки которого способны изменять свои легко детектируемые свойства при воздействии веществ, ингибирующих биосинтез белка.
Поставленная задача решается рекомбинантной плазмидной ДНК pDualrep2, предназначенной для идентификации соединений, ингибирующих биосинтез белка и/или вызывающих SOS-ответ у бактерий, включающей:
- ориджин репликации, способный поддерживать стабильное число копий плазмиды в клетке,
- селективный маркер для отбора клеток, содержащих плазмиду,
- гены флюоресцентных белков с различимыми спектрами флюоресценции RFP и Katushka2S;
- аттенюатор триптофанового оперона, в котором произведены замены триптофановых кодонов UGG на аланиновые кодоны GCG;
- промотор гена sulA Е. coli, активирующийся при инактивации репрессора SOS-ответа LexA;
при этом перед геном флюоресцентного белка Katushka2S находится аттенюатор триптофанового оперона, а перед геном флюоресцентного белка RFP поставлен промотор гена sulA Е. coli.
Предпочтительно, что рекомбинантная плазмида имеет размер 3961 нуклеотид.
Предпочтительно ориджин репликации выбирать из CloDF13, ColE1, p15a.
Предпочтительно селективный маркер выбирать из генов бета-лактамазы, аминогликозид фосфотрансферазы.
Поставленная задача также решается штаммом бактерий , трансформированным вышеуказанной плазмидой для идентификации соединений, ингибирующих биосинтез белка и/или вызывающих SOS-ответ у бактерий.
Техническим результатом предлагаемой группы изобретений является, то что созданный штамм обладает характеристиками универсальности по отношению к ингибиторам биосинтеза белка, а именно способен реагировать на широкий спектр химических соединений и способен выявлять новые классы соединений, объединенных мишенью - процессом биосинтеза белка.
Репортерный штамм способен сигнализировать о ингибировании продвижения рибосомы.
Изобретение позволяет на этапе скрининга, одновременно с выявлением антибактериальной активности, выявлять и механизм действия, из двух возможных - ингибирование биосинтеза белка или индукция SOS-ответа, вызываемая повреждениями ДНК, что ускоряет процедуру поиска потенциальных антибиотиков.
Кроме того, предложенная группа изобретений позволяет находить новые классы соединений, действующих на биосинтез белка, что имеет важное значение для понимания молекулярных механизмов этого биологического процесса.
Еще одним преимуществом предлагаемой группы изобретений является то, что при использовании заявляемой плазмиды требуется минимальное количество пипетирований и не требуется использование дорогих реактивов.
Изобретение предназначено для усовершенствования поиска новых антимикробных соединений, ингибирующих биосинтез белка и вызывающих SOS-ответ на повреждение ДНК, а также расширяет спектр представленных на рынке плазмид, позволяющих проводить идентификацию соединений, ингибирующих биосинтез белка и/или вызывающих SOS-ответ у бактерий.
Плазмида pDualrep2 содержит следующие части: ориджин репликации, способный поддерживать стабильное число копий плазмиды в клетке, например, CloDF13, ColE1, p15a, селективный маркер для отбора клеток, содержащих плазмиду, например, ген бета-лактамазы, аминогликозид фосфотрансферазы, гены флюоресцентных белков с различимыми спектрами флюоресценции, такие как RFP и Katushka2S. Перед геном флюоресцентного белка Katushka2S находится аттенюатор триптофанового оперона, в котором произведены замены триптофановых кодонов UGG на аланиновые кодоны GCG. Для сохранения вторичной структуры РНК аттенюатора были проведены дополнительные замены (Фиг. 2). Перед геном флюоресцентного белка RFP поставлен промотор гена sulA Е. coli, активирующийся при инактивации репрессора SOS-ответа LexA.
Полученная рекомбинантная плазмидная ДНК характеризуется следующими признаками:
- имеет размер 3961 п.о.;
- содержит ген флюоресцентного белка RFP, экспрессирующийся при активации SOS-ответа на повреждения ДНК; расположен в области 94-787 п.о.;
- содержит промотор гена sulA Е. coli перед геном RFP. Промотор расположен перед геном RFP и необходим для экспрессии гена RFP при активации SOS-ответа на повреждения ДНК; расположен в области 1-93 п.о.;
- содержит терминатор транскрипции гена RFP; расположен в области 895-930 п.о.;
- содержит ген флюоресцентного белка Katushka2S, экспрессирующийся при ингибировании биосинтеза белка; расположен в области 1195-1935 п.о.;
- содержит аттенюатор оперона trpLEDCBA Е. coli, с заменами нуклеотидов 28-33 с tggtgg на gcggcg, а 61-65 с cacca на gccgc; необходим для транскрипции гена Katushka2S при ингибировании биосинтеза белка; расположен в области 1044-1194 п.о.;
- содержит терминатор транскрипции гена Katushka2S; расположен в области 1974-2009 п.о.;
- содержит генетический маркер: ген бета-лактамазы (bla), определяющий устойчивость трансформированных клеток E. coli к ампициллину; расположен в области 2969-2109 п.о.;
- содержит ориджин репликации (ori pCDF), необходимый для стабильной репликации плазмиды в клетках Е. coli; расположен в области 3228-4 п.о.
При этом необходимо отметить, что порядок расположения участков плазмиды не имеет принципиального значения, важно только, чтобы перед геном флюоресцентного белка Katushka2S находится аттенюатор триптофанового оперона, а перед геном флюоресцентного белка RFP поставлен промотор гена sulA Е. Coli.
Активация экспрессии гена Katushka2S происходит при остановке работы рибосомы во время трансляции лидерного пептида, закодированного в аттенюаторном участке гена. Этот участок РНК может укладываться в два различных варианта вторичной структуры, один из которых способствует терминации транскрипции, а другой способствует продолжению транскрипции и приводит к экспрессии генов, следующих за аттенюаторным участком. То, какой вариант вторичной структуры в действительности будет сформирован, зависит от скорости движения рибосомы, транслирующей лидерный пептид.
В природном, немодифицированном, триптофановом аттенюаторе, при недостатке триптофана рибосома будет задерживаться на двух триптофановых кодонах лидерной области, что будет способствовать продолжению транскрипции. При этом будут экспрессироваться гены, отвечающие за биосинтез триптофана. Наоборот, если рибосома движется быстро, произойдет терминация транскрипции и экспрессия расположенных далее генов не будет наблюдаться.
Для ведения промотера гена sulA перед геном RFP в конструкцию pRFPCER-TrpL2A была поставлена ПЦР, заменяющая конститутивный Т5 промотер перед геном RFP на промотер гена sulA. Для этого использовались олигонуклеотиды: . Циркуляризация продукта ПЦР под действием ДНК лигазы привела к плазмиде pRFP-sulA/CER-TrpL2A.
В связи с различной абсолютной интенсивностью между RFP и CER (красный более яркий), используемых в прототипе, тяжело отличить случаи совместной индукции двух белков от просто индукции RFP. Для устранения вышеуказанных недостатков было решено перейти к автоматической детекции, например, при помощи системы ChemiDoc. В этом случае использование белка CER не представляется оптимальным, так как в канале Cy2, где детектируется этот белок, виден сильный фон среды LB. Было решено заменить ген CER на ген флюоресцентного белка Katushka2S, флюоресцирующем в дальне-красном диапазоне длин волн 588/633 нм. Ген CER был удален при помощи обработки плазмиды pRFP-su1A/CER-TrpL2A эндонуклеазами рестрикции NdeI и NaeI, последовательность белка Katushka2S была получена при помощи ПЦР с плазмиды pKatushka2S-B (Евроген). Схема плазмиды представлена на фиг. 1, а ее последовательность оформлена в виде приложения.
Полученная плазмида позволяет вдвое сократить трудоемкость, время и стоимость скрининга, поскольку можно одновременно идентифицировать как антибиотики, ингибирующие биосинтез белка, так и вызывающие SOS-ответ.
Поскольку RFP флюоресцирует в красном диапазоне 584/607 нм, а Katushka2S в дальне-красном 588/633 нм, для наглядности экспериментальные картинки, полученные с помощью системы, документирующей флюоресценцию, мы окрашивали в псевдоцвета -RFP в зеленый, Katushka2S в красный. Сканирование в каналах Cy3 и Cy5 позволяет независимо детектировать сигнал от белков RFP и Katushka2S. Совмещение картинок позволяет красочно визуализировать результаты сканирования для легкой сортировки антибиотиков по механизму действия.
Краткое описание чертежей
На фиг. 1 представлена схема плазмиды pDualrep2.
На фиг. 2 представлена вторичная структура природного (вверху) генетически модифицированного (внизу) триптофанового аттенюатора.
На фиг. 3 представлены примеры секвенирования нуклеотидной последовательности плазмиды pDualrep2 с праймеров и
На фиг. 4 представлены результаты тестирования антибиотиков с использованием плазмиды pDualrep2. Представлена чашка с агаром, на который нанесен газон штамма BW25113, трансформированный плазмидой pDualrep2 и образцы антибиотиков согласно подписям. Чашка отсканирована в каналах Cy3 (530/605 нм), Cy5 (625/695 нм) после 16 часовой инкубации при 37°C. Цифрой 1 обозначены результаты сканирования при 530/605 нм, а цифрой 2 при 625/695 нм.
На фиг. 5 представлены результаты тестирования различных количеств (обозначены на рисунке) эритромицина (ERY) и левофлоксацина (LEV) с использованием плазмиды pDualrep2 на основе штамма .
Осуществление изобретения
Все используемые реагенты являются коммерчески доступными, все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°C; Работа с бактериями проводились в условиях стерильности.
Химические символы имеют свои обычные значения: мкм (микрометр(ы)), мкл (микролитр(микролитры)), мкг (микрограмм(микрограммы)), M (моль(моли) на литр), л (литр(литры)), мл (миллилитр(миллилитры)), г (грамм(граммы)), мг (миллиграмм(миллиграммы)), моль(моли), ммоль (миллимоль(миллимоли)).
Используемые сокращения:
| Е. coli | Escherichia coli, кишечная палочка |
| sulA | ген ингибитора деления бактерий |
| ПЦР | полимеразная цепная реакция |
| SOC, LB, M9 | среды для выращивания бактерий |
| РНК | рибонуклеиновые кислоты |
| RFP | красный флюоресцирующий белок |
| CER | циановый флюоресцирующий белок |
| нм | нанометры |
| ДМСО | диметилсульфоксид |
| Katushka2S | дальне-красный флюоресцирующий белок |
| ChemiDoc | Документирующая система |
| bla | Ген бета-лактамазы |
| ДНК | дезоксирибонуклеиновые кислоты |
Трансформирование штамма плазмидой pDualrep2.
Ранее было показано, что оптимально для скрининга использовать штамм . Для трансформации необходимо приготовить компетентные клетки штамма (Sambrook J, Russell DW. The inoue method for preparation and transformation of competent E. coli: "ultra-competent" cells. CSH Protoc. 2006 Jun 1; 2006(1).). К 50-200 мкл компетентных клеток на льду добавить 10-200 нг плазмиды pDualrep2, инкубировать 30-60 минут на льду, затем нагреть до 42°C в течение 1-2 минут. После инкубации при 42°C добавить 0.5-1 мл среды LB и инкубировать при 37°C в течение 45-60 минут. После инкубации клетки необходимо высеять на агаризованную среду LB с ампициллином. Чашку инкубировать при 37°C в течение 18-24 часов. Одиночную колонию клеток , трансформированную pDualrep2 плазмидой, перенести в питательную среду с ампициллином и инкубировать при температуре 37°C при перемешивании (100 об/мин) 12-18 часов. К полученной суспензии клеток добавить 50 мл 50% стерильного (автоклавированного) раствора глицерина, разделить на аликвоты по 0,5 мл, заморозить и хранить при -20°C или использовать сразу. Трансформировав этот штамм разработанной конструкцией, была получена система для высокопроизводительного поиска ингибиторов синтеза белка и соединений, вызывающих повреждение ДНК.
Использование штамма , трансформированного плазмидой pDualrep2.
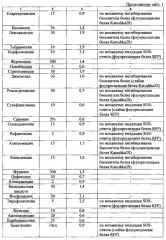
На реакционную плашку с репортерным штаммом pDualrep2 были нанесены диски с антибиотиками Эритромицин, Азитромицин, Кларитромицин, Рокситромицин, Линкомицин, Левомицетин (Хлорамфеникол), Рифампицин, Сульфаниламид, Полимиксин, Левофлоксацин, Тетрациклин, Канамицин, Неомицин, Тобрамицин, Стрептомицин, Клиндомицин, Фурадонин, Норфлоксацин, Энрофлоксацин, Новобиоцин, Олеандромицин, Сапонин, Фурагин, Цефазолин, Налидиксовая кислота, Фосфомицин, Фузидин, Амоксициллин, Карбенициллин и Бацитрацин (Фиг. 4). Чашки с дисками, пропитанными растворами антибиотиков, инкубировали 16 часов при 37°C и документировали с помощью ChemiDoc MP system с целью обнаружения колец флюоресценции по краям зоны ингибирования.
Рост репортерного штамма Е. coli ингибировали антибиотики Левофлоксацин, Полимиксин, Тетрациклин, Канамицин, Эритромицин, Неомицин, Левомицетин, Тобрамицин, Норфлоксацин, Фурадонин, Стрептомицин, Линезолид, Азитромицин, Линкомицин, Фурагин, Клиндамицин, Налидиксовая кислота, Фосфомицин, Энрофлоксацин. Не ингибировали рост бактерий и не вызывали индукции репортерного штамма Новобиоцин, Сульфаниламид, Сапонин, Цефазолин, Фузидин, Амоксициллин, Карбенициллин. Это свидетельствует о том, что клетки были устойчивы к данным антибиотикам. В случае амоксициллина и карбенициллина устойчивость объясняется маркером (bla) используемой плазмиды. Индукция репортерной конструкции без ингибирования роста клеток происходила для антибиотиков Кларитромицин, Рокситромицин, Олеандомицин, Рифампицин, Бацитрацин. Это обусловлено, по всей видимости тем, что антибиотики действовали на бактерию, но не достигали летальной концентрации.
Антибиотики, останавливающие трансляцию, Эритромицин, Азитромицин, Кларитромицин, Рокситромицин, Линкомицин, Левомицетин (Хлорамфеникол), Линкомицин и Тетрациклин вызывали индукцию репортерного гена Katushka2S. Антибиотики, не связанные с трансляцией не вызывали индукцию репортерного гена Katushka2S. Антибиотики, вызывающие ошибки трансляции, но не ее ингибирование, такие, как Канамицин, Неомицин, Тобрамицин и Стрептомицин не вызывали индукции репортерного гена Katushka2S. Таким образом, система поиска антибактериальных препаратов - веществ-ингибиторов биосинтеза белка действительно, позволяет детектировать ингибиторы биосинтеза белка, но не более общую категорию веществ, действующих на биосинтез белка. Антибиотики фторхинолонового ряда, вызывающие повреждение ДНК за счет ингибирования гиразы, Левофлоксацин, Налидиксовая кислота, Норфлоксацин, Энрофлоксацин, а также некоторые другие, вызывающие повреждение ДНК опосредованно, вызывали индукцию репортерного гена RFP, находящегося под контролем промотора sulA, активируемого SOS-системой.
Для определения чувствительности штамма , трансформированного плазмидой pDualrep2, на чашку Петри с агаризованной средой с репортерным штаммом pDualrep2 нанесли раствор эритромицина в количестве 50 мкг, 30 мкг, 15 мкг, 10 мкг, 5 мкг, 2 мкг, 1 мкг, а на другую чашку Петри с агаризованной средой с репортерным штаммом pDualrep2 нанесли раствор левофлоксацина в количестве 20 мкг, 10 мкг, 5 мкг, 3 мкг, 1.5 мкг, 1 мкг, 0.5 нг и инкубировали 16 часов при 37°C. Чашки Петри документировали с помощью ChemiDoc MP system целью обнаружения колец флюоресценции на длинах волн поглощения/испускания 625/695 нм и 530/605 по краям зоны ингибирования (Фиг. 5). Результаты подтвердили, что предел обнаружения такого ингибитора биосинтеза белка, как эритромицин менее 1 мкг, в то время, как предел обнаружения ингибитора гиразы левофлоксацина менее 0.5 нг.
Приведенные примеры конкретного осуществления изобретения и реализации назначения приведены для предоставления специалистам в данной области техники полного описания проведения и применения анализа по изобретению, и подразумевают, что приведенные примеры не ограничивают предполагаемый авторами изобретения объем изобретения.
Пример 1.
В конструкцию pRFPCER-TrpL2A при помощи полимеразной цепной реакции был введен промотер гена sulA перед геном RFP. Замена конститутивного Т5 промотера перед геном RFP на промотер гена sulA была сделана при помощи следующих о лигонуклеотидов:
RFP-sulA R
RFP-sulA F
Затем ген CER был заменен на ген дальнего красного белка Katushka2S. Ген CER был удален при помощи обработки плазмиды pRFP-sulA/CER-TrpL2A эндонуклеазами рестрикции NdeI и NaeI, последовательность белка Katushka2S была получена при помощи ПЦР с использованием олигонуклеотидов:
Katushka2S-NdeI F
Katushka2S R
с плазмиды pKatushka2S-B вектор (Евроген).
Полученная конструкция была названа pDuelrep2. Достоверность созданной конструкции была подтверждена при помощи секвенирования (фиг. 3).
Пример 2. Трансформация штамма плазмидой pDualrep2
Клетки штамма высеяли со стоков штрихом до образования отдельных колоний на чашку Петри с агаром. Отдельную колонию клеток поместили в 50 мл стерильной питательной среды LB в 250 мл колбе и инкубировали при температуре 18°C до оптической плотности А600 ~ 0.6. Культуру клеток выдержали в течение 10 мин во льду, перенесли в центрифужные пробирки 50 мл и осадили центрифугированием при 5000 об/мин в течение 10 минут. Промыли осадок дважды буферным раствором ТВ (10 мМ PIPES, 15 мМ CaCl2, 250 мМ KCl, 55 мМ MnCl2 pH 6,7) и ресуспендировали в 4 мл этого раствора, разделили на аликвоты по 100 мкл, заморозили в жидком азоте и хранили при -80°C.
Для дальнейшего использования пробирку со 100 мкл компетентных клеток разморозили во льду, добавили 100 нг плазмиды pDualrep2, инкубировали 30 мин при 0°C. Затем прогрели смесь на водяной бане в течение 45 сек при 42°C, добавили 800 мкл среды LB и инкубировали 1 час при 37°C. Трансформационную смесь высеяли на чашку Петри с агаром и ампицилином. Одиночную колонию клеток Е. coli AtolC трансформированную pDualrep2 плазмидой перенесли в 50 мл питательной среды с ампициллином и инкубировали при температуре 37°C при перемешивании (100 об/мин) 15 часов (допустимый диапазон 12-18 часов). К полученной суспензии клеток добавили 50 мл 50% стерильного (автоклавированного) раствора глицерина, разделили на аликвоты по 0,5 мл и заморозили, хранили при -20°C.
Пример 3. Тестирование соединений с помощью штамма AtolC, трансформированного плазмидой pDualrep2
Пробирку с 0,5 мл замороженной суспензии клеток репортерного штамма, полученной как указано в примере 2, смешали с 1,5 мл питательной среды LB с ампициллином и равномерно распределили по поверхности реакционной плашки. Дали высохнуть суспензии клеток.
К анализируемым веществам в 96-лучноных планшетах, по 1 мг в лунке, добавили по 200 мкл ДМСО при помощи роботизированной системы. Образцы перемешали 10 раз до полного растворения.
По 1 мкл тестируемых образцов нанесли на подготовленные на предыдущей стадии реакционные плашки при помощи роботизированной системы по 576 образцов на одну плашку. На свободное от тестируемых образцов место нанесли по 1 мкл контрольных растворов эритромицина и левофлоксацина. Образцам дали высохнуть. Чашки закрыли и выдерживали при 37°C в течение 16 ч.
В результате эксперимента получили реакционные плашки, покрытые газоном клеток с зонами ингибирования в местах нанесения антибиотиков. Полученные плашки сканировали при помощи системы гель документации ChemiDoc MP system при длинах волн флюоресценции 625/695 нм и 530/605 нм. По размеру зоны ингибирования (в мм) судили об эффективности антибиотика, по увеличению интенсивности флюоресценции на длинах волн 625/695 нм на границе зоны ингибирования детектировали действие антибиотика на биосинтез белка. Для контрольного антибиотика эритромицина (ингибирует биосинтез белка) было видно заметное увеличение флюоресценции на длинах волн 625/695 нм на границе зоны ингибирования, для левофлоксацина (ингибирует биосинтез ДНК) увеличение флюоресценции происходило на длинах волн 530/605 нм.
Результаты представлены в Таблице 1.
Рост репортерного штамма Е. coli ингибировали антибиотики Левофлоксацин, Полимиксин, Тетрациклин, Канамицин, Эритромицин, Неомицин, Левомицетин, Тобрамицин, Норфлоксацин, Фурадонин, Стрептомицин, Линезолид, Азитромицин, Линкомицин, Фурагин, Клиндамицин, Налидиксовая кислота, Фосфомицин, Энрофлоксацин. Не ингибировали рост бактерий и не вызывали индукции репортерного штамма Новобиоцин, Сульфаниламид, Сапонин, Цефазолин, Фузидин, Амоксициллин, Карбенициллин. Это свидетельствует о том, что клетки были устойчивы к данным антибиотикам. В случае амоксициллина и карбенициллина устойчивость объясняется маркером (bla) используемой плазмиды. Индукция репортерной конструкции без ингибирования роста клеток происходила для антибиотиков Кларитромицин, Рокситромицин, Олеандомицин, Рифампицин, Бацитрацин. Это обусловлено, по всей видимости, тем, что антибиотики действовали на бактерию, но не достигали летальной концентрации.
Антибиотики, останавливающие трансляцию, Эритромицин, Азитромицин, Кларитромицин, Рокситромицин, Линкомицин, Левомицетин (Хлорамфеникол), Линкомицин и Тетрациклин вызывали индукцию репортерного гена Katushka2S. Антибиотики, не связанные с трансляцией, не вызывали индукцию репортерного гена Katushka2S. Антибиотики, вызывающие ошибки трансляции, но не ее ингибирование, такие как Канамицин, Неомицин, Тобрамицин и Стрептомицин, не вызывали индукции репортерного гена Katushka2S. Таким образом, система поиска антибактериальных препаратов - веществ-ингибиторов биосинтеза белка действительно позволяет детектировать ингибиторы биосинтеза белка, но не более общую категорию веществ, действующих на биосинтез белка. Антибиотики фторхинолонового ряда, вызывающие повреждение ДНК за счет ингибирования гиразы, Левофлоксацин, Налидиксовая кислота, Норфлоксацин, Энрофлоксацин, а также некоторые другие, вызывающие повреждение ДНК опосредованно, вызывали индукцию репортерного гена RFP, находящегося под контролем промотора sulA, активируемого SOS-системой.
Результаты представлены на фото (см. фиг. 4 и 5).
1. Рекомбинантная плазмидная ДНК pDualrep2, предназначенная для идентификации соединений, ингибирующих биосинтез белка и/или вызывающих SOS-ответ у бактерий, включающая:
- ориджин репликации, способный поддерживать стабильное число копий плазмиды в клетке,
- селективный маркер для отбора клеток, содержащих плазмиду,
- гены флюоресцентных белков с различимыми спектрами флюоресценции RFP и Katushka2S;
- аттенюатор триптофанового оперона, в котором произведены замены триптофановых кодонов UGG на аланиновые кодоны GCG;
- промотор гена sulA Е. coli, активирующийся при инактивации репрессора SOS-ответа LexA;
при этом перед геном флюоресцентного белка Katushka2S находится аттенюатор триптофанового оперона, а перед геном флюоресцентного белка RFP поставлен промотор гена sulA Е. coli.
2. Рекомбинантная плазмида по п. 1, характеризующаяся тем, что она имеет размер 3961 нуклеотид.
3. Рекомбинантная плазмида по п. 1, характеризующаяся тем, что ориджин репликации выбран из CloDF13, ColE1, p15a.
4. Рекомбинантная плазмида по п. 1, характеризующаяся тем, что селективный маркер выбран из генов бета-лактамазы, аминогликозид фосфотрансферазы.
5. Штамм бактерий Е. coli ΔtolC, трансформированный плазмидой по п. 1 для идентификации соединений, ингибирующих биосинтез белка и/или вызывающих SOS-ответ у бактерий.