Способ определения пуринов и пиримидинов в биологических жидкостях человека
Иллюстрации
Показать всеИзобретение относится к области аналитической химии и касается способа определения пуринов и пиримидинов в сыворотке крови человека. Сущность способа заключается в том, что проводят приготовление стандартного раствора биомаркеров метаболизма пуринов и пиримидинов. Затем получают образцы сыворотки крови с разведением дистиллированной водой с последующим получением фракции путем центрифугирования и фильтрации. Далее к полученной фракции добавляют буферный раствор, содержащий ион-парный реагент - тетрабутиламмоний сульфат - и известное количество стандартного раствора, проводят хроматографическое разделение и строят калибровочные графики. Концентрацию веществ метаболизма пуринов и пиримидинов в анализируемых пробах вычисляют согласно полученным калибровочным кривым. Использование способа позволяет с высокой точностью определять пурины и пиримидины в сыворотке крови. 5 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к химическому анализу биологических материалов, например крови, мочи, исследованию или анализу материалов путем разделения на составные части (компоненты) с использованием адсорбции, абсорбции или подобных процессов или с использованием ионного обмена, а также метаболомному анализу, который также называют анализом метаболического профиля. В основе изобретения лежит количественный анализ гетероциклических соединений, а именно пуринов и пиримидинов, в сыворотке крови человека для получения информации об их метаболизме. Метаболомный анализ используется для изучения биологических систем наряду с протеомикой, транскриптомикой и геномикой, обеспечивая более глубокое понимание биосинтетических способностей организма, сигналинга, биохимической регуляции и адаптации, т.е. процессов, регулируемых веществами с низкой молекулярной массой. Изобретение может быть использовано для определения пуринов и пиримидинов в биологических жидкостях человека с целью осуществления оперативной оценки степени разрушения адениновых нуклеотидов в мышцах, энергетического стресса в ходе физической нагрузки и степени гистотоксической гипоксии. Также изобретение может быть использовано в гинекологической и акушерской практике для прогнозирования риска возникновения патологических состояний, осложнения течения беременности, диагностике и мониторинге развития ряда заболеваний (например, синдрома Леша-Найхана, болезни Канавана и др.). Таким образом, изобретение может быть использовано для исследования состояния организма человека, диагностики и в качестве способа медицинского обследования.
Метаболомный анализ находится в стадии раннего развития по сравнению с геномным, транскриптомным и протеомным анализами, что вызвано большим разнообразием химических и физических свойств метаболитов. Анализ определенной группы или класса метаболических соединений, например пуринов и пиримидинов, обычно подразумевает использование специализированной аналитической платформы. При этом возникает сложность при анализе и определении очень близких по структуре и свойствам веществ, концентрации которых динамически изменяются во времени в биологическом образце.
Свободные пурины и пиримидины, а также большинство их производных являются слабополярными или неполярными веществами, при этом пуриновые и пиримидиновые нуклеозиды представляют собой полярные, неионизируемые вещества. Степень полярности нуклеозидов, свободных пуринов и пиримидинов существенно различается в зависимости от типа основания (пурины более электроотрицательны, чем пиримидины), химической природы боковых групп и заместителей в гетероциклическом(их) кольце(ах). На сегодняшний момент методы одновременного разделения с высокой пропускной способностью и высокочувствительного определения этих веществ в биологических жидкостях только начинают развиваться.
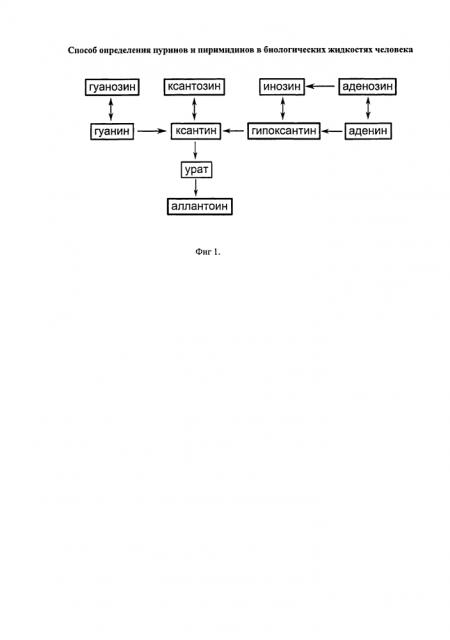
Известен способ определения пуринов и пиримидинов в биологических жидкостях человека, включающий выделение сыворотки крови, ее депротонизацию с помощью хлорной кислоты, последующую нейтрализацию с использованием карбоната калия, разделение с помощью ЖХ и определение концентраций гипоксантина, ксантина и мочевой кислоты при регистрации сигнала в ультрафиолетовой (УФ) области спектра [1, 2]. Такой анализ позволяет вычислять концентрации ограниченного количества веществ (трех), вовлеченных в метаболический цикл пуриновых и пиримидиновых оснований (Фиг.1 и 2) и важных для получения информации о пуриновом и пиримидиновом метаболизме в организме человека. Кроме того, методика определения этих веществ не может быть осуществлена без использования хлорной кислоты, что затрудняет внедрение данного способа в клиническую практику и широкое использование.
В литературе описываются применения подобных вышеуказанному способов определения пуринов и пиримидинов в биологических жидкостях человека, среди недостатков которых отмечается высокая длительность анализа, низкая чувствительность, использование хлорной кислоты в качестве необходимого реагента и возможность определения малого количества пуриновых и пиримидиновых оснований [3-6].
Известен способ определения пуринов и пиримидинов в моче с использованием метода капиллярного электрофореза (КЭ). Время анализа составляет 10 мин, предел обнаружения 1.0-5.7 мкмоль/л, при этом возможно определение девяти метаболитов, важных для получения информации о метаболизме пуриновых и пиримидиновых оснований в организме человека [7].
Известен способ определения пуринов и пиримидинов в биологических жидкостях человека, в основе которого лежит также использование метода КЭ. Способ используется для оценки наличия врожденных заболеваний и мониторинга их развития на основании одновременного анализа в образце мочи объемом 40 мкл большего количества метаболитов (14 оснований и нуклеозидов) [8]. Средняя чувствительность анализа составляет 2,51 мМ, что недостаточно (так же, как и в вышеописанном способе) для проведения высокочувствительного скрининга и оценки метаболизма пуриновых и пиримидиновых оснований в организме человека. Кроме того, способ может показывать неоднозначные результаты, вызванные присутствием маскирующих веществ и метаболитов, а также производных лекарств в анализируемых пробах мочи, кроме того, состав мочи существенно зависит от функциональной работы ряда органов [8].
Использование мочи в качестве диагностического материала накладывает ограничения также и на способы, описанные в [9, 10], где предлагается осуществление определения пуринов и пиримидинов при анализе проб мочи с помощью обращено-фазовой ЖХ. Способы характеризуются минимальной пробоподготовкой, низкой чувствительностью и отсутствием возможности определения достаточного количества пуриновых и пиримидиновых биомаркеров [11-14].
Известен способ определения пуринов и пиримидинов в биологических жидкостях человека (моче и спинномозговой жидкости) с использованием метода протонной спектроскопии ЯМР. При использовании этого способа практически не требуется подготовка образца, однако чувствительность невысока и составляет 15 мкмоль/л, при этом некоторые метаболиты не могут быть идентифицированы в ЯМР-спектре (например, мочевая кислота), и требуется использование чрезвычайно дорогостоящего оборудования [15].
Определение большего количества метаболитов в биологическом материале возможно с использованием МС. Так, например, известны способы определения пуринов и пиримидинов в моче при использовании МС с электроспрейной ионизацией (15-16 метаболитов), с бомбардировкой быстрыми атомами и химической ионизацией при атмосферном давлении [16-19]. Последняя МС техника наименее чувствительна к содержащимся в биологическом образце катионам щелочных металлов. Чувствительность определения пуриновых и пиримидиновых оснований с помощью таких методов обычно составляет нг/мл. Высокой чувствительностью также обладают способы с использованием обращенно-фазовой ВЭЖХ с электроспрейной тандемной МС для определения пуриновых и пиримидиновых оснований [20, 21]. Указанные способы позволяют определять около 24 метаболитов в моче. Предел обнаружения зависит от метаболита и варьируется в диапазоне от 0.02 мкмоль/л (гипоксантин, 2-деоксиинозин, гуанозин и др.) до 10 мкмоль/л (дигидроксиурацил), среднее значение составляет 1 мкмоль/л. Однако основными недостатками рассматриваемых способов являются использование дорогостоящего оборудования, изотопмеченых веществ в качестве внутренних стандартов и необходимость участия высококвалифицированного специалиста при выполнении анализа.
Известен способ определения пуринов и пиримидинов в биологических жидкостях человека посредством их разделения и определения их концентраций с помощью тонкослойной хроматографии. Определение положения пятна соответствующего пуринового или пиримидинового основания осуществляется нанесением на хроматографическую бумагу для проявления раствора ацетата ртути и дифенилкарбазона с последующим нагреванием до 120°С, при этом интересуемые вещества приобретают пурпурную/голубую окраску [22]. Данный способ имеет ограниченное применение, которое определяется, главным образом, низкой чувствительностью и необходимостью использования токсичных веществ в ходе эксперимента.
Наиболее близким к предложенному решению является способ одновременного определения пуриновых и пиримидиновых оснований в биологических жидкостях человека с помощью метода обращено-фазовой ЖХ с УФ детектированием для диагностики врожденных пороков метаболизма, заключающийся в следующем [23]. У испытуемых отбирают венозную кровь, мочу и амниотическую жидкость. Сыворотку крови получают стандартным способом. Полученные образцы сыворотки, мочи и амниотической жидкости разводят дистиллированной водой в 5, 25 и 3 раза соответственно. Аликвоты всех образцов перемещаются на мембрану с отсечкой по молекулярной массе разделяемых компонентов в 3 кДа и центрифугируются в течение 30 мин при 4°С и 10500×g. Депротонизированные пробы разделяют с использованием обращено-фазовой хроматографии, при этом регистрацию сигнала и детектирование пуриновых и пиримидиновых оснований осуществляют в УФ диапазоне при длинах волн 206, 234 и 260 нм (в зависимости от метаболита). Далее концентрации метаболитов в биологических жидкостях определяются по построенной ранее градуировке и идентифицированным временам удерживания, наличие среди них предельных значений может быть ассоциировано с врожденными пороками метаболизма. Способ характеризуется простотой, наличием минимальной пробоподготовки, воспроизводимостью, чувствительностью, позволяет определять одновременно основные пуриновые и пиримидиновые основания в различных биологических жидкостях человека. Однако способ обладает некоторыми недостатками, в числе которых недостаточное количество определяемых метаболитов (15 веществ).
Указанный способ выбран в качестве прототипа предложенного решения.
Технический результат изобретения заключается в использовании для хроматографического разделения в составе подвижной фазы специфического ион-парного реагента, регистрации сигнала в УФ диапазоне от 200 до 300 нм и определении специфических длин волн для каждого определяемого метаболита, что приводит к повышению точности и появлению возможности определения большего количества веществ, необходимых для получения информации о метаболизме пуринов и пиримидинов в организме человека, ассоциированной с различными заболеваниями и позволяющей более глубоко проводить скрининг функционального состояния человека.
Указанный технический результат достигается тем, что в способе определения пуринов и пиримидинов в биологических жидкостях человека, включающем выделение исследуемого материала, получение фракции, содержащей низкомолекулярные вещества, разделение продуктов и участников метаболизма пуринов и пиримидинов при помощи жидкостной хроматографии, вычисление концентрации веществ участников метаболизма пуринов и пиримидинов, согласно изобретению получение информации о метаболизме пуринов и пиримидинов в организме человека основывается на анализе биологических жидкостей человека с помощью обращено-фазовой жидкостной хроматографии с регистрацией результата анализа в ультрафиолетовой области спектра. Существует вариант, в котором в качестве биологической жидкости используется сыворотка крови, в качестве биомаркеров метаболизма пуринов и пиримидинов в организме человека используются гипоксантин, ксантин, инозин, цитозин, питидин, урацил, уридин, β-псевдоуридин, аденин, ксантозин, гуанозин, тимин, тимидин, мочевая кислота, оротовая кислота, малоновая кислота, метилмалоновая кислота, аденозин, аллантоин, никотинамид. Детально метаболические пути пуриновых и пиримидиновых оснований представлены на фиг.1 и 2 соответственно. Существует также вариант, в котором для разделения определяемых веществ в сыворотке крови используется буферный раствор, содержащий ион-парный реагент (тетрабутиламмоний сульфат).
Реализация предложенного способа осуществляется следующим образом.
Стандартная навеска каждого метаболита (гипоксантин, ксантин, инозин, цитозин, питидин, урацил, уридин, β-псевдоуридин, аденин, ксантозин, гуанозин, тимин, тимидин, мочевая кислота, оротовая кислота, малоновая кислота, метилмалоновая кислота, аденозин, аллантоин, никотинамид) массой около 1 мг растворяется в 1 мл 1 М раствора NaOH до получения гомогенной смеси всех интересующих метаболитов. Для нейтрализации рН к полученному раствору добавляется такое же количество 1 М HCl до значения рН 6-7. Вычисляются концентрации метаболитов в стандартной смеси, принимая во внимание точный вес вещества, его молекулярную массу и объем раствора. Полученный раствор фильтруют на стерильном целлюлозном фильтре с размером пор 0.22 мкм.
Приготовление проб анализируемых биологических образцов производится следующим образом. Венозная кровь отбирается в вакуумные пробирки с последующим выделением сыворотки крови согласно стандартному протоколу, аналогичному описанному в [24]. Проба сыворотки крови разводится в 2 раза дистиллированной водой (например, 250 мкл сыворотки и 250 мкл воды), наносится на мембрану инертного фильтра с отсечкой по молекулярному весу разделяемых компонентов в 3 кДа. В результате центрифугирования в течение 30 мин при температуре 4°С и 10500×g оборотах на дне пробирки собирается фракция, не содержащая белков, маскирующих определение метаболитов. Полученный раствор фильтруют на стерильном целлюлозном фильтре с размером пор 0.22 мкм.
Свежеприготовленный стандартный раствор с известным значением концентраций метаболитов и аликвоты каждого образца сыворотки крови (100 мкл) анализируются с помощью ион-парной обращенно-фазовой ЖХ.
В качестве подвижной фазы используется два буфера. Буфер А содержит 12 мМ тетрабутиламмоний сульфата, 10 мМ КН2РО4 и 0,125% метанола, рН 7.00. Буфер Б: 2.8 мМ тетрабутиламмоний сульфата, 100 мМ KH2PO4, 30% метанола, рН 5.50. Разделение смеси осуществляется градиентным элюированием в следующем режиме: 20 мин 100% буфера А, 8 мин 80% буфера А, 10 мин 70% буфера А, 12 мин 55% буфера А, 11 мин 40% буфера А, 9 мин 15% буфера А, 10 мин 0% буфера А, 10 мин 50% буфера А, 15 мин 100% буфера А. Скорость потока 1.2 мл/мин, температура колонки 10°С. Разделение осуществляется с помощью обращенно-фазовой хроматографической колонки Hypersil C-18, размер частиц 5 мкм, размер колонки 250×4.6 мм. Колонка защищается предколонкой.
Регистрация сигнала осуществляется с помощью высокочувствительного диодно-матричного детектора, позволяющего регистрировать сигнал в широкой области спектра от 200 до 300 нм. Данные анализируются с использованием программного обеспечения, предоставленного производителем к данной хроматографической системе.
Для определения концентраций веществ в сыворотке крови используют калибровочные кривые, получаемые посредством метода внутреннего стандарта при использовании соответствующего метаболита известной концентрации. К сыворотке крови добавляется известное количество определяемого вещества, производится хроматографическое разделение, определяется время удерживания и площадь пика поглощения при соответствующей для данного метаболита длине волны. Калибровочные кривые строятся в координатах зависимости концентрации метаболита от площади пика поглощения при известной характеристичной для данного вещества длине волны: 206 нм для малоновой и метилмалоновой кислот, 260 нм (гипоксантин, ксантин, инозин, питозин, питидин, урапил, уридин, β-псевдоуридин, аденин, ксантозин, гуанозин, тимин, тимидин, мочевая кислота, оротовая кислота, аденозин, аллантоин, никотинамид).
Концентрации различных веществ в анализируемых пробах вычисляются согласно полученным калибровочным кривым с учетом времени удерживания и площади пика поглощения при определенной длине волны.
Достоинства предложенного способа заключаются в следующем.
1. Способ определения пуринов и пиримидинов в биологических жидкостях человека, основанный на определении пуриновых и пиримидиновых оснований в сыворотке крови при помощи ЖХ, позволяет достаточно полно мониторировать и оценивать вариабельность продуктов и участников метаболических путей с участием пуриновых и пиримидиновых оснований.
2. Одновременное определение концентраций пуриновых и пиримидиновых оснований (20 веществ) осуществляется в сыворотке крови, объем пробы которой не превышает 250 мкл, метод обладает высокой чувствительностью, специфичностью и воспроизводимостью.
3. Простота метода, минимальная пробоподготовка биологического материала, отсутствие необходимости использования дорогостоящего оборудования и модификации определяемых компонентов - все это делает возможным использование способа определения пуринов и пиримидинов в биологических жидкостях человека в клинической практике для диагностики и оценки функционального организма человека.
4. Концентрация отдельного метаболита, принимающего участие в пуриновом и пиримидиновом метаболизме, в большинстве случаев не имеет практического значения, тогда как комплексная оценка ключевых участников этого процесса позволяет выявить заболевания, нарушения, патологии и оценить функциональное состояние человека.
Концентрации пуриновых и пиримидиновых оснований в сыворотке крови могут служить индикаторами тканевой гипоксии, биомаркерами адаптации энергетических процессов в различных тренировочных циклах, их уровни могут быть использованы для классификации физической нагрузки, а также как биомаркеры тренировочного статуса, перенапряжения и перетренированности.
Детекция пуриновых и пиримидиновых оснований в биологических жидкостях является критически важной при диагностике ряда врожденных пороков метаболизма. При этом количество определяемых пуриновых и пиримидиновых оснований, продуктов и участников данного метаболического цикла определяет точность и достоверность поставленного диагноза. Анализ биологических жидкостей, проводимый для скрининга врожденных пороков метаболизма, является крайне важным для получения пренатального или неонатального диагноза, мониторинга развития заболевания и принятия решения о терапевтическом вмешательстве.
5. Определение пуринов и пиримидинов в биологических жидкостях человека с использованием жидкостной хроматографии с диодно-матричным детектированием является точным, достоверным способом, применение которого позволит наиболее полно охарактеризовать метаболические изменения, связанные с метаболическими путями пуринов и пиримидинов в организме человека.
Проведенные патентные исследования показали, что не известны технические решения с указанной совокупностью существенных признаков в аналогичных способах определения пуринов и пиримидинов в биологических жидкостях для получения информации об их метаболизме в организме человека, т.е. предлагаемое решение соответствует критерию «новизна».
При анализе известных аналогов и прототипа не обнаружено предложение с совокупностью существенных признаков, изложенных в формуле изобретения, из чего следует, что для специалистов, занимающихся химическим анализом биологических жидкостей, диагностикой и медициной, оно явным образом не следует из уровня техники и, следовательно, соответствует критерию изобретения «изобретательский уровень».
Литература
1. The effect of endurance training on changes in purine metabolism: a longitudinal study of competitive long-distance runners. J.Zielinski, T.Rychlewski, K.Kusy, K.Domaszewska, M. Laurentowska // Eur. 1 Appl. Physiol. 2009. V.106, pp.867-876.
2. Simultaneous liquid chromatography of 5-fluorouracil, undine, hypoxanthine, xanthine, uric acid, allopurinol, and oxipurinol in plasma. W.E.Wung, S.B.Howell // Clin. Chem. 1980. V.26, pp.1704-1708.
3. Muscle adenine nucleotide metabolism during and in recovery from maximal exercise in humans. S.Zhao, RJ.Snow, C.G.Stathis, M.A.Febbraio, M.F.Carey // J. Appl. Physiol. 2000. V.88, pp.1513-1519.
4. Adenine, guanine and pyridine nucleotides in blood during physical exercise and restitution in healthy subjects. W.Dudzinska, A.Lubkowska, B.Dolegowska, K.Sananow, K.Jakubowska // Eur. 1 Appl. Phusiol. 2010. V.110, pp.1155-1162.
5. Single-run high-performance liquid chromatography of nucleotides, nucleosides, and major purine bases and its application to different tissue extracts. J.Wynants, H. van Belle // Anal. Biochem. 1985. V.144, pp.258-266.
6. Determination of sixteen nucleotides, nucleosides and bases using high-performance liquid chromatography and its application to the study of purine metabolism in hearts for transplantation. R.T.Smolensk!, D.R.Lachno, S.J.Ledingham, M.H.Yacoub // J. Chromatogr. 1990. V.527, pp.414.420.
7. Capillary electrophoresis for detection of inherited disorders of purine and pyrimidine metabolism: a selective approach. D.Friedecky, T.Adam, P.Bartak // Electrophoresis. 2002. V.23, pp.565.571.
8. Screening method for inherited disorders of purine and pyrimidine metabolism by capillary electrophoresis with reversed electroosmotic flow. T.Adam, P.Lochman, D.Friedecky // J. Chromatogr. В Analyt. Technol. Biomed. Life Sci. 2002. V.767, pp.333-340.
9. Inherited defects of purine and pyrimidine metabolism: laboratory methods for diagnosis. M.Duran, L.Borland, E.E.Meuleman, P.Allers, R.Berger // J. Inherit. Metab. Dis. 1997. Vol.20, pp.227-236.
10. Purine and pyrimidine metabolites in children's urine. C.Vidotto, D.Fousert, M.Akkennann, A.Griesmacher, M.M. Muller // Clin. Chim. Acta. 2003. V.335, pp.27-32.
11. Liquid chromatography with multichannel ultraviolet detection used for studying disorders of purine metabolism. T.Kojima, T.Nishina, M.Kitamura, N.Kamatani, K.Nishloka // Clin. Chem. 1987. Vol.33, pp.2052-2056.
12. Experience with a simple high-performance liquid chromatography method for the analysis of purine and pyrimidine nucleosides and bases in biological fluids. M.J.Bennett, K.H.Carpenter // Ann. Clin. Biochem. 1984. Vol.21, pp.131-136.
13.Hypoxanthine and xanthine concentrations determined by high performance liquid chromatography in biological fluids from patients with xanthinuria, R.Boulieu, C.Bory, P.Baltassat, P.Divry // Clin. Chim. Acta. 1984. Vol.142, pp.83-89.
14. Use of biological fluids for the rapid diagnosis of potentially lethal inherited disorders of human purine and pyrimidine metabolism. G.S.Morria, H.A.Simmonds, P.M.Davies // Biomed. Chromatogr. 1986. Vol.1, pp.109-118.
15. 1H-NMR spectroscopy of body fluids: inborn errors of purine and pyrimidine metabolism. R.A.Wevers, U.F.Engeike, S.H.Moolenaar, C.Brautigam, J.G. de. Jong, R.Duran, R.A. de Abreu, A.H. van Gennip // Clin. Chem. 1999. V.45, pp.539-548.
16. Atmospheric pressure ionization mass spectrometry of purine and pyrimidine markers of inherited metabolic disorders. P.Frycak, R. Huskova, T.Adam, K.Lemr // J. Mass Spectrom. 2002. V.37, pp.1242-1248.
17. Mass spectrometry for analysis of purine and pyrimidine compounds. K.Lemr, T.Adam, P.Frycak, D.Friedecky // Adv. Exp. Med. Biol. 2000. V.486, pp.399-403.
18. Rapid screening of high-risk patients for disorders of purine and pyrimidine metabolism using HPLC-electrospray tandem mass spectrometry of liquid urine or urine-soaked filter paper strips. T.Ito, A.B. van Kuilenburg, A.H.Bootsma, AJ.Haasnoot, A. van Cruchten, Y.Wada, A.H. van Gennip // Clin. Chem. 2000. Vol.46, pp.445-452.
19. http://www.shimadzu-biotech.net/litemture/application_note/188_2.pdf.
20. Analysis of purine and pyrimidine bases, nucleosides and deoxynucleosides in brain microsamples (microdialysates and micropunches) and cerebrospinal fluid. A.Dobolyi, A.Reichart, T.Szikra, N.Szilagyi, A.K.Kekesi, T.Karancsi, P.Slegel, M.Palkovits, G. Juhasz // Neurochem. Int. 1998. V.2, pp.247-256.
21. Comprehensive detection of disorders of purine and pyrimidine metabolism by HPLC with electrospray ionization tandem mass spectrometry. S.Hartmann, J.G.Okun, C.Schmidt, C.D.Langhans, S.F.Garbade, P.Burgard, D.Haas, J.O.Sass, W.L.Nyhan, G.F.Hof&nann // Clin. Chem. 2006. Vol.52, pp.1127-1137.
22. Two-dimensional thin-layer chromatography for the screening of disorders of purine and pyrimidine metabolism. A.H. van Gennip, D.Y. van Noordenburg-Huistra, P.K. de Bree, S.K. Wadman // Clin. Chim. Acta. 1978. Vol.86, pp.7-20.
23. Simultaneous high performance liquid chromatographic separation of purines, pyrimidines, N-acetylated amino acids, and dicarboxylic acids for the chemical diagnosis of inborn errors of metabolism. B.Tavazzi, G.Lazzarino, P.Leone, A.M.Amorini, F.Bellia, C.G.Janson, V. Di Pietro, L.Ceccarelli, S.Donzelli, J.S.Francis, B. Giardina // Clin. Biochem. 2005. Vol.38, pp.997-1008.
24. Применение метода молекулярной спектроскопии средней инфракрасной области для определения ряда биохимических показателей сыворотки крови. С.А.Хаустова, Я.И.Давыдов, Е.В.Трушкин, М.Ю.Шкурников, Р.Мюллер, И.Бекхаус, А.Г.Тоневицкий // Бюллетень экспериментальной биологии и медицины. 2009. Т.148, С.707-711.
1. Способ определения пуринов и пиримидинов в сыворотке крови человека, включающий:
- приготовление стандартного раствора из биомаркеров метаболизма пуринов и пиримидинов в организме человека с известным значением концентраций метаболитов для получения калибровочных кривых,
- получение образца сыворотки крови, разведение его дистиллированной водой в 2 раза с последующим получением фракции, содержащей низкомолекулярные вещества, для чего разведенный водой образец сыворотки крови помещают на мембрану инертного фильтра с отсечкой по молекулярному весу разделяемых компонентов в 3 кДа и центрифугируют с получением фракции, не содержащей белков, маскирующих определение метаболитов, которую затем фильтруют на стерильном целлюлозном фильтре с размером пор 0.22 мкм,
- после чего к полученной фракции добавляют буферный раствор, содержащий ион-парный реагент - тетрабутиламмоний сульфат - и известное количество стандартного раствора, после чего производят хроматографическое разделение полученной смеси с использованием обращенно-фазовой жидкостной хроматографии, при этом для разделения определяемых веществ в качестве подвижной фазы используют буферы А и Б, где буфер А содержит 12 мМ тетрабутиламмоний сульфата, 10 мМ KH2PO4 и 0,125% метанола при рН 7.00; буфер Б содержит 2.8 мМ тетрабутиламмоний сульфата, 100 мМ KH2PO4, 30% метанола, рН 5.50; разделение смеси осуществляют градиентным элюированием в следующем режиме: 20 мин 100% буфера А, 8 мин 80% буфера А, 10 мин 70% буфера А, 12 мин 55% буфера А, 11 мин 40% буфера А, 9 мин 15% буфера А, 10 мин 0% буфера А, 10 мин 50% буфера А, 15 мин 100% буфера А, скорость потока 1.2 мл/мин, температура колонки 10°С,
- концентрацию веществ метаболизма пуринов и пиримидинов в анализируемых пробах вычисляют согласно калибровочным кривым, полученным при использовании соответствующего биомаркера метаболита известной концентрации, с учетом времени удерживания и площади пика поглощения при определенной длине волны.
2. Способ по п. 1, характеризующийся тем, что в качестве биомаркеров метаболизма пуринов и пиримидинов в организме человека используют гипоксантин, ксантин, инозин, цитозин, цитидин, урацил, уридин, β-псевдоуридин, аденин, ксантозин, гуанозин, тимин, тимидин, мочевую кислоту, оротовую кислоту, малоновую кислоту, метилмалоновую кислоту, аденозин, аллантоин, никотинамид.
3. Способ по п. 2, характеризующийся тем, что для приготовления смеси стандартного раствора берут навеску каждого биомаркера массой 1 мг, которую растворяют в 1 мл 1 М раствора NaOH до получения гомогенной смеси интересующих метаболитов, к полученной смеси добавляют HCl до получения значения рН 6-7, вычисляют концентрацию метаболитов в стандартной смеси, принимая во внимание точный вес вещества, его молекулярную массу и объем раствора, полученный раствор фильтруют на стерильном целлюлозном фильтре с размером пор 0.22 мкм.
4. Способ по п. 1, характеризующийся тем, что центрифугирование осуществляют в течение 30 мин при температуре 4°С и 10500×g оборотах.
5. Способ по п. 1, характеризующийся тем, что разделение определяемых веществ осуществляют с помощью обращенно-фазовой хроматографической колонки Hypersil С-18 с размером частиц 5 мкм, размером колонки 250×4.6 мм.
6. Способ по п. 1, характеризующийся тем, что калибровочные кривые строят в координатах зависимости концентрации метаболита от площади пика поглощения при известной характеристичной для данного вещества длине волны: 206 нм - для малоновой и метилмалоновой кислот, 260 нм - для гипоксантина, ксантина, инозина, цитозина, цитидина, урацила, уридина, β-псевдоуридина, аденина, ксантозина, гуанозина, тимина, тимидина, мочевой кислоты, оротовой кислоты, аденозина, аллантоина, никотинамида.