Средство для лечения ишемии, способ его получения и способ лечения ишемии (варианты)
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к фармации, и представляет собой средство для лечения ишемии, содержащее в качестве активного начала комплекс соли этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата, а также способ получения средства для лечения ишемии и способ лечения ишемии. При этом предлагается создание вариантов средства для лечения ишемии, представляющих комплекс соли этил-2-(2-(1-метилгуанидино)-ацетамидо)ацетата с сахарами, фибринолитическими ферментами и с маннитолом. Осуществление изобретения позволяет получить средство с повышенной эффективностью и стабильностью. 6 н. и 22 з.п. ф-лы, 28 табл., 25 пр.
Реферат
Изобретение относится к области медицины, в частности к фармации, и касается лекарственных композиций, используемых для лечения острых и хронических нарушений мозгового кровообращения, а также ишемической болезни сердца и аналогичных заболеваний сердечно-сосудистой системы.
Ишемическое поражение головного мозга и миокарда, приводящее к инсульту и инфаркту миокарда, как правило, вызывается нарушением циркуляции крови в сердечно-сосудистой системе организма. Последнее инициирует патофизиологические изменения в клетках, приводит к снижению содержания высокоэнергетических соединений, в первую очередь АТФ, в тканях [Reichelt K.L. Thechemicalbasisfortheintoleranceofthebraintoanoxia. Ас-taAnesthesiol. Scand. 1978], ацидозу вследствие накопления лактата, разрушению астроцитов [HertzL. Theastrocyte-neuronlactatesshuttle. J. Cereb. Blood-FlowMetab. 2004; 24: 1241-8], компрессии капилляров головного мозга [AmesAIII, et al. Cerebral ischemia II. The no-reflow phenomenon. Amer. J. Pathol., 1968; 52: 437-53].
Известна многочисленная группа лекарственных препаратов, улучшающих энергетический метаболизм ткани, активирующих интегративные функции мозга, повышающих устойчивость мозга к повреждающим факторам (Goodman Е. Gilman's. The Pharmacological Basis of Therapeutics, 11 ed, McGraw-Hill, Medical Publ. Division, New York 2006; RU 1746886, 1991; WO 96/08527, 1996). К их числу, в частности, относятся препараты, содержащие в качестве активного (действующего) вещества тромболитики, антиагреганты, в частности, аспирин, ксантины, ноотропы (пирацетам), винпоцетин и т.п.
Недостатками большинства указанных препаратов является узкий спектр действия, значительное количество побочных эффектов и противопоказаний, невысокая нейропротективная активность, ограниченность возможности применения при острой и хронической ишемии головного мозга [The Cochrane Library, Issue 4, 2002. Oxford].
Так, показано применение тромболитиков при ишемии миокарда, однако осложнения при их использовании в высоких дозах наблюдаются в 12,8% случаев. [Wardlaw J.М. et all, Thrombolysis for acute ischaemic stroke (Cochrane Review). In: The Cochrane Library, Issue 4, 2002. Oxford]. Использование в терапии ишемического инсульта антикоагулянтов не позволяет добиться эффективной терапии инсульта и имеет значительные ограничения [Gubitz G. Et all, Anticoagulants for acute ischaemic stroke (Cochrane Review). In: The Cochrane Library. Issue 4, 2002. Oxford]; аспирин энтерально может применяться только для предотвращения ишемического инсульта, но не в острый его период [Gubitz G. et all, Antiplatelet therapy for acute ischemic stroke (Cochrane Review). In: The Cochrane Library, Issue 4, 2002. Oxford]. Неблагоприятное влияние пирацетама на смертность отмечается в ближайший период после ишемического инсульта и в постишемический период [Ricci S., Celani M.G., Cantisani А.Т., Righetti E. Piracetam for acute ischaemic stroke (Cochrane Review) In: The Cochrane Library, Issue 4, 2002. Oxford]. Применение при ишемии метилксантинов и винпоцетина также имеет значительные ограничения в связи с их недостаточной безопасностью [Bath P.М. Wet all, Pentoxifylline, propentofylline and pentifylline for acute ischaemic stroke (Cochrane Review). In: The Cochrane Library, Issue 4, 2002. Oxford; Bereczki D., Fekete I. Vinpocetine for acute ischaemic stroke (Cochrane Review). In: The Cochrane Library, Issue 4, 2002. Oxford].
В связи с изложенным, разработка лекарственных препаратов для лечения и профилактики ишемии и сегодня остается важной задачей.
Так как ишемическое повреждение клеток, в том числе нейронов мозга, представляет собой каскад патологических процессов [P. Lipton. Ischemic Cell Death in Brain Neurons. Physiological Reviews, Vol. 79, No. 4, October 1999; Shaheen E. Lakhan et all, Inflammatory mechanisms in ischemic stroke: therapeutic approaches. J. of Translational Medicine 2009, 7: 97], целесообразна разработка новых нейропротекторов - препаратов, ингибирующих основные звенья ишемического каскада [Larry В Goldstein. Neuroprotective therapy for acute ischaemic stroke: down, but not out. The Lancet, 2004, 363, 414; Gary H. Danton and W. Dalton Dietrich. The Search for Neuroprotective Strategies in Stroke. AJNR Am. J. Neuroradiol. 25: 181-194, February 2004].
Нейропротекция (цитопротекция) при ишемии должна быть направлена на восстановление кровотока, нормализацию энергетического тканевого метаболизма, снижение деполяризации мембран клеток, ингибирование свободно-радикальных процессов и факторов активации тромбоцитов [Р. Lipton. Ischemic Cell Death in Brain Neurons. Physiological Reviews, Vol. 79, No. 4, October 1999].
Перспективным направлением цитопротекции, направленной на профилактику и лечение ишемии, является использование амидов креатина и их производных (RU 2354645, 2009; US 8,350,077 В2).
Так, показана нейропротективная активность амидов креатина при ишемии головного мозга [Burov S.V et all, Creatinyl amino acids - new hybrid compounds with neuroprotective activity. J. Pept. Sci. 2011. V. 17. N. 9. P. 620-626], возможность применения для терапии инфаркта миокарда композиции, содержащей в качестве активного вещества натриевую соль креатинфосфата. [P. Lipton. Ischemic Cell Death in Brain Neurons. Physiological Reviews, Vol. 79, No. 4, October 1999].
Синтетический аналог фосфокреатина, препарат Неотон, показал эффективность при парентеральном внутривенном введении по 1-5 г в сутки в течение 5-10 дней. При инфаркте Неотон проявляет противоишемическое, антиаритмическое и антиоксидантное действие, повышает кислородную емкость крови, оказывает мягкое мочегонное действие. [V.J. Teshchuck et all, J. of Health Sciences. 2014; 04 (03): 073-080. ISSN 1429-9623/2300-665Х]. Однако антиагрегантной и тромболитической активности Неотон не проявляет. При этом энтерально препарат Неотон не применяется ввиду его быстрого разложения в желудочно-кишечном тракте.
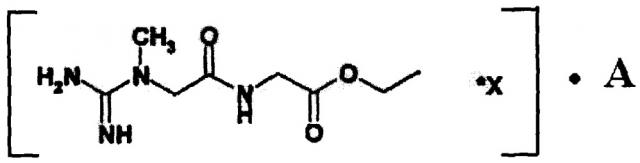
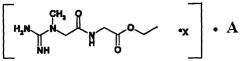
Наиболее близким к заявляемой группе изобретений по существу является средство, проявляющее нейропротективную активность при ишемии, содержащее синтезированные и исследованные авторами [RU 2 354 645, 2009] амиды креатина общей формулы NH=C(NH2)-N(CH3)-CH2-CO-NH-R*X, где R - аминокислотный остаток алифатической, ароматической или гетероароматической аминокислоты или ее производное, представляющее собой сложные эфиры аминокислот, амиды аминокислот или пептиды; X - низкомолекулярная органическая или минеральная кислота или вода.
Ранее нами было показано [Веселкина О.С. и др. Антитромботические свойства КРЕАМИДА. Вестник службы крови России, №3, с. 31-37, 2010], что наиболее активными и безопасными представителями амидов креатина являются соли этил-2-(2-(1-метилгуанидино) ацетамидо) ацетата (далее ЭГАА) - соединения, где R - СН2-С(O)-O-С2Н5, а X - низкомолекулярная органическая или минеральная кислота, общей формулы I:
Препараты, содержащие соли этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата, использовали парентерально в виде раствора активного вещества в воде или физрастворе, содержащего нипагин, или энтерально в смеси со вспомогательными веществами в дозах до 280 мг/кг массы животных. Препараты вводили по следующим схемам:
- за 1 час до ишемии или
- за 5 дней до ишемии и 7 дней после ишемии (оценка эффективности препарата для профилактики и терапии ишемии) или
- через 30 мин после индукции ишемии и далее в течение 7 дней после ишемии (оценка эффективности препарата для терапии острой ишемии).
Недостатками указанных препаратов являются недостаточная эффективность при энтеральном введении, нестабильность при хранении в виде раствора для парентерального введения в течение срока, превышающего 5 суток, что приводило к потере активности и существенному накоплению посторонних примесей.
Недостатком применения такой композиции для лечения ишемии являлось также наличие в составе препарата для парентерального введения нипагина, содержание которого в растворах для внутривенного введения человеку крайне нежелательно [Richard J. Lewis, Sr., Hazardous Chemicals Desk Reference, p. 752; F. Alan Andersen, Int. J. of Toxicology, 27 (Suppl. 4): 1-82, 2008).
Технической задачей, решаемой авторами, являлась разработка состава средства (композиции) на основе ЭГАА для парентерального и энтерального введения, обладающего повышенной эффективностью, обеспечивающего стабильность композиций при длительном хранении (не менее 2-х лет), а также более эффективной технологии их применения при ишемических заболеваниях.
В рамках решения поставленной задачи авторами было высказано предположение, что стабильность ЭГАА может быть повышена за счет введения в состав средства веществ, способных защитить наиболее уязвимые фрагменты молекулы ЭГАА, образуя комплексы, стабильные в условиях хранения и легко распадающиеся в организме.
Технический результат достигался за счет создания комплексов ЭГАА с фармакологически приемлемыми компонентами и использования в качестве комплексообразующих компонентов сахаров, фибринолитических веществ (ФВ) и маннитола общей формулы I:
где
X - низкомолекулярная C1-С4 органическая или минеральная кислота,
А - фибринолитическое вещество или маннитол или сахар.
Препараты могут содержать либо комплексы ЭГАА (1), либо смесь ингредиентов, образующих данные комплексы при контакте с окружающей средой в ходе подготовки к применению.
В качестве сахаров могут быть использованы полисахариды и их производные, моносахариды, олигосахариды и их производные или их смеси. В качестве полисахаридов препарат может содержать целлюлозу и ее эфиры, крахмал и его эфиры, гиалуроновую кислоту или соли гиалуроновой кислоты, хитозан, хондроитинасульфат, или их смеси и т.п. В качестве моносахаридов препарат может содержать глюкозу, фруктозу и их производные или их смеси и т.п., в качестве олигосахаридов может быть использованы сахароза, мальтоза, лактоза или их смеси и т.п.
В качестве фибринолитических веществ используют стрептокиназу или урокиназу.
Комплексы с сахарами получают обработкой ЭГАА в «кипящем слое» раствором сахаров в воде, смеси воды со спиртом или спирте в течение 10-30 мин. Получаемая композиция может использоваться для энтерального приема, например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, порошков, гранул или растворов.
Препарат с ФВ получают смешением ЭГАА с фибринолитическими веществами, исходя из содержания в комплексе ЭГАА 0,05-2,0 г, фибринолитических веществ - 50000-5000000 ME, растворением с последующей лиофильной сушкой. Приготовление раствора для инъекций или инфузий на основе ЭГАА проводят, как правило, непосредственно перед парентеральным применением.
Препарат с маннитолом получают смешением ингредиентов, исходя из содержания в комплексе ЭГАА 0,05-2,0 г, маннитола - 0,01-2 г, растворением с последующей лиофильной сушкой смеси. Приготовление раствора для инъекций или инфузий на основе ЭГАА проводят непосредственно перед парентеральным применением.
В качестве растворителей используют стерильные апирогенные растворители - вода, физиологический раствор, маннитол раствор для инфузий 15%, раствор глюкозы, раствор магния сульфата, растворы аминокислот для парентерального питания, раствор Рингера и т.п.
Наряду с активным началом композиции могут содержать вспомогательные вещества. В качестве вспомогательных веществ в составе композиций с сахарами могут использоваться вещества, улучшающие условия получения, хранения или применения фармацевтической композиции, такие как растворители, наполнители, связующие, разрыхлители, скользяще-смазывающие вещества, пленкообразователи, пигменты, пластификаторы, пролонгирующие вещества, ароматизаторы, вкусовые добавки, стабилизаторы, консерванты и т.п. Например, в качестве вспомогательных веществ в составе таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул может быть использована лактоза, кукурузный крахмал или его производные, целлюлоза или ее производные, аэросил, тальк, стеариновая кислота или ее соли, маннитол, аминокислоты и т.п. В состав композиций для парентерального применения для комплексов с ФВ или маннитолом могут входить вспомогательные вещества, обеспечивающие пористость и форму лиофилизованного порошка, улучшающего его растворимость, обеспечивающие стабильность при хранении, например аргинин, глицин или его эфиры, человеческий сывороточный альбумин, соли магния, полиолы и т.п.
Лечение ишемии с помощью заявляемой композиции проводят по одному из следующих вариантов:
- энтерально путем введения в организм средства в дозе не менее 0,01 г, а оптимально от 0,01 г до 1 г активного вещества ежесуточно в виде таблеток, таблеток, покрытых оболочкой, драже, твердых желатиновых капсул, порошков или гранул при содержании активного вещества от 0,01 до 0,50 г в одной дозе. Курс применения таких фармацевтических композиций составляет от нескольких недель до нескольких месяцев;
- парентерально в виде инъекций или инфузий в дозе не менее 0,05 г при суточной дозе не менее 0,05 г, оптимально от 0,05 г до 6 г и содержании активного вещества от 0,05 до 2,0 г на одну дозу. Полученный раствор вводят внутривенно инъекционно или путем внутривенной капельной инфузий. Курс парентерального применения фармацевтических композиций может быть от нескольких суток до нескольких недель.
Дозировка комплекса ЭГАА при лечении может варьироваться в достаточно широких пределах, что позволяет ее корректировать в каждом конкретном случае. Суточная доза может быть введена в виде однократной дозы или в виде раздельных доз.
Соли этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата общей формулы (I) синтезировали по методу, описанному нами ранее [RU 2428414; US 2012/0277459].
Композицию для энтерального применения получали путем обработки ЭГАА сахарами в присутствии растворителя в «кипящем слое» в течение 10-30 мин. В качестве растворителя использовали воду или смеси воды со спиртом, или спирт. Полученную смесь гранулировали, высушивали, измельчали, при необходимости вводили вспомогательные вещества в заданном соотношении с использованием традиционных технологий, таких как сухое смешение, компактирование, с использованием установки «кипящего слоя» и т.п., далее таблетировали или помещали в желатиновые капсулы или в саше и использовали для энтерального приема.
Использование комплекса ЭГАА с сахарами для получения композиций для энтерального применения позволило обеспечить эффективное высвобождение действующего вещества при энтеральном приеме композиции, повысить стабильность композиции при длительном хранении, предусмотренном для хранения фармацевтических препаратов, а также оптимизировать технологию получения композиций.
Композицию для парентерального применения получали следующим образом: ЭГАА, фибринолитические вещества и, при необходимости, вспомогательные вещества или ЭГАА, маннитоли, при необходимости, вспомогательные вещества, растворяли в токе азота вводе, раствор подвергали стерильной фильтрации, разливали в стерильные флаконы, лиофильно высушивали в вакууме при температуре от (-)50 до (+)20°С, флаконы укупоривали в токе сухого стерильного азота.
Получение композиций для парентерального применения позволило обеспечить их стабильность при длительном хранении, улучшить растворимость композиции перед введением, использовать более широкий спектр вспомогательных веществ, например, человеческий сывороточный альбумин, аминокислоты.
Наиболее эффективной областью применения заявляемого средства (композиции) согласно настоящему изобретению являются лечение ишемического поражения головного мозга и миокарда, в частности, хронические.
Наиболее эффективной областью применения заявляемого средства (композиции) согласно настоящему изобретению являются лечение ишемического поражения головного мозга и миокарда, в частности, хронические нарушения мозгового кровообращения, ишемический инсульт, ишемическая болезнь сердца, инфаркт миокарда.
В ходе проведенных исследований композиций для энтерального приема оценку распадаемости и растворения композиций в виде таблеток проводили в соответствии с рекомендациями Ph. Eur. 8.0. Среда для оценки распадаемости - вода, для оценки растворения - 0,1 М раствор кислоты хлористоводородной, 0,05 М раствор аммония ацетата (pH=4,5), 0,05 М раствор натрия фосфата (pH=7,4), объем - 900 мл. Содержание солей этил-2-(2-(1-метилгуанидино)ацетамидо) ацетата в композициях определяли методом обращенно-фазовой ВЭЖХ, колонка Zorbax Eclipse 3,5 мкм, С18, 3×150 мм. Подвижная фаза: смесь 0,03 М раствора натрия дигидрофосфата, содержащего 0,012 М октансульфоната натрия (pH 3,0) и ацетонитрила в объемном соотношении 90:10. Скорость потока подвижной фазы 0,5 мл/мин, температура колонки 30°С, детектирование при 205 нм. Активность фибринолитических веществ в составе лекарственных композиций для парентерального введения определяли по USP и/или Ph. Eur.
Конкретные примеры промышленного применения заявляемой группы изобретений представлены ниже.
Пример 1. Получение таблеток, содержащих комплекс этил-2-(2-(1-метил-гуанидино)ацетамидо)ацетата фумарата с гидроксипропилцеллюлозой (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарата с гидроксипропилцеллюлозой.
Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарат обрабатывают в течение 25 мин раствором гипролозы в смеси вода: этанол в соотношении 50:50, в «кипящем слое», сушат.
Получение таблеток.
Комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарата с гидроксипропилцеллюлозой опудривают лактозой безводной, аэросилом, МКЦ, натрия стеарилфумаратом, тальком и ароматизатором, пропускают через сито диаметром 0,8 мм и таблетируют. Получают двояковыпуклые таблетки, массой 250 мг и дозировкой активного вещества 25 мг.
Распадаемость таблеток: 9 мин. Растворение таблеток обеспечивает высвобождение 93% этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарата за 30 мин (0,1 М HCI).
Пример 2. Получение таблеток покрытых оболочкой, содержащих комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрата со смесью целлюлозы и ацетилфталилцеллюлозы (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрата со смесью целлюлозы и ацетилфталилцеллюлозы. Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрат смешивают с микрокристаллической целлюлозой, смесь обрабатывают раствором ацетилфталилцеллюлозы в спирте этиловом в «кипящем слое» 20 мин, сушат, измельчают.
Получение таблеток.
Комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрата, опудривают тальком и лактозой безводной, кремния диоксидом безводным, пропускают через сито диаметром 0,8 мм, таблетируют. Получают ядро двояковыпуклой формы массой 76 мг, покрывают оболочкой в коаторе. Масса таблетки, покрытой оболочкой, равна 80 мг. Распадаемость таблеток: 14 мин. Растворение: высвобождение 97% этил-2-(2-(1-метилгуанидино)-ацетамидо)ацетата тартрата за 30 мин (0,05 М раствор ацетата аммония).
Пример 3. Получение таблеток, содержащих комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата ацетата с лактозой (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата ацетата с лактозой.
Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата ацетат обрабатывают лактозой в присутствии воды, в «кипящем слое» 10 мин, сушат, измельчают.
Получение таблеток.
Комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата ацетата опудривают этилцеллюлозой, модифицированным крахмалом, азросилом в течение 10 мин, добавляют кальция стеарат, перемешивают еще 2 мин. Смесь пропускают через сито диаметром 0,8 мм и таблетируют. Получают таблетки-облог с риской, массой 700 мг и дозировкой активного вещества 300 мг.
Распадаемость таблеток: 7 мин. Растворение: высвобождение 97% этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрата за 30 мин (0,05 М раствор ацетата аммония).
Пример 4. Получение таблеток, содержащих комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фосфата
с хондроитина сульфатом (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фосфата с хондроитина сульфатом.
Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фосфат обрабатывают раствором хондроитина сульфата в смеси вода: спирт (40:60) в течение 10 мин, в «кипящем слое», сушат, измельчают.
Получение таблеток.
Комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фосфата с хондроитина сульфатом опудривают микрокристаллической целлюлозой, кальция фосфата дигидратом, добавляют натрия стеарилфумарат, переметит вают 2 мин. Смесь пропускают через сито диаметром 0,8 мм, таблетируют. Получают таблетки плоскоцилиндрической формы с риской, массой 500 мг, с дозировкой активного вещества 200 мг.
Распадаемость таблеток: 10 мин. Растворение таблеток: высвобождение 95% этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фосфата за 30 мин (0,1 М HCI).
Пример 5. Получение таблеток, содержащих комплекс этил-2-(2-(1-метил-гуанидино)ацетамидо)ацетата гидрохлорида
с хитозаном (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гидрохлорида с хитозаном.
Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гидрохлорид обрабатывают хитозаном в присутствии смеси вода: спирт этиловый (50:50) в течение 10 мин, в «кипящем слое», сушат, измельчают.
Получение таблеток.
Комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гидрохлорида с хитозаном смешивают с микрокристаллической целлюлозой, лактозой, тальком и кремния диоксидом в течение 10 мин. Смесь пропускают через сито диаметром 0,8 мм и таблетируют. Получают плоско-цилиндрические таблетки массой 70 мг, с содержанием активного вещества 10 мг.
Распадаемость таблеток: 5 мин. Растворение таблеток: высвобождение 98% этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гидрохлорида за 30 мин (0,1 M HCI).
Пример 6. Получение таблеток, содержащих комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гемисукцината
с фруктозой (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гемисукцитата с фруктозой.
Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гемисукцинат обрабатывают 25 мин суспензией фруктозы в смеси спирт этиловый - вода (80:20), в «кипящем слое», сушат, измельчают.
Получение таблеток.
Комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гемисукцината с фруктозой смешивают в блендере с микрокристаллической целлюлозой и кросповидоном в течение 20 мин, добавляют натрия стеарилфумарат, перемешивают 5 мин. Смесь пропускают через сито диаметром 0,8 мм, таблетируют. Масса таблетки-облонг 1000 мг, дозировка активного вещества 500 мг. Распадаемость таблеток: 12 мин. Растворение: высвобождение 92% этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гемисукцината за 30 мин (0,05 М фосфатный буфер, pH 7,4).
Пример 7. Получение таблеток, содержащих комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарата
со смесью с модифицированного крахмала и D-глюкуроновой кислоты (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарата с модифицированным крахмалом и D-глюкуроновой кислотой.
Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарат обрабатывают водным раствором смеси модифицированного крахмала и D-глюкуроновой кислоты в течение 15 мин, в «кипящем слое», сушат, измельчают.
Получение таблеток.
Смесь для таблетирования готовится методом компактирования. Комплекс смешивают с аэросилом, повидоном, магния цитратом, пропускают через компактер, опудривают крахмалом, аэросилом и стеариновой кислотой, пропускают через сито диаметром 0,8 мм и таблетируют. Получают плоскоцилиндрические таблетки массой 200 мг, с дозировкой активного вещества 100 мг.
Распадаемость таблеток: 8 мин. Растворение: высвобождение 95% этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарата за 30 мин (0,1 н HCI).
Пример 8. Получение твердых желатиновых капсул, содержащих комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гемитартрата
со смесью целлюлозы и хондроитина сульфата (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гемитартрата со смесью целлюлозы и хондроитина сульфата.
Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата гемитартрат смешивают с целлюлозой порошковой, обрабатывают в «кипящем слое» в течение 15 мин водным раствором хондроитина сульфата, гранулируют, сушат.
Заполнение капсул.
Комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрата со смесью целлюлозы и хондроитина сульфата помещают в твердые желатиновые капсулы №3. Содержание этил-2-(2-(1-метилгуанидино)ацетамидо)-ацетата тартрата в каждой капсуле: 150 мг.
Пример 9. Получение защечных таблеток, содержащих комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрата
с метилцеллюлозой (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрата с метилцеллюлозой.
Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрат обрабатывают в течение 15 мин раствором метилцеллюлозы в смеси вода: спирт этиловый (60:40), в «кипящем слое», сушат.
Получение таблеток.
Комплекс опудривают магния стеаратом, далее таблетируют. Получают двояковыпуклые таблетки, массой 140 мг. Содержание активного вещества: 100 мг. Распадаемость таблеток: 5 мин. Растворение: высвобождение 92% этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата тартрата за 30 мин (0,05 М фосфатный буфер, pH 7,4).
Пример 10. Получение порошка, содержащего комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарата
со смесью гиалуроната натрия и мальтозы, для получения раствора для энтерального приема (вариант 1).
Получение комплекса этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарата со смесью гиалуроната натрия и мальтозы.
Этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарат смешивают с мальтозой, смесь обрабатывают 15 мин в «кипящем слое» раствором гиалуроната натрия в смеси вода : спирт этиловый (40:60), сушат, измельчают.
Комплекс смешивают с калия аспарагинатом и сахарозой, порошок расфасовывают в саше-пакеты. Перед применением разводят в 100 мл воды.
Пример 11. Получение препарата для приготовления растворов для инфузий, содержащего этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фосфат
и стрептокиназу (вариант 2).
10 г этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фосфата растворяют в токе азота в 200 мл воды, прибавляют и растворяют при слабом перемешивании в токе азота 5 г альбумина, 1,1 мл (1000000 ME) раствора стрептокиназы (Kraeber &Со GMBH). Раствор подвергают стерильной фильтрации, разливают по 10 мл в стерильные флаконы, лиофильно высушивают в вакууме при температуре от (-)20 до (+)15°С. Флаконы закрывают пробками и колпачками в токе сухого стерильного азота и хранят при температуре не выше 5°С, не допуская замораживания.
Влажность композиции: 2,4%, время растворения в 20 мл воды д/и не превышает 1 мин. Содержание этил-2-(2-(1-метилгуанидино)ацетамидо)-ацетата фосфата во флаконе: 500 мг, стрептокиназы: 50000 ME.
Непосредственно перед проведением внутривенной (далее в/в) инфузий, содержимое флакона растворяют в 80 мл физраствора.
Пример 12. Получение лиофилизованного порошка для приготовления растворов для инфузий, содержащего этил-2-(2-(1-метилгуанидино)ацетамидо)-ацетата фосфат
и стрептокиназу (вариант 2).
10 г этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фосфата и 6 г аргинина гидрохлорида, растворяют в токе азота в 170 мл воды, доводят pH до 6,8, прибавляя калия фосфата 20% раствор, вводят 4 г альбумина и растворяют при слабом перемешивании, прибавляют 2,6 мл (2500000 ME) раствора стрептокиназы (Kraeber &Со GMBH), растворяют в токе азота при слабом перемешивании, доводят объем до 200 мл. Раствор подвергают стерильной фильтрации, разливают по 20 мл в стерильные флаконы, лиофильно высушивают в вакууме при температуре от (-)20 до (+)15°С. Флаконы закрывают пробками и колпачками в токе сухого стерильного азота, хранят при температуре не выше 5°С, не допуская замораживания.
Влажность композиции: 3,2%, время растворения в 20 мл воды д/и не превышает 1 мин. Содержание этил-2-(2-(1-метилгуанидино)ацетамидо)-ацетата фосфата во флаконе: 1000 мг, стрептокиназы: 250000 ME.
Непосредственно перед проведением в/в инфузий, содержимое флакона растворяют в 50 мл физраствора.
Пример 13. Получение лиофилизованного порошка для приготовления растворов для инфузий, содержащего этил-2-(2-(1-метилгуанидино)ацетамидо)-ацетата сукцинат
и стрептокиназу (вариант 2).
40 г этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата сукцинат растворяют в токе азота в 350 мл воды, прибавляют и растворяют в токе азота при слабом перемешивании 20 г альбумина, 5,3 мл (5000000 ME) раствора стрептокиназы (Kraeber &Со GMBH), доводят объем до 400 мл. Раствор подвергают стерильной фильтрации, разливают по 20 мл в стерильные флаконы, лиофильно высушивают в вакууме при температуре от (-)20 до (+)20°С. Флаконы закрывают пробками и колпачками в токе сухого стерильного азота, хранят при температуре не выше 5°С, не допуская замораживания.
Влажность композиции - 2,3%, время растворения в 20 мл воды д/и не превышает 1 мин. Содержание этил-2-(2-(1-метилгуанидино)ацетамидо)-ацетата сукцината во флаконе: 2000 мг, стрептокиназы: 250000 МЕ.
Непосредственно перед проведением в/в инфузий, содержимое флакона растворяют в 90 мл физраствора.
Пример 14. Получение лиофилизованного порошка для приготовления растворов для инфузий, содержащего этил-2-(2-(1-метилгуанидино)ацетамидо)-ацетата фосфат и урокиназу (вариант 2).
1 г этил-2-(2-(1-метилгуанидино)ацетамидо) ацетата сукцината растворяют в токе азота в 350 мл воды, растворяют в токе азота при слабом перемешивании 4 г маннитола, 5 г альбумина, 10,4 мл (10000000 ME) раствора урокиназы (Kraeber&CoGMBH), доводят объем до 400 мл. Раствор подвергают стерильной фильтрации, разливают по 20 мл в стерильные флаконы, далее лиофильно высушивают в вакууме при температуре от (-)35 до (+)25°С. Флаконы закрывают пробками и колпачками в токе сухого стерильного азота, хранят при температуре не выше 5°С, не допуская замораживания.
Влажность композиции:2,9%, время растворения в 10 мл воды д/и не превышает 1 мин. Содержание этил-2-(2-(1-метилгуанидино)ацетамидо) ацетата фосфата во флаконе: 50 мг, урокиназы: 500000 ME.
Непосредственно перед проведением в/в инфузий, содержимое флакона растворяют в 30 мл воды для инъекций.
Пример 15. Получение лиофилизованного порошка для приготовления растворов для инфузий, содержащего этил-2-(2-(1-метилгуанидино)ацетамидо)-ацетата фумарат и урокиназу (вариант 2).
10 г этил-2-(2-(1-метилгуанидино)ацетамидо) ацетата фумарата растворяют в токе азота в 150 мл воды, прибавляют и растворяют в токе азота при слабом перемешивании 2 г маннитола, 4 г альбумина, 5,2 мл (5000000 ME) раствора урокиназы (Kraeber & CoGMBH), доводят объем до 200 мл. Раствор подвергают стерильной фильтрации, разливают по 20 мл в стерильные флаконы, лиофильно высушивают в вакууме при температуре от (-)30 до (+)20°С. Флаконы закрывают пробками и колпачками в токе сухого стерильного азота, хранят при температуре не выше 5°С, не допуская замораживания.
Влажность композиции:2,9%, время растворения в 20 мл воды д/и не превышает 1 мин. Содержание этил-2-(2-(1-метилгуанидино)ацетамидо)-ацетата фумарата во флаконе: 1000 мг, урокиназы: 500000 ME.
Непосредственно перед проведением в/в инфузий, содержимое флакона разводят в 40 воды, далее смешивают со 150 мл физраствора.
Пример 16. Получение лиофилизованного порошка для приготовления растворов для инфузий или инъекций, содержащего комплекс этил-2-(2-(1-метилгуанидино)ацетамидо) ацетата фумарат и маннитола (вариант 3).
250 г этил-2-(2-(1-метилгуанидино)ацетамидо) ацетата фумарат и 100 г маннитола растворяют в токе азота в 5 л воды, раствор подвергают стерильной фильтрации, разливают в стерильные флаконы по 5 мл, лиофильно высушивают в вакууме при температуре от (-)45 до (+)20°С. Флаконы закрывают пробками и колпачками в токе сухого стерильного воздуха, хранят при температуре не выше 25°С, не допуская замораживания.
Влажность композиции: 0,5%, время растворения в 10 мл воды д/и не превышает 1 мин. Содержание активного вещества во флаконе: 250 мг.
Непосредственно перед проведением в/в инъекции содержимое флакона растворяют в 10 мл воды д/и, при проведении в/в инфузий этот же раствор смешивают с 50 мл маннитола раствора для инфузий 15%.
Пример 17. Получение лиофилизованного порошка для приготовления растворов для инфузий или инъекций, содержащего комплекс этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата сукцината
с маннитолом (вариант 3).
20 г аргинина растворяют в 10 л воды, прибавляя около 5,7 г кислоты янтарной (до pH 6,0), далее прибавляют 250 г этил-2-(2-(1-метилгуанидино)-ацетамидо)ацетата сукцината, 100 г маннитола, 125 г альбумина, растворяют в токе азота при медленном перемешивании. Раствор подвергают стерильной фильтрации, разливают во флаконы по 5 мл, лиофильно высушивают в вакууме при температуре от (-)50 до (+)20°С. Флаконы закрывают пробками и колпачками в токе сухого стерильного азота и хранят при температуре не выше 25°С, не допуская замораживания.
Влажность композиции: 0,7%, время растворения в 10 мл воды для инъекций не превышает 1 мин. Содержание этил-2-(2-(1-метилгуанидино)-ацетамидо)ацетата сукцината во флаконе: 125 мг.
Непосредственно перед проведением в/в инфузий, содержимое флакона растворяют в 5 мл воды д/и, раствор смешивают со 100 мл раствора аминокислот для парентерального питания.
Непосредственно перед проведением инъекции, содержимое флакона растворяют в 10 мл 5%-ного раствора глюкозы.
Пример 18. Получение лиофилизованного порошка для приготовления растворов для инфузий, содержащего комплекс этил-2-(2-(1-метилгуанидино)-ацетамидо)ацетата фумарата
с маннитолом (вариант 3).
20 г этил-2-(2-(1-метилгуанидино)ацетамидо)ацетата фумарата и 20 г маннитола растворяют в 400 мл воды в токе азота и при слабом перемешивании, раствор подвергают стерильной фильтрации, разливают в стерильные флаконы по 20 мл, лиофильно высушивают в вакууме при температуре от (-)45 до (+)28°С. Флаконы закрывают пробками и колпачками в токе сухого стерильного азота и хранят при температуре не выше 25°С, не допуская замораживания.
Влажность композиции: 1,8%, время растворения в 40 мл воды д/и не превышает 2 мин. Содержание активного вещества во флаконе: 1000 мг.
Непосредственно перед использованием, содержимое флакона растворяют в 40 мл воды д/и, раствор смешивают со 150 мл физраствора и вводят в/в инфузионно.
Пример 19. Получение лиофилизованного порошка для приготовления растворов для инфузий, содержащего комплекс этил-2-(2-(1-метилгуанидино)-ацетамидо)ацетата фосфата
с маннитолом