Способ индукции гибели опухолевых клеток
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для индукции гибели опухолевых клеток в эксперименте. Для этого опухолевые клетки линий НСТ116, Jurkat, U937 подвергают одновременной комбинированной обработке рекомбинантным препаратом DR5-B и бортезомибом в количестве 0,1 нМ. При этом DR5-B используют в концентрации, при которой полумаксимальная эффективная концентрация препарата DR5-B составляет 0,33±0,08 нг/мл для линии клеток НСТ116, 0,06±0,01 нг/мл для линии клеток Jurkat и 0,09±0,02 нг/мл для линии U937. Изобретение обеспечивает преодоление устойчивости опухолевых клеточных линий к TRAIL DR5-B в эксперименте. 1 з.п. ф-лы, 6 ил., 5 табл., 3 пр.
Реферат
Область техники
Изобретение относится к области клеточной и молекулярной биологии, конкретно к преодолению устойчивости опухолевых линий клеток человека к цитокину TRAIL с помощью DR5-специфического варианта TRAIL человека. Способ может быть использован как перспективная стратегия лечения злокачественных неоплазий и в качестве средства для исследования механизмов устойчивости клеток опухолевых линий различного происхождения к цитокину TRAIL.
Уровень техники
Цитокин TRAIL (TNF-related apoptosis-inducing ligand, Apo2L, TNFSF10) является одним из членов семейства фактора некроза опухоли TNF (tumor necrosis factor). Как и другие члены семейства TNF, TRAIL играет важную роль в наблюдении за опухолями, антивирусном ответе и участвует в подавлении аутоиммунных заболеваний.
Однако главным отличительным свойством TRAIL является то, что этот цитокин способен селективно вызывать апоптоз по внешнему, рецептор-зависимому механизму, в злокачественно трансформированных клетках без проявления цитотоксичности по отношению к нормальным клеткам.
TRAIL проявляет апоптотическую активность в трехмерной форме, мономером данного цитокина является трансмембранный белок II типа, состоящий из 281 аминокислотного остатка. Внеклеточный домен TRAIL (аминокислоты с 114 по 281) в организме человека может быть отщеплен металлопротеазой 7 с сохранением апоптоз-индуцирующей активности.
Рекомбинантные препараты внеклеточного домена TRAIL с нативной вторичной структурой, без аффинных последовательностей и N-концевых аминокислот, индуцируют апоптоз в широком спектре линий опухолевых клеток и первичных опухолях, не вызывая гибели нормальных клеточных линий и первичных тканей. Рекомбинантные препараты TRAIL показали высокую противоопухолевую эффективность в экспериментах на мышах с привитыми человеческими опухолями. Селективность апоптоз-индуцирующей активности подтверждается в клинических исследованиях.
TRAIL имеет 5 рецепторов: мембранные DR4, DR5, DcR1, DcR2 и растворимый остеопротегерин (OPG). Рецепторы DR4 и DR5 (рецепторы смерти, англ. death receptors) способны проводить сигнал апоптоза в опухолевую клетку. Рецепторы DcR1 и DcR2 (так называемые рецепторы-ловушки, англ decoy receptors) конкурируют с рецепторами смерти за связывание с TRAIL либо активируют в клетке антиапоптотические механизмы. Именно взаимодействие TRAIL с рецепторами-ловушками является одной из причин устойчивости опухолевых клеток к цитокину. Остеопротегерин (OPG) является растворимым рецептором-ловушкой TRAIL, активирующим белок NF-kB (RANKL), и способен взаимодействовать с молекулами лиганда в растворе. OPG скорее играет роль в подавлении остеокластогенеза, но не в регуляции TRAIL-опосредованного апоптоза, так как взаимодействие TRAIL-OPG при физиологических условиях достаточно слабо [Almasan A, Ashkenazi A. Apo2L/TRAIL: apoptosis signaling, biology, and potential for cancer therapy // Cytokine Growth Factor Rev. 2005. Vol. 14, pp. 337-348].
Исследования биологической активности TRAIL показали, что примерно половина опухолевых клеточных линий человека и первичных опухолей нечувствительна к TRAIL [Ashkenazi A, Pai RC, Fong S, Leung S, Lawrence DA et al. Safety and antitumor activity of recombinant soluble Apo2 ligand // J. Clin. Invest. 1999. Vol. 104, pp. 155-162]. К сегодняшнему дню разработано множество способов преодоления устойчивости опухолевых линий к рекомбинантным препаратам TRAIL дикого типа за счет комбинированной обработки клеточных линий препаратами TRAIL и химиотерапевтическими реагентами [Sayers TJ, Murphy WJ. Combining proteasome inhibition with TNF-related apoptosis-inducing ligand (Apo2L/TRAIL) for cancer therapy // Cancer Immunol. Immunother. 2006. Vol. 55, pp. 76-84., Shenoy K, Wu Y, Pervaiz S. LY303511 enhances TRAIL sensitivity of SHEP-1 neuroblastoma cells via hydrogen peroxide-mediated mitogen-activated protein kinase activation and up-regulation of death receptors // Cancer Res. 2009. Vol. 69, pp. 1941-1950 и др.]. Однако дикий тип TRAIL связывается и с рецепторами смерти, и с рецепторами-ловушками с примерно одинаковой аффинностью, что может снизить эффективность индукции апоптоза цитокином.
Ранее было показано, что апоптоз-индуцирующий сигнал во многих опухолевых клетках проводится в основном за счет взаимодействия TRAIL преимущественно с одним из рецепторов смерти. В большинстве типов опухолей, особенно солидных, проведение апоптотического сигнала осуществляется в основном при взаимодействии TRAIL с рецептором смерти DR5. В связи с этим, для преодоления устойчивости клеточных линий к TRAIL, наибольший интерес представляет увеличение специфичности TRAIL по отношению к рецептору DR5.
Были разработаны несколько агонистических антител к рецептору DR5 и рекомбинантных мутантных вариантов TRAIL, с повышенной специфичностью к DR5 рецептору. Однако агонистические антитела к рецептору DR5 имеют ряд существенных недостатков: отсутствие тримеризации, необходимость использования дополнительных сшивающих агентов для проявления апоптотической активности и большая себестоимость наработки. Поэтому использование DR5-специфических мутантных вариантов имеет большую перспективу в качестве стратегии для преодоления устойчивости опухолевых клеток к TRAIL.
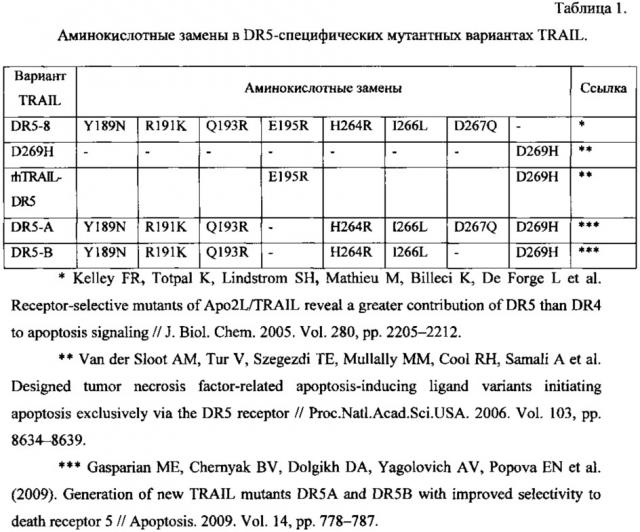
К сегодняшнему дню получено несколько DR5-специфических мутантных вариантов TRAIL: DR5-8, D269H, rhTRAIL-DR5, DR5-A и DR5-B. Аминокислотные замены в них приведены в таблице 1.
Для рецептор-селективного варианта TRAIL rhTRAIL-DR5 также предложена стратегия усиления апоптоз-индуцирующей активности в клетках карциномы яичника с помощью микромолярных концентраций цисплатина [Duiker EW, de Vries EG, Mahalingam D, Meersma GJ, Boersma-van Ek W et al. Enhanced antitumor efficacy of a DR5-specific TRAIL variant over recombinant human TRAIL in a bioluminescent ovarian cancer xenograft model // Clin. Cancer Res. 2009. Vol. 15, pp. 2048-2057]. Но все существующие на данный момент DR5-селективные варианты TRAIL, кроме DR5-B, взаимодействуют либо с рецептором DR4 (D269H), либо с DcR2 (DR5-8), причем аффинность этих вариантов TRAIL к рецепторам, хоть и снижена в разы, но довольно высока (см. таблицу 2 из Gasparian ME, Chernyak BV, Dolgikh DA, Yagolovich AV, Popova EN et al. (2009). Generation of new TRAIL mutants DR5A and DR5B with improved selectivity to death receptor 5 // Apoptosis. 2009. Vol. 14, pp. 778-787).
DR5-специфический мутантный вариант TRAIL DR5-B уникален тем, что не связывается с рецептором смерти DR4 и рецептором-ловушкой DcR1 и тем, что его аффинность к рецепторам DcR2 и OPG снижена по сравнению с таковой у других вариантов TRAIL не в разы, а более чем в 280 и 223 раза соответственно (см. таблицу 2). Ранее был запатентован способ получения рекомбинантного препарата DR5-специфического мутантного варианта цитокина TRAIL DR5-B [патент RU №2405038 от 27.11.2010 г.].
Было показано, что DR5-B обладает большей активностью, чем TRAIL дикого типа на DR5-зависимой TRAIL-чувствительной линии Т-клеточной лейкемии Jurkat. Кроме того, противоопухолевая активность рекомбинантного препарата DR5-B на TRAIL-устойчивых линиях клеток HeLa и U937 была также хорошо выражена. Чувствительность клеток к DR5-B могла быть увеличена при одновременной обработке клеток химиотерапевтическими реагентами. Более того, показано, что многие химиотерапевтические агенты вызывают увеличение экспрессии рецептора смерти DR5 на поверхности опухолевых клеток. Таким образом, DR5-B может быть использован при преодолении устойчивости к TRAIL не только DR5, но и изначально DR4-чувствительных клеток.
Наиболее близким к заявляемому является способ обработки опухолевых клеток линий Jurkat, НСТ116, А549, U937, НТ29 и MCF-7 препаратом DR5-B и химиотерапевтическими реагентами доксорубицином, паклитакселом и бортезомибом в количестве 1-100 нМ для преодоления устойчивости опухолевых клеток к цитокину TRAIL дикого типа (BYCHKOV М. Et al., 2013).
Однако остается актуальным поиск эффективных количеств химиотерапевтических препаратов, использующихся для индукции гибели опухолевых клеток, которые при сохранении противоопухолевой активности оказывали бы минимальное токсическое действие на нормальные ткани организма.
Раскрытие изобретения
Заявленное изобретение решает задачу индукции гибели опухолевых клеток, а именно к способу преодоления резистентности опухолевых клеток к цитокину TRAIL дикого типа за счет комбинирования двух подходов: индукции в опухолевых клетках апоптоза при активации DR5 рецептора с помощью рекомбинантного препарата DR5-B, и усиления апоптотической активности рекомбинантного препарата DR5-B с помощью химиотерапевтических реагентов.
Задача преодоления резистентности опухолевых линий к TRAIL решается за счет индукции DR5-опосредованного апоптоза при одновременной комбинированной обработке опухолевых клеток линий НСТ116, Jurkat, U937 в эксперименте рекомбинантным препаратом DR5-B и бортезомибом в количестве 0,1 нМ.
Предпочтительно использовать DR5-B в концентрации, при которой полумаксимальная эффективная концентрация препарата DR5-B составляет 0,33±0,08 нг/мл для линии клеток НСТ116, 0,06±0,01 нг/мл для линии клеток Jurkat и 0,09±0,02 нг/мл для линии U937.
Изобретение тестировалось на 12 линиях опухолевых клеток: аденокарциномы легкого А549, Т-лимфобластной лейкемии Jurkat, гепатоклеточной карциномы HepG2, колоректальных карцином НТ29 и НСТ116, аденокарцином молочной железы MCF-7, MDA-MB-231 и SKBR-3, моноцитарной лейкемии U937, глиобластомы U251 MG, карциномы простаты Du145, а также аденокарциномы яичника SKOV3. Токсичность рекомбинантного препарата DR5-B проверяли на клетках эндотелия пупочной вены человека (HUVEC) и фибробластах крайней плоти (HFF). Клетки А549, Du145, НСТ116, MDA-MB-231, U251 MG, культивировали в питательной среде DMEM с добавлением 10% (по объему) эмбриональной бычьей сыворотки и 2 мМ глутамина. Клетки SKBR-3 и SKOV3 культивировали в среде McCoy 5А с добавлением 10% (по объему) эмбриональной бычьей сыворотки. Опухолевые линии Jurkat, HepG2, НТ29 и U937 культивировали в среде RPMI1640 с добавлением 5% эмбриональной бычьей сыворотки. Для культивации клеток HepG2 к среде RPMI1640 добавляли аминокислоты. Линию карциномы молочной железы MCF-7 культивировали в среде ЕМЕМ с добавлением 10 мкг/мл рекомбинантного человеческого инсулина и 10% (по объему) эмбриональной бычьей сыворотки. Нормальные фибробласты крайней плоти (HFF) культивировали в среде DMEM с добавлением 10% (по объему) эмбриональной бычьей сыворотки. Клетки эндотелия HUVEC культивировали в среде DMEM/F12 с добавлением 15% эмбриональной бычьей сыворотки, 5 нг/мл рекомбинантного основного фактора роста фибробластов (FGF-2) человека, 20 нг/мл рекомбинантного фактора роста эндотелия сосудов (VEGF) человека, 1% аминокислот, 2 мМ L-глутамина, 50 ЕД/мл пенициллина и 50 нг/мл стрептомицина. Все клеточные линии культивировали в культуральных флаконах объемом 75 мл3 (для суспензионных линий клеток Jurkat и U937 использовали необработанные флаконы, для адгезионных клеточных линий - обработанные культуральные флаконы).
Уровень экспрессии рецепторов TRAIL на поверхности опухолевых клеточных линий определяли с помощью проточной цитофлуориметрии. Клетки снимались с культуральных флаконов с помощью 0,05% раствора трипсина-ЭДТА, после чего дважды промывались холодным фосфатно-солевым буфером (ФСБ) и перемешивались. Затем клетки разливали по 5-мл пробиркам (35×103 клеток на одну пробу). К суспензии клеток добавляли FITC-конъюгированные антитела к рецепторам TRAIL - DR4, DR5, DcR1 и DcR2 или антитела изотипического контроля и инкубировали в течение 1 ч при +4°С. Несвязавшиеся антитела дважды отмывали холодным ФСБ, и клетки переносили в FACS-буфер (ФСБ с добавлением 1 мкМ иодида пропидия). Пробы анализировали на проточном цитофлуориметре FACScan («Beckton Dickinson», США). Для анализа полученных данных использовали программу WinMDI 2.9.
Определяли жизнеспособность клеток с помощью МТТ-теста. За 24 часа до определения жизнеспособности адгезионные клетки адсорбировали в лунки 96 луночного обработанного культурального планшета из расчета 104 клеток на лунку. Затем, клетки отмывали от среды и к ним добавляли разведения рекомбинантных препаратов TRAIL либо DR5-B, а также химиотерапевтических реагентов в соответствующей культуральной среде без содержания эмбриональной бычьей сыворотки. После этого, клетки инкубировали в течение 24 ч. Суспензионные клетки U937 и Jurkat осаждали при 900 об/мин в течение 5 мин, суспендировали в среде без сыворотки и наносили на необработанный культуральный планшет в расчете 5×104 клеток на лунку. К клеткам добавляли препараты TRAIL и химиопрепараты, разбавленные в питательной среде без сыворотки. Спустя 24 ч к клеткам добавляли МТТ (конечная концентрация составляет 0,5 мг/мл) и инкубировали в течение 4 ч. После инкубации, содержимое планшетов осаждали в течение 5 мин при 3000 об/мин. Супернатанты удаляли и растворяли образовавшиеся при восстановлении МТТ кристаллы формазана в ДМСО. Жизнеспособность клеток определяли по оптической плотности содержимого лунок, которую детектировали с помощью планшетного спектрофотометра Bio-Rad 680 («Bio-Rad», США) при длине волны 540 нм с вычитанием фона при 655 нм. Апоптотический характер гибели клеток подтверждали по изучению морфологии клеточных ядер при окрашивании красителями Хехст 33342 и иодидом пропидия. Флуоресцентная микроскопия проводилась с помощью микроскопа Nikon Eclipse T100f.
Статистическая обработка данных проводилась с помощью программы Microsoft Office Excel 2013. Все эксперименты повторяли не менее трех раз. Полумаксимальные эффективные концентрации (ЭК50) препаратов TRAIL и DR5-B рассчитывали с помощью программы GraphPad Prism 6.
Техническим результатом заявленного изобретения является разработка нового способа индукции гибели опухолевых клеток. Способ сочетает в себе два подхода: индукцию в опухолевых клетках DR5-опосредованного апоптоза с помощью DR5-специфического мутантного варианта цитокина TRAIL, и увеличение апоптоз-индуцирующей активности DR5-B с помощью химиотерапевтических реагентов. Первый подход позволяет преодолеть устойчивость DR5-зависимых опухолевых линий к TRAIL, а второй подход способствует сенсибилизации DR4-зависимых клеток к DR5-опосредованному апоптозу. Данный способ может быть использован для преодоления устойчивости опухолевых клеточных линий к TRAIL в клеточных и преклинических моделях, а также для изучения механизмов устойчивости клеток к TRAIL.
Способ может быть использован как перспективная стратегия лечения злокачественных неоплазий. Перспективность способа заключается в том, что позволяет использовать указанные химиотерапевтические реагенты в сниженных дозировках, что, в свою очередь, приводит к снижению их токсического действия на нормальные клетки и ткани организма и синергическому взаимодействию препаратов при индукции гибели клеток злокачественных неоплазий. В перспективе - для создания комбинированного препарата. Концентрации рекомбинантного препарата DR5-специфического варианта TRAIL DR5-B и химиотерапевтического реагента подбираются в зависимости от типа опухоли, и их соотношение может варьировать в зависимости от чувствительности клеток к препаратам.
Краткое описание чертежей
Изобретение иллюстрируют рисунки:
Рисунок 1. Экспрессия рецепторов смерти и ловушек TRAIL на поверхности опухолевых клеток. Клетки инкубировали с FITC-конъюгированными антителами к мембранным рецепторам TRAIL и уровень экспрессии рецепторов определяли с помощью проточной цитофлуориметрии. Значения представлены как средние ± среднеквадратичное отклонение (n=3).
Рисунок 2. Цитотоксичность TRAIL и DR5-B на различных опухолевых клетках. Клетки инкубировали с TRAIL или DR5-B в течение 24 часов и жизнеспособность определяли с помощью МТТ теста. Значения представлены как средние ± среднеквадратичное отклонение (n=3).
Рисунок 3. Эффект доксорубицина на TRAIL или DR5-B опосредованную гибель опухолевых клеток. Клетки инкубировали в течение 24 часов с указанными количествами TRAIL или DR5-B и доксорубицином (Jurkat - 0,1 нМ, U937 - 1 нМ, MCF-7, НТ29, НСТ116, SKBR-3, А549 и MDA-MB-231 - 100 нМ, Du145 и SKOV3 - 500 нМ, HepG2 - 1 μM и U251 MG - 2 μМ) и жизнеспособность клеток оценивали с помощью МТТ теста. Значения представлены как средние ± среднеквадратичное отклонение (n=3).
Рисунок 4. Влияние паклитаксела на TRAIL или DR5-B индуцируемый гибель клеток. Указанные раковые клетки инкубировали с указанными количествами вариантов TRAIL и паклитакселом (Jurkat - 0,1 нМ, U937 - 1 нМ, НСТ116 - 5 нМ, НТ29, SKBR-3 и SKOV3 - 10 нМ, MDA-MB-231 - 50 нМ, MCF-7 и А549 - 100 нМ, Du145 - 500 нМ, HepG2 - 1 μM и U251 MG - 10 μМ) в течение 24 часов и жизнеспособность клеток определяли при помощи МТТ-теста. Значения представлены как средние ± среднеквадратичное отклонение, (n=3).
Рисунок 5. Влияние бортезомиба на TRAIL или DR5-B индуцированную гибель опухолевых клеток. Клетки инкубировали в течение 24 часов с TRAIL или DR5-B и бортезомибом (НСТ116, Jurkat, U937 - 0,1 нМ, MDA-MB-231 - 25 нМ, SKBR-3, А549 и Du145 - 50 нМ, MCF-7, НТ29 и SKOV3 - 100 нМ, HepG2 и U251 MG - 500 нМ) и жизнеспособность клеток определяли с помощью МТТ. Значения представлены как средние ± среднеквадратичное отклонение (n=3).
Рисунок 6. DR5-B не проявляет цитотоксическую активность к нормальным клеткам человека. (А) Анализ экспрессии мембранных рецепторов цитокина TRAIL на поверхности фибробластов крайней плоти человека (HFF) и клеток эндотелия пупочной вены человека (HUVEC). Влияние препаратов TRAIL и DR5-B на жизнеспособность HFF (Б) и HUVEC (В). Клетки инкубировали с различными концентрациями препаратов TRAIL и DR5-B в течение 24 ч и их жизнеспособность определяли с помощью МТТ теста. Значения представлены как средние ± среднеквадратичное отклонение (n=3).
Осуществление изобретения
Изобретение иллюстрируют примеры:
Пример 1. Рекомбинантный препарат DR5-B проявляет большую цитотоксичность по сравнению с рекомбинантным препаратом TRAIL дикого на клетках с различным уровнем экспрессии рецепторов TRAIL.
Уровень экспрессии рецепторов TRAIL на поверхности опухолевых клеток Jurkat, U937, MCF-7, НТ29, НСТ116, SKBR-3, А549 и MDA-MB-231, Du145, SKOV3, HepG2 и U251 MG исследовали с помощью метода проточной цитофлуориметрии. Клетки ингибирования с антителами к рецепторам TRAIL, мечеными FITC, либо с антителами изотипического контроля и экспрессия рецепторов на клеточной мембране определялась с помощью цитометра FACScan (рис. 1).
Клеточные линии экспрессируют различное количество рецепторов TRAIL, однако прямой корреляции между чувствительностью раковых клеток к TRAIL и количеством рецепторов смерти не было зафиксировано. Во всех исследованных линиях клеток уровень экспрессии рецепторов ловушек был сравнительно невелик по сравнению с рецепторами смерти (2-11% DcR1 и 6-19% DcR2 от совокупной экспрессии рецепторов). Исключение составили клетки А549 (DcR2 30%) и MDA-MB-231 (DcR1 35,5%), в которых количество рецепторов ловушек было достаточно высоко (рис. 1).
Далее анализировали влияние различных концентраций рекомбинантных препаратов TRAIL и DR5-B на жизнеспособность клеточных линий Jurkat, U937, MCF-7, НТ29, НСТ116, SKBR-3, А549 и MDA-MB-231, Du145, SKOV3, HepG2 и U251 MG (рис. 2). Клетки опухолевых линий инкубировали с препаратами TRAIL в течение 24 часов и определяли их жизнеспособность с помощью МТТ-теста. Анализ результатов исследований показал, что:
1. Половина из 12 проанализированных линий нечувствительны к TRAIL дикого типа (гибель клеток менее 20%).
2. На девяти из двенадцати линий (MCF-7, НТ29, НСТ116, HepG2, Jurkat, U937, А549, SKBR-3 и U251 MG) препарат DR5-B вызывал гибель клеток более эффективно по сравнению с TRAIL дикого типа (рис. 2, табл. 3).
3. Цитотоксичность препаратов TRAIL и DR5-B на трех линиях клеток, в основном (но не полностью) проводящих сигнал к апоптозу через DR4 рецептор (Du145, SKOV3 и MDA-MB-231), практически не отличалась.
Результаты примера показывают, что рекомбинантный препарат DR5-B превосходит препарат цитокина дикого типа в эффективности индукции апоптоза.
Пример 2. Химиопрепараты доксорубицин, таксол и бортезомиб в большей мере усиливают DR5-B опосредованный апоптоз, по сравнению с TRAIL-индуцированным.
Анализ влияния на жизнеспособность клеточных линий Jurkat, U937, MCF-7, НТ29, НСТ116, SKBR-3, А549 и MDA-MB-231, Du145, SKOV3, HepG2 и U251 MG комбинированного воздействия рекомбинантных препаратов TRAIL и DR5-B и химиотерапевтических реагентов доксорубицина, бортезомиба и таксола проходил по следующей схеме. Подбор концентраций химиопрепаратов для совместной инкубации осуществлялся исходя из их цитотоксичности на клетки. Гибель клеток под действием химиопрепаратов не превышала 30% клеток. После подбора концентраций клетки инкубировали с доксорубицином (рис. 3), паклитакселом (рис. 4) и бортезомибом (рис. 5) в течение 24 часов, после чего их жизнеспособность определялась с помощью МТТ-теста.
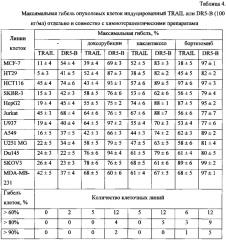
Результаты показали, что доксорубицин, паклитаксел и бортезомиб усиливают как TRAIL, так и DR5-B индуцированную гибель клеток, но для большинства клеток этот эффект был более сильно выражен для DR5-B (рис. 3-5). При совместном воздействии химиопрепаратов с DR5-B гибель клеток всех линий превышает 60%, тогда как в случае TRAIL менее половины комбинаций (16 из 36) показали такой результат (табл. 4).
При совместном воздействии доксорубицина или паклитаксела с TRAIL, ни в одной линии не наблюдалась гибель более 80% клеток, тогда как в случае с DR5-B этот барьер преодолевается в пяти линиях. Из трех протестированных химиопрепаратов бортезомиб наиболее эффективно усиливает гибель клеток, вызванную обоими препаратами TRAIL, однако этот сенсибилизирующий эффект сильнее выражается с DR5-В. Так, DR5-B совместно с бортезомибом вызывает гибель свыше 70% клеток во всех клеточных линиях, а для TRAIL-чувствительных линий НСТ116 и MDA-MB-231, равно как и для TRAIL-устойчивых линий клеток MCF-7, HepG2 и SKOV3 наблюдалась гибель более 90% клеток. В то же время TRAIL дикого типа совместно с бортезомибом вызывала гибель 70% клеток только в трех линиях, а на 90% погибли только TRAIL-чувствительные клетки линии НСТ116 (табл. 4).
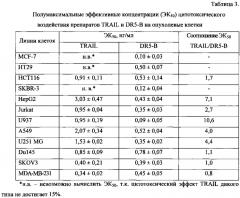
Полумаксимальные эффективные концентрации (ЭК50) препарата DR5-B на девяти клеточных линиях примерно в 2 -10 раз ниже по сравнению с TRAIL (табл. 3).
Все три протестированные химиопрепарата (доксорубицин, паклитаксел и бортезомиб) значительно снизили значения ЭК50 обоих форм TRAIL (табл. 5), но DR5-B при совместном применении с химиопрепаратами остается в 1,5-10 раз эффективнее, чем TRAIL для большинства клеточных линий. ЭК50 для DR5-B совместно с доксорубицином и паклитакселом составляла менее 0,35 нг/мл и 0,25 нг/мл соответственно для всех клеточных линий. Такие значения ЭК50 для TRAIL дикого типа достигались лишь на четырех линиях с доксорубицином и на шести линиях с паклитакселом. Эффективнее всего цитотоксичность обоих форм TRAIL усиливает бортезомиб. При совместной инкубации с бортезомибом значения ЭК50 для DR5-B снижались несколько раз (менее 0,1 нг/мл у десяти линий), тогда как для TRAIL дикого типа это происходило лишь на линии SKOV3.
Результаты показывают, что доксорубицин, таксол и бортезомиб в большей мере усиливают DR5-B индуцированную гибель клеток, чем с TRAIL-индуцированный апоптоз.
Пример 3. Рекомбинантный препарат DR5-B не проявляет токсичность по отношению к нормальным клеткам.
Уровень экспрессии рецепторов TRAIL на поверхности клеток эндотелия HUVEC и фибробластов крайней плоти человека HFF исследовали с помощью метода проточной цитофлуориметрии. Клетки инкубировали с антителами к рецепторам TRAIL, мечеными FITC, либо с антителами изотипического контроля и экспрессия рецепторов на клеточной мембране определяли с помощью цитометра FACScan (рис. 6 (А)). Результаты исследования показали, что нормальные клетки, в отличие от опухолевых, экспрессируют меньшие количества как рецепторов смерти TRAIL, так и рецепторов-ловушек цитокина.
Влияние препаратов TRAIL и DR5-B на жизнеспособность HFF и HUVEC анализировали с помощью МТТ-теста после 24-часовой инкубации клеток с рекомбинантными препаратами TRAIL дикого типа и DR5-B (рис. 6 (Б) и (В)). Клетки инкубировали с различными концентрациями препаратов TRAIL и DR5-B в течение 24 ч и их жизнеспособность определяли с помощью МТТ теста. Результаты исследования показали, что рекомбинантные препараты TRAIL и его DR5-специфического мутантного варианта DR5-B являются нетоксичными для нормальных клеток в концентрациях до 10 мкг/мл, что в 100 раз превышает максимальную токсическую концентрацию препаратов на 12 опухолевых линиях клеток различной природы.
Пример 3 показывает, что рекомбинантный препарат DR5-специфического варианта TRAIL DR5-B является нетоксичным по отношению к нормальным клеткам и может быть изучен в преклинических моделях как селективное и высокоактивное противоопухолевое средство.
1. Способ индукции гибели опухолевых клеток линий НСТ116, Jurkat, U937 в эксперименте, заключающийся в одновременной комбинированной обработке опухолевых клеток рекомбинантным препаратом DR5-B и бортезомибом в количестве 0,1 нМ.
2. Способ по п. 1, заключающийся в том, что DR5-B используют в концентрации, при которой полумаксимальная эффективная концентрация препарата DR5-B составляет 0,33±0,08 нг/мл для линии клеток НСТ116, 0,06±0,01 нг/мл для линии клеток Jurkat и 0,09±0,02 нг/мл для линии U937.