Метод спектрофотометрического определения фторид-иона в природных объектах и сточных водах
Иллюстрации
Показать всеИзобретение относится к высокочувствительному, селективному, экспрессному методу количественного спектрофотометрического определения фторид-иона в природных объектах и сточных водах. Для определения фторид-иона применен хромогенный комплекс цирконин - цирконий, взаимодействующий с фторид-ионом по новой аналитической реакции: (C15H12N2O8S)2Zr+3HF+Н+=[ZrF3]++2C15H14N2O8S, в соответствии с которой к анализируемому образцу прибавляют комплекс цирконина с Zr, измеряют оптическую плотность полученного раствора при длине волны 610 нм относительно раствора сравнения, не содержащего фторид-ион, и определяют концентрацию фторид-иона в пробе по градуировочному графику. Метод имеет чувствительность 0,02 мг/дм3, повышенную избирательность в присутствии сульфат-, фосфат-, нитрат- и хлорид-ионов, Al(III), Fe(III), и занимает не более 1 минуты. 1 ил., 8 табл., 8 пр.
Реферат
Изобретение относится к области аналитического спектрофотометрического определения фторид-иона в природных объектах и сточных водах и может быть использовано в области анализа поверхностных вод суши, морской воды, минералов, конденсатов вулканических газов, талой воды, растворов, полученных при отборах проб воздуха, биологических пробах, извлеченных из растений и животных, а также в областях науки и техники, связанных с необходимостью экспрессного, высокочувствительного и селективного определения фторид-иона в водных растворах.
Известно, что для спектрофотометрического определения фторид-иона достаточно часто применяются методы, основанные на разложении комплексов органических реагентов с металлами. Так, известен метод полевого спектрофотометрического определения фторид-иона, основанный на разложении комплекса Al(III) с хинализарином (aluminium quinalizarin reagent). Метод позволяет определять фторид-ион с чувствительностью 0,3 мг/дм3, время выполнения анализа составляет ≈2 мин.
Недостатком метода является его низкая селективность по отношению к сульфат-иону (100 мг/дм3 сульфат-иона вызывают погрешность 25% при определении 1 мг/л фторид-иона) [1].
Для определения фторид-иона применен комплекс Zr(IV) с метилтимоловым синим, адсорбированным на силикагеле [2]. Недостатком используемого реагента является низкая чувствительность определения фторид-иона (0,8 мг/дм3) и невысокая селективность по отношению к сульфат- и фосфат-ионам (1:10).
Описано применение для определения фторид-иона комплексов алюминия с трифенилметановыми красителями (хромазурол В, малахитовый зеленый) [3]. Недостатком обоих реагентов является невысокая чувствительность (0,3-0,5 мг/дм3) и невозможность достоверного определения фторид-иона в присутствии более чем 20 мг/дм3 нитрат и 100 мг/дм3 хлорид и сульфат-ионов. Известны методы, основанные на разрушении комплексов циркония с ксиленоловым оранжевым [4] и азокрасителем СПАДНС [5, 6]. Недостатками метода [4] является сравнительно низкая селективность к фосфат-иону (1:20), необходимость последовательного добавления соединения Zr(IV), реагента и раствора карбамида и выдерживание растворов в течение 10 минут. Недостатком методик, основанных на разрушении циркониевого комплекса СПАДНС, является их низкая селективность к фосфат и сульфат-ионам, а также Fe и Al. Таким образом, эти методы не могут использоваться в ряде задач определения фторид-иона в природных объектах, в том числе для мониторинга содержания фтора в сточных и природных водах с повышенным содержанием сульфат- и фосфат-иона.
Известно упоминание об использовании нерастворимого комплекса циркония с галлоцианином на носителе для получения тест-форм твердофазных реагентов для цветометрического определения [7]. Однако не приведены чувствительность, селективность, время развития окраски, влияние условий на определение фторидов.
Известно, что определение фторид-иона может быть также осуществлено потенциометрическим методом с чувствительностью 0,02 мг/дм3 [8], однако в интервале концентрации 0,02-0,2 мг/дм3 потенциал электрода устанавливается медленно (до 15 мин), электродная функция нелинейна и для получения надежных результатов требуется построение градуировочной зависимости по большому числу стандартных растворов. Таким образом, потенциометрическое определение фторид-иона не является экспрессным и требует точного контроля условий измерений и не подходит для многих целей, в том числе для полевого экологического анализа.
С высокой чувствительностью также может быть осуществлено определение фторид-иона спектрофлюориметрическими методами [9-10], однако спектрофлюориметрическое определение требует очень точного соблюдения условий выполнения реакции, спектрофлюориметры экономически существенно менее доступны, чем спектрофотометры, и цена одного определения фторид-иона оказывается значительно выше, чем для фотометрического метода.
Наиболее близким к заявляемому по технической сущности является метод, приведенный в ГОСТ [11], в котором используется комплекс циркония с ализариновым красным С. Недостатками методики является невозможность проведения анализа высокоминерализованных проб (>5 г/л), низкие чувствительность (0,5 мг/л) и экспрессность определения (необходимо выдерживание растворов в течение часа), проведению анализа мешают гидрокарбонат-ионы при содержании >400 мг/л и ионы железа при содержании >2 мг/л.
Задачей изобретения является разработка нового спектрофотометрического метода определения фторид-иона путем применения, ранее не исследованного для этих целей доступного реагента.
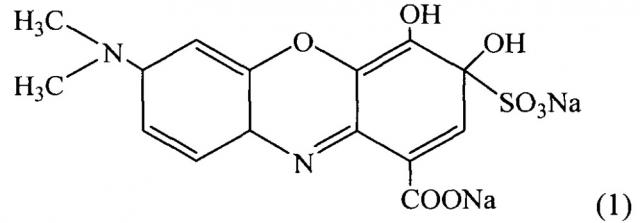
Техническим результатом, достигаемым при разработке заявляемого метода, является высокая чувствительность спектрофотометрического определения фторид-иона в природных объектах и сточных водах при его высоких селективности и экспрессности. Технический результат достигается применением для определения фторид-иона цирконина (7-(диметиламино)-3-гидрокси-4-оксо-3-сульфо-10H-феноксазин-1-карбоновая кислота; галлоцианин МС, CAS 27822-77-1), формулы 1:
Кроме того, технический результат достигается тем, что в заявляемом методе используется комплекс цирконина с Zr.
Авторам не известны методы спектрофотометрического определения фторид-иона с использованием комплексов цирконина с Zr. Кроме того, авторам не известны методы спектрофотометрического определения фторид-иона с использованием комплексов цирконина с Zr, которые при использовании в условиях проведения анализа обеспечивают указанный выше технический результат. Следовательно, заявляемое техническое решение удовлетворяет критерию «Новизна».
Заявляемый метод позволяет определять фторид-ион в водных растворах путем проведения оптических измерений непосредственно в жидкой фазе после добавления раствора реагента, т.к. реагент цирконии хорошо растворим в воде и в отличие от ализарина и галлоцианина образует с цирконием устойчивый в водных растворах комплекс, разложение которого в водной среде удобно отслеживается методом прямой спектрофотометрии водного раствора
(C15H12N2O8S)Zr+3HF+H+=[ZrF3]++2C15H14N2O8S
Заявляемые высокая чувствительность - 0,02 мг/дм3, экспрессность (одно определение занимает не более 1 минуты) и высокая селективность (в присутствии сульфат-, фосфат-, нитрат- и хлорид-ионов, Al(III), Fe(III) и др.) обеспечиваются исключительно индивидуальными свойствами комплекса цирконина с цирконием. Следовательно, предлагаемое техническое решение соответствует критерию "Уровень техники".
Заявляемый метод может найти применение для анализа поверхностных вод суши, морской воды, минералов, конденсатов вулканических газов, талой воды, растворов, полученных при отборах проб воздуха, биологических пробах, извлеченных из растений и животных, а также для контроля качества питьевой воды и т.д. Наиболее перспективно применение метода для аналитического определения фторид-иона в сточных водах предприятий. Следовательно, заявляемое техническое решение соответствует критерию «Промышленная применимость».
В общем случае аналитическое определение фторид-иона в водных растворах осуществляется без дополнительной пробоподготовки в соответствии с реакцией, представленной на схеме 1, хотя в некоторых случаях, при наличии большого количества примесей, в частности для почвенных растворов, может возникнуть необходимость пробоподготовки.
Цирконий - CAS 27822-77-1, известный коммерчески доступный реагент [12-14]. В качестве источника Zr может быть применена любая его растворимая соль или соль цирконила в средах кислотностью до 12 М по кислоте, предпочтительно, однако, применение доступного ZrOCl2⋅8H2O в 6 М HCl. Эффект взаимодействия фторид-ионов с комплексом циркония с цирконином наблюдается в широком диапазоне концентраций в растворе циркония, цирконина и кислоты и ограничивается, с одной стороны, только растворимостью этих соединений в воде и чувствительностью цветной реакции - с другой стороны. При проведении аналитического определения фторид-иона предпочтительным, но не ограничивающим является использование реактива состава: цирконии - 270 мг, ZrOCl2⋅8H2O - 36 мг, 6М HCl - 250 см3, вода - до 500 см3. Раствор устойчив при хранении не менее 10 месяцев без потери аналитических свойств.
Температура реакции может колебаться от -5°C до температуры +60°C, однако предпочтительно от +10°C до +25°C.
Реакцию можно проводить как при атмосферном, так и при повышенном или пониженном давлении, однако обычно работают при атмосферном давлении.
Заявляемый метод позволяет проводить аналитическое определение фторид-иона с чувствительностью 0,02 мг/дм3 и быстродействием (1 определение в минуту) в присутствии повышенных концентраций сульфат-, фосфат-, нитрат- и хлорид-ионов, Al(III), Fe(III) (табл. 1).
Сущность заявляемого способа поясняется примерами конкретного выполнения.
Пример 1. Получение комплекса цирконии Zr и градуировка для аналитического определения фторид-иона.
Для получение комплекса цирконии Zr в мерную колбу емкостью 500 см3 помещают 270 мг цирконина, 100 см3 дистиллированной воды, 10 см3 раствора Zr(IV) с концентрацией 1 мг/см3 в 6М HCl, 250 см3 6М HCl, перемешивают и разбавляют водой до объема 500 см3.
Для построения градуировочной зависимости в 5 мерных пробирок вместимостью 15 см3 помещают соответственно 0,1; 0,2; 0,3; 0,4; 0,5 см3 стандартного раствора фторид-иона с концентрацией 20 мг/дм3, разбавляют водой до 10 см3, добавляют 2 см3 раствора комплекса Zr с цирконином. Через 1 мин растворы фотометрируют в кювете с толщиной оптического слоя 1 см относительно раствора сравнения, не содержащего фторид-ион. Градуировочная зависимость представлена на фиг. 1.
Пример 2. Определение фторид-иона в пробах природной и водопроводной воды.
Комплекс цирконии Zr получают и градуировку для аналитического определения фторид-иона осуществляют, как в примере 1. Далее к 10 см3 анализируемой воды с содержанием фторид-иона 0,1-2 мг/дм3 (пробы с большим содержанием предварительно разбавляют) в пробирке добавляют 2 см3 раствора комплекса цирконина с Zr и тщательно перемешивают. Через 1 мин растворы фотометрируют в кювете с толщиной оптического слоя 1 см относительно раствора сравнения, не содержащего фторид-ион при длине волны 610 нм.
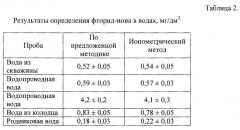
Сопоставление результатов определения фторидов с предложенным реагентом и известным ионометрическим методом [8] показывает хорошую сходимость (табл. 2).
Пример 3. Определение фторид-иона в талой воде.
Комплекс цирконии Zr получают и градуировку для аналитического определения фторид-иона осуществляют, как в примере 1. Далее к 5 см3 отфильтрованной пробы талой воды в пробирке добавляют 1 см3 раствора комплекса цирконина с Zr и тщательно перемешивают. Через 1 мин растворы фотометрируют в кювете с толщиной оптического слоя 1 см относительно раствора сравнения, не содержащего фторид-ион при длине волны 610 нм.
Сопоставление результатов определения фторидов с предложенным реагентом и известным ионометрическим методом [8] показывает хорошую сходимость (табл. 3).
Пример 4. Определение фторид-иона в пробах криолита.
Навеску стандартного образца состава криолита (СК-1, ГСО 1824-80) 0,2 г при нагревании растворяют в 10 мл 4%-ного раствора гидроксида натрия. Раствор охлаждают, количественно переносят в мерную колбу емкостью 100 см3, разбавляют водой до метки и перемешивают. Отбирают аликвотную часть раствора 200 мкл в мерную колбу емкостью 200 см3, разбавляют водой до метки и перемешивают.
Комплекс цирконии Zr получают и градуировку для аналитического определения фторид-иона осуществляют, как в примере 1.
Далее к 5 см3 полученного раствора в пробирке добавляют 1 см3 раствора комплекса цирконина с Zr и тщательно перемешивают. Через 1 мин растворы фотометрируют в кювете с толщиной оптического слоя 1 см относительно раствора сравнения, не содержащего фторид-ион при длине волны 610 нм. Результаты анализа представлены в табл. 4.
Пример 5. Определение фторид-иона в пробах вулканических газов, полученных по методу Гиггенбаха.
Комплекс цирконии Zr получают и градуировку для аналитического определения фторид-иона осуществляют, как в примере 1. Далее к 10 см3 разбавленной в 100 раз пробы в пробирке добавляют 1 см3 раствора комплекса цирконина с Zr и тщательно перемешивают. Через 1 мин растворы фотометрируют в кювете с толщиной оптического слоя 1 см относительно раствора сравнения, не содержащего фторид-ион при длине волны 610 нм.
Сопоставление результатов определения фторидов с предложенным реагентом и известным ионометрическим методом показывает хорошую сходимость (табл. 5).
Пример 6. Определение фторид-иона в пробе морской воды.
Комплекс цирконии Zr получают и градуировку для аналитического определения фторид-иона осуществляют, как в примере 1. Далее к 10 см3 пробы морской воды в пробирке добавляют 2 см3 раствора комплекса цирконина с Zr и тщательно перемешивают. Через 1 мин растворы фотометрируют в кювете с толщиной оптического слоя 1 см относительно раствора сравнения, не содержащего фторид-ион при длине волны 610 нм.
Сопоставление результатов определения фторидов с предложенным реагентом и известным ионометрическим методом показывает хорошую сходимость (табл. 6).
Пример 7. Определение фторид-иона в сточных водах металлургического производства.
Комплекс цирконии Zr получают и градуировку для аналитического определения фторид-иона осуществляют, как в примере 1. Далее к 10 см3 пробы сточной воды в пробирке добавляют 50 мг аскорбиновой кислоты, затем 2 см3 раствора комплекса цирконина с Zr и тщательно перемешивают. Через 1 мин растворы фотометрируют в кювете с толщиной оптического слоя 1 см относительно раствора сравнения, не содержащего фторид-ион при длине волны 610 нм. Сопоставление результатов определения фторидов с предложенным реагентом и известным ионометрическим методом [8] показывает хорошую сходимость (табл. 7).
Пример 8. Определение фтора в растениях.
К навеске образца растения массой 0,2 г, высушенной до постоянной массы при 105°C в корундовом тигле, добавляют 5 мл 40%-ного раствора гидроксида натрия, подсушивают при 200°C на плитке и сплавляют в муфельной печи при 500°C в течение 3 часов. Полученный плав по каплям нейтрализуют 6 н. соляной кислотой до pH 7 и переводят в мерную колбу емкостью 100 см3. В аликвотной части полученного раствора 5 см3 определяют фторид ион в условиях, описанных в примере 1.
Сопоставление результатов определения фторидов с предложенным реагентом и известным ионометрическим методом показывает хорошую сходимость (табл. 8).
Литература
1. Barghouthia Z., Amereihc S. Field method for estimation of fluoride in drinking ground water by photometric measurement of spot on aluminium quinalizarin reagent paper // Arabian Journal of Chemistry - In Press (http://dx.doi.org/10.1016/j.arabjc.2013.11.024).
2. Zaporozhets O.A., Tsyukalo L. Ye. Determination of fluoride and oxalate using the indicator reaction of Zr(IV) with methylthymol blue adsorbed on silica gel // Analytica Chimica Acta - 2007. - V. 597. - P. 171-177.
3. Barghouthil Z., Amereih S. Spectrophotometric determination of fluoride in drinking water using aluminium complexes of triphenylmethane dyes // Water SA - 2012. - V. 38. - P. 543-548.
4. Sahu P., Panda J.D., Sinhat B.C. A rapid spectrophotometric method for determination of fluoride in silicates with the zirconyl-xylenol orange complex // Talanta - 1992. - V. 39. - P. 541-545.
5. Haj-Hussein T.A., Al-Momani I.F. Indirect spectrophotometric determination of fluoride in water with zirconium-SPADNS by flow injection aalysis // Analytical Letters - 1989. - V. 22. - P. 1581-1599.
6. Bellack E., Schouboe P.J. Rapid photometric determination of fluoride in water use of sodium 2-(p-SuIfophenylazo)-1,8-dihydroxynaphthalene-3,6-disulfonate-zirconium Lake // Anal. Chem. - 1958. - V. 30. - P. 2032-2034.
7. Рощин AB, Кумпаненко И.В., Петров С.И., Марченко Д.Ю., Гаркуша Е.В., Рощина Н.М. // Патент РФ №2315976 C1 (RU).
8. Мидгли Д., Торренс К. Потенциометрический анализ воды. М.: Мир, 1980. - 519 с.
9. Mukherjee S., Paul A.K., Evans H.S. A family of highly selective fluorescent sensors for fluoride based on excited state proton transfer mechanism // Sensors and Actuators В - 2014. - V. 202. - P. 1190-1199.
10. Sokkalingam P., Lee C.-H. Highly Sensitive Fluorescence "Turn-On" Indicator for Fluoride Anion with Remarkable Selectivity in Organic and Aqueous Media // J. Org. Chem. - 2011. - V. 76. - P. 3820-3828.
11. ГОСТ 23268.18-78. Воды минеральные питьевые лечебные, лечебно-столовые и природные столовые. Метод определения фторид-ионов; Введ. с 01.01.1980. - Москва: Изд-во стандартов, 1983. - 11 с.
12. Мустафин И.С., Щукина В.С. Колориметрическое определение циркония в сплавах с реагентом «цирконии» // Заводская лаборатория. - 1967. - Т. 33. - №7. - С. 12-14.
13. Коренман И.М. Органические реагенты в неорганическом анализе. М.: Химия, 1980. - 448 с.
14. URL: http://www.molbase.com/en/search.html?search_keyword=27822-77-1 (Дата обращения: 08.07.2015).
Высокочувствительный, селективный, экспрессный метод количественного спектрофотометрического определения фторид-иона в природных объектах и сточных водах, отличающийся тем, что для определения фторид-иона применен хромогенный комплекс цирконин - цирконий, взаимодействующий с фторид-ионом по новой аналитической реакции: (C15H12N2O8S)2Zr+3HF+Н+=[ZrF3]++2C15H14N2O8S, в соответствии с которой к анализируемому образцу прибавляют комплекс цирконина с Zr и после измерения оптической плотности полученного раствора при длине волны 610 нм относительно раствора сравнения, не содержащего фторид-ион, определяют концентрацию фторид-иона в пробе по градуировочному графику.