Способ определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано, в частности, для определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием. Изобретение раскрывает способ определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием, в котором у пациентов берут две аликвоты спермы, на одну аликвоту воздейстуют низкоинтенсивным электромагнитным излучением миллиметрового диапазона с длиной волны λ=7,1 мм, частотой f=42,194 ГГц и плотностью мощности Р=0,1 мВт⋅см-2, далее сперматозоиды отмывают от семенной плазмы, получая опытный образец, а сперматозоиды второй аликвоты отмывают, получая контрольный образец, после проводят ресуспендирование сперматозоидов в образцах, далее в образцы вводят реагенты Аннексии V-FITC и йодид пропидия, образцы инкубируют, отмывают и осуществляют флуоресцентную микроскопию, подсчитывая процентное содержание в опытном и контрольном образцах окрашенных сперматозоидов. О нарушении фертильности сперматозоидов судят по величине индекса апоптоза. Изобретение направлено на повышение точности определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием. 1 табл., 3 пр.
Реферат
Изобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано, в частности, для определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием.
В настоящее время в мире отмечается отчетливая тенденция снижения количественных и качественных характеристик спермы человека. Рост дисфункций репродуктивной системы мужчин, приводящих к нарушению фертильности, выходит за рамки медицинской проблемы, приобретая социально-демографическую значимость [Артифексова М.С., и др. Показатели качества жизни мужчин, состоящих в бесплодном браке // Пробл. репрод. - 2015. -№5. - С. 84-88; Agarwal A., et al. A unique view on male infertility around the globe // Reprod. Biol., and Endocrinol. - 2015. - Vol. 13. - P. 37].
До сих пор не вполне понятны причины, структура и биохимические основы нарушения фертильности у мужчин: достаточно высоким остается процент идиопатического бесплодия (т.е. бесплодия неясного генеза), который при разных подходах к диагностике колеблется от 31 до 75% [Каприн А.Д. и др. Инструментальные методы диагностики идиопатического мужского бесплодия // Материалы 12-го Российского научно-образовательного Форума «Мужское здоровье и долголетие» - Москва, 19-20 февраля, 2014, с. 16; Галимов Ш.Н. и др. Идиопатическое бесплодие у мужчин: проблемы и перспективы // Материалы 12-го Российского научно-образовательного Форума «Мужское здоровье и долголетие». - Москва, 19-20 февраля, 2014, с. 7].
При постановке диагноза идиопатическое бесплодие или, другими словами, необъяснимое бесплодие врачи руководствуются наличием хороших анализов и отсутствием детей при незащищенном половом акте в течение года и больше.
Лечение идиопатического бесплодия представляет собой трудную задачу, поскольку оно не может быть специфичным вследствие неопределенности этиологии и неоднородности групп пациентов, что предопределяет его эмпирический характер с непредсказуемым результатом.
С внедрением современных вспомогательных репродуктивных технологий (ВРТ) стало возможным деторождение от бесплодных мужчин, но для применения этих технологий необходимо использовать только качественные фертильные сперматозоиды. Клетки, програмированные на гибель и запустившие генетически обусловленную суицидную программу - апоптоз, не пригодны для оплодотворения.
Апоптоз имеет характерное сочетание морфологических и биохимических признаков, позволяющим диагностировать данный вид гибели клеток: изменения в ядре и цитоплазме, в клеточной мембране сперматозоида, экспрессия некоторых молекул на поверхности мембраны клетки.
Сперматозоиды, маркированные для гибели путем апоптоза, могут быть подвижными, морфологически полноценными и визуально ничем не отличаться от нормальных, но процесс апоптоза запускает в клетках необратимые изменения, в частности разрушение их ДНК на отдельные фрагменты. При оплодотворении, если оно произойдет, такой сперматозоид не способен обеспечить нормального развития, поскольку его ДНК разрушена.
В практике лабораторной диагностики для оценки качества и фертильности спермы в настоящее время выполняется спермограмма [WHO laboratory manual for the examination and processing of human semen. - 5th ed. - WHO (Geneva), 2010. - Vol. 270; Руководство ВОЗ по исследованию и обработке эякулята человека. Пер. с англ. Н.П. Макаровой под научн. ред. Л.Ф. Курило. 5-е изд. – М.: Изд-во "Капитал принт", 2012]. Данное исследование включает в себя определение целого ряда параметров, из которых, однако, на практике преимущественно используется только ограниченное число (определение концентрации, жизнеспособности, подвижности и морфологии сперматозоидов).
К недостаткам данного способа относится то, что он:
- основан на визуальном исследовании функционально-морфологических критериев и не позволяет выявить биохимические нарушения в половых клетках;
- носит субъективный характер, отчего результат оценки качества половой клетки зависит от проводящего данный анализ;
- не позволяет в 40% случаев, а иногда и более, дать приемлемую интерпретацию причин бесплодия неясного генеза, так как показатели спермограмм мужчин с идиопатическим бесплодием находятся в пределах нормы, согласно критериям ВОЗ, и соответствуют критериям фертильных мужчин, поскольку нет достаточного количества данных о биохимических механизмах лежащих в основе формирования фертильности.
Поэтому клинически традиционных показателей спермограммы не всегда достаточно в оценке фертильности сперматозоидов. Необходим поиск новых диагностических критериев мужской фертильности и биохимических маркеров для расширения доказательной базы некоторых параметров спермы и определения качества половых клеток.
Существуют способы оценки качества и фертильности сперматозоидов, основанные на определении апоптоза и характерных для апоптоза биохимических маркеров.
Так, известен способ определения одного из таких маркеров - фрагментации ДНК сперматозоидов - с использованием различных методов документации этого явления: TUNEL-тест (TdT-mediated dUTP Nick End Labeling); электрофорез ДНК индивидуальных, заключенных в агарозу клеток - Comet assay (single cell gel electrophoresis); тест на структуру хроматина - метод SCSA (sperm chromatin structure assay), который позволяет определить степень повреждения нитей ДНК в сперматозоидах, коррелирующую с мужской фертильностью как в естественных условиях, так и во вспомогательной репродукции. Для количественного определения клеток с нарушенной ДНК используют проточную цитометрию или флуоресцентную микроскопию [Жабин С.Г. и др. Сравнительная оценка уровня ДНК-фрагментации и других показателей фертильности эякулята // Пробл. репрод. - 2015. - Т. 21. - №4. - С. 121-124; Evenson D.P., et al. Sperm chromatin structure assay: Its clinical use for detecting sperm DNA fragmentation in male infertility and comparison with other technique // J. Androl. - 2002. - Vol. 23. - P. 25-43; Muratori M., et al. Nuclear staining identifies two populations of human sperm with different DNA fragmentation extent and relationship with semen parameters // Hum. Reprod. - 2008. - Vol. 23. - №5. - P. 1035-1043; Tomsu M., et al. Embryo quality and IVF treatment outcomes may correlate with different sperm comet assay parameters // Hum. Reprod. - 2002. - Vol. 17. - №7. - P. 1856-1862].
Однако недостатками способов определения фрагментации ДНК являются:
- трудоемость и технические сложности;
- необходимость использования дорогостоящих реактивов и оборудования (например, проточного цитофотометра);
- недостаточная стандартизированность методологии и общепринятого протокола исследования;
- отсутствие понимания биологических механизмов, лежащих в основе анализируемого параметра, так как источником повреждения ДНК в сперме могут быть либо повреждения, возникающие в ходе сперматогенеза, либо инициация процесса апоптоза, либо оксидативный стресс.
- фрагментация ДНК является поздним маркером апоптоза, поэтому способ не позволяет выявить ранние биохимические нарушения начавшиеся в клетке и ассоциированные с ее гибелью, т.е. когда клетка находится на ранних этапах апоптоза.
Существует способ, позволяющий выявлять ранние признаки апоптоза, а именно изменения проницаемости плазматической мембраны и хроматина, предшествующие межнуклеосомной фрагментации ДНК.
В живых клетках существует фосфолипидная асимметрия плазматической мембраны, т.е. фосфатидилсерин находится исключительно во внутреннем слое мембраны. Инициация апоптоза приводит к экстернализации фосфатидилсерина в наружный слой мембраны, определить которую можно Аннексином V.
Так, известен способ определения раннего маркера апоптоза - экстернализации фосфатидилсерина, согласно которому получают свежевыделенный эякулят от пациентов, отбирают аликвоту спермы и инкубируют, окрашивая флуоресцентным красителем Аннексином V-FITC, далее отмывают сперматозоиды и окрашивают йодидом пропидия, а после осуществляют цитометрический анализ полученных образцов и, подсчитывая процентное содержание в них окрашенных Аннексином V-FITC сперматозоидов, оценивают апоптоз сперматозоидов [Ricci G., Perticarari S., Fragonas E. et al. Apoptosis in human sperm: its correlation with semen quality and the presence of leukocytes // Hum. Reprod. - 2002. - Vol. 17. - №10. - P. 2665-2672]. Указанный способ принимается за наиболее близкий аналог - прототип.
Недостатком этого способа является то, что результаты окрашивания Аннексином V-FITC в комбинации с йодидом пропидия сперматозоидов бесплодных мужчин могут достоверно не отличаться от результатов окрашивания сперматозоидов фертильных мужчин и поэтому дать приемлемую интерпретацию причин нарушения фертильности и причин бесплодия не удается.
Изобретение направлено на повышение точности определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием.
Указанный технический результат достигается тем, что для определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием из свежевыделенного эякулята берут две аликвоты спермы, на одну аликвоту воздейстуют низкоинтенсивным электромагнитным излучением миллиметрового диапазона с длиной волны λ=7,1 мм, частотой f=42,194 ГГц и плотностью мощности Р=0,1 мВт⋅см-2 в течение 20 мин, далее сперматозоиды отмывают от семенной плазмы, получая опытный образец, а сперматозоиды второй аликвоты отмывают, получая контрольный образец, при этом отмывание сперматозоидов опытного и контрольного образцов проводят дважды фосфатно-солевым буфером с рН=7,4, после проводят ресуспендирование сперматозоидов опытного и контрольного образцов в рабочем растворе буфера для окрашивания 1Х Armexin V Binding Buffer до концентрации 1×106 сперматозоидов/мл, при этом рабочий раствор буфера для окрашивания 1Х Arnnexin V Binding Buffer представляет собой смесь концентрированного буфера для окрашивания 10Х Annexin V Binding Buffer с дистиллированной водой в объемном соотношении 1:9 соответственно, далее в опытный и контрольный образцы вводят реагенты Аннексии V-FITC и йодид пропидия, образцы инкубируют в темноте при комнатной температуре в течение 15 мин, далее отмывают сперматозоиды опытного и контрольного образцов рабочим раствором буфера для окрашивания 1Х Annexin V Binding Buffer и осуществляют флуоресцентную микроскопию полученных образцов, подсчитывая процентное содержание в опытном и контрольном образцах окрашенных только Аннексином V-FITC сперматозоидов, а далее вычисляют индекс апоптоза по формуле
ИА = Апоптоз опыт / Апоптоз контроль, где
ИА - индекс апоптоза;
Апоптоз опыт - процентное содержание окрашенных только Аннексином V-FITC и не окрашенных йодидом пропидия сперматозоидов в опытных образцах после воздействия низкоинтенсивного электромагнитного излучения миллиметрового диапазона;
Апоптоз контроль - процентное содержание окрашенных только Аннексином V-FITC и не окрашенных йодидом пропидия сперматозоидов в контрольных образцах,
и при величине индекса апоптоза более 1,1 судят о нарушении фертильности сперматозоидов у пациентов с идиопатическим бесплодием.
Достаточно давно известна высокая биологическая активность миллиметровых волн на уровне клеточных структур [Девятков Н.Д. и др. Особенности медико-биологического применения миллиметровых волн. - М., 1994. - 164 с.]. Низкоинтенсивное электромагнитное излучение миллиметрового диапазона широко используется в различных областях практической медицины, показывая обнадеживающие клинические результаты [Руденко Т.Л. Физиотерапия. - Ростов-на-Дону, 2000. - 352 с.].
Для создания электромагнитного поля в предлагаемом изобретении использовался генератор монохроматических электромагнитных волн «Явь-1-7,1». Электромагнитное поле, генерируемое «Явь-1-7,1» имело следующие характеристики: длина волны λ=7,1 мм, частота f=42,194 ГГц. Известно, что такие характеристики наиболее часто приводят к индукции биологических эффектов [Боголюбов В.М., Пономаренко Г.Н. Общая физиотерапия. - Москва, 1997. - 480 с.; Петросян В.И., Гуляев Ю.В., Житенева Э.А. и др. Физика взаимодействия ММ-волн с биологическими объектами // Мат. 10 Росс, симп. «Миллиметровые волны в медицине и биологии». - М., 2000. - С. 140-143; Николаев А.А., Кузнецова М.Г., Сердюков В.Г. Гонадотоксическое действие миллиметрового излучения. Астрахань: Изд-во ГБОУ ВПО АГМА. 2013].
Плотность мощности составляла Р=0,1 мВт⋅см-2 и была выбрана как рекомендованная для клинического и экспериментального использования. Она не обладает тепловым эффектом и поэтому возможное биологическое действие при плотности мощности 0,1 мВт⋅см-2 является специфическим [Бецкий О.В. ММВ в биологии и медицине // Радиотехника и электроника. -1993. - Т. 38, Вып. 10. - С. 1760-1782; Плетнев С.Д. Применение электромагнитных волн мм-диапазона в клинической медицине // Мат. 10 Росс. симп. «Миллиметровые волны в медицине и биологии». - Москва, 2000. - С. 9-10].
При воздействии низкоинтенсивного ЭМИ миллиметрового диапазона на сперму в эксперименте было выбрано время экспозиции - 20 мин как оптимальное для реализации возможных биологических эффектов.
Двукратное отмывание сперматозоидов фосфатно-солевым буфером с рН=7,4 необходимо для максимального освобождения сперматозоидов от семенной плазмы и получения чистой культуры гамет.
Последующее ресуспендирование сперматозоидов в рабочем растворе буфера для окрашивания 1Х Annexin V Binding Buffer до концентрации 1×106 сперматозоидов/мл обеспечивает необходимый количественный стандарт клеток. Использование при этом рабочего раствора буфера для окрашивания 1Х Annexin V Binding Buffer, представляющего смесь концентрированного буфера для окрашивания 10Х Annexin V Binding Buffer с дистиллированной водой в объемном соотношении 1:9 соответственно, необходимо для подготовки сперматозоидов к дальнейшему внесению красителей Аннексина V-FITC и йодида пропидия.
Проведение флуоресцентной микроскопии после добавления в образцы реагентов Аннексина V-FITC и йодида пропидия является традиционным.
Точность предлагаемого способа определения фертильности сперматозоидов, основанного на определении состояния структуры фосфолипидного слоя мембран сперматозоидов у пациентов с идиопатическим бесплодием, после двадцатиминутного воздействия на сперму низкоинтенсивного ЭМИ миллиметрового диапазона, обеспечивается тем, что экспериментально установлен соответствующий состояниию фертильности конкретный численный показатель, получаемый через соотношение между процентным содержанием окрашенных Аннексином V-FITC сперматозоидов в опытных и контрольных образцах - индекс апоптоза, который не должен превышать 1,1. Благодаря этому показателю можно говорить о нарушении фертильности сперматозоидов пациентов и активации апоптоза (если содержание окрашенных Аннексином V-FITC сперматозоидов в опытном образце превосходит их содержание в контрольном образце), либо об отсутствии нарушений и стабилизирующем действии низкоинтенсивного ЭМИ миллиметрового диапазона на клеточные мембраны (если содержание окрашенных Аннексином V-FITC сперматозоидов в опытном образце ниже их содержания в контрольном образце), или отсутствии какого-либо эффекта воздействия КВЧ-поля на мембраны клеток (если содержание окрашенных Аннексином V-FITC сперматозоидов в опытном и контрольном образце равны).
По указанному в предлагаемом способе показателю можно судить о фертильности эякулятов пациентов с идиопатическим бесплодием, что в дальнейшем может стать важным диагностическим критерием при лечении идиопатического бесплодия и прогностическим критерием при подготовке спермы для процедур ВРТ.
Способ осуществляли следующим образом:
Из эякулята после полного его разжижения и исследования на физико-химические и морфофункциональные критерии качества, брали две аликвоты.
Одна аликвота спермы подвергалась воздействию низкоинтенсивного электромагнитного излучения миллиметрового диапазона (длина волны λ=7,1 мм; частота f=42,194 ГГц; плотность мощности Р=0,1 мВт⋅см-2) в течение 20 мин - опыт. Для создания электромагнитного поля использовался генератор монохроматических электромагнитных волн «Явь-1-7,1».
Вторая аликвота не подвергалась воздействию низкоинтенсивного электромагнитного излучения миллиметрового диапазона - контроль.
Далее каждую аликвоту смешивали (1:10) с фосфатно-солевым буфером с рН=7,4 и дважды отмывали клетки спермы, центрифугируя при 220 g в течение 10 мин, получая опытный и контрольный образцы клеток.
Полученную взвесь клеток спермы опытного и контрольного образцов ресуспендировали в рабочем растворе буфера для окрашивания 1Х Annexin V Binding Buffer до концентрации 1×106 сперматозоидов/мл. Причем рабочий раствор буфера для окрашивания 1Х Annexin V Binding Buffer представлял собой смесь концентрированного буфера для окрашивания 10Х Annexin V Binding Buffer (компонент No. 51-66121Е из набора Cat. No. 550911, производство фирмы BD, BIOSCIENCES PHARMINGEN, SAN DIEGO, USA) с дистиллированной водой в объемном соотношении 1:9. В состав концентрированного буфера для окрашивания 10Х Annexin V Binding Buffer входила смесь солей: хлорида натрия, хлорида кальция, Hepes/NaOH, с рН=7,4.
Далее переносили по 500 мкл суспензии клеток спермы опытного и контрольного образцов в пробирки, добавляли 5 мкл Аннексии V-FITC и 10 мкл (конечная концентрация 1 мкг/мл) йодида пропидия. После этого содержимое пробирок аккуратно перемешивали и инкубировали в темноте 15 мин при комнатной температуре.
Далее в каждую пробирку к опытному и контрольному образцам добавляли по 5 мл рабочего раствора буфера для окрашивания 1Х Annexin V Binding Buffer и отмывали сперматозоиды опытного и контрольного образцов путем центрифугирования при 220 g в течение 10 мин.
После этого суспензию клеток спермы опытного и контрольного образцов наносили мазком на стеклянные пластинки и высушивали на воздухе.
Таким образом, для каждого пациента анализировалось 2 пластинки - опытная (после воздействия на сперму низкоинтенсивным электромагнитным излучением миллиметрового диапазона) и контрольная (без воздействия).
Мазки исследовались на флуоресцентном микроскопе МИКРОМЕД 3 ЛЮМ (Санкт-Петербург) под иммерсионным объективом ×100. В каждом мазке были рассмотрены как минимум 500 сперматозоидов. Отношение количества окрашенных Аннексином V-FITC сперматозоидов к общему количеству сперматозоидов в тесте выражали в процентах.
Экстернализацию фосфатидилсерина, выявляемую с помощью Аннексии V-FITC, визуализировали в виде зеленой флуоресценции, в то время как окрашивание йодидом пропидия PI головки сперматозоида проявлялось в виде красной флуоресценции.
Результаты оценивали следующим образом: неокрашенные клетки (AnV-/PI-) оценивали как живые; клетки, вступившие в апоптоз, окрашивались только Аннексином V-FITC и были (AnV+/PI-); некротические клетки были (AnV+/PI+) или (AnV-/PI+).
Рассчитывали Индекс апоптоза (ИА) по формуле
ИА = Апоптоз опыт / Апоптоз контроль, где
ИА - индекс апоптоза;
Апоптоз опыт - процентное содержание окрашенных только Аннексином V-FITC и не окрашенных йодидом пропидия сперматозоидов в опытных образцах после воздействия низкоинтенсивного электромагнитного излучения миллиметрового диапазона;
Апоптоз контроль - процентное содержание окрашенных только Аннексином V-FITC и не окрашенных йодидом пропидия сперматозоидов в контрольных образцах.
При величине индекса апоптоза более 1,1 судили о нарушении фертильности сперматозоидов у пациентов с идиопатическим бесплодием.
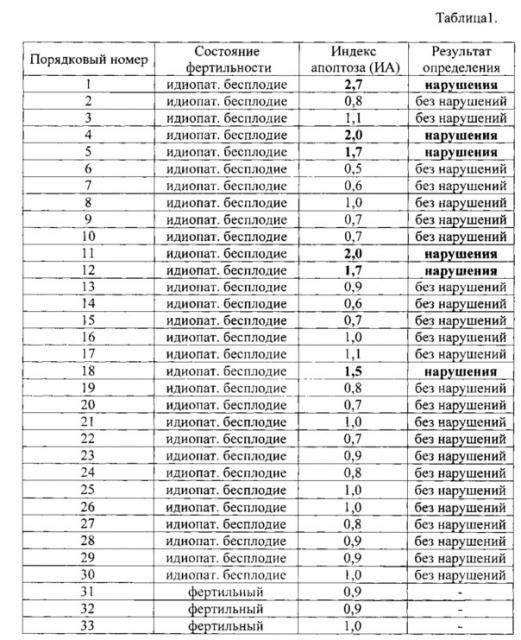
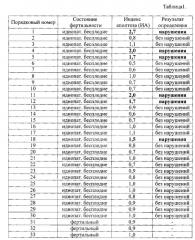
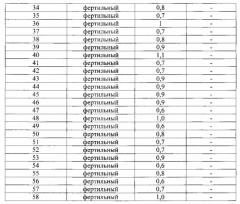
Предлагаемый способ прошел успешную апробацию на 30 образцах эякулятов пациентов с идиопатическим бесплодием в совместной практической работе кафедры химии ГБОУ ВПО Астраханского гос.медицинского университета и ГБУ Здравоохранения Астраханской области «Центр охраны здоровья семьи и репродукции» и лаборатории «Диамед-экспресс» ООО МФВФ «Техномед», г. Астрахань в течение 2015 года. Ниже приводятся результаты апробации.
Пример №1
Донор спермы №1, возраст 29 лет, длительность бесплодного брака 3 года. Показатели спермограммы соответствуют критериям, предъявляемым экспертной группой ВОЗ к фертильной сперме. Время разжижения 14 минут. Объем эякулята 3,2 мл. Концентрация сперматозоидов - 17 млн/мл, подвижных сперматозоидов 44,0%, нежизнеспособных 25,4%, атипичных форм 42,3%.
Из эякулята после полного его разжижения и исследования на физико-химические и морфо-функциональные критерии качества, брали две аликвоты. Одна аликвота спермы подвергалась воздействию низкоинтенсивного электромагнитного излучения миллиметрового диапазона (λ=7,1 мм; f=42,194 ГГц; Р=0,1 мВт⋅см-2) в течение 20 мин - опыт. После этого исследовали морфофункциональные критерии качества сперматозоидов. Вторая аликвота не подвергалась воздействию низкоинтенсивного электромагнитного излучения миллиметрового диапазона - контроль.
Далее каждую аликвоту смешивали (1:10) с фосфатно-солевым буфером с рН=7,4 и дважды отмывали клетки спермы, центрифугируя при 220 g в течение 10 мин, получали опытный и контрольный образцы клеток. Полученную взвесь клеток спермы опытного и контрольного образцов ресуспендировали в растворе буфера для окрашивания 1Х Annexin V Binding Buffer до концентрации 1×106 сперматозоидов/мл. Далее переносили по 500 мкл суспензии клеток спермы опытного и контрольного образцов в пробирки, добавляли 5 мкл Аннексии V-FITC и 10 мкл (конечная концентрация 1 мкг/мл) йодида пропидия. После этого содержимое пробирок аккуратно перемешивали и инкубировали в темноте 15 мин при комнатной температуре. Далее в каждую пробирку к опытному и контрольному образцам добавляли по 5 мл раствора буфера 1Х Annexin V Binding Buffer и отмывали сперматозоиды опытного и контрольного образцов путем центрифугирования при 220 g в течение 10 мин. После этого суспензию клеток спермы опытного и контрольного образцов наносили мазком на стеклянные пластинки и высушивали на воздухе. Мазки исследовались на флуоресцентном микроскопе МИКРОМЕД 3 ЛЮМ (Санкт-Петербург) под иммерсионным объективом ×100, подсчитывали отношение количества окрашенных только Аннексином V-FITC сперматозоидов к общему количеству сперматозоидов в тесте и выражали в процентах.
Количество окрашенных Аннексином V-FITC сперматозоидов в опытном образце составило 24% (апоптоз опыт).
Количество окрашенных Аннексином V-FITC сперматозоидов в контрольном образце составило 8,8% (апоптоз контроль).
Индекс апоптоза (ИА) рассчитывали как
ИА = Апоптоз опыт / Апоптоз контроль = 2,7, что соответствует нарушению фертильности сперматозоидов.
Результаты исследования представлены в таблице 1.
Пример №2
Донор спермы №2, возраст 32 года, длительность бесплодного брака 7 лет. Показатели спермограммы соответствуют критериям, предъявляемым экспертной группой ВОЗ к фертильной сперме. Время разжижения 15 минут. Объем эякулята 4,2 мл. Концентрация сперматозоидов - 18 млн/мл, подвижных сперматозоидов 41,0%, нежизнеспособных 22,4%, атипичных форм 38,6%.
Из эякулята после полного его разжижения и исследования на физико-химические и морфофункциональные критерии качества, брали две аликвоты: одна аликвота подверглась воздействию низкоинтенсивного электромагнитного излучения миллиметрового диапазона (λ=7,1 мм; f=42,194 ГГц; Р=0,1 мВт⋅см-2) в течение 20 мин - опыт. Далее исследовались морфофункциональные критерии качества сперматозоидов; вторая аликвота не подвергалась воздействию низкоинтенсивного электромагнитного излучения миллиметрового диапазона и служила контролем.
После двухкратного отмывания клеток спермы каждой аликвоты от семенной плазмы с фосфатно-солевым буфером с рН=7,4 и получения опытного и контрольного образцов клеток проводили, как описано выше, ресуспендирование клеток каждого образца в растворе буфера 1Х Annexin V Binding Buffer, окраску клеток Аннексином V-FITC в комбинации с йодидом пропидия, инкубирование в темноте 15 мин при комнатной температуре, далее отмывали сперматозоиды опытного и контрольного образцов раствором буфера 1Х Annexin V Binding Buffer при 220 g в течение 10 мин. Для опытного и контрольного образцов делали мазки на стеклянных пластинках, высушивали на воздухе и осуществляли флуоресцентную микроскопию на микроскопе МИКРОМЕД 3 ЛЮМ (Санкт-Петербург) под иммерсионным объективом ×100, подсчитывая в % количество окрашенных только Аннексином V-FITC сперматозоидов в опытном и контрольном образцах.
Количество окрашенных Аннексином V-FITC сперматозоидов в опытном образце составило 8,4% (апоптоз опыт).
Количество окрашенных Аннексином V-FITC сперматозоидов в контрольном образце составило 10,6% (апоптоз контроль).
Индекс апоптоза (ИА) рассчитывали как
ИА = Апоптоз опыт / Апоптоз контроль = 0,8, т.е. нет нарушений.
Результаты исследования представлены в таблице 1.
Пример №3.
Донор спермы №3, возраст 41 год, длительность бесплодного брака 6 лет. Показатели спермограммы соответствуют критериям, предъявляемым экспертной группой ВОЗ к фертильной сперме. Время разжижения 20 минут. Объем эякулята 3,0 мл. Концентрация сперматозоидов - 15 млн/мл, активно подвижных сперматозоидов 42,0%, нежизнеспособных 28%, атипичных форм 39%.
Из эякулята после полного его разжижения и исследования на критерии качества, брали две аликвоты: одна аликвота подверглась воздействию низкоинтенсивного электромагнитного излучения миллиметрового диапазона (λ=7,1 мм; f=42,194 ГГц; Р=0,1 мВт⋅см-2) в течение 20 мин - опыт. Далее исследовались морфофункциональные критерии качества сперматозоидов; вторая аликвота не подвергалась воздействию низкоинтенсивного электромагнитного излучения миллиметрового диапазона и служила контролем.
После двухкратного отмывания клеток спермы каждой аликвоты от семенной плазмы с фосфатно-солевым буфером с рН=7,4 и получения опытного и контрольного образцов клеток, проводили, как описано выше, ресуспендирование клеток каждого образца в растворе буфера 1Х Annexin V Binding Buffer, окраску клеток Аннексином V-FITC в комбинации с йодидом пропидия, инкубирование в темноте 15 мин при комнатной температуре, далее отмывали сперматозоиды опытного и контрольного образцов раствором буфера 1Х Annexin V Binding Buffer при 220 g в течение 10 мин. Далее для опытного и контрольного образцов делали мазки на стеклянных пластинках, высушивали на воздухе и осуществляли флуоресцентную микроскопию на микроскопе МИКРОМЕД 3 ЛЮМ (Санкт-Петербург) под иммерсионным объективом ×100, подсчитывая в % количество окрашенных только Аннексином V-FITC сперматозоидов в опытном и контрольном образцах.
Количество окрашенных Аннексином V-FITC сперматозоидов в опытном образце составило 11,0% (апоптоз опыт).
Количество окрашенных Аннексином V-FITC сперматозоидов в контрольном образце составило 10,0% (апоптоз контроль).
Индекс апоптоза (ИА) рассчитывали как
ИА = Апоптоз опыт / Апоптоз контроль = 1,1, т.е. нет нарушений.
Результаты исследования представлены в таблице 1.
В основу изобретения были положены результаты обследования 28 образцов эякулятов фертильных мужчин и 30 образцов эякулятов пациентов с идиопатическим бесплодием. Образцы эякулятов всех обследованных мужчин исследовали до - контроль, и после воздействия на сперму низкоинтенсивного ЭМИ миллиметрового диапазона - опыт. Это результаты морфологического анализа сперматозоидов, анализа двигательной активности, концентрации, жизнеспособности сперматозоидов и анализа структурно-биохимических изменений в фосфолипидном слое мембран сперматозоидов, связанных с экстернализацией фосфатидилсерина.
Выявлено, что у мужчин с бесплодием неясного генеза после воздействия на сперму микроволнового излучения не наблюдалось видимых морфологических изменений сперматозоидов, изменений двигательной активности, концентрации и жизнеспособности сперматозоидов по сравнению с этими критериями в контроле (до воздействия КВЧ-поля). Реакция сперматозоидов мужчин с идиопатическим бесплодием на воздействие низкоинтенсивного ЭМИ миллиметрового диапазона не отличалась от реакции фертильных мужчин по этим критериям.
Анализ структурно-биохимических изменений в фосфолипидном слое мембран сперматозоидов после воздействия на сперму низкоинтенсивного ЭМИ миллиметрового диапазона показал, что индекс апоптоза (ИА) фертильных мужчин не превышал 1,1 (таблица 1), поэтому пороговым значением при оценке фертильности сперматозоидов у пациентов с идиопатическим бесплодием было выбрано значение ИА, равное 1,1.
У 20% (у 6 из 30) обследованных мужчин с идиопатическим бесплодием после 20 мин воздействия на сперму низкоинтенсивного ЭМИ миллиметрового диапазона происходило увеличение количества окрашенных Аннексином V-FITC сперматозоидов, о чем свидетельствовало увеличение индекса апоптоза ИА более 1,1 (таблица 1).
Это означает, что у сперматозоидов этих 20% мужчин с идиопатическим бесплодием имеются какие-то нарушения или скрытые дефекты, которые нельзя выявить, сделав обычную спермограмму или проведя анализ на наличие маркеров апоптоза, что не позволяет отличить эти сперматозоиды от нормальных здоровых клеток. Однако, как показали результаты предлагаемого нами способа определения фертильности, сперматозоиды этих бесплодных мужчин обладают наибольшей чувствительностью к изменениям в структуре фосфолипидного слоя клеточной мембраны, следствием которых является нарушение фосфолипидной асимметрии и экстернализация фосфатидилсерина на поверхность мембраны в ответ на воздействие низкоинтенсивного ЭМИ миллиметрового диапазона.
Таким образом, эмпирическое определение у сперматозоидов экстернализации фосфатидилсерина, ассоциированной с апоптозом, в ответ на воздействие низкоинтенсивного ЭМИ миллиметрового диапазона на сперму в течение 20 мин можно использовать как способ определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием и как прогностический метод и функциональный тест для оценки качества сперматозоидов мужчин, а также как критерий отбора сперматозоидов для использования в программах ВРТ.
Предлагаемый способ имеет следующие преимущества:
- повышается точность определения фертильности сперматозоидов у пациентов с бесплодием неясного генеза.
- сокращается группа пациентов с идиопатическим бесплодием, в данном случае на 20%.
- позволяет прогнозировать качество сперматозоидов мужчин с целью отбора сперматозоидов для использования в программах ВРТ, так как выявляет клетки со структурно-биохимическими нарушениями в цитоплазматической мембране, не отличающиеся от нормальных сперматозоидов по другим критериям.
- обладает простотой и при выполнении минимальным числом манипуляций, повреждающих клетки.
- обладает доступностью и экономической целесообразностью, так как основан на оценке при помощи флуоресцентной микроскопии известного биохимического маркера апоптоза - фосфатидилсерина, и не требует использования дорогостоящего лабораторного оборудования.
Предлагаемый способ может быть использован в фундаментальной и практической медицине для определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием для оценки качества сперматозоидов как диагностический способ при лечении идиопатического бесплодия, а также как прогностический способ и способ отбора сперматозоидов для использования в программах ВРТ.
Способ определения фертильности сперматозоидов у пациентов с идиопатическим бесплодием путем исследования апоптоза сперматозоидов, включающий получение свежевыделенного эякулята от пациента, отбор аликвоты, инкубацию и окрашивание сперматозоидов Аннексином V-FITC и йодидом пропидия, отмывание сперматозоидов с последующим подсчетом процентного содержания в образце окрашенных Аннексином V-FITC сперматозоидов, отличающийся тем, что у пациентов с идиопатическим бесплодием из свежевыделенного эякулята берут две аликвоты спермы, на одну аликвоту воздейстуют низкоинтенсивным электромагнитным излучением миллиметрового диапазона с длиной волны λ=7,1 мм, частотой f=42,194 ГГц и плотностью мощности Р=0,1 мВт⋅см-2 в течение 20 мин, далее сперматозоиды отмывают от семенной плазмы, получая опытный образец, а сперматозоиды второй аликвоты отмывают, получая контрольный образец, при этом отмывание сперматозоидов опытного и контрольного образцов проводят дважды фосфатно-солевым буфером с рН=7,4, после проводят ресуспендирование сперматозоидов опытного и контрольного образцов в рабочем растворе буфера для окрашивания 1X Annexin V Binding Buffer до концентрации 1×106 сперматозоидов/мл, при этом рабочий раствор буфера для окрашивания 1X Annexin V Binding Buffer представляет собой смесь концентрированного буфера для окрашивания 10Х Annexin V Binding Buffer с дистиллированной водой в объемном соотношении 1:9 соответственно, далее в опытный и контрольный образцы вводят реагенты Аннексин V-FITC и йодид пропидия, образцы инкубируют в темноте при комнатной температуре в течение 15 мин, далее отмывают сперматозоиды опытного и контрольного образцов рабочим раствором буфера для окрашивания 1X Annexin V Binding Buffer и осуществляют флуоресцентную микроскопию полученных образцов, подсчитывая процентное содержание в опытном и контрольном образцах окрашенных только Аннексином V-FITC сперматозоидов, а далее вычисляют индекс апоптоза по формуле
ИА=Апоптоз опыт/Апоптоз контроль, где
ИА - индекс апоптоза;
Апоптоз опыт - процентное содержание окрашенных только Аннексином V-FITC и не окрашенных йодидом пропидия сперматозоидов в опытных образцах после воздействия низкоинтенсивного электромагнитного излучения миллиметрового диапазона;
Апоптоз контроль - процентное содержание окрашенных только Аннексином V-FITC и не окрашенных йодидом пропидия сперматозоидов в контрольных образцах, и при величине индекса апоптоза более 1,1 судят о нарушении фертильности сперматозоидов у пациентов с идиопатическим бесплодием.