Применение препарата "виферон" у беременных женщин с папилломавирусной инфекцией для профилактики инфицирования плаценты и фетоплацентарной недостаточности
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к акушерству, и может быть использовано для осуществлении профилактики фетоплацентарной недостаточности и инфицирования плаценты у беременных женщин с папилломавирусной инфекцией (ПВИ). Применяют препарат Виферон посредством введения суппозиториев ректальных в сочетании с интравагинальным введением Виферона в виде геля. Использование изобретения позволяет добиться профилактики фетоплацентарной недостаточности и инфицирования плаценты у беременных женщин с ПВИ. 4 ил., 1 табл.
Реферат
Изобретение относится к медицине, в частности к акушерству, и может быть использовано при осуществлении профилактики фетоплацентарной недостаточности и инфицирования плаценты у беременных женщин с папилломавирусной инфекцией.
Этиологическая структура воспалительных заболеваний половых органов женщины разнообразна. Спектр возбудителей включает десятки видов микроорганизмов. Кроме того, часто данные инфекции носят смешанный характер. При внутриутробном инфицировании резко увеличивается частота осложнений беременности, среди которых преобладают потеря беременности и фетоплацентарная недостаточность.
Известно, что при многих видах акушерской и экстрагенитальной патологии происходят изменения в плаценте. Они связаны с характером, временем и длительностью воздействия неблагоприятных факторов на формирование и развитие плаценты, а также уровнем ее поражения. Большую роль в этом на нарушение маточно-плацентарного кровотока в патогенезе плацентарной недостаточности оказывают различные острые и хронические инфекции.
Среди различного рода инфекций сложную проблему в лечении и профилактике представляют собой герпесвирусная, цитомегаловирусная и папилломавирусная (ПВИ) инфекции. Эти вирусы могут приводить к заболеваниям шейки матки, осложнениям беременности, заражению плода, нарушению его роста и развития.
Папилломавирусная инфекция занимает одно из ведущих мест в ряду инфекций, передающихся половым путем. Доля инфицированных больных, по данным Всемирной организации здравоохранения, увеличилась более чем в 10 раз и составляет 23,5% населения. Беременность же является фактором риска ПВИ и способствует активной репликации и персистенции вируса папилломы человека. Частота развития ПВИ у беременных в 2,3 раза превышает таковую у небеременных, при этом количество вирусной ДНК у беременных в среднем в 10 раз больше того же количества у небеременных. У беременных проявления ПВИ либо локализуются, преимущественно на шейке матки в виде плоской кондиломы или развития цервикальной интраэпителиальной неоплазии, либо определяются в области вульвы и влагалища в виде остроконечных кондилом. Во время беременности видимые кондиломы часто рецидивируют, прогрессивно растут и могут достигать гигантских размеров.
Однако в настоящее время нет единого мнения о влиянии ПВИ на течение и исход беременности. Известно, что беременность является фактором риска развития ПВИ и способствует активной репликации и персистенции вируса папилломы человека (ВПЧ). Число случаев передачи ВПЧ от матери плоду составляет от 4 до 87%. Имеются также сведения о том, что ПВИ гениталий приводит к учащению самопроизвольных абортов. Передача вируса от матери плоду через кровь маловероятна, так как ВПЧ лишь иногда обнаруживается в лейкоцитах крови. Наиболее вероятна восходящая ВПЧ-инфекция околоплодных вод и плаценты. Возможна передача и при непосредственном соприкосновении (кожный контакт), а также при родах - заражение новорожденного от инфицированной матери; еще один возможный путь - инфицирование во время зачатия через сперму (1).
Полагают, что диссеминация вирусной инфекции в организме происходит на фоне изменения иммунной системы, что обусловливает целесообразность иммунокоррекции, в частности интерферонами, при папилломавирусной инфекции. Кроме того, на сегодняшний день доказано, что интерферон не проникает через плаценту и не может оказывать негативного воздействия на иммунитет развивающегося плода. Именно это доказывает безопасность применения интерферонов во время беременности (2).
Одним из таких препаратов, содержащих интерфероны, является Виферон.
Виферон в своем составе содержит интерферон альфа-2b человеческий рекомбинантный, который обладает выраженными иммуномодулирующими, противовирусными, антипролиферативными свойствами, подавляет репликацию РНК- и ДНК-содержащих вирусов.
Эти свойства позволяют использовать его для лечения различного рода вирусных инфекций.
Наиболее близким аналогом изобретения является использование Виферона для элиминационного лечения генитальной папилломавирусной инфекции, где эндовагинально вводят суппозитории, содержащие интерферон α-2b в дозе 1 млн ME на ночь в течение 10 дней во вторую фазу менструального цикла на протяжении 3-6 менструальных циклов (3).
Недостатком прототипа является то, что несмотря на применение препарата Виферона для лечения ПВИ у женщин с целью нормализации иммунитета и лечения инфекции, препарат Виферон не применяется у беременных женщин для профилактики фетоплацентарной недостаточности и инфицирования плаценты.
Таким образом, существует задача в разработке обоснованного, в рамках доказательной медицины, подхода применения препарата Виферона для профилактики фетоплацентарной недостаточности и инфицирования плаценты у беременных женщин с ПВИ.
Предпосылками к разработке данной задачи явился анализ опубликованных исследований, который относительно патоморфологического выявления папилломавируса человека в доношенных плацентах при хронической их дисфункции показывает, что ВПЧ присутствует при спонтанных выкидышах и неразвивающейся беременности, а также в случаях преждевременных родов (Gomes L.M. et al., 2008 (4); Zuo Z. Et al., 2011 (5)).
Также проведенные ранее исследования показали, что Виферон возможно применять при лечении плацентарной недостаточности в условиях инфицирования другими инфекциями (Логутова Л.С., Малиновская В.В. и др., 2011 (6); Новикова С.В., Малиновская В.В. и др., 2011 (7)), в которых представлен положительный эффект подобной терапии за счет улучшения микробиоценоза влагалища и оптимизации гормонального статуса женщины.
Таким образом, данные работы стали предпосылками к изучению возможности применения препарата Виферон у беременных женщин с ПВИ для профилактики фетоплацентарной недостаточности и инфицирования плаценты.
Проведенные нами исследования показали, что применение с 14 недели беременности препарата Виферон посредством введения суппозиториев ректальных (интерферон альфа-2b) по 500000 ME 2 раза в сутки через 12 часов, ежедневно в течение 10 дней и далее 2 раза в сутки дважды в неделю - дополнительно 10 свечей; вводимых в сочетании (2 раза в сутки дважды в неделю) с интравагинальным введением Виферона в виде геля 36000 МЕ/г по 2 мл, проведение повторных курсов в 22-24 и 32-34 недели беременности теми же дозами и режимами позволяет добиться профилактики фетоплацентарной недостаточности, предотвратить инфицирование плаценты и внутриутробного инфицирования новорожденных..
Техническими результатами данного изобретения являются
- отсутствие ВПЧ в плаценте у пациенток с ПВИ, которые получали терапию,
- профилактика фетоплацентарной недостаточности и внутриутробного инфицирования у беременных женщин с ПВИ,
- возросший объем компенсаторных реакций, таких как ангиоматоз терминальных ворсин, увеличение числа специализированных ворсин с тонким плацентарным барьером, а также расширение сосудов опорных ворсин, что означает адаптационное увеличение притока венозной крови от плода к плаценте и увеличение контакта ее с материнской кровью за счет тонких участков плацентарного барьера после курсового применения препарата Виферон,
- оптимизация гемостаза в межворсинчатом пространстве плацент, а также более полноценное созревание ворсин после курсового применения препарата Виферон.
Подтверждением этого явились следующие материалы исследования.
В течение 2014 года нами был собран материал от трех групп беременных женщин: первая - с нормальным течением беременности и родами при отсутствии ПВЧ, диагностика проводилась с помощью ПЦР (15 женщин в возрасте от 24 до 32 лет).
Вторая группа - 15 беременных женщин с подтвержденной папилломавирусной инфекцией разных подтипов, но без лечения Вифероном, поскольку они наблюдались в разных роддомах Московской области и Москвы.
Третья группа - 15 беременных женщин с ПЦР-подтвержденной папилломавирусной инфекцией и прошедших курсовое лечение Вифероном, где осуществляли с 14 недели беременности введение суппозиториев ректальных (интерферон альфа-2b) по 500000 ME 2 раза в сутки через 12 часов, ежедневно в течение 10 дней и далее 2 раза в сутки дважды в неделю - дополнительно 10 свечей; вводимых в сочетании (2 раза в сутки дважды в неделю) с интравагинальным введением Виферона в виде геля 36000 МЕ/г по 2 мл, проведение повторных курсов в 22-24 и 32-34 недели беременности теми же дозами и режимами.
Кроме того, для контроля методики выявления папилломавируса человека был взят операционный материал от 3-х женщин с папилломами шейки матки.
После рождения последа выделялась плацента, из которой сразу вырезалась полоска шириной 2-3 см через толщу органа. Из полоски вырезали 6-8 кусочков по центру и периферии с обязательным присутствием базальной пластины (материнская поверхность). Если плацента была толще 1-1,5 см, выделяли два сегмента (с хориальными и базальными пластинками). В дальнейшем, после маркировки, кусочки фиксировали в 10% нейтральном формалине и проводили по стандартной схеме. На микротоме делали серийные срезы и верхние из них окрашивали гематоксилином и эозином. По этим препаратам проводили полуколичественную балльную оценку основных компонентов плацентарной ткани.
Выделены 10 компонентов различных компенсаторных и патологических реакций, которые оценивались по 3-балльной степени по возрастанию их объема во всех микропрепаратах плацент конкретных женщин:
1. Воспалительные изменения - их отсутствие (0), незначительная лимфолейкоцитарная инфильтрация в хориальной или базальной пластинках (1 балл); аналогичная реакция в двух пластинках (2 балла) + в межворсинчатом пространстве (3 балла).
2. Межворсинчатые кровоизлияния - возрастающий объем материнских эритроцитов среди ворсин.
3. Склеенные ворсины - сближение нескольких, группы или целой зоны ворсин (котиледона) - афункциональные зоны.
4. Расширение просвета сосудов в составе опорных ворсин - от узких до эктазированных артериол и венул.
5. Компенсаторный ангиоматоз - возрастающее количество капилляров в составе мелких, терминальных ворсин.
6. Увеличение количества специализированных ворсин - прирост терминальных ворсин с синцитиокапилярными мембранами - самыми тонкими участками плацентарного барьера.
7. Кальцификаты - объем известковых включений - маркеры переношенной беременности.
8. Толщина синцитиотрофобласта - от обычного, с микроворсинками, до истонченного, атрофичного, с микродефектами.
9. Диссоциированное развитие - отставание в развитии нескольких котиледонов - морфофункциональных единиц плаценты.
10. Суммарная морфологическая оценка степени хронической плацентарной недостаточности - от 0 к 1, 2, 3 степеням.
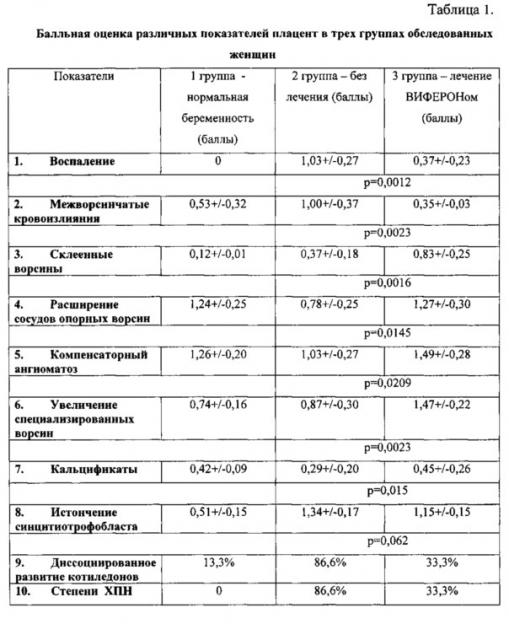
Статистическая обработка полученных данных - критерии сравнения Стьюдента и Манна-Уитни (табл. 1).
После просмотра микропрепаратов, окрашенных гематоксилином и эозином, отбирались из них те, которые были перспективны для выявления вирусных агентов (по 2-3 среза из каждого случая). Выбранные срезы подвергались депарафинизации, наклеиванию на предметные стекла с полилизиновым покрытием. В качестве первичных антител применялись моноклональные мышиные антитела к папилломавирусу (тип 6, 11, 18, фирмы «Novocastra», клон NCL-HPV и к цитокератину-8 (RTU-CK-8-TS1). Использовалась единая система детекции той же фирмы - Novolink ТМ Polymer. Detection System «Novocastra».
Первым этапом иммуногистохимического раздела работы стала проверка эффективности антител для визуализации реакции антиген-антитело. С этой целью взяты три наблюдения операционного материала удаленных папиллом шейки матки, которые были проведены по вышепредставленной технологии.
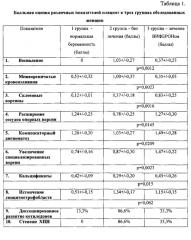
У всех женщин микроскопически выявлена типичная плоскоклеточная папиллома шейки матки из выбухающих узлов с многослойным плоским эпителием и участками акантоза, паракератоза. На большем увеличении видны митозы, преимущественно в ростковой зоне эпителия (Рис. 1,А, увеличение зоны Рис. 1,Б). В субэпителиальной строме выявлена лимфолейкоцитарная инфильтрация, проникающая в отдельных местах в толщу эпителия. Наличие увеличения отдельных ядер эпителиоцитов в нижней трети эпителиального пласта, их пикноз и гиперхроматоз, образование двух- и многоядерных клеток соответствовало по данным Н.И. Кондрикова (2008) (8) цитопатологическому действию папилломавируса человека.
При использовании моноклонального мышиного антитела против папилломавируса человека (тип 6, 11 и 18) получена убедительная реакция антиген-антитело в виде мелкоточечных коричневатых включений в цитоплазме и, отчасти, ядрах клеток ростковой зоны многослойного плоского эпителия шейки матки. Тем самым, получено подтверждение готовности используемого антитела и технологии для визуализации ВПЧ.
Первая группа сравнения:
во всех 15 плацентах отсутствовали признаки воспалительной реакции, что соответствовало отрицательным результатам ПЦР-диагностики вирусов и, в том числе, ВПЧ. Три женщины не включены в данную группу, поскольку при отрицательной ПЦР-диагностике на вирусы в базальных пластинках плацент были обнаружены мелкие очаги лимфолейкоцитарной инфильтрации неясной этиологии.
В целом плаценты отвечали нормальному строению основных структурных компонентов при минимальном объеме патологических реакций, таких как межворсинчатые кровоизлияния, склеенные ворсины, кальцификаты, для которых характерно небольшое количество баллов (табл. 1). В соответствии с доношенным сроком, благополучными родами и новорожденными с нормальной массой тела в плацентах выявлены компенсаторные реакции (табл. 1, показатели 4, 5, 6); Они свидетельствовали об адекватном кровенаполнении сосудов опорных ворсин, компенсаторном ангиоматозе терминальных ворсин - увеличении расширенных капилляров-синусоидов и приближении их к истонченному эпителию (формирование самых тонких участков плацентарного барьера). В отдельных плацентах встречались группы ворсин промежуточного незрелого типа, а также участки с увеличением числа активных синцитиальных почек, что соответствовало неравномерному созреванию котиледонов - морфофункциональных единиц плацентарной ткани. Однако наличие таких ворсин легко компенсировалось соседними котиледонами (диссоциированное развитие плаценты, выявленное в 13,3% всех наблюдений).
В целом, по всем компонентам плаценты соответствовали нормальному строению в доношенном сроке беременности при отсутствии каких-либо признаков острой и хронической плацентарной недостаточности. Ожидаемыми стали и результаты иммуногистохимического исследования, так как в 45 изученных срезах (15 женщин × 3 среза плаценты) не выявлено продукта реакции антиген-антитело, то есть присутствия ВПЧ.
Вторая группа (15) нелеченых женщин.
Собрана из разных роддомов Москвы и Московской области; ПЦР-диагностика подтвердила наличие разных типов ПВЧ в крови, но лечение женщин Вифероном не проводилось, поскольку они не наблюдались нашими коллегами-акушерами во время беременности. В эту группу не вошли 5 женщин из-за неправильной фиксации плацент.
По макроскопии родившиеся плаценты не отличались от группы сравнения; они были овальной формы, нормальной толщины. На материнской поверхности много сгустков материнской крови, которые «уходили» вглубь плацентарной ткани. На поперечных разрезах определялось относительное малокровие при отсутствии очагов некроза.
Микроскопическое исследование в 15 отобранных плацентах выявило воспалительные изменения умеренной степени в виде очаговой лимфолейкоцитарной инфильтрации базальной пластины и линейного скопления сегментоядерных лейкоцитов в субхориальной зоне. По преимущественной локализации преобладал гематогенный путь инфицирования, поскольку в амниальном эпителии признаки воспаления отсутствовали. В целом воспалительный компонент во второй группе женщин был не столь велик (табл. 1, около 1 балла), чтобы реально влиять на развитие плода. Из других патологических реакций отмечено относительное повышение объема межворсинчатых кровоизлияний, склеенных ворсин, но их негативную роль нейтрализовали компенсаторные механизмы, такие как ангиоматоз и увеличение числа синцитиокапиллярных мембран в терминальных ворсинах. Их балльная оценка соответствовала группе сравнения (табл. 1). Вместе с тем, при общем обзоре всех микропрепаратов у конкретных женщин чаще встречались небольшие очаги незрелых ворсин с отдельными стромальными каналами и плацентарными макрофагами - клетками Кашенко-Гофбауэра. Наличие незрелых ворсин (более высокий процент диссоциированного развития котиледонов), воспалительных изменений и выраженного истончения синцитиотрофобласта ворсин обусловили морфологическую диагностику хронической плацентарной недостаточности начальной степени (86,6% от всех плацент).
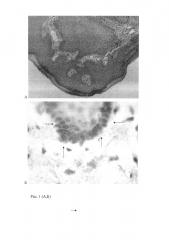
Особый интерес представила иммуногистохимическая визуализация ВПЧ, которая потребовала большого объема микроскопии. Из 15 плацент на препаратах, окрашенных гематоксилином и эозином, отобраны срезы (15×3=45), перспективные для выявления вируса, - это очаги воспалительной инфильтрации в базальной и хориальной пластинках. Реакция антиген-антитело против папилломавируса (тип 6,11 и 18) обнаружена у 5 из 15 женщин (33,3%) в разных компонентах плацент. У 3-х женщин вирусположительные клетки выявлены в составе или возле лимфолейкоцитарных инфильтратов базальных пластин (Рис. 2,A, увеличение зоны Рис. 2,Б). По большим размерам и иммуноположительным гранулам в цитоплазме они соответствуют материнским макрофагам, а мелкие, негативные клетки инфильтрата - лимфоцитам, вероятно, Т-лимфоцитам, поскольку для их идентификации необходимы специальные маркеры.
Кроме того, у одной женщины вирусположительные клетки выявлены в промежуточном цитотрофобласте в составе септы- перегородки, отделяющей ворсины одного котиледона от другого. Септы берут начало от базальной пластины, давая возможность коллатерального кровотока по всей плаценте. В составе септ имеется разновидность цитотрофобласта - периферический цитотрофобласт в отличие от инвазивной формы, проникающей вглубь эндометрия. Вирусположительные клетки концентрировались вокруг остатков замурованной ворсины (Рис. 3,A, увеличение зоны Рис. 3,Б) и в составе фибриноида, некоторые из них находились на краю септы, то есть граничили с материнской кровью.
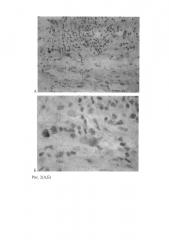
В одном наблюдении вирусположительные клетки выявлены в основании септы, возле базальной пластины (Рис. 4,А), по локализации они соответствовали инвазивному цитотрофобласту. Клетки располагались группами и обнаруживали умеренную иммуноэкспрессию в цитоплазме.
Следует особо подчеркнуть наличие во всех 5 наблюдениях отдельных вирусположительных клеток в межворсинчатом пространстве (рис. 4,Б): они располагались среди эритроцитов и по характерным иммуноэкспрессирующим гранулам в цитоплазме соответствовали материнским макрофагам. Сочетание этих клеток с другими вирусположительными клетками и отсутствие таковых у остальных 10 женщин подчеркивает вирусную инфицированность в 33,3% обследованных беременных женщин.
Таким образом, вторая группа нелеченых женщин с наличием ВПЧ (типы 6, 11 и 18), подтвержденным ПЦР-диагностикой, характеризуется очаговой лимфолейкоцитарной инфильтрацией при сохранении достаточного уровня компенсаторных реакций (ангиоматоз, увеличение синцитиокапиллярных мембран в терминальных ворсинах). Однако по более частому выявлению диссоциированного развития котиледонов, истончению синцитиотрофобласта ворсин, уменьшению притока крови через сосуды опорных ворсин (табл. 1) констатирована начальная (первая степень) хронической плацентарной недостаточности или, по другой терминологии, - компенсированная ХПН. Такую общую морфологическую оценку подтвердила и иммуногистохимическая визуализация ПВЧ, которая выявлена у 5 из 15 женщин, в составе воспалительных инфильтратов базальной пластины, в промежуточном и инвазивном цитотрофобласте, а также в материнских макрофагах в межворсинчатом пространстве плацент
Третья группа женщин, получавших курсовое лечение Вифероном, насчитывала первоначально 30 беременных, из них 15 пациенток исключены из выборки, поскольку у них выявлены экстрагенитальные заболевания (открытый артериальный проток сердца, хронический пиелонефрит (3), двойня, лимфобластный лейкоз в анамнезе, зрелая тератома яичника, миома больших размеров (2), ожирение 3-й степени и другие). Результаты ПЦР-диагностики крови 15 отобранных для анализа случаев таковы: явно преобладали сочетания типов 16 и 18 (соответственно 13 и 5 женщин), реже встречались 31 и 33 тип (по 3 женщины) и единичные находки типов 45, 52, 57 и 58). Примерно у трети пациенток кроме папилломавируса в крови обнаружены цитомегаловирус (5), вирус простого герпеса (6), вирус Эпштейн-Барр (3 женщины). Частота выявления ВПЧ в плаценте составила 33.3%.
При визуальном исследовании 15 родившихся плацент не отмечено каких-либо весомых отличий от первой и второй групп женщин. Плаценты были обычной, овальной формы, без признаков патологии на материнской и плодной поверхностях. На разрезе ткань плаценты полнокровная, но без видимых межворсинчатых кровоизлияний. При балльной оценке компонентов плацент выявлены достоверные различия в сравнении с группой нелеченых беременных женщин. Так, почти в 3 раза меньше обнаружено очагов лимфолейкоцитарной инфильтрации (табл. 1 p=0,0012), межворсинчатых кровоизлияний (p=0,0023), резко увеличилось полнокровие сосудов опорных ворсин (p=0,0145), достигнув значений, сходных с группой сравнения. Компенсаторные реакции возросли - ангиоматоз (p=0,0209) даже чуть превысил нормальные баллы, а увеличение специализированных ворсин превысило соответствующий показатель в группе нелеченых женщин (p=0,0023) и в 2 раза выше, чем в группе сравнения.
Лишь отдельные показатели, такие как количество склеенных ворсин (p=0,0016) и кальцификаты (p=0,015), достоверно увеличились в группе леченых женщин.
В соответствии с преобладающей динамикой гистологических показателей большинство плацент соответствовали доношенному сроку, поскольку очаги незрелых ворсин (диссоциированное развитие котиледонов) отмечены лишь у трети женщин. В сумме начальная или компенсированная степень хронической плацентарной недостаточности диагностирована в 33,3% случаев женщин третьей группы, что выражалось в некотором разбросе массоростовых показателей новорожденных мальчиков и девочек: колебания массы тела от 2400 до 3860 г, длины от 46 до 51 см при нормальных показателях шкалы Апгар - 8-9 баллов.
Ни в одной из плацент третьей группы не выявлены вирусположительные макрофаги в межворсинчатом пространстве, как во второй группе нелеченых женщин.
Результаты: Перед нами ставилась актуальная задача на уровне доказательной медицины проверить эффект Виферона на выявляемость папилломавируса человека в клеточных компонентах плаценты и морфологических критериев компенсаторных реакций, а также хронической плацентарной недостаточности.
Данные результаты, по нашему мнению, являются достоверными, поскольку:
1. Собраны тщательно отобранные, достаточные по объему группы беременных женщин в доношенном сроке. Использованы жесткие критерии исключения женщин с разнообразной экстрагенитальной и акушерской патологией. У всех женщин с помощью ПЦР-диагностики исключено (первая группа сравнения) или подтверждено (вторая и третья группы) наличие разных типов ВПЧ.
2. Для проверки готовности антитела против ВПЧ собран дополнительный операционный материал папиллом шейки матки, где подтверждена иммуногистохимическая визуализация папилломавируса в ростковой зоне эпителия.
3. Использованы общепринятые структурные критерии оценки плацент, компенсаторных реакций и степени хронической плацентарной недостаточности (Жемкова З.П., Топчиева О.И., 1973 (9); Калашникова Е.П., 1987 (10); Милованов А.П., 1999 (11); Краснопольский В.И. и др., 2008 (12); Burton G.J. et al, 2011(13)), а также стандартные способы статистической обработки материала.
Сопоставляя результаты иммуногистохимической визуализации ВПЧ и балльной оценки структурных компонентов плацент во второй (нелеченой) и третьей (леченой) группах беременных женщин, получены весомые доказательства эффективности использованного курсового лечения Вифероном.
Во-первых, если в первой группе сравнения ВПЧ не выявлен вообще, то во второй, нелеченой группе, он обнаружен у 1/3 обследованных женщин в составе воспалительных инфильтратов, промежуточном и инвазивном цитотрофобласте, а также в материнских макрофагах в межворсинчатом пространстве плацент, что свидетельствовало о несомненной инфицированности этим вирусом определенной части женщин второй группы. Частота выявления ВПЧ в плаценте у пациенток без лечения составила 33,3%.
Во-вторых, морфометрическое сопоставление второй и третьей групп обследованных женщин подтвердило вышеизложенные данные, поскольку у женщин, леченых Вифероном, достоверно меньше стало явных признаков патологии, таких как воспалительная инфильтрация (почти в 3 раза, межворсинчатые кровоизлияния (в 2,5 раза), истончение синцитиотрофобласта и, главное, уменьшение участков незрелых ворсин (диссоциированное развитие котиледонов), а также диагностированной начальной степени хронической плацентарной недостаточности.
В-третьих, достоверным новым фактом стало выявление в микропрепаратах плацент у женщин, леченых Вифероном, возросшего объема компенсаторных реакций, таких как ангиоматоз терминальных ворсин, увеличение числа специализированных ворсин с тонким плацентарным барьером, а также расширение сосудов опорных ворсин, что означает адаптационное увеличение притока венозной крови от плода к плаценте и увеличение контакта ее с материнской кровью за счет тонких участков плацентарного барьера. Подобная структурная перестройка капилляров и эпителия ворсин обеспечивает компенсаторное увеличение диффузионной способности плацент (Милованов А.П., 1999 (11)), в группе леченых женщин.
В-четвертых, имеются весомые основания считать, что Виферон обладает дополнительными полезными свойствами, такими как оптимизация гемостаза в межворсинчатом пространстве плацент, а также более полноценное созревание ворсин; можно предположить, что эти эффекты зависят от второго компонента Виферона - антиоксидантной системы.
Таким образом, проведенные нами исследования подтвердили возможность применения Виферона у беременных женщин с ПВИ для профилактики фетоплацентарной недостаточности и предотвращения инфицирования плаценты.
Л итература
1. Н.В. Зароченцева и др. Вирус папилломы человека и беременность, Вестник Ферона 2013, №1, С. 17.
2. Буданов П.В. Беременность, Иммунитет и инфекции, Вестник Ферона, 2013, №1, С. 5
3. BY 15772 30.04.2012 С1.
4. Gomez L.M. Ma Y. Et al. - Placental infection with human papillomavirus is associated with spontaneous preterm delivery. Hum. Reprod. 2008; 23(3): 709-715.
5. Zuo Z. Goel S. Carter J.E. - Association of cervical cytology and HPV DNA status during pregnancy with placental abnormalities and preterm birth. Amer. J. Clin. Pathol. 2011; 136(2): 260-265.
6. Логутова Л.С., Малиновская B.B. и др. - Место интерферонкорригирующей терапии в лечении плацентарной недостаточности в современных условиях. Российск. Вест. Акуш. гинекол. 2011, №3, 80-82.
7. Новикова С.В., Малиновская В.В. и др. - Лечение плацентарной недостаточности в современных условиях. Репрод. медицина, КАРМ, 2011, 3-4 (8-9): 66-68.
8. Кондриков Н.И. - Патология матки. Практ. медицина, М., 2008, 334 с.
9. Жемкова З.П., Топчиева О.И. - Клиникоморфологическая диагностика недостаточности плаценты. - Л.: «Медицина», 1973, 182 с.
10. Калашникова Е.П. - патоморфология плацентарной недостаточности. - Вестн. АМН СССР. 1987., №1., с 11-17.
11. Милованов А.П. - Патология системы мать-плацента-плод. - М.: Медицина, 1999, 448 с.
12. Краснопольский В.И. - Компенсаторные механизмы развития плода в условиях плацентарной недостаточности. - М. «Медкнига», 2008, 298 с.
13. The Placenta and Human Developmental Programming. Ed. G.J. Burton et al. 2011, Cambridge, Univ. Press, 246p.
Применение препарата Виферон для профилактики фетоплацентарной недостаточности и инфицирования плаценты у беременных женщин с папиловирусной инфекцией.