Способ лечения тяжелых форм псориаза
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к дерматовенерологии, и касается лечения тяжелых форм псориаза. Для этого осуществляют комплексное лечение, включающее введение препаратов для улучшения микроциркуляции, десенсибилизирующих и деинтоксикационных средств, местную терапию и введение иммуномодулятора стемокина. Стемокин вводят внутримышечно 1 мл раствора в течение 7 дней, делают два дня перерыв, курс лечения повторяют. Далее интраназально вводят стемокин в виде спрея в каждый носовой ход 2 раза в неделю в течение 2 месяцев. Такой режим введения иммуномодулирующего препарата обеспечивает достижение выраженной клинической ремиссии и удлинение межрецидивного периода. 10 табл., 1 пр.
Реферат
Изобретение относится к медицине, а именно к дерматовенерологии, и может быть использовано для лечения тяжелых форм псориаза.
Актуальность проблемы псориаза обусловлена его широкой распространенностью от 0,1 до 10%, склонностью к рецидивирующему течению, ростом заболеваемости в последние годы [Lima Х.Т., Minnillo R., Spencer J.M., Kimball A.B. Psoriasis prevalence among the 2009 AAD National Melanoma.Skin Cancer Screening Program participants. J Eur Acad Dermatol Venereol. 2012 Apr 4. doi: 10.1111/j. 1468-3083.2012.04531.x. [Epub ahead of print; Короткий Н.Г., Уджуху А.Э., Абдулаева А.Э., Терапевтические возможности тимодепрессина у больных псориазом и механизмы его лечебного действия. // Поликлиника, 2013 -№1- С. 105-107], тенденцией к увеличению частоты тяжелых, инвалидизирующих форм заболевания, таких как псориатическая артропатия, значительно ухудшающих качество жизни [Кунгуров Н.В., Кохан М.М., Филимонкова Н.Н., Гришаева Е.В., Кениксфест Ю.В., Кащеева Я.В.//Вестник дерматологии и венерологии. - 2008. №2. С. 23-28; Ступин А.В. Полиненасыщенные жирные кислоты в комплексной терапии различных форм псориаза на примере жителей приморского края, (клинико-экспериментальное исследование) автореферат. 2009. С. 22.].
Лечение псориаза остается актуальной проблемой дерматологии, так как, несмотря на широкий спектр терапевтических средств в настоящий момент нет препаратов, приводящих к полному излечению заболевания. При выборе же терапии больным псориазом учитывают возраст, стадию, клиническую форму и распространенность процесса, наличие сопутствующей патологии. /Комплексная иммуномодулирующая терапия больных псориазом /Короткий Н.Г., Уджуху В.Ю., Абдулаева А.Э. и др.// Рос. журнал кожных и венерических болезней. - 2001. - №1. - С. 14-16.]. Особенную проблему составляет лечение тяжелых форм псориаза, так как необходимое лечение часто имеет осложнения, либо дорогостоящее, либо не приводит к длительной ремиссии.
Известен способ лечения с использованием биологического препарата инфликсимаб, который исключает провоспалительные цитокины из каскада иммунопатологического процесса [Пирятинская В.Α., Карякина Л.Α., Пирятинская А.Б., Лалаева A.M., Грибанова Т.В., Смирнова О.Н.. Псориаз. Дифференциальная диагностика. Принципы лечения. Клиническая дерматология и венерология. - 2011. - №1 - С. 87 -88.] Являясь высокоаффинным целевым антителом, при попадании в организм, он непосредственно связывается со своей специфической цитокиновой молекулой-мишенью, тем самым прерывает развитие воспаления в коже, без включения в метаболические процессы [Курдина М.И.. Новое в системной терапии псориаза. Клиническая дерматология и венерология. 2011. - №5. - С. 54-59.].
Однако данный способ терапии является дорогостоящим и составляет 1 млн. руб. в год, при этом существует возможность невосприимчивости пациента к лечению, а также возникновение нежелательных инфекций и осложнений со стороны сердечно - сосудистой системы. [Чикин В.В., Знаменская Л.Ф., Минеева А.А. Патогенетические аспекты лечения больных псориазом. Вестник дерматологии и венерологии. - 2014. - №5. - С. 86-89].
Наиболее близким является способ применения традиционной терапи-ии в сочетании с тимодепрессином при различных формах псориаза. [Короткий Н.Г., Уджуху А.Э., _ Абдулаева А.Э., Терапевтические возможности тимодепрессина у больных псориазом и механизмы его лечебного действия. // Поликлиника, 2013 -№1- С. 105-107]. Данный синтетический пептид, состоящий из D-аминокислот (глутаминовой кислоты и триптофана) ингибирует реакции гуморального и клеточного иммунитета, обратимо снижает общее количество лимфоцитов (как хелперов, так и супрессоров), угнетает спонтанную выработку TNF-α, усиливает выработку интерлейкина -7, не влияет на выработку интерлейкина 1, подавляет колониеобразование и вступление стволовых клеток - предшественников кроветворения в S - фазу. Однако лечение тяжелых форм псориаза заключается в ведении 2 мл раствора внутримышечно 1 раз в день в течение 21 дня.
Данный способ лечения финансово достаточно затратен, кроме того, препарат чистый иммуноссупрессор, что может привести к побочным эффектам.
Задачей изобретения является разработка комбинированной терапии, которая позволяет добиться стойкого и выраженного результата за счет применения иммуномодулятора стемокина.
Поставленная задача достигается способом лечения тяжелых форм псориаза, включающим проведение традиционной терапии с использованием препаратов для улучшения микроциркуляции, десенсибилизирующих и де-интоксикационных, наружную терапию в сочетании с приемом иммунокор-ректора. В качестве иммунокорректора используют иммуномодулятор сте-мокин. Стемокин вводят внутримышечно 1 мл раствора в течение 7 дней, делают два дня перерыв, курс лечения повторяют. Далее интраназально вводят стемокин в виде спрея в каждый носовой ход 2 раза в неделю в течение 2 месяцев.
Новизна способа:
- В качестве иммунокорректора используют иммуномодулятор стемокин. L - изолейцил - L - глутамил - L - триптофана натриевая соль-иммуномодулятор; увеличивает резистентность организма в отношении локальных и генерализованных инфекций; вызывает нормализацию измененных иммунологических показателей (относительного и абсолютного количества лимфоцитов, CD3+, CD8, CD 19, CD 16+ лимфоцитов, поглотительной способности моноцитов по отношению к St. aureus); увеличение показателей спонтанной хемилюминесценции и аффинности к общей антигенной детерминанте антител; увеличение количества HLA-DR+ лимфоцитов; обладает выраженной детоксика-ционной активностью.
- Стемокин вводят внутримышечно 1 мл раствора в течение 7 дней, делают два дня перерыв, курс лечения повторяют.
- Далее интраназально вводят стемокин в виде спрея в каждый носовой ход 2 раза в неделю в течение 2 месяцев.
Совокупность существенных признаков изобретения позволяет получить новый технический результат, у пациентов с тяжелой формой псориаза заключающийся в получении клинического улучшения подтвержденного снижением индекса PASI на 50% и более у 85% пациентов, сопровождающийся значительным снижением концентраций отдельных цитокинов в крови (TNF-α, IL-6) и повышением содержания регуляторно- транспортных белков (ЛФ, a1-AT), статистически значимо нормализуется уровень а2-МГ. Отсутствуют рецидивы псориаза у 69% и 62% больных через 3 и 6 месяцев соответственно.
Препарат стемокин хорошо переносится, не обладает митогенной, поликлональной активностью, антигенными свойствами, не оказывает аллергизирующего, мутагенного, эмбриотоксического, тератогенного и канцерогенного действия.
Фармакокинетика: При парентеральном введении препарата максимальная концентрация (Сmах) в крови достигается через 5 минут; в костном мозге, печени, почках, лимфатических узлах Сmах наблюдается через 30-40 минут после введения.
Период полувыведения препарата составляет 24 часа, полностью выводится из организма в течение 72 часов с момента введения. Метаболиты препарата выводятся преимущественно с мочой - до 60%, до 20% - с калом.
Показаниями для назначения данного препарата являются фурункул, абсцесс, карбункул. Данный препарат для лечения тяжелых форм псориаза не использовался.
Механизм действия L - изолейцил -L - глутамил - L - триптофана натриевой соли основан на влиянии препарата на процесс пролиферации и дифференцировки ранних клеток-предшественников гемопоэза. [Энциклопедия лекарственных средств]. Препарат оказывает корригирующее действие на клеточные и гуморальные звенья иммунитета, нормализуя цитокиновый профиль, однако механизм действия и точки приложения данного препарата до конца не изучены [Борисов И.В. Клинико-иммунологическое обоснование патогенетической терапии генитального герпеса. Автореф. дис. канд. мед. наук. М., 2007]. Максимальная тропность препарата выявлена к костному мозгу.
Среди пусковых механизмов развития псориаза прежде всего имеет значение эмоциональный стресс и психоэмоциональный статус пациента, однако наличие инфекционных заболеваний, очагов хронической инфекции (тонзиллит, гайморит, инфекции верхних дыхательных путей) также может спровоцировать появление первых признаков псориаза. [О.Ю. Олисова. Псориаз: эпидемиология, патогенез, клиника, лечение Дерматология. Con. med. - 2010/ - №4. - С. 3-8]. Таким образом, увеличивая резистентность организма в отношении локальных и генерализованных инфекций L - изолейцил -L -глутамил - L - триптофана натриевая соль воздействует на один из главных тригерных факторов, снижая риск обострений.
L - изолейцил - L - глутамил - L - триптофана натриевая соль влияет на процессы дифференцировки лимфоидных клеток, индуцируя экспрессию дифференцировочных антигенов на лейкоцитах.
После воздействия облучения, приема цитостатических препаратов L - изолейцил - L - глутамил - L - триптофана натриевая соль ускоряет восстановление популяции коммитивированных и полипотентных клеток - предшественников гемопоэза.
Способ осуществляется следующим образом. Проводят обследование пациента с определением выраженности поражения, эритемы, шелушения и инфильтрации с помощью определения индекса PASI, который больше 50, либо когда псориатические бляшки имеют экссудативный компонент, на основании чего определяют тяжелую форму псориаза. Назначают традиционное лечение, включающее препараты для улучшения микроциркуляции, десенсибилизирующие и деинтоксикационные препараты, проводят наружную терапию. Назначают прием иммунокорректора.
Общепринятое лечение больных осуществляется согласно клиническим рекомендациям больным с псориазом, подготовленным Экспертным советом Российского общества дерматовенерологов и включает:
- антигистаминные препараты
- препараты для улучшения микроциркуляции: пентоксифиллин 2%-5 мл на 200 мл 0,9% физиологичского раствора внутривенно капельно №5-10, никотиновая кислота 1%-1 мл внуримышечно №5-10,
- гипосенсибилизирующую и эфферентную терапию (кальция хлорид 1%-100 мл, реамберин 400 мл внутривенно капельно),
- витаминотерапию (витамины В5, В6, В12),
- эссенциале 10,0 в/в №10 с последующим его назначением per os до 3 месяцев.
- у пациентов с тяжелой формой псориаза в лечении применялся метат-рексат в дозе 15 мг/неделю 2-3 недели.
В наружной терапии использовались: 2% салициловая и папавериновая мази, мази на основе солидола (карталин, пикладол), местные глюкокортико-стероидные препараты (гидрокортизон, мометазона фуроат) в зависимости от клинических проявлений процесса. Также в лечении применялись физиотерапевтические методы: сеансы общего кварца, кислородные ванны.
Для усиления лечения назначают иммуномодулятор стемокин 1 мл (0,1 мг) раствора в течение 7 дней - 2 курса с двухдневным перерывом. Далее назначают интраназальное введение стемокина в каждый носовой ход 2 раза в неделю в течение 2 месяцев для профилактики рецидивирования кожного процесса.
Обследовано 66 пациентов в возрасте от 18 до 45 лет с установленным диагнозом: «Псориаз, прогрессирующая стадия», без предварительного специфического лечения в течение 2-6 месяцев, индекс PASI составлял более 50, либо присутствовал экссудативный компонент.
Критерии исключения: Возраст младше 18 или старше 45 лет; наличие острых инфекционных заболеваний и обострений сопутствующих хронических заболеваний, паразитарной инвазии на момент исследования, аллергических, аутоиммунных и онкологических заболеваний, сахарного диабета, эпилепсии, психических заболеваний; наличие проявлений заболевания в виде псориатического артрита; прием иммунотропных препаратов; беременность, лактация; отсутствие добровольного информированного согласия.
Кроме того, было обследовано 30 практически здоровых доноров в возрасте 20-40 лет (мужчины и женщины) сопоставимого возраста, отобранных по результатам плановой диспансеризации (контрольная группа). В момент обследования доноры были клинически здоровы, без хронических заболеваний, им не проводились профилактические прививки и не назначались имму-нотропные препараты в течение последних 2 месяцев. Они не имели отягощенного семейного, аллергологического и иммунологического анамнеза.
Верификация диагноза псориаза основывалась:
1. На наличии папулезных элементов розово-красного цвета с четкими границами, плотной консистенции, возвышающихся над уровнем кожи, склонных к слиянию и образованию бляшек различной формы и величины, покрытых мелкими, рыхлыми чешуйками серебристо-белого цвета, легко отпадающими при поскабливании; типичной локализации высыпаний (разгибательные поверхности верхних и нижних конечностей, область поясницы, волосистая часть головы); поражении ногтевых пластин в виде симптомов наперстка, масляного пятна, онихолизиса, ониходистрофии и онихогрифоза.
2. На диагностических феноменах (псориатическая триада): а) феномен стеаринового пятна: при поскабливании папул и бляшек наблюдается усиление шелушения, придающего поверхности папул некоторое сходство с каплей стеарина; б) феномен терминальной пленки: появление после полного удаления чешуек влажной, тонкой, блестящей, просвечивающей поверхности элементов; в) феномен кровяной росы (феномен Ауспитца): при дальнейшем поскабливании после отторжения терминальной пленки на обнажившейся влажной поверхности возникает точечное (капельное) кровотечение.
3. На наличии феномена Кебнера (возникновение новых элементов на месте механического или химического раздражителей).
4. На жалобах пациентов: зуд различной степени интенсивности.
Пациенты были разделены на группы: группу 2А составили больные тяжелой формой псориаза, который применяли только общепринятое лечение, в группу 2Б вошли пациенты с тяжелой формой псориаза, у которых наряду с общепринятой терапией (за исключением метатрексата) применялся современный отечественный иммуномодулятор, являющейся натриевой солью синтетического пептида, состоящего из L-аминокислотных остатков изолейцина, глутаминовой кислоты и триптофана (стемокин). Регистрационный номер: №ЛСР-003014/09 от 16.04.2009. Пациентам внутримышечно вводили 1 мл (0,1 мг) раствора в течение 7 дней, после двухдневного перерыва курс повторяли, а далее было назначено интраназальное введение стемокина в каждый носовой ход 2 раза в неделю в течение 2 месяцев.
Обследование основной группы включало сбор анамнеза, инструментальные методы исследования (дуоденальное зондирование), стандартное лабораторное обследование, включавшее: общий анализ крови с формулой, общий анализ мочи; исследование крови на сифилис, уровень общего белка, сахара, билирубина, холестерина, АЛТ, ACT; ИФА крови на определение AT к АГ описторхий и лямблий, кал на простейшие, кал на дисбактериоз.
При поступлении среднее значение индекса PASI у пациентов с тяжелой формой псориаза группа 2А составило 48,4±2,03, в группе 2Б - 51,8±2,4, с практически одинаковыми значениями у мужчин и у женщин.
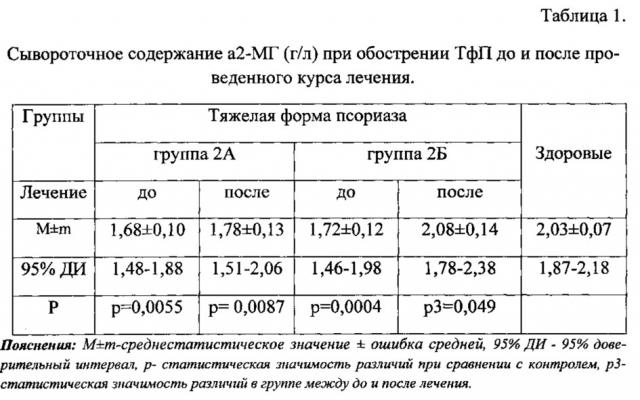
При сравнительном изучении влияния традиционной терапии и терапии с применением иммуномодулятора стемокина у пациентов с ТфП (группы 2А и 2Б соответственно) установлено, что в группе больных, принимавших комбинированное лечение с иммуномодулятором, при исходно сопоставимом с традиционной терапией и значимо сниженном уровне а2-МГ до лечения (p1=0,0004), после лечения происходит нормализация данного показателя.
Выявлены статистически значимые различия между группами 2А и 2Б после лечения (р=0,049), что подтверждает более выраженную эффективность комбинированной терапии с применением стемокина по сравнению с общепринятой схемой лечения (табл. 1).
При исследовании концентрации a1-AT после проведенной терапии у пациентов тяжелой формой в группе 2А отмечена незначительная тенденция к снижению данного показателя и отсутствие отличий от уровня, характерного для здоровых доноров. На фоне проведенной общепринятой терапии в сочетании с иммуномодулятором (группа 2Б) наоборот отмечалось нарастание уровня a1-AT в сыворотке крови со статистически значимым различием в сравнении с контролем р=0,0006 при этом патологически высокий уровень a1-AT выявлен у 30% пациентов (табл. 2).
При изучении содержания лактоферрина отмечены еще более выраженные изменения: до лечения сывороточная концентрация ЛФ была статистически значимо повышена, в сравнении с контрольной группой, в группах 2А и 2Б (табл. 3).
После проведенного общепринятого лечения в группе 2А отмечена тенденция к снижению средней концентраций лактоферрина у 56%, однако его уровень оставался статистически значимо высоким по сравнению с контролем (р=0,0001). После комбинированного лечения с применением стемокина уровень ЛФ нарастал и также статистически значимо отличался от группы контроля (р=0,0001) (табл. 3).
При этом индивидуальная вариабельность у больных до и после лечения увеличивалась примерно вдвое по сравнению с контрольной группой (табл. 3). Патологически высокий уровень (3,62 мкг/мл) обнаруживался у 36,6% больных тяжелой формой псориаза.
Кроме того, для выяснения влияния терапии на иммунологические показатели, мы изучили сывороточный уровень некоторых цитокинов, принимающих активное участие в развитие клинической картины и поддержании воспалительной реакции, способствующих хронизации и рецидивированию кожного процесса.
Выявлено, что концентрация IL-1β, до и после терапии в группах 2А и 2Б была статистически неизменной и значимо не отличалась от уровней, характерных для здоровых доноров (табл. 4), таким образом, нам не удалось выявить влияния проведенного лечения на уровень IL-1β.
Более выраженные различия демонстрировала концентрация TNF-α: до лечения обнаруживалось статистически значимое повышение цитокина во всех группах больных псориазом (табл. 5). На фоне общепринятой терапии (группа 2А) не происходило нормализации показателя TNF-α в сравнении с контролем, в то время как после лечения с применением иммуномодулятора (группа 2Б) отмечалось уменьшение концентрации TNF-α в сыворотке крови более чем в 2 раза практически до показателей контроля (табл. 5), и если до лечения мы видим статистическую значимость различий в сравнении с контрольной группой, то после комбинированного лечения значимости нет.
Индивидуальная вариабельность в группах до лечения была сопоставимой, а после лечения увеличивалась (табл. 5).
Изучение концентрации IL-8 в сыворотке крови показало, что статистически значимое увеличение наблюдалось в группе 2А, в группе 2Б отмечалось повышение содержания IL-8 без значимых различий в сравнении с контролем (табл. 6).
При определении влияния проведенного курса терапии на концентрацию IL-8 отмечено, что в группе 2А имелась тенденция к снижению содержания цитокина на фоне лечения у 71% пациентов, но, не смотря на это, его уровень был статистически значимо повышен относительно контрольной группы. После применения комплексного лечения в сочетании со стемокином отмечалось повышение концентрации IL -8, однако статистически значимых различий не было, что вероятно связано с большой индивидуальной вариабельностью показателя как до, так и после лечения (табл. 6).
Анализ концентрации IFN-γ до курса терапии в группе 2А и 2Б показал (табл. 7), что его уровень в сыворотке крови был значимо выше, чем в группе контроля. Определение содержания IFN-γ после проведенного общепринятого курса терапии выявило снижение IFN-γ в 54% случаев, но он оставался статистически значимо высоким при сравнении с контрольными показателями.
В группе с ТфП на фоне применения общепринятой терапии и иммуномодулятора конценрация IFN-γ в сыворотке крови оставалась практически неизмененной с сохранением статистической значимости различий с контролем. Индивидуальная вариабельность уровня IFN-γ до и после лечения была сопоставимой с контролем.
Концентрация IL -6 демонстрировала выраженные различия: сывороточное содержание IL -6 во всех группах было статистически значимо повышено, в сравнении с контрольными показателями с высокой вариабельностью показателя (табл. 8).
Изучение содержания IL - 6 после проведенного общепринятого лечения показало, что оно имело тенденцию к повышению, в то время как на фоне лечения стемокином была выявлена тенденция к снижению концентрации IL - 6, однако статистическая значимость различий в сравнении с контролем сохранялась (табл. 8).
Изучение влияния терапии на регуляторно-транспортные белки и цитокины у пациентов с тяжелой формой течения псориаза показало, что их среднестатистические концентрации не изменялись после общепринятого лечения, что может свидетельствовать о недостаточной эффективности терапии, направленной не столько на излечение заболевания, сколько на купирование его проявлений. При добавлении в схему лечения иммунорегуляторного препарата стемокин нами отмечена нормализация концентрации а2-МГ, тенденция к росту a1-AT и ЛФ, двукратное снижение содержания TNF-α, играющего немаловажную роль в патогенезе псориатической болезни, а также снижение концентрации IL-6, в то время как при общепринятой терапии при ТфП он еще больше повышается.
Критерием клинической эффективности назначенного лечения являлось уменьшение жалоб, регресс очагов или стабилизация процесса. Объективным критерием явилось снижение показателей индекса PASI.
В результате проведенного традиционного лечения, зафиксировано снижение индекса ΡASI на 75% и более, что соответствует выраженному улучшению клинической картины у 30,8% больных с ТфП в группе 2Б в сравнении с 12,5% в группе 2А. У 14 пациентов в группе 2Б и у 22 больных в группе 2А индекс PASI снизился на 50-74%, что соответствовало удовлетворительному улучшению. Незначительная динамика кожного процесса отмечалась лишь у 4 человек в группе с комбинированным лечением, в то время как после общепринятой терапии 12 человек имели данной улучшение.
Лишь у 1 больного (2,5%) с ТфП не было видимого улучшения процесса. При описании клинико-морфологических изменений у пациентов с комплексной терапией, включающей иммуномодулятор стемокин, важно отметить, что к 3-4 дню лечения у 5 пациентов (19,2%) отмечалось усиление гиперемии бляшек на фоне снижения остальных проявлений: шелушение инфильтрация.
В группах оценивались отдаленные результаты проводимого лечения по прошествии 3 и 6 месяцев методом анкетирования (табл. 10): через 3 месяца рецидивирование псориаза отмечали 31% больных во 2 группе, при этом стрессовые ситуации у 7 больных явились причиной обострения, в то время как в 1 группе после отмены лечения, включая метатрексат 56% пациентов указывали на обострение кожного процесса. Через 6 месяцев обострение процесса отметили 38,4% в группе 2Б и 71% в группе 2А. При статистическом анализе установлено достоверное улучшение процесса при сравнении групп 1 и 2: через 3 месяца Х2=6,73, р=0,035; через 6 месяцев Х2=4,67, р=0,031. Через 6 месяцев 2 пациента указали на прогрессирование заболевания на фоне применения алкогольных напитков.
Хотелось бы отметить, что все пациенты группы 2Б отмечают улучшение общего самочувствия, а также толерантность к инфекциям на фоне лечения и через 3 и 6 месяцев после.
Таким образом, можно констатировать, что в результате лечения имелась хорошая положительная динамика клинической картины псориаза: снижение не только объективных жалоб, но и выраженности кожных проявлений. При этом, легкая форма дерматоза лучше поддавалась традиционному лечению, в то время как значительное улучшение процесса и более стойкая ремиссия у пациентов с ТфП отмечалось у 30,8% с применением иммуномодулятора стемокин в сравнении с 12,5% на фоне традиционной терапии.
Клинический пример:
Больной Ч, 42 года, госпитализирован в дерматовенерологическое отделение с диагнозом: Псориаз бляшечный, частичная эритродермия, прогрессирующая стадия. При осмотре индекс PASI равен 62, что соответствовало тяжелой форме псориаза. Учитывая, что при обследовании TNF-α=7,2 пкг/мл, IL-6=8,45 пкг/мл, а2-МГ=0,8 г/л, пациенту проведена общепринятая терапия: реамберин 400 мл внутривенно капельно №10, тиосульфат натрия 30% - 10 мл внутривенно №5, в сочетании с иммуномодулятором стемокином. Стемокин вводили внутримышечно 1 мл раствора в течение 7 дней, делали два дня перерыв, курс лечения повторяли, далее интраназально вводили стемокин в виде спрея по одной дозе в каждый носовой ход 2 раза в неделю в течение 2 месяцев. Наружно пациент применял 2% салициловую мазь в сочетании с метилпреднизолона ацепонатом. Регресс или дефрагментация отдельных очагов отмечалась уже после первого курса терапии, т.е. на 8 день. К 18 дню индекс PASI регрессировал на 80%. и составлял 15. Контроль через 3 и 6 месяцев показал отсутствие обострения кожного процесса.
Больная П, 34 года, госпитализирована в дерматовенерологическое отделение с диагнозом: Псориаз бляшечный с экссудативным компонентом, прогрессирующая стадия. При осмотре индекс PASI равен 34.Учитывая данный показатель и наличие экссудации процесс соответствовал тяжелой форме псориаза. При обследовании TNF-α более 6 пкг/мл, IL-6 более 6,5 пкг/мл, а2-МГ≤1,5 г/л, в связи с чем пациентке проведена общепринятая терапия: реамберин 400 мл внутривенно капельно №10, тиосульфат натрия 30%-10 мл внутривенно №5, в сочетании с иммуномодулятором Стемокином, который вводили внутримышечно 1 мл раствора в течение 7 дней, делали два дня перерыв, курс лечения повторяли, далее интраназально вводили стемокин в виде спрея по одной дозе в каждый носовой ход 2 раза в неделю в течение 2 месяцев. Наружно пациент применял 2% салициловую мазь в сочетании с метилпреднизолона ацепонатом. Регресс или дефрагментация отдельных очагов отмечалась уже после первого курса терапии, те на 8 день. К 18 дню индекс PASI регрессировал на 80%. и составлял 15. Контроль через 3 и 6 месяцев показал отсутствие обострения кожного процесса.
Таким образом, нам удалось разработать достаточно эффективный способ лечения тяжелых форм псориаза с получением выраженной клинической ремиссии и удлинением межрецидивного периода.
Способ лечения тяжелых форм псориаза, включающий проведение традиционной терапиии с использованием препаратов для улучшения микроциркуляции, десенсибилизирующих и деинтоксикационных, наружную терапию в сочетании с приемом иммунокорректора, отличающийся тем, что в качестве иммунокорректора используют иммуномодулятор стемокин, который вводят внутримышечно 1 мл раствора в течение 7 дней, делают два дня перерыв, курс лечения повторяют, далее интраназально вводят стемокин в виде спрея в каждый носовой ход 2 раза в неделю в течение 2 месяцев.