Способ прогнозирования развития коморбидной формы артериальной гипертензии и хронической обструктивной болезни легких
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для прогнозирования развития коморбидной формы артериальной гипертензии (АГ) и хронической обструктивной болезни легких (ХОБЛ). У больного АГ или ХОБЛ определяют генотипы полиморфного локуса М235Т гена ангиотензиногена (AGT) и полиморфного локуса A1166C гена рецептора I типа агиотензина II (AGTR1). При наличии у больного генотипа Т/Т полиморфного локуса М235Т гена AGT и генотипа А/С полиморфного локуса А1166С гена AGTR1 прогнозируют высокую вероятность развития коморбидной АГ и ХОБЛ в течение 10 лет после дебюта первого из заболеваний. Изобретение позволяет с высокой долей вероятности прогнозировать развитие коморбидной формы АГ и ХОБЛ. 1 з.п. ф-лы, 1 ил., 10 табл., 4 пр.
Реферат
Изобретение относится к медицине, а именно к кардиологии, пульмонологии и превентивной медицине и может быть использовано для прогнозирования развития коморбидной формы патологии артериальная гипертензия в сочетании с хронической обструктивной болезнью легких.
Хроническая обструктивная болезнь легких (ХОБЛ) - заболевание, характеризующееся нарушением вентиляционной функции по обструктивному типу, частично обратимому, которое обычно прогрессирует и связано с повышенным хроническим воспалительным ответом легких на действие патогенных частиц или газов. У ряда пациентов обострения и сопутствующие заболевания могут влиять на общую тяжесть ХОБЛ [4, 11].
Под термином "артериальная гипертензия" (АГ) подразумевают синдром повышения систолического артериального давления (АД) более 140 мм рт.ст. и/или диастолического АД более 90 мм рт.ст. Под гипертонической болезнью или эссенциальной артериальной гипертензией принято понимать хронически протекающее заболевание, при котором повышение АД не связано с выявлением явных причин, приводящих к развитию вторичных форм АГ [5, 15].
Как АГ, так и ХОБЛ являются одними из самых распространенных хронических неинфекционных заболеваний человека и составляют значительную проблему современной медицины. На сегодня ХОБЛ является третьей причиной заболеваемости и смертности взрослого населения, на втором месте - инсульт [10], который рассматривают как суррогатный показатель АГ, так как именно АГ является его основной причиной [9].
Распространенность самой АГ оценивается как 35 - 45% популяции в целом [8].
Под термином «коморбидность» понимают наличие у больного одновременно двух и более нозологических форм, возникновение и развитие которых патогенетически взаимосвязано [6]. Коморбидное состояние модифицирует течение каждого заболевания. АГ и ХОБЛ - одно из наиболее частых сочетаний бронхолегочной и кардиоваскулярной патологии [6, 17], для которого характерно утяжеление течения обоих патологических процессов. Фактически, коморбидность АГ и ХОБЛ представляет собой качественно новое состояние, отличающееся по патогенетическим механизмам и клиническим проявлениям от изолированного течения заболеваний, требующее ранней и отличной от изолированного течения болезней терапевтической стратегии [7, 16, 17]. Прогнозирование коморбидного течения АГ в сочетании с ХОБЛ актуально в современной клинике внутренних болезней, так как необходимо для совершенствования программ диспансеризации, разработки индивидуальных профилактических мероприятий, ранней диагностики ХОБЛ у больного АГ и, наоборот, АГ у больного ХОБЛ, своевременного начала терапии именно коморбидного состояния. Учитывая патогенетические и клинические особенности коморбидности АГ и ХОБЛ [7, 16, 17], прямая экстраполяция данных о предикторах заболевания, полученных при изучении больных с изолированной патологией, невозможна, коморбидное состояние требует отдельного изучения.
В настоящее время в пульмонологии и кардиологии известны следующие способы, позволяющие прогнозировать развитие коморбидной патологии АГ и ХОБЛ.
Известен способ скрининговой оценки развития ХОБЛ, ассоциированной с наличием АГ, описанный в патенте на изобретение России №2565018 (опубликован 10.10.2015). Проводят спирометрию у лиц с АГ. Определяют показатели объема форсированного выдоха за первую секунду FEV1 (ОФВ1), форсированной жизненной емкости легких FVC (ФЖЕЛ) и отношение этих двух показателей FEV1/FVC (ОФВ1 / ФЖЕЛ). При значениях FEV1 (ОФВ1) 85-80% и FEV1/FVC (ОФВ1/ФЖЕЛ) 75-70% прогнозируют риск развития или раннюю стадию ХОБЛ. Способ позволяет провести своевременное лечение за счет проведения спирометрии у лиц с АГ.
Недостатком способа является то, что он основан на обнаружении уже сформировавшегося ограничения бронхиальной проходимости, но еще не соответствующего принятым диагностическим критериям, следовательно, он позволяет осуществить только краткосрочный прогноз, и результаты прогноза будут применимы прежде всего для целей ранней диагностики ХОБЛ и в меньшей степени для профилактики развития болезни. Метод не позволяет выявить пациентов высокого риска развития ХОБЛ среди лиц с нормальными показателями вентиляционной функции легких. Кроме того, вентиляционная функция легких может быть изменена за счет других заболеваний бронхолегочной, костно-мышечной систем, обменных нарушений, что ограничивает область применения метода.
Известен способ прогнозирования развития АГ у больных ХОБЛ, описанный в статье Ахминеевой А.Х. и соавт. «Прогнозирование развития артериальной гипертензии и ишемической болезни сердца у больных хронической обструктивной болезнью легких» (Курский научно-практический вестник "Человек и его здоровье". - 2014. - №4. - С. 29-34).
Способ заключается в том, что у больного ХОБЛ общепринятыми в данной области техники способами определяют возраст и коэффициент эндотелиальной функции, далее решают уравнение p=1/1+e-z, где z = 0.31 × возраст + 9.36 × КЭФ - 26.82. Показатель «возраст» означает возраст пациента с ХОБЛ, показатель «КЭФ» - коэффициент эндотелиальной функции (отношение степени прироста показателя микроциркуляции при ионофорезе ацетилхолина к степени увеличения показателя микроциркуляции при ионофорезе нитропруссида натрия). Результат вычислений означает вероятность развития АГ у больного ХОБЛ.
Способ позволяет определять вероятность развития АГ у больного ХОБЛ, но не применим для прогнозирования развития ХОБЛ у больного АГ или прогнозирования развития ХОБЛ и АГ у изначально здорового человека. Способ применим для ранней диагностики и профилактики АГ у больного ХОБЛ, но не для ранней диагностики и профилактики ХОБЛ у лица с АГ и не коморбидности в целом.
Частое развитие АГ и ХОБЛ у одного больного обусловлено общими факторами риска (курение), общими эпидемиологическими данными (и АГ, и ХОБЛ чаще болеют лица пожилого возраста), но, главное, общими патогенетическими механизмами. На сегодня известно много патогенетических факторов, которые одновременно значимы и для развития АГ, и для ХОБЛ. В первую очередь это компоненты системного воспалительного ответа, а также активация симпато-адреналовой и ренин-ангиотензин-альдостероновой (РААС) систем [6, 12, 13, 17 20]. Патологическая активация РААС давно известна как ключевое звено патогенеза АГ, которое обуславливает и повышение АД, и поражение органов-мишеней за счет профиброзного и пролиферативного действия [13]. В последнее время появляется все больше данных о роли РААС и в патогенезе ХОБЛ. Гиперэкспрессия ангиотензинпревращающего фермента приводит к снижению активности воспаления при ХОБЛ, но в то же время активирует фиброзные процессы и тем самым усиливает ремоделирование бронхов [12, 20]. Коморбидность АГ и ХОБЛ - это качественно новое состояние по сравнению с изолированным течением каждой болезни, которое характеризуется большей тяжестью и АГ, и ХОБЛ, худшим прогнозом и определяет необходимость коррекции подхода к лечению и ведению таких больных [7, 16, 17]. В частности, в исследовании ECLIPSE (Evaluationof COPD LongitudinallytoIdentifyPredictiveSurrogateEnd-points) при ХОБЛ в сочетании с АГ наблюдали выше счет mMRC, хуже результат теста 6-минутной ходьбы [17]. При АГ в сочетании с ХОБЛ раньше формируются сердечно-сосудистые осложнения [7]. Ряд гипотензивных препаратов, например, неселективные бета-блокаторы, тиазидовые диуретики, противопоказаны при ХОБЛ. Пациенты с ХОБЛ могут плохо переносить терапию ингибиторами ангиотензинпревращающего фермента. В то же время антагонисты кальция и блокаторы рецепторов ангиотензина II обладают плейотропными эффектами, полезными при ХОБЛ (снижение давления в легочной артерии). Препараты для лечения ХОБЛ - бета 2 агонисты и М-холиноблокаторы - могут оказывать неблагоприятные сердечно-сосудистые эффекты, и сочетание АГ и ХОБЛ - дополнительное показание к комбинированной терапии со снижением дозы каждого из препаратов указанных классов [6]. Применение особой терапевтической стратегии необходимо уже на самых ранних стадиях, до развития тяжелых необратимых осложнений обоих заболеваний, что определяет актуальность разработки методов прогнозирования развития коморбидного состояния с целью ранней диагностики присоединения второй болезни.
В настоящее время в клинической практике вероятность развития ХОБЛ оценивают на основании выявления факторов риска (курение, профессиональные и бытовые поллютанты, дефицит альфа 1 антитрипсина, возраст) [4, 6, 11]. При наличии фактора риска делают вывод о высокой вероятности развития ХОБЛ у данного пациента. Вероятность развития пульмогенной АГ при ХОБЛ оценивают как высокую при тяжелой степени тяжести ограничения воздушного потока и развитии дыхательной недостаточности [6, 11]. Существующие общепринятые методы имеют низкую достоверность оценки вероятности развития коморбидного состояния.
АГ и ХОБЛ - заболевания с наследственной предрасположенностью.
Полиморфизмы М235Т гена ангиотензиногена (ATГ, AGT), А1166С гена рецептора I типа ангиотензина II (AGTR1), полиморфизма Ins/Del(I/D) гена ангиотензинпревращающего фермента (АПФ, АСЕ) ассоциированы с АГ и другими сердечно-сосудистыми заболеваниями [19].
Полиморфизм М235Т гена ангиотензиногена, РААС и АГ Полиморфизм М235Т гена ангиотензиногена заключается в замене азотистого основания тимина (Т) на цитозин (С) в позиции+704 гена AGT (AGT+704T>C, генетический маркер Т704С, международный код полиморфизма: rs699), что приводит к замене аминокислоты метионина на треонин в 235 кодоне пептидной цепи с последующими изменениями свойств AGT.
Ангиотензиноген является одним из важных генов РААС. Было обнаружено, что наличие одного или двух Т-аллелей приводило к существенному повышению уровня АТГ в плазме, что вело к увеличению содержания ангиотензина II, чем многие авторы объясняют ассоциацию этого полиморфизма с АГ. У представителей европеоидной расы отмечалось повышение концентрации АТГ в плазме крови на 5% у М/Т гетерозигот и на 11% у гомозигот по 235Т аллелю по сравнению с носителями М/М генотипа. М235Т полиморфизм гена АТГ ассоциирован с риском развития АГ у европеоидов и коренных жителей Азии [3].
Полиморфизм А1166С гена рецептора I типа агиотензина II, РААС и АГ
Полиморфизм А1166С гена рецептора I типа агиотензина II (AGTR1) заключается в замене азотистого основания аденина на цитозин в некодирующей области гена в позиции 1166, международный код полиморфизма: rs5186. У носителей аллеля С повышен уровень продукции рецептора, что вызывает гиперактивность ренин-ангиотензиновой системы и повышение АД [19]. Полиморфизмы AGTR1 часто используются в качестве маркеров генетически обусловленного повышенного кровяного давления. Вариант 1166С чаще встречается у пациентов с гипертонией (гипертензией), чем у здоровых доноров (вероятность заболеть гипертонией при наличии у пациента генотипа 1166С увеличивается в 1,3 раза [1].
А1166С-полиморфизм гена AGTR1 можно считать генетический маркером, предрасполагающим к повышению АД [18].
Увеличение частоты аллелей 1166С является фактором риска и, следовательно, позволяет предположить, что изменение в гене рецептора III типа ангиотензина ассоциируется с гипертонической [21].
Полиморфизм Alu Ins/Del I->D гена АСЕ, АГиХОБЛ
Полиморфизм AluIns/DelI->D гена АСЕ имеет два варианта, отличающихся наличием (insertion, I) или отсутствием (deletion, D) Alu-последовательности в интроне гена АСЕ. С данным полиморфизмом связана различная степень экспрессии гена АСЕ. Суммарная активность АПФ у носителей сочетания D/D аллеля на 30% выше, чем у лиц с вариантом I/I, что является фактором риска АГ.
Известна ассоциация полиморфного локуса Ins/Del I/D (rs4646994) гена АСЕ с ХОБЛ в некоторых популяциях [14].
РААС, ХОБЛ и АГ. Полиморфизм M235TAGT и ХОБЛ
В статье Асташиной И.Н. и соавт. «Механизмы активации ренин-ангиотензин-альдостероновой системы как причины системной артериальной гипертензии у пациентов с хронической обструктивной болезнью легких» (Современные проблемы науки и образования. - 2015. - №3. URL: http://www.science-education.ru/ru/article/view?id=19860) показано, что появление у пациентов с ХОБЛ системной АГ является следствием активации РААС.
В указанном исследовании идет речь о, так называемой, «пульмогенной» АГ, развивающейся у больных с тяжелой ХОБЛ и дыхательной недостаточностью. В описании нашего изобретения речь идет о сочетании ХОБЛ и эссенциальной АГ (пульмогенная была критерием исключения из исследования).
Ceylan Ayada и соавт.в статье "Angiotensinogen gene М235Т and angiotensin II-type 1 receptor gene A/C1166 polymorphisms in chronic obstructive pulmonary disease» (Int J Clin Exp Med. 2015; 8(3): 4521-4526; http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4443212) высказывают мнение, что полиморфизм М235Т гена AGT может играть определенную роль в развитии ХОБЛ. Авторы считают, что существует связь между генотипом ТТ и развитием ХОБЛ. Скорее всего, пациенты с ХОБЛ, имеющие генотип ТТ, достигают финальной стадии своей жизни раньше, чем пациенты с генотипами ММ и МТ.
В указанном источнике идет речь о генетической предрасположенности только к ХОБЛ, а не к коморбидности ХОБЛ и АГ.
В статье Железняковой Н.М. и соавт. «Роль генетических факторов в оценке кардиоваскулярного риска у пациентов с сочетанным течением хронического обструктивного заболевания легких и хронического панкреатита» описаны результаты генетического обследования лиц с ХОБЛ и лиц с ХОБЛ и хроническим панкреатитом. У больных ХОБЛ в 2,1 раза чаще, чем в группе здоровых лиц, выявляли гомозиготы с патологическим генотипом ТТ в полиморфизме М235Т гена AGT. По мнению автора, обнаруженная связь неблагоприятного варианта гена AGT с развитием ХОБЛ, видимо, отражает роль данного полиморфизма в запуске окислительного стресса и стимуляции экспрессии провоспалительных цитокинов за счет повышенного уровня ангиотензина II.
В указанном источнике также идет речь о генетической предрасположенности только к ХОБЛ, а не к коморбидности ХОБЛ и АГ.
Последние два источника содержат данные об ассоциации генотипа ТТ в полиморфизме М235Т гена AGT и ХОБЛ, но не указывают прогностической ценности наличия у больного данного генотипа (прогнозирование развития заболевания по генетическому маркеру не было задачей данных исследований).
Раскрытие изобретения
Заявляемый способ прогнозирования развития коморбидной формы артериальной гипертензии (АГ) и хронической обструктивной болезнью легких (ХОБЛ) характеризуется тем, что у больного артериальной гипертензией или хронической обструктивной болезнью легких определяют генотипы полиморфного локуса М235Т гена ангиотензиногена (AGT) и полиморфного локуса А1166С гена рецептора I типа агиотензина II (AGTR1) и при наличии у больного генотипа Т/Т полиморфного локуса М235Т гена AGT и генотипа А/С полиморфного локуса А1166С гена AGTR1 прогнозируют высокую вероятность развития коморбидной АГ и ХОБЛ в течение 10 лет после дебюта первого из заболеваний. Указанная вероятность развития коморбидной АГ и ХОБЛ составляет 61,5%.
Способ осуществляют следующим образом:
- известным в данной области техники способом получают образец цельной крови больного артериальной гипертензией или хронической обструктивной болезнью легких;
- из лимфоцитов полученного образца выделяют ДНК методом фенолхлороформной экстракции, далее методом полимеразной цепной реакции (ПЦР) в реальном времени определяют генотип полиморфного локуса М235Т гена AGT и полиморфного локуса А1166С (rs5186) гена ATGR1;
- при наличии у больного сочетания генотипов Т/Т полиморфного локуса М235Т гена AGT и А/С полиморфного локуса А1166С гена AGTR1 делают вывод о том, что в данном случае имеется высокая вероятность (61,5%) развития коморбидной формы патологии артериальная гипертензия в сочетании с хронической обструктивной болезнью легких в течение 10 лет после дебюта первого из заболеваний;
- при отсутствии обоих из указанных генотипов (Т/Т полиморфного локуса М235Т гена AGT и А/С полиморфного локуса A1166C гена AGTR1) делают вывод о низкой вероятности сочетанного течения артериальной гипертензии и хронической обструктивной болезни легких.
Определение высокой вероятности сочетанного течения артериальной гипертензии хронической обструктивной болезни легких позволит: 1. обоснованно сформулировать рекомендации по профилактике заболевания; 2. скорректировать программу диагностических мероприятий (например, включить методы оценки вентиляционной функции легких у больных артериальной гипертензией) с целью своевременной диагностики, а, следовательно, и начала терапии второго заболевания; 3. своевременно выбрать терапевтическую стратегию относительно артериальной гипертензии, оптимальную для ситуации сочетания ее с ХОБЛ. Выбор лечебно-диагностических мероприятий с учетом риска развития коморбидной патологии позволит улучшить результаты лечения этой группы больных.
Перечень фигур иллюстративного материала
Фиг. 1. Кривая выживаемости «без коморбидности АГ + ХОБЛ» больных артериальной гипертензией или ХОБЛ с генотипом Т/Т полиморфного локуса М235Т гена AGT и А/С полиморфного локуса А1166С гена AGTR1 (группа 1) и с другими вариантами генотипов полиморфного локуса М235Т гена AGT и полиморфного локуса А1166С гена AGTR1 (группа 0) (метод Каплан-Майера).
Обоснование изобретения
Цель исследования. Определить прогностическую значимость полиморфизма М235Т гена AGT, полиморфизма А1166С гена AGTR1, полиморфизма Ins/De1 I/D (rs4646994) гена АСЕ относительно развития коморбидной формы эссенциальной АГ и ХОБЛ.
Материалы и методы. Дизайн исследования.
Одноцентровое исследование «случай-контроль»
Осуществляли параллельное включение больных в три страты: больные эссенциальной артериальной гипертензией, коморбидной с ХОБЛ (группа АГ + ХОБЛ, n=103), больные артериальной гипертензией без коморбидности с ХОБЛ (группа АГ, n=99), больные хронической обструктивной болезнью легких без АГ (группа только ХОБЛ n=101), контрольная группа (n=99) - условно здоровые лица.
На первом этапе исследования определяли частоту генотипов полиморфного локуса М235Т гена AGT, частоту генотипов полиморфного локуса А1166С (rs5186) гена AGTR1, частоту генотипов полиморфного локуса Ins/Del I/D (rs4646994) гена АСЕ в каждой группе и проводили сравнение между группами. Также определяли концентрацию ангиотензина I и II в сыворотке крови у лиц исследуемых групп и в зависимости от генотипа по исследуемым генам в каждой группе и проводили сравнение между группами. Оценивали вероятность развития коморбидной формы патологии АГ и ХОБЛ при различных генотипах полиморфного локуса М235Т гена AGT, полиморфного локуса А1166С гена AGTR1, полиморфного локуса Ins/Del I/D гена АСЕ.
На втором этапе для генотипа риска развития коморбидной патологии АГ и ХОБЛ определяли вероятность развития коморбидной патологии АГ и ХОБЛ в течение 10 лет после дебюта первого из заболеваний методом Каплан-Майер, сравнивали вероятности при наличии генотипа риска и в его отсутствие.
Критерии включения больных в исследование: артериальная гипертензия 1-3 степени (критерии ESH/ESC, 2013) [13] в сочетании с хронической обструктивной болезнью легких 1-4 степени тяжести (критерий GOLD 2011) [9] для страты 1,эссенциальная артериальная гипертензия 1-3 степени без коморбидности с ХОБЛ для страты 2, ХОБЛ 1-4 степени тяжести по GOLD 2011 для страты 3, возраст старше 40 лет и моложе 80 лет.
Критерии исключения больных из исследования: другие, кроме ХОБЛ, заболевания бронхолегочной системы, вторичная артериальная гипертензия, легочная артериальная гипертензия любой этиологии, кроме ХОБЛ, дефицит альфа 1 антитрипсина, отсутствие информированного согласия больного на участие в исследовании.
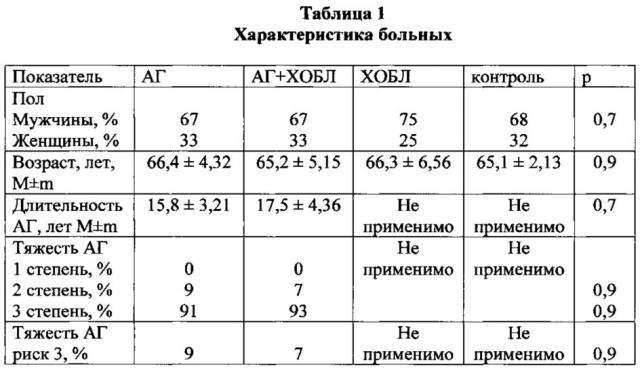
В группе АГ было 66 (67%) больных мужчин, 33 (33%) женщины, возраст обследованных 66,4±4,32 года, курящих - 89 (90%) В группе АГ + ХОБЛ было 69 (67%) мужчин, 30 (33%) женщин, возраст обследованных 65,2±5,1 лет, курящих - 92 (89%). В группе только ХОБЛ было 76 (75%) мужчин, 25 (25%) женщин, возраст обследованных 66,3±6,56 лет, курящих - 89 (88%). В группе контроля было 67 (68%) мужчин, 32 (32%) женщины, возраст обследованных - 65,1±2,13 года, курящих 87 (88%) человек. Характеристика больных представлена в таблице 1. Группы были сопоставимы по полу, возрасту, длительности и тяжести артериальной гипертензии, числу курящих больных и индексу пачка-лет для курящих.
Артериальное давление измеряли тонометром Microlife BP AG 1-3 О (Швейцария) в положении больного сидя после пятиминутного отдыха, по крайней мере, два раза с интервалом в 1-2 минуты; если первые два значения существенно различались, повторяли измерения. Манжета тонометра находилась на уровне сердца. При первом визите измеряли АД на обеих руках, при выявлении разницы ориентировались на более высокое значение АД. Общий сердечно-сосудистый риск у больных АГ определяли на основании клинических рекомендаций Министерства здравоохранения РФ 2013 г. [3].
Спирометрию проводили на спирографе «MicroLab» фирмы MicroMedical (Великобритания) согласно международным стандартам [Milleretal., 2005] с определением постбронходилататорных значений объема форсированного выдоха за первую секунду (ОФВ 1), форсированной жизненной емкости легких (ФЖЕЛ). У больных ХОБЛ оценивали тяжесть симптомов на основании Модифицированного вопросника Британского медицинского исследовательского совета (Modified British Medical Research Council questionnaire, mMRC), выполняли пульсоксиметрию на пульсоксиметре ArmedYX300 (Китай).
Определение однонуклеотидных полиморфизмов проводилось методом полимеразной цепной реакции (ПЦР) в реальном времени на приборе «АНК-32М» (Россия). ДНК выделяли методом фенолхлороформной экстракции. Использованы наборы реагентов для исследования полиморфного локуса А1166С (rs5186) гена AGTR1, полиморфного локуса М235Т гена AGT, полиморфного локуса Ins/Del I/D (rs4646994) гена АСЕ компании Синтол (Россия). Исследование содержания ангиотензина I и II в образцах сыворотки крови было проведено на иммуноферментном 8-канальном планшетном фотометре «ExpertPlus» фирмы «ASYSHITECH» (Австрия), стандартная длина волны измерения 450 нм. Иммуноферментный анализ «сэндвич» - типа, проводили наборами фирм ВСМ Diagnostics (США) и AssayPro (США). Забор крови проводился в утренние часы (8:00).
Статистический анализ. Описательная статистика для шкалированных переменных - средняя и стандартная ошибка средней, (М±m), данные распределены нормально (тест Колмогорова-Смирнова), для номинальных переменных определяли их доли. Для сравнения количественных переменных двух групп использован U критерий Манна-Уитни, трех групп - критерий Крускалла-Уоллиса с последующим множественным сравнением при помощи критерия Данна. Сравнение качественных переменных двух групп - критерий χ2.
И прогнозируемая, и прогностическая величина - номинальные, для построения прогноза рассчитывали частоты совместного распределения. Для оценки вероятности развития коморбидного состояния АГ + ХОБЛ в течение 10 лет от дебюта первого из заболеваний при наличии генотипа риска и в его отсутствие использован метод Каплан-Майера, сравнение двух групп - критерий Гехана [2].
Критический уровень значимости р=0,05.
Результаты
При исследовании частоты генотипов исследуемых генов в группах больных АГ, АГ + ХОБЛ и ХОБЛ получены результаты, приведенные в таблицах 2, 3, 4, 5, 6, 7.
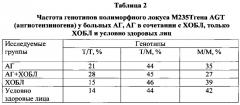
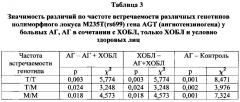
У больных с коморбидностью АГ + ХОБЛ чаще, чем при АГ без ХОБЛ и при ХОБЛ без АГ, встречались генотипы Т/Т полиморфного локуса М235Т гена AGT (28% против 21% и 15%, р=0,003), С/С полиморфного локуса А1166С гена AGTR1 (9% против 7% и 5%, р=0,002),DD полиморфного локуса Ins/Del I/D гена АСЕ (25% против 19% и 16%, р=0,003).
В группе больных АГ без коморбидности с ХОБЛ чаще, чем в группе АГ + ХОБЛ, встречались генотипы М/М полиморфного локуса М235Т гена AGT (35% против 27%, р=0,018), АА полиморфного локуса A1166C гена AGTR1 (55% против 48%, р=0,018) и I/D полиморфного локуса Ins/Del I/D гена АСЕ (53% против 45%, р=0,032).
При изучении фенотипических характеристик ренин-ангиотензин-альдостероновой системы наблюдали различия концентрации ангиотензина I и ангиотензина II в зависимости от генотипа полиморфного локуса М235Т гена AGT (таблица 8). Так, у гомозигот Т/Т концентрация ангиотензина I и ангиотензина II была самой высокой (52,2±6,93 пг/мл и 19,6±2,44 пг/мл соответственно), у гомозигот М/М - самой низкой (35,3±7,81 пг/мл и 10,2±3,25 пг/мл), р=0,002 и р=0,001. Различались и концентрации ангиотензина I и ангиотензина II в группах больных АГ, АГ + ХОБЛ и только ХОБЛ (табл. 9), наименьшие значения которых наблюдали в группе больных только ХОБЛ (концентрация ангиотензина I 28,4±8,9 пг/мл в группе только ХОБЛ, 37,4±11,61 пг/мл в группе АГ и 48,6±6,57 пг/мл в группе АГ + ХОБЛ, р=0,003, концентрация ангиотензина II в группе только ХОБЛ 9, 8±2,50 пг/мл, в группе АГ 11,9±2,93 пг/мл, в группе АГ + ХОБЛ 17,8±4,30 пг/мл, р=0,001).
С учетом гетерозигот в группе АГ без ХОБЛ аллель М полиморфного локуса М235Т гена AGT преобладал над аллелем Т, ассоциированным с неблагоприятным течением болезни (75% против 69%, р=0,003), а в группе больных с сочетанной патологией АГ + ХОБЛ оба аллеля встречались одинаково часто (73% против 72%, р=0,5), что может объяснять выявленные фенотипические различия в концентрации ангиотензина и ангиотензина II между исследуемыми группами. Таким образом, генетический фактор ассоциирован с различиями концентрации ангиотензина I и ангиотензина II в группах больных АГ и АГ + ХОБЛ. Ангиотензин II участвует и в патогенезе АГ, и в патогенезе ХОБЛ. Он является вазопрессорным фактором (обеспечивает повышение АД) и профиброзным фактором (участвует в процессах ремоделирования сердца и сосудов при АГ, а также в ремоделировании стенок бронхов при ХОБЛ), следовательно, высокая частота развития коморбидной патологии у носителей аллеля Т полиморфизма М235Т гена AGT представляется закономерной.
Учитывая достоверные различия частоты встречаемости изучаемых генотипов в группах больных АГ, АГ + ХОБЛ и только ХОБЛ, проведено исследование их прогностической значимости относительно вероятности развития коморбидной формы патологии АГ + ХОБЛ. При исследовании частот совместного распределения вероятность развития сочетанной патологии АГ и ХОБЛ при наличии генотипа Т/Т полиморфного локуса М235Т гена AGT составляет 58%, при наличии генотипа А/С полиморфного локуса А1166С гена AGTR1 - 56%. При наличии одновременно генотипа Т/Т полиморфного локуса М235Т гена AGT и А/С полиморфного локуса А1166С гена AGTR1 вероятность развития коморбидной патологии увеличивается до 61,5%. Факт курения на прогноз не влиял (при добавлении переменной курение вероятность составила 62%). Генотипы гена АСЕ на прогноз не влияли. Генотип СС полиморфного локуса А1166С гена AGTR1 не пригоден для целей прогнозирования ввиду низкой частоты встречаемости.
Вероятность развития коморбидной патологии АГ в сочетании с ХОБЛ в течение 10 лет от дебюта первого из заболеваний, оцененная методом Каплан-Майер, при сочетании генотипа Т/Т полиморфного локуса М235Т гена AGT и А/С полиморфного локуса А1166С гена AGTR1 составила 62% (выживаемость «без коморбидности АГ + ХОБЛ» 38%), при отсутствии указанного сочетания генетических полиморфизмов- 49% (выживаемость «без коморбидности АГ + ХОБЛ» 51%), р=0,0003 (фиг. 1). Во время исследования нежелательных явлений либо серьезных нежелательных явлений, в том числе связанных с процедурами исследования, включая диагностические манипуляции, не было.
Клинические примеры
Пример 1
Больной Д., 62 лет. Наблюдается в течение 12 лет с момента развития стойкого повышения АД с диагнозом артериальная гипертензия 3 степени, риск 4. Не курит. Контакта с профессиональными и бытовыми поллютантами нет. Уровень альфа 1 антитрипсина в пределах нормы. На момент дебюта артериальной гипертензии хронических заболеваний бронхо-легочной системы не было (заключение сделано на основании отсутствия респираторных жалоб, отсутствия респираторных симптомов по данным физикального исследования, высокой толерантности к физической нагрузке по результатам кардиореспираторного теста, отсутствия нарушения вентиляционной функции легких по результатам спирографии и бодиплетизмографии, отсутствия патологии по результатам рентгенографии органов грудной клетки). Перенесенных острых заболеваний бронхо-легочной системы в анамнезе нет. При генетическом исследовании выявлен генотип Т/Т полиморфного локуса М235Т гена AGT и генотип А/С полиморфного локуса А1166С гена ATGR1. Больному ежегодно проводили спирометрию, при выборе антигипертензивной терапии отказались от препаратов, усиливающих бронхообструкцию, больной получал амлодипин и телмисартан. Через 9 лет от начала наблюдения (и дебюта АГ) при отсутствии респираторных жалоб и достаточной толерантности к физической нагрузке впервые при проведении спирографии констатировано нарушение вентиляционной функции легких: ОФВ1/ФЖЕЛ 65%, ОФВ1 90%. Диагностирована хроническая обструктивная болезнь легких легкой степени тяжести, группа А по классификации GOLD [2, 9], назначена соответствующая терапия.
Пример 2
Больной И., 66 лет. Наблюдается в течение 18 лет с момента развития стойкого повышения АД с диагнозом артериальная гипертензия 3 степени, риск 4. Курит в течение 48 лет, индекс пачка-лет - 15,1. Контакта с профессиональными и бытовыми поллютантами нет. Уровень альфа 1 антитрипсина- в пределах нормы. На момент дебюта артериальной гипертензии имеется хронический необструктивный бронхит курильщика (кашель с мокротой в течение 3 месяцев непрерывно 2 последовательных года) в течение 10 лет. В возрасте 25 лет перенес правостороннюю внебольничную пневмококковую пневмонию средней степени тяжести. Отсутствие нарушений вентиляционной функции легких по результатам спирографии и бодиплетизмографии, высокая толерантность к физической нагрузке по результатам кардиореспираторного теста, нормальные показатели газового состава крови позволили исключить хроническую обструктивную болезнь легких. При генетическом исследовании выявлен генотип Т/М полиморфного локуса М235Т гена AGT и А/А полиморфного локуса А1166С гена ATGR1. Больному ежегодно проводили спирометрию. Через 10 и 18 лет от начала наблюдения (и дебюта АГ) при проведении спирографии нарушений вентиляционной функции легких нет: ОФВ1/ФЖЕЛ 102%, ОФВ1 108%.
Пример 3
Больной И., 63 лет. Наблюдается в течение 13 лет с диагнозом «хроническая обструктивная болезнь легких средней степени тяжести» (ОФВ1 60%, ОФВ1/ФЖЕЛ 65%), группа В по классификации GOLD. На момент диагностики ХОБЛ значения АД не более 120/80 мм рт.ст., в том числе при суточном мониторировании АД. За время наблюдения дыхательная недостаточность не сформировалась (парциальное давление кислорода в артериальной крови более 80 мм рт.ст., сатурация кислорода более 95%), легочная артериальная гипертензия не сформировалась (среднее давление в легочной артерии по данным допплер эхокардиографии не более 20 мм рт.ст.). Курит 45 лет, индекс пачко-лет - 14. Постоянно принимал тиотропия бромид - 18 мкг 1 доза утром, и пратропия бромид - 20 мкг 1-2 дозы при усилении одышки. При генетическом исследовании выявлен генотип Т/Т полиморфного локуса М235Т гена AGT и А/С полиморфного локуса A1166C гена ATGR1. Больному регулярно проводили измерения АД, через 7 лет наблюдения выявлено стойкое повышение АД более 140/90 мм рт.ст. (колебания АД до лечения 140/90 мм рт.ст. - 160/105 мм рт.ст.). Проведено обследование согласно рекомендациям РКО [3], исключены вторичные варианты артериальной гипертензии, диагностирована гипертоническая болезнь, назначена соответствующая терапия.
Пример 4
Больной К., 67 лет. Наблюдается в течение 17 лет с диагнозом «хроническая обструктивная болезнь легких». Объем форсированного выдоха за первую секунду в начале наблюдения - 68%, снижение за время наблюдения до 55%, ОФВ1/ФЖЕЛ в начале наблюдения - 68%, за время наблюдения - снижение до 61%. Тяжесть одышки по mMRC в начале наблюдения составляет 1. Через 7 лет сформировалась дыхательная недостаточность 1 степени (парциальное давление кислорода артериальной крови составляет 75%, сатурация кислорода - 92%). Через 9 лет наблюдения констатировано развитие легочной артериальной гипертензии 1 степени (среднее давление в легочной артерии при допплерэхокардиографии - 32 мм рт.ст). Постоянно принимал тиотропия бромид - 18 мкг 1 доза утром, ипратропия бромид - 20 мкг 1-2 дозы при усилении одышки. При генетическом исследовании выявлен генотип Т/М полиморфного локуса М235Т гена AGT и А/А полиморфного локуса A1166C гена ATGR1. Через 10 и 17 лет наблюдения значения АД как при однократных измерениях, так и по результатам суточного мониторирования АД не более 120 мм рт.ст.
Таким образом, при сочетании генотипа Т/Т полиморфного локуса М235Т гена AGT и А/С полиморфного локуса A1166С гена ATGR1 можно с вероятностью 61,5% прогнозировать развитие коморбидного состояния артериальная гипертензия и хроническая обструктивная болезнь легких. Предлагаемый метод прост в исполнении и достаточно безопасен, единственным противопоказанием к его применению является отсутствие информированного согласия пациента на исследование. Возможные нежелательные эффекты ограничиваются только нежелательными эффектами венепункции; забор крови из вены - малоинвазивная стандартная манипуляция; методы ПЦР в режиме реального времени и твердофазного иммуноферментного анализа сэндвич типа выполняются практически в каждой медицинской лаборатории.
Список литературы
1. Генетическая предрасположенность к ряду мультифакториальных заболеваний [Электронный ресурс] // http://www.vitasite.ru/articles/expert-article/dnk-k-rjadu-multifaktorialnykh-zabolevanij, опубликовано: 16.11.2010.
2. Герасимов А.Н. Медицинская статистика: Учебное пособие. М.: ООО «Медицинское информационное агентство», 2007. - 480 с.
3. Мартынович Т.В. и соавт. Анализ полиморфизма генов ренин-ангиотензин-альдостероновой системы у пациентов с сердечнососудистыми заболеваниями. http://www.science-education.ru/ru/article/view?id=17392).
4. Федеральные клинические рекомендации по диагностике и лечению хронической обструктивной болезни легких [Электронный ресурс]. URLhttp.7/193.232.7.120/feml/clinical_ref/0001372263S/HTML/#1 (дата обращения: 21.10.2015).
5. Чазова И.Е., Ощепкова Е.В. и др. Диагностика и лечение артериальной гипертензии. Клинические рекомендации [Электронный ресурс]. URLhttp://www.gipertonik.ru/clinical_recommendations.
6. Чазова И.Е., Чучалин А.Г. и др. Диагностика и лечение пациентов с артериальной гипертонией и хронической обструктивной болезнью легких (Рекомендации Российского медицинского общества по артериальной гипертонии и Российского респираторного общества). Системные Гипертензии. 2013; 10:5 - 34.
7. Шпагин И.С., Шабалин А.В., Шпагина Л.А., Герасименко О.Н., Шляхтина Н.В. Особенности клинико-функциональных параметров сердца, сосудов и микроциркуляции у больных артериальной гипертонией в сочетании с хронической обструктивной болезнью легких // Бюллетень Сибирской медицины. - Томск, 2010. - №10. - С. 56-61.
8. Costanzo S, Di Castelnuovo A et al. Prevalence, awareness, treatment and control of hypertension in healthy unrelated male-female pairs of European regions: the dietary habit profile in European communities with different risk of myocardial infarction: the impact of migration as a model of gene environment interaction project. J Hypertens 2008; 26:2303-2311.
9. Cooper RS. Using public health indicators to measure the success of hypertension control. Hypertension 2007; 49:773-774.
10. [GBD] Global Burden of Disease: Generating Evidence, Guiding Policy. [Электронный ресурс]. URL: http://www.healthmetricsandevaluation.org/gbd/publications/policy-report/global-burden-disease-generating-evidence-guiding-policy. (дата обращения: 21.10.2015).
11. Global Initiative for Chronic Obstructive Lung Disease [Электронный ресурс]. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (Updated 2014). URL: http://www.goldcopd.com. (дата обращения: 21.10.2015).
12. Kaparianos A, Argyropoulou E. Local renin-angiotensin II systems, angiotensin-converting enzyme and its homologue ACE2: their potential role in the pathogenesis of chronic obstructive pulmonary diseases, pulmonary hypertension and acute respiratory distress syndrome. Curr Med Chem. 2011;18(23):3506-15.
13. Kobori H, Nangaku M, Navar LG, Nishiyama A: The intrarenal renin-angiotensin system: from physiology to the pathobiology of hypertension and kidney disease. Pharmacol Rev 59:251-287, 2007.
14. Li X, Wei N et al., The D/I polymorphism in the angiotensin-converting enzyme gene and chronic obstructive pulmonary disease risk: a metaanalysis. COPD. 2012 Aug; 9(5):485-91.
15. Mancia G., Fagard R et al., 2013 ESH/ESC Guidelines for the management of arterial hypertension. Blood Press. 2014 Feb; 23(1):3-16.
16. Mannino DM, Thorn D, Swensen A, Holguin F. Prevalence and outcomes of diabetes, hypertension and cardiovascular disease in COPD. EurRespir J 2008.
17. Miller J, Edwards LD et al., Comorbidity, systemic inflammation and outcomes in the ECLIPSE cohort. Respir Med. 2013 Sep; 107(9):1376-84.
18. Palatini P, Ceolotto G, Dorigatti F. et al. Angiotensin