Дифференцирование эмбриональных стволовых клеток человека
Иллюстрации
Показать всеИзобретения касаются способов (варианты) формирования и дифференциации популяции клеток, в которой более 80% клеток популяции экспрессирует маркеры, характерные для линии сформированной эндодермы. Способ включает дифференциацию популяции эмбриональных стволовых клеток человека в среде DMEM или MCDB-131, содержащей активин А и лиганд Wnt, или GDF-8 и 14-проп-2-ен-1-ил-3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он, где концентрация глюкозы не превышает 10,5 ммоль/л, где эмбриональные стволовые клетки человека представляют собой клетки стабильных линий эмбриональных стволовых клеток человека, клетки стабильных линий эмбриональных зародышевых клеток человека, такие как клетки H1, клетки Н7, клетки Н9 или клетки BG01V. Изобретения могут быть использованы в лабораторной практике для создания in vitro функциональной экспрессирующей инсулин клетки, которая была бы более близка к β-клетке. 3 н. и 7 з.п. ф-лы, 9 ил., 2 табл., 4 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка притязает на приоритет предварительной патентной заявки серийный номер 61/378448, поданной 31 августа 2010 г, которая включена в настоящий документ посредством ссылки.
Область применения изобретения
В данном изобретении описываются способы содействия дифференциации плюрипотентных стволовых клеток в клетки, вырабатывающие инсулин. В частности, настоящее изобретение относится к способу получения популяции клеток, в которой более 80% клеток экспрессирует маркеры, характерные для линии сформированной эндодермы.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Последние достижения в области заместительной клеточной терапии для лечения сахарного диабета 1 типа и нехватка островков Лангерганса для трансплантации заставили обратить внимание на разработку источников инсулин-продуцирующих клеток, или β-клеток, подходящих для трансплантации. Одним из подходов является формирование функциональных β-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки дают начало группе клеток, формирующих три зародышевых листка (эктодерму, мезодерму и эндодерму) в ходе процесса, именуемого гаструляцией. Такие ткани, как, например, щитовидная железа, тимус, поджелудочная железа, кишечник и печень, будут развиваться из эндодермы через промежуточную стадию. Промежуточной стадией данного процесса является образование сформированной эндодермы. Клетки сформированной энтодермы экспрессируют ряд маркеров, как например, HNF3 бета, GATA4, MIXL1, CXCR4 и SOX17.
Формирование поджелудочной железы происходит при дифференцировании сформированной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют ген панкреатическо-дуоденального гомеобокса, Pdx1. При отсутствии Pdx1 развитие поджелудочной железы не идет дальше формирования вентрального и дорзального зачатков. Таким образом, экспрессия PDX1 характеризует критическую стадию органогенеза поджелудочной железы. Зрелая поджелудочная железа содержит, помимо других типов клеток, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани образуются при дифференцировании панкреатической эндодермы.
По имеющимся данным, клетки, обладающие свойствами островковых клеток, были получены из эмбриональных клеток мыши. Например, Lumelsky et al. описывают дифференцирование мышиных эмбриональных стволовых клеток в инсулин-секретирующие структуры, аналогичные островкам поджелудочной железы. Soria et al. (Diabetes 49:157, 2000) описывают инсулин-секретирующие клетки, производные мышиных эмбриональных стволовых клеток, которые нормализуют гликемию у мышей с диабетом, индуцированным стрептозотоцином.
В одном примере, Hori et al. (PNAS 99: 16105, 2002) описывается, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид-3-киназы (LY294002) приводила к получению клеток, подобных β-клеткам.
В другом примере, Blyszczuk et al. (PNAS 100:998, 2003), сообщается о получении инсулин-продуцирующих клеток из мышиных эмбриональных стволовых клеток с конститутивной экспрессией Pax4.
В публикации Micallef et al. сообщается, что ретиноевая кислота может регулировать способность эмбриональных стволовых клеток формировать Pdx1-положительную панкреатическую эндодерму. Ретиноевая кислота с наибольшей эффективностью индуцирует экспрессию Pdx1 при добавлении в культуру на 4 день дифференцирования эмбриональных стволовых клеток в течение периода, соответствующего концу гаструляции эмбриона (Diabetes 54:301, 2005).
В публикации Miyazaki et al. сообщается о линии мышиных эмбриональных стволовых клеток со сверхэкспрессией Pdx1. Результаты показывают, что экспрессия экзогенного Pdx1 очевидно повышает экспрессию генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, p48, Pax6 и HNF6 в образующихся дифференцированных клетках (Diabetes 53: 1030, 2004).
В публикации Skoudy et al. сообщается, что активин A (входящий в надсемейство TGF-β) повышает экспрессию экзокринных панкреатических генов (p48 и амилазы) и генов эндокринных клеток (Pdx1, инсулина и глюкагона) в эмбриональных стволовых клетках мыши. Максимальный эффект наблюдался при добавлении 1 нмоль/л активина A. Кроме того, авторы отметили, что экспрессия мРНК инсулина и Pdx1 не изменялась под действием ретиноевой кислоты; однако добавление 3nM FGF7 привело к повышению концентрации транскрипта Pdx1 (Biochem. J. 379: 749, 2004).
В работе Shiraki et al. изучались эффекты факторов роста, специфически ускоряющих дифференцирование эмбриональных стволовых клеток в Pdx1-положительные клетки. По наблюдению этих авторов, TGF-β2 приводил к воспроизводимому увеличению доли Pdx1-положительных клеток (Genes Cells. 2005 Jun; 10(6): 503-16).
В работе Gordon et al. показана индукция образования брахиурических [положительных]/HNF3 бета [положительных] энтодермальных клеток из эмбриональных стволовых клеток мыши в отсутствие сыворотки и в присутствии активина в сочетании с ингибитором сигнального каскада Wnt (патент США № 2006/0003446A1).
Gordon et al. (PNAS, т. 103, с. 16806“, 2006) утверждают: «Для образования передней первичной полоски одновременно требовались сигнальные пути Wnt и TGF-бета/nodal/активин».
Однако модель развития эмбриональных стволовых клеток на мышах может не имитировать в точности программу развития у высших млекопитающих, например, у человека.
В работе Thomson et al. эмбриональные стволовые клетки выделяли из человеческих бластоцист (Science 282:114, 1998). Параллельно с этим Gearhart и соавторы получили клеточные линии эмбриональных зародышевых клеток человека (hEG) из ткани половых желез эмбриона (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от эмбриональных стволовых клеток мыши, воспрепятствовать дифференцированию которых можно путем простого культивирования с фактором, ингибирующим лейкемию (LIF), эмбриональные стволовые клетки человека необходимо культивировать в крайне специфических условиях (патент США № 6,200,806; WO 99/20741, WO 01/51616).
D’Amour et al. описывают производство обогащенных культур сформированной эндодермы, производной от человеческих эмбриональных стволовых клеток, в присутствии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005). Трансплантация этих клеток под почечную капсулу мышей привела к их дифференцированию в более зрелые клетки, обладающие характерными особенностями некоторых эндодермальных органов. Клетки сформированной эндодермы, производные от эмбриональных стволовых клеток человека, могут подвергаться дальнейшему дифференцированию в Pdx1-положительные клетки после добавления FGF-10 (US 2005/0266554A1).
D’Amour et al. (Nature Biotechnology-24, 1392-1401 (2006)) утверждают: “Мы разработали процесс дифференцировки, преобразующий эмбриональные клетки человека (hES) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы: инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Данный процесс имитирует органогенез поджелудочной железы in vivo, проводя клетки через фазы, напоминающие образование сформированной эндодермы, эндодермы кишечной трубки, панкреатической эндодермы и превращение предшественников эндокринных клеток в клетки, экспрессирующие эндокринные гормоны”.
В другом примере, в публикации Fisk et al., сообщается о системе для производства островковых клеток поджелудочной железы из эмбриональных стволовых клеток человека (US2006/0040387A1). В данном случае процесс дифференцирования был разделен на три стадии. Человеческие эмбриональные стволовые клетки были впервые дифференцированы до эндодермы с помощью сочетания бутирата натрия и активина A. Затем клетки культивировали с антагонистами ФНО-β, например, Noggin в сочетании с EGF или бетацеллюлином для получения PDX1-положительных клеток. Окончательное дифференцирование запускалось никотинамидом.
Таким образом, сохраняется значительная потребность в разработке лабораторных способов создания in vitro функциональной экспрессирующей инсулин клетки, которая была бы более близка к β-клетке. Настоящее изобретение представляет альтернативный подход к повышению эффективности дифференцирования эмбриональных стволовых клеток человека в экспрессирующие инсулин клетки путем получения популяции клеток, в которых более 80% клеток экспрессирует маркеры, характерные для линии сформированной панкреатической энтодермы.
Краткое описание
В одном варианте осуществления настоящее изобретение относится к способу получения популяции клеток, в которой более 80% клеток экспрессирует маркеры, характерные для линии сформированной эндодермы.
В одном варианте осуществления настоящего изобретения представлен метод получения популяции клеток, более 80% которых экспрессирует маркеры, характерные для линии сформированной эндодермы, состоящий из следующих стадий:
a) культивирование популяции плюрипотентных стволовых клеток;
b) дифференциация популяции плюрипотентных стволовых клеток в популяцию, в которой более 80% клеток экспрессирует маркеры, характерные для линии сформированной эндодермы, в среде с концентрацией глюкозы не более 10,5 ммоль/л.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
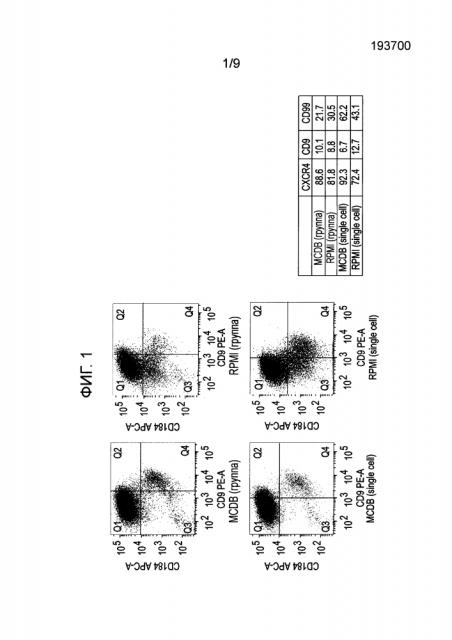
На фиг. 1 показаны результаты анализа экспрессии белков в клетках человеческой эмбриональной линии H1, дифференцированной по способам, описанным в Примере 1, методом флуоресцентной проточной цитометрии (FACS, ФПЦ).
На фиг. 2 показано влияние концентрации глюкозы в среде на степень экспрессии CXCR4 (панель B) и число клеток, а также жизнеспособность клеток (панель В) человеческой эмбриональной клеточной линии H1, дифференцированной по способам, описанным в примере 2.
На фиг. 3 показано влияние концентрации глюкозы в среде на степень экспрессии CXCR4 и внешний вид культуры (панель А) и экспрессию SOX17 в клетках человеческой эмбриональной клеточной линии H1, дифференцированной по способам, описанным в примере 2.
На фиг. 4 показаны результаты анализа экспрессии генов в клетках человеческой эмбриональной линии H1, дифференцированной по первому способу, описанному в Примере 2, методом ПЦР в реальном времени.
На фиг. 5 показан анализ экспрессии генов в клетках человеческой эмбриональной линии H1, дифференцированной по второму способу, описанному в Примере 2, методом ПЦР в реальном времени.
На фиг. 6 показан рН разных сред после 24-часового культивирования клеток на 1-4 сутки согласно способам, описанным в Примере 2.
На фиг. 7 показано влияние рН на экспрессию указанных генов в клетках человеческой эмбриональной линии H1, дифференцированной по второму способу, описанному в Примере 3.
На фиг. 8 показан анализ экспрессии генов в клетках человеческой эмбриональной линии H1, дифференцированной по способу, описанному в Примере 4, методом ПЦР в реальном времени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не для ограничения изобретения, подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые по их способности на уровне единичной клетки как самообновляться, так и дифференцироваться с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцирования из нескольких зародышевых листков (эндодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от нескольких зародышевых листков, и вносить существенный вклад в формирование большинства, если не всех, тканей после инъекции в бластоцисты.
Стволовые клетки классифицируют по потенциалу развития: (1) тотипотентные, то есть способные преобразоваться в любой из эмбриональных и внеэмбриональных типов клеток; (2) плюрипотентные, то есть способные преобразоваться во все типы эмбриональных клеток; (3) мультипотентные, то есть способные преобразоваться во множество клеточных линий, но в рамках одной ткани, органа или физиологической системы (например, гемопоэтические стволовые клетки (ГСК) могут порождать ГСК (самообновление), олигопотентные ограниченные клетки-предшественники крови и все типы клеток и элементов (например, тромбоциты), являющиеся стандартными составляющими крови); (4) олигопотентные, то есть способные преобразоваться в более ограниченное подмножество клеточных линий, чем мультипотентные стволовые клетки; и (5) унипотентные, то есть способные преобразоваться в единственную клеточную линию (например, сперматогенные стволовые клетки).
Дифференцирование представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например, нервной или мышечной клетки. Дифференцированная клетка или клетка с индуцированным дифференцированием представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцирования клетки. Термин «коммитированная» применительно к процессу дифференцирования обозначает клетку, дошедшую в ходе процесса дифференцирования до стадии, от которой в нормальных условиях она продолжит дифференцироваться до определенного типа клеток или набора типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться обратно к менее дифференцированному типу. Дедифференцированием называется процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцирования. Используемый в настоящей заявке термин «линия дифференцирования клетки» определяет наследственность клетки, то есть определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В линии дифференцирования клетка помещается в наследственную схему развития и дифференцирования. Маркером, специфичным для линии дифференцирования, называется характерная особенность, специфически ассоциированная с фенотипом клеток конкретной линии дифференцирования, которая может использоваться для оценки дифференцирования некоммитированных клеток в клетки данной линии дифференцирования.
Используемые в настоящей заявке термины «клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы», «клетки стадии 1» или «стадия 1», относятся к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: SOX17, GATA4, HNF3 beta, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобный гомеобоксовый белок, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 или OTX2. К клеткам, экспрессирующим маркеры, характерные для линии сформированной эндодермы, относятся клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезэндодермы и клетки сформированной эндодермы.
Используемый в настоящей заявке термин «клетки с экспрессией маркеров, характерных для линии панкреатической эндодермы» относится к клеткам с экспрессией по меньшей мере одного из следующих маркеров: PDX1, NKX6.1, HNF1-бета, PTF1-альфа, HNF6, HNF4-альфа, SOX9, HB9 или PROX1. К клеткам, экспрессирующим маркеры, характерные для линии панкреатической эндодермы, относятся клетки панкреатической эндодермы, клетки первичной кишечной трубки и клетки поздней передней кишки.
Используемый в настоящей заявке термин «сформированная эндодерма» относится к клеткам, обладающим характерными особенностями клеток, происходящих в ходе гаструляции от эпибласта, и формирующим желудочно-кишечный тракт и его производные. Клетки сформированной энтодермы экспрессируют следующие маркеры: HNF3-бета, GATA4, SOX17, Cerberus, OTX2, goosecoid, C-Kit, CD99 и MIXL1.
Используемый в настоящей заявке термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в интересующих клетках. В данном контексте под дифференциальной экспрессией подразумевается повышение уровня экспрессии для положительного маркера и понижение уровня экспрессии для отрицательного маркера. Поддающийся обнаружению уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличить ее от других клеток с помощью любого из множества известных в данной области способов.
«Панкреатической эндокринной клеткой», «клеткой, экспрессирующей гормон поджелудочной железы» или «клеткой, экспрессирующей характеристики эндокринной линии поджелудочной железы» в настоящем документе называется клетка, способная экспрессировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
Выделение, размножение и культивирование полипотентных стволовых клеток
Характеристика плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать один или более стадийно-специфичных эмбриональных антигенов (SSEA) 3 и 4, а также маркеры, определяемые антителами, обозначенными как Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Дифференцирование плюрипотентных стволовых клеток in vitro приводит к потере экспрессии SSEA-4, Tra 1-60 и Tra 1-81 (при наличии) и к повышению экспрессии SSEA-1. В недифференцированных полипотентных стволовых клетках, как правило, активна щелочная фосфатаза, которая может быть обнаружена путем фиксации клеток с помощью 4% параформальдегида, с последующим обнаружением с помощью Vector Red, применяемого в качестве субстрата, в соответствии с инструкциями производителя (Vector Laboratories, Burlingame Calif.). Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессируют OCT4 и TERT, определяемые с помощью ПЦР в реальном времени.Другим желательным фенотипическим свойством выращенных плюрипотентных стволовых клеток является потенциал дифференцирования в клетки всех трех зародышевых листков: в энтодермальные, мезодермальные и эктодермальные ткани. Полипотентность полипотентных стволовых клеток может быть подтверждена, например, путем инъекции клеток мышам с тяжелым комбинированным иммунодефицитом (SCID), фиксирования образующихся тератом с помощью 4% параформальдегида, и их гистологического исследования для получения доказательств наличия клеточных типов, происходящих от трех зародышевых листков. В качестве альтернативы плюрипотентность можно определить по созданию эмбриоидных телец и анализа их на предмет присутствия маркеров, ассоциирующихся с тремя зародышевыми листками.
Выращенные линии плюрипотентных стволовых клеток могут быть кариотипированы с применением стандартного способа окрашивания с использованием красителя Гимза (G-banding) и сравнения с опубликованными кариотипами соответствующих видов приматов. Желательно получить клетки, имеющие «нормальный кариотип», т.е. эуплоидные клетки, в которых все человеческие хромосомы присутствуют и не имеют видимых изменений.
Источники плюрипотентных стволовых клеток
К типам плюрипотентных стволовых клеток, которые можно использовать, относятся устойчивые линии плюрипотентных клеток, получаемые из формируемой после вынашивания плода ткани, в том числе из преэмбриональной ткани (такой как бластоциста), эмбриональной ткани или ткани плода, взятой в любой момент в ходе вынашивания, как правило, но не обязательно, до срока приблизительно 10-12 недель беременности. Примерами, не ограничивающими настоящее изобретение, являются стабильные линии человеческих эмбриональных стволовых клеток или человеческих эмбриональных зародышевых клеток, например, клеточные линии человеческих эмбриональных стволовых клеток H1, H7 и H9 (WiCell). Также возможно использование описываемых в настоящей заявке составов в ходе первоначального установления или стабилизации таких клеток, в этом случае исходными клетками являются первичные плюрипотентные клетки, взятые напрямую из тканей-источников. Также соответствуют целям настоящего изобретения клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие питающих клеток. Также соответствуют целям настоящего изобретения клетки мутантных линий эмбриональных стволовых клеток человека, таких как, например, BG01v (BresaGen, Атенс, Джорджия, США).
В одном варианте осуществления подготовка человеческих эмбриональных стволовых клеток была описана Thomson et al. (патент США № 5843780; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff., 1998; Proc. Natl. Acad. Sci. U.S.A. 92:7844, 1995).
Культивирование плюрипотентных стволовых клеток
В одном варианте осуществления плюрипотентные стволовые клетки культивируют на слое питающих клеток, которые поддерживают плюрипотентные стволовые клетки в различных отношениях. Как вариант, полипотентные стволовые клетки культивируются в культуральной системе, по существу не содержащей питающих клеток, но, тем не менее, поддерживающей пролиферацию полипотентных стволовых клеток и не допускающей существенной дифференцировки. Рост плюрипотентных стволовых клеток в свободной от питающих клеток культуральной системе без дифференцирования поддерживается путем использования среды, кондиционированной посредством предварительного культивирования клеток иного типа. В качестве альтернативы рост плюрипотентных стволовых клеток в свободной от питающих клеток культуральной системе без дифференцирования поддерживается путем использования среды с химически определенным составом.
В одном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать на питающем слое фибробластов эмбриона мыши в соответствии со способами, изложенными в работе Reubinoff et al. (Nature Biotechnology 18: 399-404 (2000)). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое фибробластов эмбриона мыши в соответствии со способами, изложенными в работе Thompson et al. (Science 6, ноябрь 1998 г.: Vol. 282. no. 5391, pp. 1145-1147). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на любом из питающих слоев клеток, описанных в работе Richards et al. (Stem Cells 21: 546-556, 2003).
В одном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека в соответствии со способами, изложенными в работе Wang et al. (Stem Cells 23: 1221-1227, 2005). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека, описанном в работе Stojkovic et al. (Stem Cells 2005 23: 306-314, 2005). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека, описанном в работе Miyamoto et al. (Stem Cells 22: 433-440, 2004). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека, описанном в работе Amit et al. (Biol. Reprod 68: 2150-2156, 2003). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать на питающем слое клеток человека, описанном в работе Inzunza et al. (Stem Cells 23: 544-549, 2005).
В одном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 20020072117. В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 6642048. В альтернативном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в международной заявке WO2005014799. В альтернативном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в работе Xu et al. (Stem Cells 22: 972-980, 2004). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 20070010011. В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 20050233446. В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, представленными в патенте США № 6800480. В альтернативном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в культуральной среде, полученной в соответствии со способами, описанными в международной заявке WO2005065354.
В одном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в среде, описанной в международной заявке WO2005065354. Альтернативно, плюрипотентные стволовые клетки можно культивировать в среде, описанной в международной заявке WO2005086845.
В одном варианте осуществления плюрипотентные стволовые клетки можно культивировать по методам, описанным Cheon et al. (BioReprod DOI:10.1095/biolreprod.105.046870, October 19, 2005). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в соответствии со способами, представленными в работе Levenstein et al. (Stem Cells 24: 568-574, 2006). В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в соответствии со способами, представленными в патенте США № 20050148070. В альтернативном варианте осуществления плюрипотентные стволовые клетки можно культивировать в соответствии со способами, представленными в патенте США № 20050244962. В альтернативном варианте осуществления изобретения плюрипотентные стволовые клетки можно культивировать в соответствии со способами, описанными в международной заявке WO2005086845.
Плюрипотентные стволовые клетки могут быть высеяны на соответствующий культуральный субстрат. В одном из вариантов осуществления соответствующим культуральным субстратом является компонент внеклеточного матрикса, такой как, например, компонент, полученный из базальной мембраны, или компонент, который может участвовать в лиганд-рецепторном взаимодействии с участием молекулы адгезивного слоя. В одном из вариантов осуществления подходящим культуральным субстратом является МАТРИГЕЛЬ® (Becton Dickenson). МАТРИГЕЛЬ® представляет собой растворимый препарат из клеток опухоли Энгельбрета-Холма-Суорма, который при комнатной температуре превращается в гель и образует восстановленную базальную мембрану.
В качестве альтернативы можно использовать другие компоненты внеклеточного матрикса и смеси компонентов. В зависимости от типа пролиферирующих клеток, это может быть ламинин, фибронектин, протеогликан, энтактин, гепарансульфат и т.п., по отдельности или в различных сочетаниях.
Плюрипотентные стволовые клетки могут высеиваться на субстрат с соответствующим распределением по поверхности и в присутствии среды, поддерживающей выживание, размножение и сохранение требуемых характеристик клеток. Все эти характеристики улучшаются при тщательном подходе к распределению клеток при посеве и могут быть определены специалистом в данной области.
Подходящая культуральная среда может быть изготовлена, например, из следующих компонентов модифицированная по способу Дульбекко среда Игла (DMEM), Gibco № 11965-092, нокаутная модифицированная по способу Дульбекко среда Игла (KO DMEM), Gibco №10829-018, базовая среда Хэма F12/50% DMEM, 200 ммоль/л L-глутамина, Gibco № 15039-027; раствор неосновных аминокислот, Gibco 11140-050; β-меркаптоэтанол, Sigma № M7522; человеческий рекомбинантный основной фактор роста фибробластов (bFGF), Gibco № 13256-029.
Формирование клеток, экспрессирующих маркеры, характерные для линии сформированной панкреатической энтодермы, из плюрипотентных стволовых клеток
Настоящее изобретение представляет способы получения популяций клеток, экспрессирующих маркеры, характерные для клеточной линии сформированной эндодермы, из популяций плюрипотентных стволовых клеток. В одном варианте осуществления настоящее изобретение представляет способы дальнейшей дифференциации клеток, экспрессирующих маркеры ростка эндокринных клеток поджелудочной железы. В одном варианте осуществления это достигается пошаговым протоколом дифференцирования, в котором популяции плюрипотентных стволовых клеток сначала дифференцируются в популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы. Далее, популяции клеток, экспрессирующих маркеры, характерные для клеточной линии сформированной эндодермы, дополнительно дифференцируются в популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы. Далее, популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической энтодермы, дополнительно дифференцируются в популяции клеток, экспрессирующих маркеры, характерные для линии эндокринных клеток поджелудочной железы.
В настоящем изобретении представлена популяция, в которой более 80% клеток экспрессирует маркеры, характерные для линии сформированной эндодермы. Популяция клеток может подвергаться дальнейшей обработке для получения популяции клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы. Популяция клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, можно дополнительно обрабатывать для получения популяции клеток, экспрессирующих маркеры, характерные для линии эндокринных клеток поджелудочной железы.
Эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессируемый клетками, экспрессирующими маркеры, характерные для желательного вида клеток.
Способы оценки экспрессии маркеров белков и нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Сюда относятся количественная ревертазная полимеразная цепная реакция (ОТ-ПЦР), Нозерн-блот, гибридизация in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001, доп.)), а также способы иммунологического анализа, такие как иммуногистохимический анализ среза материала, Вестерн-блоттинг, а для маркеров, доступных в интактных клетках, - способ проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Характеристики плюрипотентных стволовых клеток хорошо известны специалистам в данной области, и продолжается выявление дополнительных характеристик плюрипотентных стволовых клеток. К маркерам плюрипотентных стволовых клеток относится, например, экспрессия одного или нескольких следующих маркеров: ABCG2, CRIPTO, FOXD3, Connexin43, Connexin45, OCT4, SOX2, Nanog, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60, Tra 1-81.
После обработки плюрипотентных стволовых клеток с применением способов, составляющих предмет настоящего изобретения, дифференцированные клетки могут быть выделены путем воздействия на популяцию клеток агентом (например, антителом), специфически распознающим белковый маркер, например CXCR4, экспрессируемый клетками, экспрессирующими маркеры, характерные для линии сформированной эндодермы.
К плюрипотентным стволовым клеткам, которые могут использоваться в настоящем изобретении, относятся, например, человеческие эмбриональные стволовые клетки линии H9 (код NIH: WA09), человеческие эмбриональные стволовые клетки линии H1 (код NIH: WA01), человеческие эмбриональные стволовые клетки линии H7 (код NIH: WA07) и человеческие эмбриональные стволовые клетки линии SA002 (Cellartis, Швеция). Также для использования в рамках настоящего изобретения подходят клетки, экспрессирующие по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, cripto, CD9, FOXD3, CONNEXIN43, CONNEXIN45, OCT4, SOX2, Nanog, hTERT, UTF1, ZFP42, SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81.
Маркеры, характерные для сформированной линии энтодермы, выбираются из группы, содержащей SOX17, GATA4, HNF3-бета, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобный гомеобоксовый белок, FGF4, CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и Otx2. Подходит для использования в настоящем изобретении клетка, экспрессирующая, как минимум, один из маркеров, характерных для линии сформированной эндодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой клетку-предшественника первичной полоски. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой мезэндодермальную клетку. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой клетку сформированной эндодермы.
Маркеры, характерные для линии энтодермы поджелудочной железы, выбираются из группы, содержащей PDX1, NKX6.1, HNF1-бета, PTF1-альфа, HNF6, HNF4-альфа, SOX9, HB9 и PROX1. Подходит для использования в настоящем изобретении клетка, экспрессирующая, как минимум, один из маркеров, характерных для линии панкреатической эндодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатической эндодермы, представляет собой клетку панкреатической эндодермы.
Маркеры, характерные для линии дифференцирования панкреатических эндокринных клеток, выбирают из группы, состоящей из следующих маркеров: NGN3, NEUROD, ISL1, PDX1, NKX6.1, PAX4, NGN3 и PTF-1-альфа. В одном варианте осуществления панкреатическая эндокринная клетка способна к экспрессии по меньшей мере одного из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид. Соответствующей целям настоящего изобретения является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии панкреатических эндокринных клеток. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатических эндокринных клеток, представляет собой панкреатическую эндокринную клетку. Панкреатическая эндокринная клетка может представлять собой панкреатическую клетку, экспрессирующую гормоны. В альтернативном варианте осуществления панкреатическая эндокринная клетка может представлять собой панкреатическую клетку, секретирующую гормоны.
В одном аспекте настоящего изобретения панкреатическая эндокринная клетка представляет собой клетку с экспрессией маркеров, характерных для линии дифференцирования β-клеток. Клетка с экспрессией маркеров, характерных для линии β-клеток, экспрессирует PDX1 и по меньшей мере один из следующих транскрипционных факторов: NGN3, NKX2.2, NKX6.1, NEUROD, ISL1, HNF3-бета, MAFA, PAX4 и PAX6. В одном аспекте настоящего изобретения клетка с экспрессией маркеров, характерных для линии дифференцирования β-клеток, представляет собой β-клетку.
Получение клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, из плюрипотентных стволовых клеток
В одном аспекте настоящего изобретения популяции плюрипотентных стволовых клеток могут дифференцироваться в популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде с концентрацией глюкозы, не превышающей 10,5 ммоль/л. В одном варианте осуществления изобретения дифференциация популяции плюрипотентных стволовых клеток в направлении популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, достигается обработкой плюрипотентных стволовых клеток активином А и лигандом Wnt.
В альтернативном варианте осуществления дифференциация популяции плюрипотентных стволовых клеток в направлении популяции клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, достигается обработкой плюрипотентных стволовых клеток GDF-8 и по меньшей мере одним из факторов, выбранных из группы, состоящей из нижеперечисленных: анилин-пиридинотриазин, циклический анилин-пиридинотриазин, N-{[1-(фенилметил)азепан-4-ил]метил}-2-пиридин-3-илацетамид, 4-{[4-(4-{[2-(пиридин-2-иламино)этил]амино}-1,3,5-триазин-2-ил)пиридин-2-ил]окси}бутан-1-ол, 3-({3-[4-({2-[метил(пиридин-2-ил)амино]этил}амино)-1,3,5-триазин-2-ил]пиридин-2-ил}амино)пропан-1-ол, N~4~-[2-(3-фторфенил)этил]-N~2~-[3-(4-метилпиперазин-1-