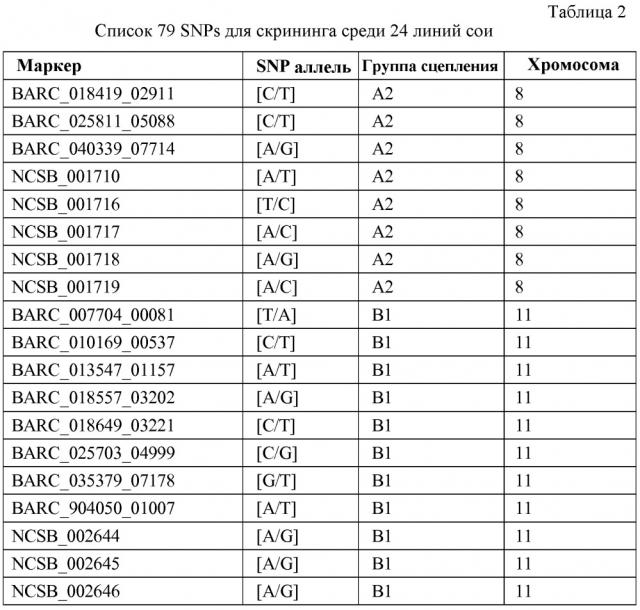
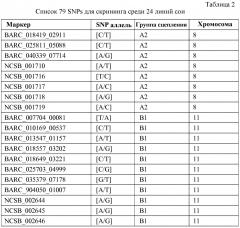
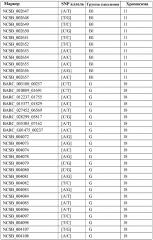
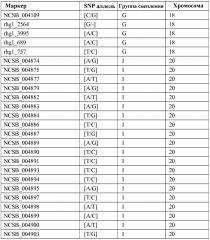
Маркеры, сцепленные с устойчивостью растений сои к scn
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу идентификации растения, включающему по крайней мере одну детерминанту устойчивости сорта растения сои к соевой цистообразующей нематоде (SCN), а также к способу получения SCN-устойчивого растения сои, представляющего собой интерес сорта, включающему стадии скрещивания растения сои, имеющего признак устойчивости к SCN, с растением сои SCN-неустойчивого сорта, представляющий интерес, применение маркер-вспомогательной селекции, а также размножение растений сои F1 с получением SCN-устойчивого растения сои. Также раскрыт способ придания растению сои устойчивости к SCN, способ переноса как минимум одной детерминанты устойчивости к SCN в сорт сои, а также способ введения как минимум одной детерминанты устойчивости к SCN сорта сои в растение-хозяина с помощью генетической трансформации, где каждый способ предусматривает исследование геномной ДНК растения для обнаружения маркера, сцепленным с SCN-устойчивым фенотипом сорта сои. Изобретение позволяет эффективно идентифицировать растение, включающеее по крайней мере одну детерминанту устойчивости сорта растения сои к SCN. 5 н. и 16 з.п. ф-лы, 9 ил., 4 табл., 7 пр.
Реферат
ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
Настоящая заявка претендует на приоритет предварительной заявки на патент США с порядковым номером 61/410783, поданной 5 ноября 2010.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящая заявка относится к устойчивости растений к заболеваниям. В некоторых вариантах осуществления, изобретение относится к устойчивости сои к соевой цистообразующей нематоде (SCN). В отдельных вариантах осуществления, настоящее изобретение относится к композициям и способам выявления признака устойчивости организма к SCN, например, к молекулярным маркерам, которые тесно сцеплены с устойчивостью к SCN. Другие варианты осуществления относятся к композициям и способам введения в организм хозяина признака устойчивости к SCN, например, с применением молекулярных маркеров, тесно сцепленных с устойчивостью к SCN.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Соя, т.е. Glycine max, является одной из основных сельскохозяйственных культур с экономической точки зрения, и ее выращивают по всему миру в качестве важнейшего источника растительного масла и белка. Растущая потребность в рационе питания с низким содержанием холестерина и высоким содержанием пищевых волокон повысила важность соевых бобов в качестве пищевого сырья. К настоящему времени в Соединенных Штатах было внедрено более 10000 сортов сои, ограниченное число которых образует генетическую основу культурных сортов, разработанных в результате осуществления программ гибридизации и селекции. Johnson and Bernard, The Soybean, Norman Ed., Academic Press, N.Y., pp.1-73, 1963.
Соевая цистообразующая нематода (SCN, Heterodera glycines (HG) Ichinohe) является наиболее опасным вредителем сои, который наносит наибольший урон как в Соединенных Штатах, так и в большинстве других крупнейших стран-производителей сои в мире. Согласно оценке, снижения урожая в Соединенных Штатах из-за поражения SCN в 2003 и 2004 годах составило примерно от 2,9 до 3,4 миллиона тонн, что соответствует ежегодному убытку примерно 1,5 миллиарда долларов. Wrather et al. (2001); Wrather and Koenning (2006). SCN-устойчивый фенотип является очень сложным признаком, который управляется большим количеством генов, как рецессивных, так и доминантных. Concibido et al. (2004). Выявление устойчивого к SCN фенотипа является продолжительным, дорогостоящим и трудоемким процессом.
Заражение SCN вызывает различные симптомы, которые могут включать хлороз листьев и стеблей, отмирание корней, уменьшение урожайности, ослабление роста корней и побегов. Симптомы заражения SCN, проявляющиеся на поверхностной части растений, не являются характерными только для заражения SCN, и их можно перепутать с недостатком питательных веществ, в особенности с дефицитом железа, стрессом от недостатка воды, поражением гербицидами или другими болезнями. Первым признаком заражения является появление групп растений с желтеющими листьями и отставанием в росте. Кроме того, обсуждаемый патоген трудно определить на корнях, поскольку ослабленная корневая система также является обычным симптомом стресса или заболевания растений. Взрослые самки и цисты SCN имеют длину примерно 1/32 дюйма, что позволяет видеть их без увеличительных приборов. Регистрация наличия взрослых самок и цист на корнях является единственным точным путем обнаружения и диагностирования заражения данного поля SCN.
Присутствие SCN, как правило, не является очевидным на первом этапе заражения почвы. Плотность популяции SCN в почве должна увеличиваться до тех пор, пока она не станет достаточной для проявления симптомов на надземной части растений или уменьшения продуктивности. Увеличение плотности популяции до значительной величины может занять несколько лет. Таким образом, текущий урон от SCN является результатом заражения, которое возрастало в течение нескольких лет. Хотя соя является основным хозяином SCN, другие бобовые растения, как например, зеленая фасоль, обыкновенная фасоль, зерновая фасоль, красная фасоль, лимская фасоль, золотистая фасоль, кустовая фасоль, фасоль адзуки, горох огородный и вигна китайская, также могут служить хозяевами SCN. Жизненный цикл SCN насчитывает тридцать дней. Поэтому за один сезон роста растений развивается несколько поколений паразитов. Кроме того, яйца SCN могут сохраняться в почве в течение нескольких лет до выведения паразитов.
В прошлом популяции SCN относили к определенной «расе», сравнивая их воспроизводство на наборе из четырех линий зародышевой плазмы (генетического материала) сои с воспроизводством на стандартном культурном сорте сои, неустойчивом к SCN. В наиболее широко применяемой классификации рас идентифицировано 16 рас SCN. Отнесение к той или иной расе давало возможность нематологам и специалистам по разведению сои делиться информацией о способности определенных популяций SCN воспроизводиться на различных сортах сои, которые содержат те или иные гены устойчивости к SCN.
В 2003 году вместо теста для определения расы был разработан тест на определение типа HG. Этот новый тест включает семь источников устойчивости (линий генетического материала), и его результаты представляют в виде процентных долей, показывающих прирост популяции нематод из образца почвы на каждой из этих семи линий. Этот тест показывает, какой из источников устойчивости мог бы оказаться подходящим для данного конкретного поля, проходящего тестирование, а какой оказывается неподходящим. Поскольку генетические источники устойчивости в настоящее время ограничены коммерчески доступными сортами сои, важно чередовать эти «источники устойчивости» для того чтобы отсрочить появление опасной популяции SCN.
Вскоре после обнаружения SCN в Соединенных Штатах, были выявлены источники устойчивости к SCN. Ross and Brim (1957) Plant Dis. Rep. 41:923-4. Некоторые линии, например, Peking и PI 88788 были быстро включены в селекционные программы. Peking нашел широкое применение в качестве источника устойчивости, благодаря отсутствию свойств, нежелательных с агрономической точки зрения, причем первым выведенным культурным сортом, устойчивым к SCN, стал Pickett. Установление того факта, что некоторые популяции SCN способны заражать устойчивые сорта сои привело к расширению поисков дополнительных источников устойчивости к SCN. PI 88788 появился как популярный источник устойчивости к расам SCN 3 и 4, несмотря на то, что индекс его устойчивости к цистам расы 4 был более 10% (но менее 20%), и Peking и его производные стали популярным источником устойчивости к расам 1 и 3. Впоследствии был выявлен сорт PI 437654, обладающий устойчивостью ко всем известным расам, и его устойчивость к SCN путем обратного скрещивания была передана сорту Forrest. В настоящее время известны более 130 PIs, обладающих устойчивостью к SCN. PI 209332 и PI 90763 являются другими примерами SCN-устойчивых селекционных линий сои. Не все сорта одного и того же источника устойчивости обладают сравнимой продуктивностью, и, кроме того, они неодинаковым образом реагируют на SCN.
Устойчивые сорта сои являются наиболее эффективным средством борьбы с SCN. Плотность SCN обычно уменьшается при возделывании устойчивых сортов сои, поскольку большинство неполовозрелых (ювенильных) особей SCN не способны питаться и развиваться на корнях устойчивых сортов. Однако на любом инфицированном поле в природных условиях небольшое количество ювенильных особей SCN (<1%) будут обладать способностью к воспроизводству на имеющихся в настоящее время устойчивых сортах. Количество ювенильных особей SCN, которые способны воспроизводиться на устойчивых сортах сои, может возрастать, если повторно выращивать один и тот же устойчивый сорт. В конце концов популяция SCN может приобрести способность воспроизводиться на устойчивом сорте столь же хорошо, как и на неустойчивом сорте, если SCN-устойчивый сорт постоянно выращивать на зараженном поле. К счастью, количество ювенильных особей SCN, которые способны к воспроизведению на устойчивых сортах, снижается, при выращивании неустойчивых сортов сои, поскольку эти нематоды не могут в достаточной степени конкурировать в почве за источники пищи с другими ювенильными особями SCN, которые не способны питаться устойчивыми сортами.
Считается, что раса 3 SCN является наиболее важной расой в штатах-производителях сои среднего запада. Значительные усилия были посвящены исследованию генетики и достижению устойчивости к SCN расы 3. Хотя и Peking, и PI 88788 устойчивы к расе 3 SCN, классические генетические исследования позволили предположить, что устойчивость в расе 3 вызвана разными генами. Rao-Arelli and Anand (1988) Crop Sci. 28:650-2. Устойчивость к расе 3, по-видимому, управляется тремя или четырьмя различными генами. Там же; см. также Mansur et al., (1993) Crop Sci. 33:1249-53. Одним из основных QTL (локусов количественных признаков), который локализован на группе сцепления G, является rhg1. Concibidio et al. (1996) Theor.Appl.Genet. 93:234-41. Другие QTLs локализованы на группах сцепления A2, C1, M, D, J, L25, L26 и K. Там же; патент США 5491081. QTLs, определяющие устойчивость к SCN, проявляют себя в зависимости от расы, по крайней мере с учетом различных пропорций общего изменения фенотипа в отношении различных рас SCN. Concibido et al. (1997) Crop.Sci. 37:258-64. Однако, локус rhg1 на группе сцепления G может быть необходим для проявления устойчивости к любой из выявленных рас SCN. Но см. Qui et al. (1999) Theor. Appl. Genet. 98:356-64.
Маркеры, которые сцеплены с признаками устойчивости к SCN, включают RFLPs (полиморфизмы длин рестрикционных фрагментов), SSRs (простые повторяющиеся последовательности) и SNPs (одиночные нуклеотидные полиморфизмы). Маркеры SNP, идентифицированные в настоящем изобретении, могут применяться для генотипирования устойчивости к SCN с целью содействия программе выведения устойчивых сортов. Использование раскрытых в настоящей заявке SNP маркеров для осуществления генотипирования устойчивости к SCN при содействии селекционной программе обеспечивает: экономию средств и времени, ранний отбор желаемого потомства и более точное и быстрое продвижение на рынок SCN-устойчивых сортов сои.
СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Молекулярные маркеры, которые сцеплены с SCN-устойчивым фенотипом, могут применяться для облегчения селекции с использованием маркеров для получения признака устойчивости к SCN у сои. Селекция с использованием маркеров обеспечивает значительные преимущества с точки зрения времени, стоимости и трудозатрат по сравнению с SCN-фенотипированием. В настоящем изобретении было неожиданно обнаружено, что среди 15 SNP маркеров, выявленных внутри или вблизи от областей QTL в геноме сои, ответственных за устойчивость к SCN, которые были полиморфными в генотипах родителей, только три оказались сцеплены с признаком устойчивости к SCN. Далее, три этих SNP-маркера приносят значительную пользу при селекции SCN-устойчивых сортов сои с использованием маркеров.
В настоящей заявке описаны содержащиеся в нуклеиновых кислотах молекулярные маркеры, которые сцеплены (например, сцеплены, тесно сцеплены или исключительно тесно сцеплены) с SCN-устойчивым фенотипом. В конкретных примерах эти молекулярные маркеры могут являться SNP-маркерами. Кроме того, в настоящей заявке описаны способы применения содержащихся в нуклеиновых кислотах молекулярных маркеров, которые сцеплены с SCN-устойчивым фенотипом, например, и не ограничиваясь этим, для выявления растений с SCN-устойчивым фенотипом, для введения SCN-устойчивого фенотипа в генотипы новых растений (например, путем селекции с использованием маркеров или генетической трансформации) и для культивирования растений, с высокой вероятностью имеющих SCN-устойчивый фенотип.
Кроме того, описаны средства для введения SCN-устойчивого фенотипа в растения сои, и средства для идентификации растений, имеющих SCN-устойчивый фенотип. В некоторых примерах, средство для введения SCN-устойчивого фенотипа в растения сои может представлять собой маркер, который сцеплен (например, сцеплен, тесно сцеплен или исключительно тесно сцеплен) с SCN-устойчивым фенотипом. В некоторых примерах, средство идентификации растений, имеющих SCN-устойчивый фенотип, может представлять собой зонд, который специфично гибридизуется с маркером, который сцеплен (например, сцеплен, тесно сцеплен или исключительно тесно сцеплен) с SCN-устойчивым фенотипом.
Кроме того, в настоящем изобретении описаны растения и растительные материалы, которые получены из растений, имеющих SCN-устойчивый фенотип, выявленный с помощью молекулярных маркеров, описанных в настоящей заявке. Так, например, описаны растения сои, которые получены селекцией с применением одного или нескольких молекулярных маркеров, которые сцеплены с SCN-устойчивым фенотипом.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
На Фиг. 1a и 1b приведен список QTLs, связанных с устойчивостью к SCN, которые приведены в литературе по SCN.
На Фиг.2 приведен геном сои, включая хромосомы и группы сцепления (LGs).
На Фиг.3 представлена хромосома сои 18 (группа сцепления G), а также QTLs и интервалы QTL, связанные с устойчивостью к SCN, и локализованные в них SNPs.
На Фиг.4 представлена хромосома сои 8 (группа сцепления A2), а также QTLs и интервалы QTL, связанные с устойчивостью к SCN, и локализованные в них SNPs.
На Фиг.5 представлена хромосома сои 11 (группа сцепления B1), а также QTLs и интервалы QTL, связанные с устойчивостью к SCN, и локализованные в них SNPs.
На Фиг.6 представлена хромосома сои 20 (группа сцепления I), а также QTLs и интервалы QTL, связанные с устойчивостью к SCN, и локализованные в них SNPs.
На Фиг.7 изображены кластеры из 24 культурных сортов или родительских линий сои, устойчивых или неустойчивых к SCN, на четырех локусах SNP. Кроме того представлена таблица, в которой показаны 24 культурных сорта сои и использованное SCN-картирование родителей. В приведенной таблице первая строка примеров и два последних примера во второй строке неустойчивы к SCN (зеленые), а первые 10 примеров во второй строке устойчивы к SCN (желтые). Три последних образца во втором ряду являлись родительскими линиями двух популяций для SCN-картирования.
На Фиг.8 показаны кластеры из 96 линий на трех локусах SNPs, которые демонстрируют косегрегацию с признаком устойчивости к SCN.
На Фиг.9 показано распределение индексов устойчивости к SCN, присвоенных популяциям для картирования. На гистограмме отражен диапазон от 0,01 до 3,8 со средним значением 0,63 и медианным значением 0,465.
СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Последовательности нуклеиновых кислот, приведенные в приложенных к заявке списках последовательностей, показаны с применением стандартных буквенных сокращений для нуклеотидных оснований, которые определены в 37 C.F.R. § 1.822. Для каждой из последовательностей нуклеиновых кислот показана только одна нить, но предполагается, что комплементарная нить включена посредством ссылки на показанную нить. В приложенных списках последовательностей:
SEQ ID NO:1 демонстрирует последовательность праймера, применяемого в анализе с помощью конкурентной аллель-специфичной системы генотипирования PCR SNP KBiosciences (KASParTM), которая специфична для аллели rhg1-3995: GAAGGTGACCAAGTTCATGCTGGAATT ATGTTGGGTTTTTTTTCTTTCTGT.
SEQ ID NO:2 демонстрирует последовательность второго праймера, используемого в анализе KASParTM, которая специфична для аллели rhg1-3995: GAAGGTCGGAGTCAACGGATTGAATTATGTTGGGTTTT TTTTCTTTCTGG.
SEQ ID NO:3 демонстрирует последовательность общего обратного праймера, используемого в анализе KASParTM для rhg1-3995: GCCCAGAAAAAAGGGATAAATAACGGATA.
SEQ ID NO:4 демонстрирует последовательность праймера, используемого в анализе KASParTM, которая специфична для аллели NCSB_004074: GAAGGTGACCAAGTTCATGCTATTATGTTGTAACACAAATTTGCA CCTCAT.
SEQ ID NO:5 демонстрирует последовательность второго праймера, используемого в анализе KASParTM, которая специфична для аллели NCSB_004074: GAAGGTCGGAGTCAACGGATTATGTTGTAACACAAATTTGCACCTCAG.
SEQ ID NO:6 демонстрирует последовательность общего обратного праймера, используемого в анализе KASParTM, для NCSB_004074: CTATACAACTAAATCGTAATTCCATTGTAT.
SEQ ID NO:7 демонстрирует последовательность праймера, используемого в анализе KASParTM, которая специфична для аллели BARC_010889-01691: GAAGGTGACCAAGTTCATGCTGAAAAAATAAAATTGATCATCACATATGGTTAG.
SEQ ID NO:8 демонстрирует последовательность второго праймера, используемого в анализе KASParTM, которая специфична для аллели BARC_010889-01691: GAAGGTCGGAGTCAACGGATTGAAAAAATAAAATTGATCATCACATATGGTTAA.
SEQ ID NO:9 демонстрирует последовательность общего обратного праймера, используемого в анализе KASParTM для BARC_010889-01691: TAAGTGAGGGCAATGTATTAGTATYAAGTA.
SEQ ID NO:10 демонстрирует последовательность маркера NCSB_004074: CACGATTTTGTTGTGTTACATAAATTACTATACAACTAAATCGTAATTCCA TTGTATTAC [А/С] TGAGGTGCAAATTTGTGTTACAACATAATTGTAATTTTA TTGTACGATAAAAACTATAAC.
SEQ ID NO:11 демонстрирует последовательность маркера BARC_010889-01691:
CTCTTCACACCTTTAAGGAAGTTAGTACCATTCCACTATTCAAGTATTTTTT
TTAATTCAAAATTATTAAGTGAGGGCAATGTATTAGTATNAAGTA[C/T]TA
ACCATATGTGATGATCAATTTTATTTTTTCATGGCTTTGTCGAAAGTAACA
TTATATTGTGGTTTTAAATGAAAATCTGTGATTTGCAT.
SEQ ID NO:12 демонстрирует последовательность маркера rhg1-3995: TCTGATAACTATGACAGCATCTTCCAAGATAATGACTTCCAAGTTCCAACA
CTGGCTCTGTACATTTGAACTAATTTTATATCATTTATCTATTGTGATTGAA
ATATAAAATTGAAGTGATGTGAACAATACAAATCACATCTTGAATTAAAA
TATCTAACAACTGGAACAAATAAGAGGCCCAGAAAAAAGGGATAAATAA
CGGATAACAAG[A/C]CAGAAAGAAAAAAAACCCAACATAATTCCAACTTC
AAAATTCACTCAATAAAAAGTTTAACATGTAAATTTACTTGGAAACAAAA
CTCATAACCAATAATAATAATAATAAAAGAAATCAGTTTTATAGCATTAA
TTTGGGATGCTCTGCTTGTATGCAAATGGCACAACCTTACCCTCAAGATTG
CAAAACACAGATGAGTAACAGATGCAATGTGAATCAATAAAAAGTATTGT
TGCGTTGTTGATGACACAACCTTACTCATAAAAAATGCAT.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Общее описание некоторых вариантов осуществления изобретения
Конкретные варианты осуществления изобретения включают три типовых SNP маркера (rhg1-3995, BARC_010889_01691 и NCSB_004074), которые демонстрируют косегрегацию с признаком устойчивости к цистообразующей соевой нематоде (SCN) в 96 исследованных линиях растений сои. Маркеры, которые проявляют косегрегацию с устойчивостью к SCN, сцеплены с этим признаком и, следовательно, могут быть полезны для селекции и выведения новых сортов с использованием этих маркеров. Кроме того, в заявке раскрыта стратегия, применяемая для выявления этих трех типовых SNP-маркеров, сцепленных с устойчивостью к SCN. Определены положения этих трех типовых SNP маркеров на физической карте генома Glycine max. С применением трех типовых маркеров, описанных в настоящей заявке, был разработан специфичный анализ, использующий конкурентную аллель-специфичную систему PCR SNP генотипирования KBiosciences (KASParTM), для быстрого и точного выявления растений, несущих признак устойчивости к SCN. Хотя варианты осуществления настоящего изобретения описаны применительно к трем типовым SNP маркерам, сцепленным с устойчивостью к SCN, специалист в данной области поймет, что используя методики, описанные в настоящей заявке, можно выявить дополнительные эквивалентные маркеры. SNP маркеры, сцепленные с устойчивостью к SCN, можно применять, например, в SCN-генотипировании, для выбора SCN-устойчивых индивидуальных растений из выведенных популяций сои.
Устойчивость к соевой цистообразующей нематоде (SCN) является очень сложным признаком. Заражение SCN может быть вызвано одной или несколькими различными расами Heterodera glycines, причем устойчивость к каждой из них может потребовать наличия различных генов устойчивости, локализованных на различных группах сцепления. Смотрите таблицу 1. Все три маркера, приведенных в таблице 1, локализованы на группе сцепления G. Считается, что ген(гены) устойчивости к SCN в группе сцепления G несут ответственность за устойчивость к расам 3 и 14.
Описанная в настоящей заявке стратегия применяется для выявления маркеров в других группах сцепления (например, A2, B1 и I), которые сцеплены с устойчивостью к SCN. Таким образом, изобретение относится также к способам идентификации таких маркеров. Разработанная общая стратегия применяется также для картирования других интересующих признаков. Эта стратегия является более эффективной, чем традиционные стратегии картирования, и может найти применение, в частности, в программах молекулярной селекции.
| Таблица 1 | ||
| Источники устойчивости к SCN | ||
| Устойчивый генетический материал (зародышевая плазма) | Расы H.glycines | Группы сцепления (LG) |
| PI 88788 | 3, 14 | G |
| Peking | 1, 3 и 5 | G, A2 и B |
| PI 437654 | все | G(Rhg1), A2 (Rhg4), B, C1, L25, L26, M и D1a |
| PI 90763 | 3 |
| PI 438489B | 1, 2, 3, 5 и 14 | G, E, A1, B1 и C1 |
| PI 89772 | 1, 2, 3 и 5 | G, E, A1, C1, C2 и D1a |
| PI 209332 | все | G(Rhg1) и A2 (Rhg4) |
| PUSCN14 | 3 | A, G, B, I и F |
| Hartwig | 3 | |
| Forrest | 3 | G и A2 |
| Pyramid | 3, 14 (из PI 88788) | A2, D и G |
II. Термины
Популяция для картирования: в настоящем описании термин «популяция для картирования» может относиться к популяции растений, использованной для составления генетических карт. Популяции для картирования, как правило, получают в результате управляемого скрещивания родительских генотипов. Решения по поводу выбора родительских растений и плана скрещивания для получения популяции для картирования, а также типа используемых маркеров, зависят от гена, который предполагается картировать, доступности маркеров и молекулярной карты. Предки растений в популяции для картирования должны обладать достаточным разнообразием в отношении интересующего признака (признаков), как на уровне последовательностей нуклеиновых кислот, так и на уровне фенотипа. Разнообразие родительских последовательностей нуклеиновых кислот используется для того, чтобы следить за явлениями рекомбинации у растений популяции для картирования. Доступность информативных полиморфных маркеров зависит от количества вариантов последовательностей нуклеиновых кислот.
Обратное (возвратное) скрещивание: способы обратного скрещивания могут применяться для введения в растения определенной последовательности нуклеиновой кислоты. Методика обратного скрещивания в течение нескольких десятилетий широко применяется для придания растениям новых признаков. N.Jensen, Ed., Plant Breeding Methodology, John Wiley & Sons, Inc., 1988. В типовой методике обратного скрещивания исходный сорт интересующего растения (рекуррентного родителя) скрещивают со вторым сортом (не рекуррентным родителем), несущей интересующий ген, который необходимо передать. Полученное от этого скрещивания потомство вновь скрещивают с рекуррентным родителем и повторяют этот процесс до тех пор, пока не получают растение, в котором воспроизводятся практически все желаемые морфологические и физиологические характеристики рекуррентного растения, наряду с генами, перенесенными из не рекуррентного родителя.
Конкурентная аллель-специфичная система PCR SNP генотипирования KBiosciences (KASParTM): KASParTM представляет собой коммерчески доступную гомогенную флуоресцентную систему для определения SNP генотипов (KBiosciences Ltd., Hoddesdon, UK). Анализ с применением системы KASParTM включает SNP-специфичную «аналитическую смесь», которая содержит три немеченых праймера, и «реакционную смесь», которая содержит все остальные необходимые компоненты, например, универсальную флуоресцентную систему регистрации результатов. Кроме этих смесей, пользователю системы необходим, в числе прочего, планшет-ридер, способный регистрировать FRET (резонансный перенос энергии флуоресценции), микротитровальный планшет (планшеты) и образцы ДНК, в которых содержится примерно 5 нг/л ДНК.
Типовая методика анализа KASParTM включает стадии: разработки аллель-специфичного праймера (например, с использованием PrimerPickerTM, т.е. бесплатного сервиса, который доступен через Интернет на веб-сайте KBiosciences), приготовления реакционной смеси, включающей аллель-специфичные праймеры, смешивание этой реакционной смеси с образцами ДНК в микротитровальном планшете, термоциклирование, считывание планшетов на флуоресцентном планшет-ридере, построение графиков и обсчет данных по флуоресценции. Данные для всех образцов наносят на один двумерный график, где оси x- и y- соответствуют значениям флуоресценции групп FAM и VIC. Образцы, имеющие один и тот же кластер генотипов SNP, находятся на графике вместе (т.е. A/A, A/a и a/a). Более подробную техническую информацию о системе KASPar, включая руководство по решению типичных проблем, можно получить у KBiosciences Ltd. (например, KASPar SNP Genotyping System Reagent Manual (Руководство по реагентам системы SNP генотипирования KASPar)).
Сцепленные, тесно сцепленные и исключительно тесно сцепленные: в настоящем описании сцепление между генами и маркерами может относиться к явлению, при котором гены или маркеры на хромосоме демонстрируют определенную вероятность совместно передаваться индивидуумам в следующем поколении. Чем ближе друг к другу находятся два гена или маркера, тем ближе к единице становится эта вероятность. Таким образом, термин «сцепленный» может относиться к одному или нескольким генам или маркерам, которые передаются по наследству вместе с другим геном с вероятностью более 0,5 (которая ожидается от независимого распределения генов, если маркеры/гены локализованы на различных хромосомах). Если наличие гена вносит вклад в фенотип индивидуума, можно сказать, что маркеры, которые сцеплены с этим геном, сцеплены с фенотипом. Таким образом, термин «сцепленный» может относиться к взаимосвязи между маркером и геном или между маркером и фенотипом.
Поскольку близость двух генов или маркеров на хромосоме непосредственно связана с вероятностью совместной передачи этих генов или маркеров индивидуумам следующего поколения, термин «сцепленный» может также относиться в настоящей заявке к одному или нескольким генам или маркерам, которые расположены в пределах примерно 2,0 Mb (MegaBase, млн.пар оснований) друг от друга на одной и той же хромосоме.
Таким образом, «сцепленные» гены или маркеры могут быть отделены друг от друга примерно 2,1 Mb, 2,00 Mb, примерно 1,95 Mb, примерно 1,90 Mb, примерно 1,85 Mb, примерно 1,80 Mb, примерно 1,75 Mb, примерно 1,70 Mb, примерно 1,65 Mb, примерно 1,60 Mb, примерно 1,55 Mb, примерно 1,50 Mb, примерно 1,45 Mb, примерно 1,40 Mb, примерно 1,35 Mb, примерно 1,30 Mb, примерно 1,25 Mb, примерно 1,20 Mb, примерно 1,15 Mb, примерно 1,10 Mb, примерно 1,05 Mb, примерно 1,00 Mb, примерно 0,95 Mb, примерно 0,90 Mb, примерно 0,85 Mb, примерно 0,80 Mb, примерно 0,75 Mb, примерно 0,70 Mb, примерно 0,65 Mb, примерно 0,60 Mb, примерно 0,55 Mb, примерно 0,50 Mb, примерно 0,45 Mb, примерно 0,40 Mb, примерно 0,35 Mb, примерно 0,30 Mb, примерно 0,25 Mb, примерно 0,20 Mb, примерно 0,15 Mb, примерно 0,10 Mb, примерно 0,05 Mb, примерно 0,025 Mb и примерно 0,01 Mb. Конкретные примеры маркеров, которые «сцеплены» с SCN-устойчивым фенотипом у растений сои, включают нуклеотидные последовательности на хромосоме 18 генома сои.
Термин «тесно сцепленные» в настоящем описании может относиться к одному или нескольким генам или маркерам, которые расположены в пределах примерно 0,5 Mb друг от друга на одной и той же хромосоме. Таким образом, два «тесно сцепленных» гена или маркера могут быть отделены друг от друга примерно 0,6 Mb, примерно 0,55 Mb, 0,5 Mb, примерно 0,45 Mb, примерно 0,4 Mb, примерно 0,35 Mb, примерно 0,3 Mb, примерно 0,25 Mb, примерно 0,2 Mb, примерно 0,15 Mb, примерно 0,1 Mb и примерно 0,05 Mb.
Термин «исключительно тесно сцепленные» в настоящем описании может относиться к одному или нескольким генам или маркерам, которые расположены в пределах примерно 100 Kb друг от друга на одной и той же хромосоме. Таким образом, два «исключительно тесно сцепленных» гена или маркера могут быть отделены друг от друга примерно 125 Kb, примерно 120 Kb, примерно 115 Kb, примерно 110 Kb, примерно 105 Kb, 100 Kb, примерно 95 Kb, примерно 90 Kb, примерно 85 Kb, примерно 80 Kb, примерно 75 Kb, примерно 70 Kb, примерно 65 Kb, примерно 60 Kb, примерно 55 Kb, примерно 50 Kb, примерно 45 Kb, примерно 40 Kb, примерно 35 Kb, примерно 30 Kb, примерно 25 Kb, примерно 20 Kb, примерно 15 Kb, примерно 10 Kb, примерно 5 Kb и примерно 1 Kb.
Конкретные примеры маркеров, которые «исключительно тесно сцеплены» с SCN-устойчивым фенотипом в растениях сои, включают rhg1-3995, BARC_010889_01691 и NCSB_004074.
В связи с изложенным выше, следует понять, что маркеры, сцепленные с конкретным геном или фенотипом, включают те маркеры, которые тесно сцеплены, и те маркеры, которые исключительно тесно сцеплены с этим геном или фенотипом. Сцепленные, тесно сцепленные и исключительно тесно сцепленные генетические маркеры SCN-устойчивого фенотипа могут найти применение в программах селекции с использованием маркеров для выявления SCN-устойчивых сортов сои и для воспроизведения этого признака в других сортах сои и придания им устойчивости к SCN.
Локус: в настоящем описании термин «локус» относится к положению на геноме, которое соответствует определенной характеристике (например, признаку). SNP-локус определяется с помощью зонда, который гибридизуется с ДНК, находящейся в этом локусе.
Маркер: в настоящем описании термин «маркер» относится к гену или нуклеотидной последовательности, которые могут применяться для идентификации растений, имеющих конкретную аллель. Маркер можно описать как изменение в данном локусе генома. Генетический маркер может являться короткой ДНК-последовательностью, например, последовательностью, окружающей изменение в одной паре оснований (одиночный нуклеотидный полиморфизм или «SNP») или длинной ДНК-последовательностью, например, микросателлитом/простой повторяющейся последовательностью («SSR»). Термин «маркерная аллель» относится к варианту маркера, который присутствует у конкретного индивидуума.
Термин «маркер» в настоящем описании может относиться к клонированному сегменту хромосомной ДНК сои (например, сегменту, включающему rhg1-3995, BARC_010889_01691 или NCSB_004074) и может также или в качестве альтернативы относиться к молекуле ДНК, которая комплементарна клонированному сегменту хромосомной ДНК сои (например, ДНК, комплементарной сегменту, включающему rhg1-3995, BARC_010889_01691 или NCSB_004074).
В некоторых вариантах осуществления, присутствие маркера в растении может быть обнаружено с помощью зонда, представляющего собой нуклеиновую кислоту. Зонд может являться молекулой ДНК или молекулой РНК. РНК-зонды можно синтезировать способами, известными в технике, например, используя молекулу ДНК в качестве матрицы. Зонд может содержать часть или всю нуклеотидную последовательность маркера и, кроме того, соседнюю нуклеотидную последовательность из генома растения. Это именуется в настоящей заявке «зондом, включающим соседнюю последовательность». Эта дополнительная соседняя нуклеотидная последовательность именуется «расположенной выше» или «расположенной ниже» исходного маркера, в зависимости от того, находится ли соседняя нуклеотидная последовательность хромосомы растения на 5’ или 3’ стороне от исходного маркера, как это обычно подразумевается. Как понятно рядовому специалисту в данной области техники, способ получения дополнительной соседней нуклеотидной последовательности для включения в маркер можно повторять практически неограниченно (ограничением является только длина хромосомы), выявляя тем самым дополнительные маркеры на хромосоме. Все описанные выше маркеры могут применяться в некоторых вариантах осуществления настоящего изобретения.
Олигонуклеотидную последовательность зонда можно получать синтетически или с помощью клонирования. Подходящие векторы для клонирования хорошо известны специалисту в данной области техники. Олигонуклеотидный зонд может быть меченым или не меченым. Существует целый ряд методик для введения меток в молекулы нуклеиновых кислот, в том числе, например, но не ограничиваясь этим, введение радиоактивной метки с помощью ник-трансляции, случайное праймирование, наращивание цепи с помощью терминальной дезокситрансферазы и т.п., где используемые нуклеотиды помечены, например, радиоактивными атомами 32P. Другие подходящие метки включают, например, и не ограничиваясь этим: флуорофоры (например, FAM и VIC), ферменты, субстраты ферментов, кофакторы ферментов, ингибиторы ферментов и т.п. В качестве альтернативы, вместо применения метки, которая дает измеримый сигнал, сама по себе, либо в сочетании с другими реакционноспособными агентами, можно использовать лиганды, с которыми связываются рецепторы, причем эти рецепторы являются мечеными (например, перечисленными выше метками) и обеспечивают получение измеримых сигналов, либо сами по себе, либо в сочетании с другими реагентами. Смотрите, например, Leary et al., (1983) Proc.Natl.Acad.Sci. USA 80:4045-9.
Зонд может содержать нуклеотидную последовательность, которая не является соседней по отношению к первоначальному маркеру, и такой зонд именуется в настоящей заявке «зондом, включающим несвязанную последовательность». Несвязанная последовательность такого зонда располагается на геноме достаточно близко к последовательности первоначального маркера, так что зонд, включающий несвязанную последовательность, генетически сцеплен с тем же самым геном или признаком (например, с устойчивостью к SCN). Например, в некоторых вариантах осуществления изобретения, зонд, включающий несвязанную последовательность, расположен в пределах 500 kb, 450 kb, 400 kb, 350 kb, 300 kb, 250 kb, 200 kb, 150 kb, 125 kb, 100 kb, 0,9 kb, 0,8 kb, 0,7 kb, 0,6 kb, 0,5 kb, 0,4 kb, 0,3 kb, 0,2 kb или 0,1 kb от первоначального маркера на геноме сои.
Зонд может являться точной копией маркера, который необходимо обнаружить. Кроме того, зонд может являться молекулой нуклеиновой кислоты, включающей или состоящей из нуклеотидной последовательности, которая практически идентична клонированному сегменту хромосомной ДНК интересующего организма (например, сои). В настоящей заявке термин «практически идентичный» может относиться к нуклеотидным последовательностям, которые идентичны более чем на 85%. Например, практически идентичная нуклеотидная последовательность может быть идентична исходной последовательности на 85,5%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,5%.
Зонд может также представлять собой молекулу нуклеиновой кислоты, которая «способна специфично гибридизоваться» или «специфично комплементарна» точной копии маркера, который необходимо обнаружить («ДНК мишени»). Термины «способна специфично гибридизоваться» и «специфично комплементарна» указывают на степень комплементарности, достаточную для того, чтобы между молекулой нуклеиновой кислоты и ДНК мишенью возникало устойчивое и специфичное связывание. Молекула нуклеиновой кислоты не должна быть на 100% комплементарна целевой последовательности, для того, чтобы была возможна специфичная гибридизация. Молекулы нуклеиновых кислот способны к специфичной гибридизации, если имеется достаточная степень комплементарности для того, чтобы избежать неспецифичного связывания нуклеиновой кислоты с нецелевыми последовательностями в условиях, когда желательно специфичное связывание, например, в жестких условиях гибридизации.
Условия гибридизации, означающие ту или иную конкретную степень жесткости, будут меняться в зависимости от природы выбранной методики гибридизации, а также от структуры и длины гибридизующихся последовательностей нуклеиновых кислот. Жесткость условий гибридизации, главным образом, будут определять температура гибридизации и ионная сила (в частности, концентрация Na+ и/или Mg++) буфера для гибридизации, хотя время промывания также оказывает влияние на жесткость условий. Рядовому специалисту в данной области техники известны способы расчета условий гибридизации, требующихся для достижения конкретной степени жесткости, и эти способы обсуждаются, например, в Sambrook et al., (ed.) Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, главы 9 и 11; и Hames and Higgins (eds.) Nucleic Acid Hybridization, IRL Press, Oxford, 1985. Более подробные инструкции и указания, относящиеся к гибридизации нуклеиновых кислот, можно найти, например, в Tijssen, "Overview of principles of hybridization и the strategy of nucleic acid probe assays," in Laboratory Techniques в Biochemistry и Molecular Biology - Hybridization with Nucleic Acid Probes, Part I, Chapter 2, Elsevier, NY, 1993; и Ausubel et al., Eds., Current Protocols в Molecular Biology, Chapter 2, Greene Publishing and Wiley-Interscience, NY, 1995.
В настоящем описании, термин «жесткие условия» охватывает условия, в которых гибридизация будет происходить только в том случае, если имеется менее 50% несоответствий между гибридизующейся молекулой и ДНК мишенью. «Жесткие условия» включают дополнительные отдельные уровни жесткости. Так, например, в настоящей заявке условия «умеренной жесткости» представляют собой такие условия, в которых не будут гибридизоваться молекулы с более чем 50% несоотв