Способ получения культуры мезенхимных стволовых клеток человека из периваскулярного пространства вены пупочного канатика
Иллюстрации
Показать всеИзобретение относится к области клеточной биологии и биотехнологии, а именно к получению культуры мезенхимных стволовых клеток человека (МСК) из периваскулярного пространства пупочного канатика. Способ включает вырезание фрагмента пупочного канатика, заполнение его 0,2% раствором коллагеназы, закрывание обоих его концов и выдерживание в течение 20-40 минут при температуре 37°С с последующим промыванием сбалансированным солевым раствором, заполнением новой порцией 0,2% раствора коллагеназы, закрыванием обоих его концов и выдерживанием в течение 30-60 минут при температуре 37°С. После второго выдерживания упомянутую пупочную вену промывают сбалансированным солевым раствором, полученную при промывке жидкость центрифугируют и культивируют полученный осадок на селективных средах. Изобретение позволяет повысить выход и чистоту получаемой культуры МСК и в ряде случаев уменьшить время получения МСК. 1 з.п. ф-лы, 2 ил., 3 пр.
Реферат
Изобретение относится к области клеточной биологии и биотехнологии, а именно к клеточным технологиям, в частности к способам получения мезенхимных стволовых клеток человека, применяемых в регенеративной терапии.
Мезенхимные стромальные (стволовые) клетки (МСК) - это мультипотентные клетки, происходящие из мезодермального зародышевого листка, обладающие способностью к самоподдержанию популяции и дифференцировке в клетки мезенхимного ряда: хондроциты, остеоциты, адипоциты. Существуют методы дифференцировки МСК в клетки, которые в организме формируются из других зародышевых листков: эпителиоциты, нейроноподобные клетки. МСК оказывают иммуномодулирующие действие, выделяют ангиогенные факторы, а также способны к миграции к месту повреждения. Кроме того, МСК способны дифференцироваться в клетки поврежденных тканей, способствуя, таким образом, восстановлению функциональной целостности органа или ткани. Подобные свойства позволяют рассматривать МСК как перспективный инструмент регенеративной терапии, основанной на клеточных технологиях.
Пуповина, в частности Вартонов студень и периваскулярное пространство сосудов, а также пуповинная кровь и плацента, обычно утилизируемые после родов, представляют собой удобные источники получения МСК, поскольку в них содержится большое количество МСК в пересчете на 1 грамм ткани, и количество получаемой ткани велико по сравнению с остальными источниками. Кроме этого, клетки из этих источников обладают более высоким пролиферативным потенциалом по сравнению с МСК жировой ткани и костного мозга взрослого человека, что позволяет сократить время экспансии, то есть наращивания клеток без утраты дифференцировочного потенциала в условиях in vitro. Подобная экспансия необходима в большинстве случаев, т.к. для большинства терапевтических и хирургических процедур с использованием МСК ни один источник получения МСК не позволяет получить клетки в количестве, достаточном для взрослого пациента, то есть 20-80 млн в зависимости от массы тела пациента и проводимой процедуры.
В пуповине обнаружено пять зон, из которых возможно выделить МСК:
1. 20-50% свежевыделенной мононуклеарной фракции пуповинной крови;
2. субэндотелиальный слой пупочной вены;
3. внешние слои (периваскулярное пространство) пуповинных сосудов;
4. интраваскулярное пространство;
5. субамниотическое пространство.
МСК, выделенные из разных зон пупочного канатика, являются отдельными популяциями с одинаковым иммунофенотипом, но различной пролиферативной активностью и дифференцировочной способностью, обзор этих данных сделан в статье: Conconi М.Т., Di Liddo R., Tommasini M., Calore C., Parnigotto P.P. Phenotype and differentiation potential of stromal populations obtained from various zones of human umbilical cord: an overview // The Open Tissue Eng Regen Med J. - 2011. - V. 4. - P. 6-20. МСК периваскулярного пространства характеризуются высокой скоростью роста популяции in vitro и высоким уровнем экспрессии панцитокератина и CD146 [Carvalho М., Teixeira F.G., Reis R.L., Sousa N., Salgado AJ. Mesenchymal stem cells in the umbilical cord: phenotypic characterization, secretome and applications in central nervous system regenerative medicine // Current stem cell research & therapy. - 2011. - V. 6. - №. 3. - P. 221-228]. Кроме того, МСК из этих двух регионов отличаются по уровню продукции IL-6 и Flt3 [Xu М., Zhang В., Liu Y., Zhang J., Sheng H., Shi R., Chen H. The immunologic and hematopoietic profiles of mesenchymal stem cells derived from different sections of human umbilical cord // Acta biochimica et biophysica Sinica. - 2014. - C. 100].
В статье: Ennis J., Sarugaser R., Gomez A., Baksh D., Davies J.E. Isolation, characterization, and differentiation of human umbilical cord perivascular cells (HUCPVCs) // Methods in cell biology. - 2008. - V. 86. - P. 121-136 показана возможность получения МСК из периваскулярного пространства пупочной вены.
Известен способ получения культуры МСК из периваскулярного пространства пупочного канатика, описанный в: Sarugaser R., Lickorish D., Baksh D., Hosseini M.M., Davies J.E. Human umbilical cord perivascular (HUCPV) cells: a source of mesenchymal progenitors // Stem Cells. - 2005. - V. 23. - №2. З. 220-229. Способ заключается в том, что сосуды - вену и обе артерии - пупочного канатика поочередно вырезают из Вартонова студня, сшивают концы каждого сосуда друг с другом, чтобы образовалась замкнутая петля, и инкубируют в 0,1% растворе коллагеназы в течение 18-24 часов. Затем петли вынимают, раствор центрифугируют, осадок несколько раз промывают и культивируют стандартным способом. Вышеописанный способ очень трудоемкий, включает в себя сложные процедуры препарирования сосудов из Вартонова студня и длительную 24-часовую ферментативную обработку. Это делает вышеописанный способ непригодным для применения в терапевтических целях для большого количества пациентов, особенно при необходимости быстрого получения МСК. Жизнеспособность выделенных клеток низка в результате длительной 24-часовой ферментативной обработки.
В статье: Айзенштадт А.А., Иванова Н.А., Багаева В.В., Смолянинов А.Б., Самойлович М.П., Климович В.Б. Внутриклеточные иммуноглобулины в линиях Namalva и U266 при сокультивировании с мезенхимными клетками // Цитология - 2014. - Т. 56. - №2. - С. 117-121 описан способ получения МСК из периваскулярного пространства пупочного канатика, позволяющий сократить время обработки пупочного канатика с 16-26 ч до 1,5 ч. Этот способ заключается в том, что в пупочную вену цельного неизмельченного фрагмента канатика (10-30 см) вводят 0,2% раствор коллагеназы IV типа, закрывают с обоих концов клеммами и выдерживают в течение 60 мин при температуре 37°С. После инкубации, пупочную вену промывают фосфатно-солевым буфером и полученную при промывке жидкость центрифугируют. Осадок переносят в селективную среду и культивируют несколько пассажей в культуральных емкостях, приспособленных для культивирования адгезивных клеток.
Полученные клетки обладают иммунофенотипом МСК и способны дифференцироваться в остео-, хондро- и адипогенном направлении. Вышеописанный способ существенно сокращает время получения культуры МСК за счет исключения этапа препарирования сосудов пуповины и сокращения времени обработки коллагеназой. Однако недостатками метода являются: а) низкий выход клеток - 1 млн клеток на 10 см длины канатика после первого пассажа; б) загрязнение выделяемых МСК клетками других типов, в-основном, эндотелиоцитами; в) низкая сохранность МСК в результате длительного 1-часового инкубирования в растворе коллагеназы, а вследствие этого - их низкая пролиферативная активность; г) большое время эксплантации МСК в культуру (5 дней). Эти недостатки делают вышеописанный способ малопригодным для коммерческого использования. Данный способ является наиболее близким к заявляемому изобретению и выбран в качестве прототипа.
Задачей настоящего изобретения является создание способа получения культуры МСК из периваскулярного пространства пупочного канатика, обеспечивающего уменьшение времени получения культуры МСК, повышение выхода и сохранности получаемых клеток, повышение чистоты культуры МСК.
Поставленная задача решается тем, что в способе получения культуры МСК из периваскулярного пространства пупочного канатика вырезают фрагмент упомянутого пупочного канатика, заполняют вену упомянутого канатика раствором 0,2% коллагеназы, закрывают оба конца упомянутого пупочного канатика и выдерживают в течение по меньшей мере 20 минут, но не более 40 минут при температуре 37°С, после этого упомянутую вену промывают сбалансированным солевым раствором, вену заполняют новой порцией упомянутого раствора коллагеназы, закрывают оба конца упомянутого пупочного канатика и выдерживают в течение по меньшей мере 30 минут, но не более 60 минут при температуре 37°С, после этого упомянутую вену промывают сбалансированным солевым раствором, полученную при промывке жидкость центрифугируют. Полученный осадок культивируют известным способом с использованием селективных сред.
В отличие от прототипа в заявляемом способе получения культуры МСК проводят два цикла инкубации в растворе коллагеназы. После первого инкубирования пупочных канатиков в 0,2% растворе коллагеназы, которая заполняет только просвет пупочной вены, часть внеклеточного матрикса стенки пупочной вены разрушается. Таким образом, в растворе, собранном из пупочной вены, содержатся в основном клетки из зон 1-2. То есть кроме МСК в этой порции встречается значительное количество эндотелиоцитов, клеток крови, гематопоэтических стволовых клеток и т.д. После второй инкубации в получаемой фракции содержатся преимущественно клетки 3-4 зон, а мукополисахариды Вартонова студня (зона 5) чаще всего отсутствуют. В результате последующей промывки удаляются излишки коллагеназы, таким образом, большая часть клеток сохраняется от ее повреждающего воздействия. При осуществлении настоящего способа увеличивается доля МСК в препарате выделенных клеток, уменьшается общее время получения культуры клеток, увеличивается сохранность клеток и чистота клеточной культуры, увеличивается доля активно пролиферирующих МСК периваскулярного пространства и уменьшается доля медленнорастущих МСК Вартонова студня, вплоть до их полного отсутствия. МСК культуры, полученной при осуществлении настоящего способа, сохраняют свою жизнеспособность и пролиферативный потенциал.
При необходимости обе фракции после первой и второй обработки коллагеназами культивируют раздельно на селективных средах с использованием адгезивного пластика, а полученные культуры МСК объединяют для использования в целях регенеративной терапии.
Описанная в заявляемом способе последовательность операций обработки полученного фрагмента пупочного канатика, выбранные режимы и вещества, используемые при этом, обеспечивают решение поставленной задачи.
Изобретение иллюстрируется следующими графическими материалами.
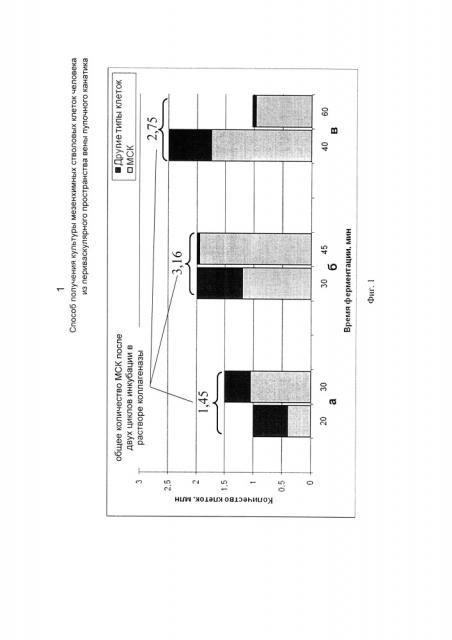
На Фиг. 1 представлено количество получаемых МСК и клеток других типов после первого пассажа в зависимости от длительности первого и второго выдерживания в 0,2% растворе коллагеназы.
На Фиг. 1а представлено количество МСК и клеток других типов, полученных способом, описанным в примере 1.
На Фиг. 1б представлено количество МСК и клеток других типов, полученных способом, описанным в примере 2.
На Фиг. 1в представлено количество МСК и клеток других типов, полученных способом, описанным в примере 3.
На Фиг. 2 представлены полученные с помощью микроскопа изображения культур клеток, полученных при различной длительности первого и второго выдерживания в 0,2% растворе коллагеназы.
На Фиг. 2а представлено полученное с помощью микроскопа изображение культуры клеток, полученной после первого выдерживания в 0,2% растворе коллагеназы в течение 20 минут, как описано в примере 1.
На Фиг. 2б представлено полученное с помощью микроскопа изображение культуры клеток, полученной после второго выдерживания в 0,2% растворе коллагеназы в течение 30 минут, как описано в примере 1.
На Фиг. 2в представлено полученное с помощью микроскопа изображение культуры клеток, полученной после первого выдерживания в 0,2% растворе коллагеназы в течение 30 минут, как описано в примере 2.
На Фиг. 2г представлено полученное с помощью микроскопа изображение культуры клеток, полученной после второго выдерживания в 0,2% растворе коллагеназы в течение 45 минут, как описано в примере 2.
На Фиг. 2д представлено полученное с помощью микроскопа изображение культуры клеток, полученной после первого выдерживания в 0,2% растворе коллагеназы в течение 40 минут, как описано в примере 3.
На Фиг. 2е представлено полученное с помощью микроскопа изображение культуры клеток, полученной после второго выдерживания в 0,2% растворе коллагеназы в течение 60 минут, как описано в примере 3.
Изображения получены с помощью микроскопа биологического для лабораторных исследований (микроскоп серии Axiovert 40 со штативом Axiovert 40 CFL) и фотокамеры для микроскопа (Progress СТ 3 Carl Zeiss, ФРГ).
Способ осуществляли следующим образом.
Пример 1. Полученный стандартным способом пупочный канатик помещали в сосуд, содержащий достаточное количество «гепариновой воды» (5 мл гепарина на 200 мл физиологического раствора), с добавлением антибиотика, после этого транспортировали его в лабораторию. Тщательно промывали пупочную вену сбалансированным солевым раствором, например раствором Версена, с помощью шприца. Затем промывали пупочную вену 0,2% раствором коллагеназы I и IV типа (1:1) в PBS с помощью шприца. Клеммировали пупочный канатик с одной стороны, затем наполняли пупочную вену вышеупомянутым раствором коллагеназы. Клеммировали пупочный канатик с противоположной стороны. Клеммированный образец помещали в чашку Петри и выдерживали в шейкере-инкубаторе, например, ES-20 (Biosan, Латвия), при температуре 37°С и слабом помешивании в течение 20 минут. После этого упомянутый раствор коллагеназы собирали и тщательно промывали пупочную вену сбалансированным солевым раствором, например раствором PBS. Раствор коллагеназы и солевой раствор после промывок собирали и центрифугировали, например, на центрифуге СМ-6М (Elmi, Латвия), 7 минут при 1100 об/мин. Удаляли супернатант, осадок помещали в культуральный флакон площадью 75 см2, в который предварительно было добавлено 10-15 мл полной культуральной среды, например, среды МЕМ-α/ Advanced Stem Cell Media (HyClone, Германия) с добавлением 20% фетальной коровьей сыворотки для МСК или заменителя сыворотки Advanced Supplement for Stem Cells (HyClone, Германия). Помещали флаконы в СО2-инкубатор, например, BBD 6220 (Thermo, Германия), для прикрепления фракции МСК к пластику, время экспозиции 3-5 суток в зависимости от состояния клеток. Полученную первую фракцию МСК использовали для сравнения. Вторично промывали пупочную вену упомянутым раствором коллагеназы с помощью шприца. Клеммировали пупочный канатик с одной стороны, затем наполняли пупочную вену упомянутым раствором коллагеназы. Клеммировали пупочный канатик с противоположной стороны. Клеммированный образец помещали в чашку Петри и выдерживали в упомянутом шейкере-инкубаторе при температуре 37°С и слабом помешивании в течение 30 минут. После выдерживания упомянутый раствор коллагеназы собирали и тщательно промывали пупочную вену упомянутым сбалансированным солевым раствором. Раствор коллагеназы и солевой раствор после промывок собирали и центрифугировали на упомянутой центрифуге 7 минут при 1100 об/мин. Удаляли супернатант, осадок помещали в культуральный флакон площадью 75 см2, в который предварительно было добавлено 10-15 мл полной упомянутой культуральной среды. Помещали флаконы в упомянутый СО2-инкубатор для прикрепления фракции МСК к пластику, время экспозиции 3-5 суток в зависимости от состояния клеток. Далее МСК культивировали известным способом культивирования МСК.
Пример 2. Получение культуры МСК проводили по схеме, приведенной в примере №1, отличающейся тем, что первое выдерживание в упомянутом растворе коллагеназы проводили в течение 30 минут, а второе выдерживание в упомянутом растворе коллагеназы проводили в течение 45 минут.
Пример 3. Получение культуры МСК проводили по схеме, приведенной в примере №1, отличающейся тем, что первое выдерживание в упомянутом растворе коллагеназы проводили в течение 40 минут, а второе выдерживание в упомянутом растворе коллагеназы проводили в течение 60 минут.
Заявитель просит рассмотреть представленные материалы заявки «Способ получения культуры мезенхимных стволовых клеток человека из периваскулярного пространства вены пупочного канатика» на предмет выдачи патента РФ на изобретение.
1. Способ получения культуры мезенхимных стволовых клеток человека из периваскулярного пространства пупочного канатика, заключающийся в том, что вырезают фрагмент пупочного канатика, заполняют вену упомянутого фрагмента пупочного канатика 0,2% раствором коллагеназы, закрывают оба конца упомянутого фрагмента пупочного канатика и выдерживают его в течение по меньшей мере 20 минут, но не более 40 минут при температуре 37°С, отличающийся тем, что после этого упомянутую вену промывают сбалансированным солевым раствором, заполняют новой порцией упомянутого раствора коллагеназы, закрывают оба конца упомянутого пупочного канатика и выдерживают в течение по меньшей мере 30 минут, но не более 60 минут при температуре 37°С, после этого упомянутую вену промывают сбалансированным солевым раствором, полученную при промывке жидкость центрифугируют, полученный осадок культивируют на селективных средах.
2. Способ получения культуры мезенхимных стволовых клеток человека из периваскулярного пространства пупочного канатика по п. 1, отличающийся тем, что жидкость, полученную при промывке после первого цикла инкубации в 0,2% растворе коллагеназы, собирают, центрифугируют, полученный осадок культивируют на селективных средах, а полученную культуру клеток добавляют к культуре, полученной по п. 1