Способ профилактики дислипидемии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к терапии, и касается профилактики дислипидемии. Для этого ежедневно перорально вводят пищевые добавки «Маристим» и «Фуколам-С». «Фуколам -С» вводят по 1 капсуле один раз в день во время еды, а «Маристим» по 3 капсулы 3 раза в день после еды в течение 3-6 месяцев. При этом первый прием «Маристима» осуществляют через 2 часа после приема «Фуколама-С». Такое сочетанное введение пищевых добавок обеспечивает максимальное липидкорригирующее действие и позволяет уменьшить дозу статинов у пациентов с дислипидемией. 1 табл., 3 пр.
Реферат
Изобретение относится к медицине, а именно к методам профилактики нарушений липидного обмена.
Профилактика гипердислипидемий у людей направлена на коррекцию нарушний липидного обмена (обнаружение повышенного уровня общего холестерина (ХС) и триглицеридов (ТГ) в крови, липопротеидов низкой плотности (ЛПНП) и липопротеидов очень низкой плотности (ЛПОНП) в целях предупреждения атеросклероза, метаболического синдрома, сахарного диабета, стеатогепатита.
Известно использование БАД к пище, выделенной из печени командорского кальмара, обладающего липидкорригирующими и иммуномодулирующими свойствами (Патент РФ №2241026, «Средство, обладающее липидкорригирующими и иммуномодулирующими свойствами»).
Известно использование БАД к пище, выделенной из бурых водорослей (Патент РФ №2309763, от МПК A61K 36/03, А61Р 9/00, «Средство, обладающее липидкорригирующими и антиоксидантными свойствами»).
Известен способ профилактики и лечения заболеваний желудочно-кишечного тракта, сердечно-сосудистой и эндокринной систем с помощью пищевой добавки «Фуколамин» (Патент РФ №2297234, от 12.05.2005. МПК A61K 36/03).
Известен способ оздоровления организма (Патент РФ №2317092, от 11.07.2006, МПК A61K 36/03, A61K 9/06).
Известен способ лечения ишимической болезни сердца с применением пищевой добавки «Маристим» (Патент РФ №2438665, от 28.06.2010. МПК A61K 31/343, A61K 35/54).
Недостатком данных способов является то, что все вышеуказанные пищевые добавки, применяемые в профилактических целях, использовались не комплексно и, как правило, вместе с базисной терапией.
Задачей настоящего изобретения является создание эффективного способа профилактики дислипидемии за счет комплексного применения пищевых добавок, способствующих снижению поступления холестерина и насыщенных жиров с пищей, созданию условий для уменьшения интенсивности усвоения жиров, ингибированию образования атерогенных фракций липидов и нормализации углеводного обмена, а также расширение арсенала способов профилактики дислипидемии человека.
Она решается в способе профилактики дислипидемии тем, что пациенты ежедневно в течение 3-6 месяцев перорально принимают комплекс продуктов переработки икры морских ежей и сульфатированные полисахариды бурых водорослей; при этом продукты переработки икры морских ежей находятся в составе пищевой добавки «Маристим», а сульфатированные полисахариды бурых водорослей в составе пищевой добавки «Фуколам-С». «Фуколам-С» принимают по 1 капсуле один раз в день во время еды, а «Маристим» по 3 капсулы 3 раза в день после еды, причем первый прием «Маристима» осуществляют через 2 часа после приема «Фуколама».
Пищевая добавка «Фуколам-С» (Свидетельство о государственной регистрации № RU 77.99.88.003.Е 000395.02.16 от 01.02.2016. Изготовитель ТИБОХ ДВО РАН, ТУ 9284-065-02699170-2011) - первая отечественная биологически активная добавка на основе полисахарида фукоидана, выделенного из бурой водоросли Fucus evanescens. На имя Тихоокеанского института биоорганической химии им. Г.Б. Елякова ДВО РАН (ТИБОХ ДВО РАН) зарегистрирован товарный знак Фуколам-Fucolam (свидетельство №308197). На основании экспертной оценки Минздрава России, ГУ НИИ питания РАМН рекомендован в качестве дополнительного источника полисахаридов (фукоидан) и растворимых пищевых волокон (альгинат). Одна капсула содержит 100 мг фукоидана и 400 мг альгиновой кислоты. Способ применения: по 1 капсуле один раз в день во время еды.
Сульфатированные полисахариды (фукоиданы) стимулируют моторную и секреторную функцию кишечника, очищают сердечно-сосудистую систему и кишечник от холестерина и шлаков, нормализуют обмен веществ и оказывают лечебное действие на эндокринную систему, способствуют снижению избыточной массы тела на фоне низкокалорийной диеты.
Пищевая добавка «Маристим» (Свидетельство Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека о государственной регистрации №77.99.20.916Б.000796.06.04 от 01.06.2004 г.) - 100% натуральный продукт из сублимированной икры морских ежей, содержащий уникальный комплекс биологически активных веществ с широким спектром биологической активности. Выпускается в виде капсул по 500 мг. Одна капсула содержит биологически активные вещества, не менее: полиненасыщенные жирные кислоты (ПНЖК) - 125 мг, в том числе ПНЖК омега - 3-85 мг, что составляет 4% от адекватной суточной нормы потребления. Этот биопрепарат является дополнительным источником полиненасыщенных жирных кислот. В его состав входят жиры - 20% (триглицериды 60-75%, фосфолипиды - 22-36%, в составе фосфолипидов преобладает лецитин (61-67%), ПНЖК омега-3 (более 20%), сиалогликолипиды, каротиноиды, витамины (С, В1, В2, В12, РР, К1 и др.); макро- и микроэлементы (йод, железо, медь, кобальт и др.).
Икра и гонады морских ежей содержат биоактивные компоненты, обусловливающие многочисленные положительные эффекты на различные системы организма, в том числе показана способность полиненасыщенных жирных кислот икры к нормализации липидного и углеводного обмена, эйкозопентаеновой кислоты - снижать синтез триглицеридов и холестерина, уменьшать свертываемость крови и предотвращать образование тромбов, каротиноидов - способствовать снижению уровня ЛПНП и глюкозы в крови, проявлять антиоксидантное и противовоспалительное действие.
Новым в предлагаемом изобретении является то, что продукты, полученные из морских гидробионтов, принимают в комплексе. Это способствует получению синергетического эффекта, который положительно влияет на организм пациента. Данные продукты можно применять для предупреждения атеросклероза, метаболического синдрома, сахарного диабета, стеатогепатита.
Таким образом, заявляемое техническое решение соответствует критериям «Новизна». Изобретение имеет «Изобретательский уровень», так как оно для специалиста явным образом не следует из уровня техники.
Предлагаемое решение соответствует критерию изобретения «Промышленная применимость», так как используемые продукты «Маристим» и «Фуколам-С» в достаточном количестве имеются в аптечной сети.
Сущность способа заключается в следующем.
Пациентам, в биохимическом анализе крови которых обнаружено повышенное содержание уровня холестерина и триглицеридов или липопротеидов низкой плотности (ЛПНП) и липопротеидов очень низкой плотности (ЛПОНП), в целях предупреждения развития атеросклероза, метаболического синдрома, сахарного диабета, стеатогепатита ежедневно в течение 3-6 месяцев назначают прием комплекса пищевых добавок - «Маристим» и «Фуколам-С». «Фуколам-С» принимают по 1 капсуле один раз в день во время еды, а «Маристим» по 3 капсулы 3 раза в день после еды, причем первый прием «Маристима» осуществляют через 2 часа после приема «Фуколама-С».
Оценка эффективности применения комплекса биопрепаратов (продукта переработки водорослей и продукта переработки икры морских ежей) у пациентов с дислипидемией (гиперхолестеринемией) проводилась в рандомизированном исследовании на условиях добровольного информированного согласия, в которое были включены пациенты от 30 до 45 лет с повышенным содержанием холестерина и его фракций в крови - дислипидемией (гиперхолестеринемией) при отсутствии диагноза ишемическая болезнь сердца (ИБС), стенокардия напряжения, атеросклероз, метаболический синдром, сахарный диабет, стеатогепатит, находящиеся на амбулаторном наблюдении в период с 2009 по 2013 гг.
Были сформированы четыре группы пациентов:
1-я контрольная группа - здоровые доноры (не получающие пищевые добавки)- 40 человек;
2-я группа - пациенты с дислипидемией (гиперхолестеринемией), получающие «Фуколам-С» в течение 180 дней, - 39 человек;
3-я группа - пациенты с дислипидемией (гиперхолестеринемией), получающие «Маристим» в течение 180 дней, - 20 человек;
4-я группа - пациенты с дислипидемией (гиперхолестеринемией), получающие комплекс биопрепаратов «Фуколам-С» и «Маристим» в течение 180 дней, - 35 человек.
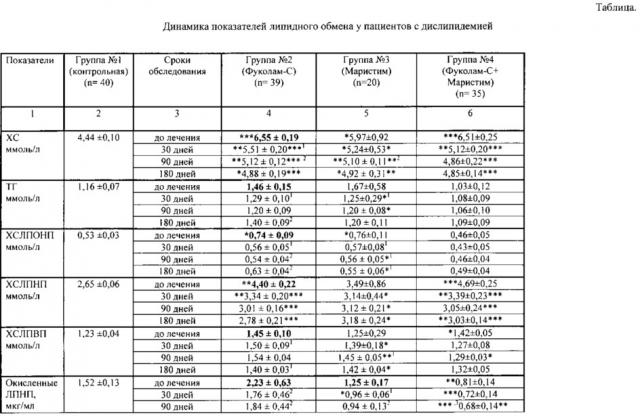
Динамика показателей липидного спектра крови у пациентов 2-ой группы, принимавших «Фуколам-С», через 30 дней после начала лечения характеризовалась снижением уровня общего ХС и ХС ЛПНП на 15,9% (р<0,05) и на 24,1% (р<0,05) соответственно относительно исходных значений. Снижение уровня атерогенных фракций на фоне сохранения нормальных значений ХС ЛПВП привело к снижению на 21,5% коэффициента ХС-не-ЛПВП (р<0,05), интегрального показателя КА на 27,2% (р<0,05) и увеличению коэффициента ХС ЛПВП-отношение на 37,9% (р<0,05). Уровни окисленных ЛПНП, ЛП(а), аполипопротеинов и соотношение апоВ/anoA1 у пациентов через 30 дней не изменялись и оставались выше значений контрольной группы.
Через 90 дней от начала лечения у пациентов установлена положительная динамика показателей липидного обмена по сравнению с исходными значениями до лечения. Уровень общего ХС и ХС ЛПНП приблизился к показателям пациентов контрольной группы (снижение на 21,8%, р<0,001 и на 31,6%, р<0,001 соответственно). Содержание ХС ЛПВП в крови существенно не изменялось, оставаясь на исходно нормальном уровне. Следствием снижения атерогенных фракций явилось уменьшение коэффициентов, отражающих атерогенные свойства крови: ХС не-ЛПВП (на 29,9%, р<0,01), КА (на 37,8%, р<0,001) и увеличение ХС ЛПВП - отношения (на 55,2%, р<0,01). У пациентов этой группы установлено снижение уровня апоВ на 8,8% (р<0,05). Уровень ЛП(а), несмотря на снижение на 18% (р<0,01) от исходного уровня, оставался повышенным в 2,5 раза (р<0,01) по сравнению с контрольными значениями, что свидетельствует о сохранении у пациентов риска развития ИБС.
Через 180 дней у пациентов наблюдалась более выраженная динамика показателей липидного обмена. Уровень общего ХС и ХС ЛПНП снизился соответственно на 25,5% (р<0,001) и на 36,8% (р<0,001), достигнув значений контрольной группы. Снижение окисленных ЛПНП у пациентов составило 19,3% (р<0,05) относительно исходного значения. Снижение апоВ у пациентов на 13,4% (р<0,05) привело к уменьшению отношения апоВ/апоА1 на 18,4% (р<0,01). Уменьшение атерогенных свойств крови у пациентов подтверждалось увеличением ХС ЛПВП-отношение на 48,3% (р<0,01) и снижением ХС не-ЛПВП на 31,9% (р<0,01), КА на 36% (р<0,001).
Динамика показателей липидного спектра крови у пациентов 3-й группы, получавших «Маристим», через 30 дней проявлялась снижением уровня общего ХС на 12,3% (р<0,05), ТГ на 25,1% (р<0,05), ХС ЛПНП на 10% (р<0,05) и повышением уровня ХС ЛПВП на 11,2% (р<0,05) относительно исходных значений. Снижение атерогенных фракций и увеличение содержания ХС ЛПВП привело к снижению КА на 9,7% (р>0,05).
Через 90 дней у пациентов этой группы наблюдалось снижение уровня общего ХС на 14,6% (р<0,01), ХС ЛПНП на 10,6% (р<0,05), ТГ на 28,1% (р<0,05) по сравнению с показателями до лечения. Соответственно снижались коэффициенты, отражающие атерогенные свойства крови: ХС не-ЛПВП (на 27,5%, р<0,05), КА (на 17,4%, р<0,05). Содержание ХС ЛПВП повышалось на 11,6% (р<0,05). У пациентов также установлено снижение уровня апо В на 8,6% (р<0,05) и ЛП(а) на 24% (р<0,01) от исходного уровня.
Через 180 дней у пациентов наблюдалась дальнейшая нормализация показателей липидного обмена. Уровень общего ХС и ХС ЛПОНП снизился соответственно на 17,6% (р<0,01) и на 27,6% (р<0,05), ТГ на 28,1% (р<0,05). Уменьшение атерогенных свойств крови у пациентов подтверждалось увеличением ХС ЛПВП-отношение на 36,7% (р<0,01) и снижением ХС не-ЛПВП на 27,1% (р<0,05), КА на 19,3% (р<0,05). У пациентов наблюдалось снижение апоВ на 10% (р<0,05).
У пациентов 4-ой группы, получавших комплекс биопрепаратов, уже через 30 дней выявлено снижение по сравнению с исходным уровня общего ХС на 21,4%) (р<0,001) и ХС ЛПНП на 27,7% (р<0,001) относительно исходных показателей. Содержание ХС ЛПВП сохранялось на исходно нормальном уровне. Снижение общего ХС, ХС ЛПНП на фоне контрольных значений ХС ЛПВП привело к уменьшению коэффициента ХС не-ЛПВП на 24,4% (р<0,001) и увеличению коэффициента ХС ЛПВП-отношение на 20,7% (р<0,05), что свидетельствовало об уменьшении проатерогенных свойств крови. Также у пациентов достоверно снизились уровни апоВ на 8,2% (р<0,001), ЛП(а) на 10,6% (р<0,05) и соотношение апоВ/апоА на 10,8% (р<0,001).
Через 90 дней на фоне приема комплекса БАВ у пациентов установлено достоверное снижение содержания общего ХС на 25,3% (р<0,001), ХС ЛПНП на 35% (р<0,001) и окисленного ХС ЛПНП на 16% (р<0,01) от исходного уровня. При этом значения этих показателей приближались к показателям в контрольной группе. Отмечалось снижение содержания ХС ЛПВП в крови на 9,2% (р<0,05). Уменьшились атерогенные свойства крови, о чем свидетельствовало увеличение показателя ХС ЛПВП - отношение на 34,5% (р<0,01) и снижение ХС не-ЛПВП на 29,9% (р<0,001), КА на 17,8% (р<0,05). Значения этих показателей через 90 дней не отличались от таковых в контрольной группе. Изменения в транспортной системе аполипопротеидов характеризовались уменьшением апоВ на 16,6% (р<0,001) и уменьшением коэффициента апоВ/aпoA1 на 17,1% (р<0,001). Уровень ЛП (а) через 90 дней достоверно снизился на 26% (р<0,001).
Через 180 дней у пациентов содержание общего ХС уменьшилось на 20,4% (р<0,001) от исходного показателя, достигая значений нормы, и ХС ЛПНП - на 33,7% (р<0,001) от исходных показателей. Концентрация ХС ЛПВП к концу курса лечения оставалась на исходно нормальном уровне. Об уменьшении атерогеных свойств крови свидетельствовали увеличение коэффициента ХС ЛПВП-отношения на 27,6% (р<0,01), снижение отношения ХС не-ЛПВП на 28,7% (р<0,001) и интегрального показателя КА на 22,7% (р<0,05). Изменения в транспортной системе аполипопротеидов проявлялось снижением апоВ на 19,4% (р<0,01), что привело к уменьшению соотношения апоВ/anoA1 на 17,1% (р<0,001) от исходного показателя до контрольных значений. Положительным моментом является снижение уровня ЛП(а) на 31,1% (р<0,001) от исходного значения.
Таким образом, применение комплекса биопрепаратов («Фуколам-С» и «Маристим») дает наилучший профилактический эффект, при котором основные показатели липидного обмена через 90-180 дней их приема снижались до показателей нормы. Все показатели сведены в таблицу.
Современная липидкорригирующая терапия направлена, прежде всего, на снижение поступления холестерина и насыщенных жиров с пищей, создание условий для уменьшения интенсивности усвоения жиров, ингибирование образования атерогенных фракций липидов и нормализацию углеводного обмена.
Пищевая добавка из икры морских ежей - натуральный продукт, содержащий уникальный комплекс биологически активных веществ (ПНЖК омега-3, эйкозопентаеновую кислоту, сиалогликолипиды, каротиноиды, витамины, макро - и микроэлементы). ПНЖК, входящие в состав икры морских ежей участвуют в реализации множества биохимических реакций и обменных процессов, в том числе нормализуют липидный и углеводный обмен [Пожарицкая О.Н., Шиков А.Н., Макарова М.Н. и др. Эффективность стандартизованного экстракта из гонад зеленых морских ежей на экспериментальной модели метаболического синдрома // Эксперм. и клинич. Фармакология. 2015. №78(5). С.13-18; Utkina N.K., Pokhilo N.D. Free radical scavenging activities of naturally occurring and synthetic analogues of sea urchin naphthazarin pigments // Nat. Product Communications. 2012. Vol. 7, №7. P. 901-904; Артюков А.А. Разработка биотехнологических основ получения некоторых биологически активных веществ из океанического сырья: автореф…. дисс.докт.биол. наук: Владивосток, 2011. 53 с]. Регуляторная направленность ПНЖК как медиаторов реакций метаболизма зависит от их класса (омега-6-линолевая и гамма-линоленовая кислоты или омега-3 -эйкозапен-таеновая и докозагексаеновая) и их оптимального соотношения в рационе питания (5:1). Механизм действия омега-3 ПНЖК частично связан с их влиянием на состояние системы эйкозаноидов, нормализующим влиянием на структуру ХСЛПНП и ХСЛПОНП, способностью изменять жидкостные свойства мембран клеток и функциональную активность расположенных там рецепторов, что приводит к улучшению взаимодействия липопротеинов с ферментами, и катаболизм липопротеинов [Weber Р., Fischer S., von Schaky С.Dietary omega-3 polyunsaturated fatty acid and eicosanoids formation in man / Health effects of polyunsaturated fatty acid in seafood's / eds. A. Simopoulos, R. Kifer, R. Martin. - Orlando (FL): Academic press, 1986. P. 227-238]. Эйкозопентаеновая кислота, содержащаяся в гонадах морских ежей, снижает синтез триглицеридов и холестерина, уменьшает свертываемость крови и предотвращает образование тромбов [Макаренко И.Е., Фаустова Н.М., Ванатиев Г.В. и др. Оценка эффективности препарата из гонад морских ежей // Фармация. 2015. №2. С. 47-50]. Каротиноиды, к которым относится содержащийся в гонадах астаксантин и эхиненон, содержащийся в икре, проявляют антиоксидантное и противовоспалительное действие [Так P.P., Firestein G.S. NFkB: a key role in inflammatory diseases // J. Klin Invest. 2001. Vol.107 (1). P. 7-11], способствуют снижению уровня ЛПНП [Meachem S., Nieschlag E., Simoni M. Inhibin В in male reproduction: pathophysiology and clinical relevance // Eur. J. of Endocrinology. 2001. Vol. 145(5). P. 561-571].
Как было установлено ранее [Кузнецова Т.А., Крыжановский С.П., Богданович Л.Н., Беседнова Н.Н. Влияние биологически активных веществ из гидробионтов Тихого океана на показатели липидного обмена при экспериментальной гиперхолестеринемии // Бюлл. Эксп биол. и мед. 2014. Т. 158, №8. С. 149-153], гиполипидемическое действие фукоидана проявляется, прежде всего, снижением атерогенных фракций - ХС и ХС ЛПНП. При этом фукоидан не оказывает существенного влияния на транспорт ХС в составе ЛПВП из периферических тканей в печень.
Учитывая литературные сведения по механизмам гиполипидемического действия фукоиданов, можно предполагать их способность ингибировать аккумуляцию липидов путем стимуляции липолиза в клетках жировой ткани адипоцитах, ингибировать адипогенез и дифференцировку адипоцитов, либо стимулировать внутриклеточный транспорт липопротеинлипазы и уменьшать деградацию этого фермента в адипоцитах [Kim K.J., Lee О.Н., Lee Н.Н., Lee B.Y. A 4-week repeated oral dose toxicity study of fucoidan from the Sporophyll of Undaria pinnatifida in Sprague-Dawley rats // Toxicology. 2010. Vol. 267. P. 154-158; Park M.K., Jung U., Roh C. Fucoidan from marine brown algae inhibits lipid accumulation // Mar. Drugs. 2011. Vol. 9. P. 1359-1367]. Отмечается способность фукоиданов связывать холестерин и желчные кислоты, участвующие в транспорте жиров из кишечника в кровь [Kim K.J., Lee О.Н., Lee Н.Н., Lee B.Y. A 4-week repeated oral dose toxicity study of fucoidan from the Sporophyll of Undaria pinnatifida in Sprague-Dawley rats // Toxicology. 2010. Vol. 267. P. 154-158]. Принимая во внимание факт, что при жировой инфильтрации печени и при дислипидемиях в качестве аккумулируемых липидов обычно выступают триглицериды, а одной из причин накопления ТГ в печени может быть усиление их синтеза вследствие повышения активности триглицеридсинтетазы, можно предположить влияние фукоидана на этот фермент. Примеры конкретного применения. Пример 1
Пациентка М., 34 года. Результаты биохимического анализа крови показали содержание общего ХС - 6,50 ммоль/л, ХСЛПНП - 4,61 ммоль/л, ХСЛПВП - 1,23 ммоль/л. На фоне приема «Фуколама-С» по 1 капсуле один раз в день во время еды в течение 30 дней содержание общего ХС снизилось до 6,21 ммоль/л, а уровень ЛПНП достиг значений 4,22 ммоль/л, уровень ЛПВП 1,31 ммоль/л. Через 90 дней показатели липидограммы (ХС, ХСЛПНП, ХСЛПВП) составили соответственно 6,20 ммоль/л, 4,13 ммоль/л, 1,34 ммоль/л. Через 180 дней показатели ХС, ХСЛПНП, ХСЛПВП составили соответственно 5,97 ммоль/л, 4,12 ммоль/л, 1,34 ммоль/л. Показатели нормы для женщин возраста 34 года составляют: ХС 3,57-5,9 ммоль/л, ХСЛПНП 1,81-4,04 ммоль/л, ХСЛПВП 0,93-1,99 ммоль/л. Показатели печеночного обмена (АЛТ, ACT) оставались на уровне нормальных значений.
Состояние пациентки оценено как удовлетворительное, однако показатели липидного обмена (ХС, ХСЛПНП) не достигали допустимых для данного возраста границ нормы, а показатели ХСЛПВП возрастали незначительно (на 9%).
Пример 2
Пациент Б., 31 год. Результаты биохимического анализа крови показали содержание ХС - 6,44 ммоль/л, ХСЛПНП - 3,9 ммоль/л, ХСЛПВП - 1,28 ммоль/л. В течение 30 дней применения «Маристима» по 3 капсулы 3 раза в день содержание общего ХС снизилось до 5,99 ммоль/л, уровень ХСЛПНП - до 3,46 ммоль/л, уровень ХСЛПВП достиг 1,39 ммоль/л. Через 90 дней показатели ХС, ХСЛПНП, ХСЛПВП составили соответственно 5,72 ммоль/л, 3,14 ммоль/л и 1,48 ммоль/л. Через 180 дней эти показатели составили соответственно 5,56 ммоль/л, 3,02 ммоль/л и 1,59 ммоль/л.
Показатели нормы для мужчины возраста 31 год составляют: ХС 3,6-6,3 ммоль/л, ХСЛПНП 2,02-4,6 ммоль/л, ХСЛПВП 0,78-1,63 ммоль/л. Показатели печеночного обмена оставались на уровне нормальных значений. Состояние пациента оценено как удовлетворительное.
Наблюдалась нормализация показателей липидного обмена, однако этот процесс оценивался как недостаточно динамичный: содержание общего ХС снизилось на 13,7%, ХСЛПНП - на 22,5%, содержание ХСЛПВП повысилось на 24,2%.
Пример 3
Пациентка М., 44 года. Результаты биохимического анализа крови: содержание общего ХС - 7,00 ммоль/л, из них атерогенных ХСЛПНП - 4,72 ммоль/л, содержание ХСЛПВП - 1,34 ммоль/л. Пациентка получала в течение 30 дней «Фуколам-С» по 1 капсуле один раз в день и «Маристим» по 3 капсулы 3 раза в день. На фоне приема этих препаратов через 30 дней содержание общего ХС снизилось до 6,51 ммоль/л, а уровень ХСЛПНП достиг значений 3,92 ммоль/л, уровень ХСЛПВП повысился до 1,45 ммоль/л. Через 90 дней показатели ХС, ХСЛПНП, ХСЛПВП составили соответственно 6,10 ммоль/л, 3,46 ммоль/л и 1,51 ммоль/л. Через 180 дней эти показатели составили соответственно 5,64 ммоль/л, 3,14 ммоль/л и 1,66 ммоль/л.Показатели нормы для женщины 44 лет составляют: ХС 3,8-6,5 ммоль/л, ХСЛПНП 1,92-4,51 ммоль/л, ХСЛПВП 0,88-2,28 ммоль/л. Показатели печеночного обмена оставались на уровне нормальных значений. Динамика нормализации показателей липидного обмена оценивалась как достаточно интенсивная. Так, уже к 30 дню эти показатели достигали верхних границ нормы для соответствующего возраста, а к 90-180 дню эти показатели доходили до средних значений показателей нормы. За весь период приема препаратов содержание общего ХС снизилось на 22%, ХСЛПНП - на 33%, содержание ХСЛПВП повысилось на 23,9%.
Субъективное состояние пациентки оценено как удовлетворительное. Каких-либо побочных эффектов в результате применения «Фуколама С» и «Маристима» не отмечено.
Таким образом, проведенные исследования показали, что сочетанное применение «Фуколама-С» и «Маристима» позволяет достигнуть максимального профилактического липидкоррегирующего эффекта без применения базисной терапии у пациентов при отсутствии у них диагноза ИБС, стенокардия напряжения, атеросклероз, метаболический синдром, сахарный диабет.
При этом комплекс препаратов «Фуколам-С» и «Маристим» можно с успехом применять и пациентам с диагнозом ИБС, стенокардия напряжения, атеросклероз, метаболический синдром, сахарный диабет вместе с базисной терапией. Это позволяет снизить дозу статинов, что положительно сказываться на здоровье больного и стоимости лечения.
Способ профилактики дислипидемии характеризуется тем, что пациенты ежедневно перорально принимают продукты переработки икры морских ежей и сульфатированные полисахариды бурых водорослей; при этом продукты переработки икры морских ежей находятся в составе пищевой добавки «Маристим», а сульфатированные полисахариды бурых водорослей в составе пищевой добавки «Фуколам-С», причем «Фуколам-С» принимают по 1 капсуле один раз в день во время еды, а «Маристим» по 3 капсулы 3 раза в день после еды в течение 3-6 месяцев, при этом первый прием «Маристима» осуществляют через 2 часа после приема «Фуколама-С».