Способ прогнозирования тромбоэмболических осложнений
Иллюстрации
Показать всеИзобретение относится к диагностике, а именно к способу прогнозирования тромбоэмболических осложнений у больных с повреждениями или заболеваниями опорно-двигательного аппарата, которым предстоит операционное вмешательство. Способ прогнозирования тромбоэмболических осложнений у больных с повреждениями или заболеваниями опорно-двигательного аппарата, которым предстоит операционное вмешательство, включающий исследование венозной крови, при этом определяют фактор роста эндотелия сосудов (ФРЭС) и при значении ФРЭС выше 183,6 пг/мл прогнозируют высокий риск тромбоэмболических осложнений у больных с повреждениями или заболеваниями опорно-двигательного аппарата, которым предстоит операционное вмешательство. Вышеописанный способ позволяет эффективно прогнозировать тромбоэмболические осложнения у больных с повреждениями или заболеваниями опорно-двигательного аппарата, которым предстоит операционное вмешательство. 3 пр., 3 табл., 1 ил.
Реферат
Изобретение относится к медицине, в частности к лабораторной диагностике, и может быть использовано для определения риска тромбоэмболических осложнений у больных, которым предстоит оперативное вмешательство.
Венозные тромбоэмболические осложнения (ВТЭО) превратились в последние годы в актуальнейшую медицинскую проблему. На фоне общего снижения операционной летальности венозный тромбоз и легочная эмболия становятся доминирующими послеоперационными осложнениями [Кириенко А.И., Гологорский В.А., Андрияшкин В.В. Профилактика венозных тромбоэмболических осложнений у госпитальных больных// Русский медицинский вестник, 2001. - N 3. - С. 110-113].
Венозные тромбоэмболические осложнения (ВТЭО) - одни из наиболее частых осложнений, развивающихся при лечении повреждений и заболеваний опорно-двигательного аппарата (ОДА). Росту числа ВТЭО способствует увеличение тяжести повреждений, объема и травматичности оперативных вмешательств, а также увеличение доли пациентов пожилого возраста с большим числом сопутствующих заболеваний -факторов риска развития ВТЭО [Профилактика венозных тромбоэмболических осложнений в травматологии и ортопедии// Российские клинические рекомендации, приложение 1(63)-2012].
Учитывая, что тромбоз является одной из ведущих причин в патогенезе острой сосудистой патологии при тотальном эндопротезировании крупных суставов нижних конечностей, для лечения этих состояний в комплексной терапии широко применяют антикоагулянты. Наиболее часто применяются низкомолекулярные гепарины (НМГ).
В новой редакции антитромботических рекомендаций Американского колледжа пульмонологов прослеживается применение метода индивидуальной оценки риска ВТЭО, указаны конкретные средства помощи. Добиться этого без лабораторных тестов не возможно. В данной редакции антитромботических рекомендаций Американского колледжа пульмонологов (АССР) четко прослеживается возврат к более широкому применению метода индивидуальной оценки риска ВТЭО, указаны конкретные средства помощи принятия решений в этом [модель J.Caprini; on-line версия калькулятора расчета представлена на www.hemostas.ru].
В настоящее время предложено множество способов прогнозирования послеоперационных осложнений, основанных на определении гемостатических показателей в послеоперационном периоде, отражающих степень и динамику коагуляционных сдвигов, таких как D-димеры, тромбоцитарный фактор-4, р-тромбоглобулин [Gando S.T., Karneue S., Nanzaki S. And Nakanishi Y. Disseminated intravascular coagulation isafrecu ent complication of system icinflammatory response syndrome (SIRS) // Thromb. Haemost. 1996. 75. P.224-228], а также фибринолитической активности [Ixvi. M. Dissiminated intravascular coagulation // N.lingl. J. Mud. 1999. 341. P.586-592; Ten Cate H., Timmerman J.J., Levi M. The pathophysiology of disseminated intravascular coagulation // ThrombHaemost. 1999. Aug; 82(2). Р.713-717].
Известны способы прогнозирования тромбоэмболических осложнений при операциях на крупных суставах нижних конечностей путем формирования групп риска на основе анамнестических данных и клинических исследований [Clayton J.K., Anderson J.А., McNicol G.P. Preoperative prediction of postoperative deep vein thrombosis // Br Med J. 1976. Vol. 2. P. 910-912.; Wells P.S., Lensing A.W.A., Hirsh J. Graduated compression stockings in the prevention of postoperative venous thromboembolism.A metaanalysis // Arch. Intern. Med. 1994. Vol. 154, №1. p. 67-72], формирование групп повышенного риска тромбоэмболических осложнений в зависимости от сочетания различных факторов риска и их значимости по Баешко А.А. [Баешко А.А., Шорох Г.П., Сысов А.В. Риск и профилактика тромбоза глубоких вен нижних конечностей в абдоминальной хирургии // Вестник хирургии им. И.И. Грекова. 1996. Т. 155. №3. С. 34-39].
Однако в этих данных не учитываются нарушения микроциркуляции как пускового механизма развития тромбоэмболических нарушений. Недостаточно информации об явлениях, участвующих в патогенезе развития тромбоэмболических осложнений, отсутствуют объективные критерии, позволяющие надежно прогнозировать развитие тромбоэмболических осложнений.
Известен способ прогнозирования тромбоэмболических осложнений [Прохоренко В.М., Чорний С.И., патент RU №2272560, 2006], основанный на применении метода лазерной допплеровской флоуметрии. Определяется уровень микроциркуляторного кровотока до операции и в раннем послеоперационном периоде. Производится сравнение полученных показателей уровня фонового микроциркуляторного кровотока, на основании которых выполняется прогноз тромбоэмболических осложнений в раннем послеоперационном периоде. Данный способ основан на многократном исследовании состояния кровенаполнения сосудистого русла, является продолжительным по времени, что увеличивает продолжительность пребывания больного на дооперационном этапе, что впоследствии приводит к увеличению количества койко-дней. Недостатком данного метода является использование сложной дорогостоящей аппаратуры и специально обученного персонала, что усложняет процедуру диагностики. Метод недостаточно точный, так как при этом не учитывается состояние свертывающей системы крови как основного показателя тромбообразования. Данный метод позволяет прогнозировать тромбоэмболические осложнения лишь на послеоперационном этапе.
В настоящее время для исследования системы гемостаза используются показатели стандартной коагулограммы (АЧТВ, протромбиновое время по Квику, фибриноген, тромбиновое время), которые не могут точно отражать всю его картину, поэтому значительное количество исследований посвящено поиску маркеров и прогностических критериев развития геморрагических и тромбоэмболических осложнений [Effect of preoperative activation hemostasis on the dynamics of coagulation and fibrinolysis post large joint arthroplasty / Irina P. Antropova, Boris G., Igor L. Shlykov et al.// International journal of Biomeicine. - 2012. - №3. - P. 186-191].
Например, такой показатель, как время свертывания крови, не отражает состояние системы гемостаза при коагуляционных сдвигах. Даже при резком удлинении времени свертывания крови у пациентов может наблюдаться возникновение множественных тромбозов и эмболии. Большинство других исследований системы гемостаза основаны на ответе сыворотки крови на различные воздействия. Это так называемые «динамические тесты» (АЧТВ, тромбиновое время, время рекальцификации), которые отражают лишь время прохождения определенных стадий гемокоагуляционных реакций и не могут отражать всю систему в целом.
Известен способ прогнозирования тромбоэмболических осложнений, основанный на определении показателя Международного нормализованного отношения (MHO), который является дополнительным способом представления результатов протромбинового теста, рекомендованным комитетом экспертов ВОЗ, Международным комитетом по изучению тромбозов и гемостаза и Международным комитетом по стандартизации в гематологии [Гаранина Е.Н. Стандартизация и контроль качества исследования протромбинового времени. / Е.Н.Гаранина, Н.А.Авдеева // Клиническая и лабораторная диагностика. - 1994. - №6. - С. 23-25].
Данный способ основан на исследовании состояния свертывающей системы крови. Он является не точным, так как не учитывает состояние микроциркуляторного русла поврежденной конечности, важного для оценки системных и регионарных нарушений гемодинамики. [Оценка микроциркуляции при заболеваниях и травмах конечностей в процессе лечения по Илизарову. / В.И. Шевцов, Т.И. Долганова, В.А.Щуров и др. // Сб. статей «Методология флоуметрии». - Москва, 1999. - С. 99-108].
Известен «Способ раннего прогнозирования развития тромбоэмболических осложнений после операций на органах брюшной полости [Патент 2367350 РФ, МПК А61В 8/06. Способ раннего прогнозирования развития тромбоэмболических осложнений после операций на органах брюшной полости, 2009], основанный на определении Международного нормализованного отношения (MHO) и исследовании кровотока. Проводят исследование методом лазерной доплеровской флоуметрии на передней поверхности в средней трети голени, с помощью которого определяют максимальную амплитуду колебаний миогенного, нейрогенного и дыхательного компонентов. При значении Т<0,40 прогнозируют развитие тромбоэмболических осложнений. Данный способ не достаточно точен, так как не учитывается состояние системы фибринолиза [Гуманенко Е.К., Немченко Н.С., Бояринцев В.В., Гаврилин СВ. Нарушения в системе гемостаза при тяжелых ранениях и травмах: диагностика и лечение. - СПб: ООО «Издательство Фолиант», 2006. - 96 с].
Однако перечисленные методы диагностики тромбоза глубоких вен (ТГВ), как было отмечено выше, не всегда доступны для клинической практики, требуют определенного времени и присутствия квалифицированного персонала.
Известен способ определения уровня D-димера, который является показателем кругооборота фибрина в крови. У здоровых людей его концентрация не превышает 500 нг/мл. Избыток D-димера свидетельствует об активации фибринолиза, которой предшествует усиление коагуляционного каскада с избыточным образованием нерастворимого фибрина [Панченко Е.П. Концепция атеротромбоза - основа патогенеза сердечно-сосудистых заболеваний. Основные направления антитромботической терапии. РМЖ. 2005; 7(13):433-440]. Определение уровня D-димера нашло широкое применение в клинической практике с целью диагностики тромбозов глубоких вен нижних конечностей и тромбоэмболий легочной артерии [Папаян Л. П., Князева Е.С. D-димер в клинической практике: Пособие для врачей. М.: Инсайтполиграфик, 2002; Fancher T.L., White R.H., Kravitz R.L. Combined use of rapid D-dimer testing and estimation of clinical probability in the diagnosis of deep vein thrombosis: systematic review. BMJ. 2004; 329:821-4…]. К патологическим факторам, повышающим концентрацию D-димера в крови, относятся травматические повреждения, преэклампсия, злокачественные новообразования, инфекционные процессы, синдром диссеминированного внутрисосудистого свертывания, артериальные и венозные тромбоэмболии, фибрилляция предсердий, острый коронарный синдром, острые желудочно-кишечные кровотечения.
Повышение уровня D-димера не может само по себе служить убедительным доказательством наличия у больного тромбоэмболии легочной артерии (ТЭЛА) или тромбоза глубоких вен нижних конечностей (ТГВНК), так как очень многие заболевания или клинические ситуации могут приводить к положительным результатам анализа на D-димер. К непатологическим факторам, способствующим повышению уровня D-димера, относятся, например, курение, пожилой возраст, послеоперационные состояния и инвазивные манипуляции, такие как установка периферического венозного катетера.
Благодаря последним достижениям молекулярно-биологических технологий сегодня появились высокоэффективные технологии, делающие персонализированную медицину реальностью. Так, в клиническую диагностику в последнее время внедряется технология пиросеквенирования - метод определения нуклеотидной последовательности в режиме реального времени, основанный на детекции высвобождающегося пирофосфата при элонгации цепи ДНК в результате синтеза второй цепи ДНК на матрице одноцепочечной ДНК. Высвобождающийся пирофосфат проходит серию ферментативных превращений, в результате чего регистрируется хемилюминесцентный сигнал, совокупность сигналов соответствует нуклеотидной последовательности анализируемого генетического локуса [Ronaghi М, Uhlen М., Nyren Р. (1998) Real-Time Pyrophosphate Detection for DNA Sequencing. Science 281:363-365].
Так в лечебной практике особое внимание исследователей уделяется проблеме изучения полиморфных маркеров, относящихся к генам свертывающей системы крови, а именно, генам, напрямую связанным со склонностью к возникновению тромботических заболеваний и осложнений.
В последние годы в связи с открытием ряда ранее неизвестных генетически обусловленных дефектов гемостаза, предрасполагающих к тромбозу (мутация ингибитора активатора плазминогена -PAI-1), стало возможным объяснение ранее необъяснимых случаев тромботических осложнений. Особенностью полиморфных вариантов данных генов является то, что они могут долгое время никак себя не проявлять. Выяснение этих дополнительных условий помогает эффективно предотвращать развитие заболеваний и их осложнений у носителей вариантных генов.
Этот метод на данный момент является самым точным, однако он дорогостоящий, сложный в исполнении, в связи с этим быстрое проведение индивидуального анализа не представляется возможным из-за сбора достаточного количества образцов для генетического исследования, что связано с высокой себестоимостью реактивов, еще один немаловажный аспект, то что для проведения этого исследования требуется дорогостоящее оборудование и специально обученный персонал.
Задачей настоящего изобретения является разработка нового способа прогнозирования тромбоэмболических осложнений, простого, доступного, дешевого, не требующего дорогостоящего и сложного оборудования, с быстрым получением результата, доступного для любой лаборатории.
Нами впервые установлено, что при значениях содержания фактора роста эндотелия сосудов (ФРЭС) в сыворотке крови до 183,6 пг/мл прогнозируется низкий риск, а при значениях выше 183,6 пг/мл - высокий риск возникновения тромбоэмболических осложнений.
Использование заявленного способа позволяет повысить эффективность определения степени риска венозных тромбоэмболических осложнений.
Проведено обследование 151 пациента, которым было проведено тотальное эндопротезирование (ТЭП) крупных суставов нижних конечностей, из которых мужчин - 51 (34%), женщин - 100 (66%) в возрасте 25-68 лет, находящихся на лечении в СарНИИТО.
Критерии включения: возраст 25-70 лет, наличие первичного коксартроза III стадии, первичный гонартроз; информированное согласие, подписанное пациентом.
Критерии исключения: сахарный диабет и физикальный статус пациентов, позволяющий отнести их к I или II классу по классификации ASA (Американской ассоциации анестезиологов).
Лабораторному исследованию подвергалась сыворотка крови на момент поступления больного в стационар, после оперативного вмешательства, а так же на момент выписка больного из стационара, в которой количественно определяли значимый клеточно-молекулярный маркер ФРЭС. Этим же больным проводилось генетическое исследование методом пиросеквенирования по профилю "Плазмо-скрин. Плазменные факторы системы свертывания крови". Содержание ФРЭС определяли в сыворотке крови с помощью наборов реактивов для твердофазного ИФА фирм Biosource, Europe S.A., на иммуноферментном анализаторе Stat-Fax - 2100. Исследование генетического полиморфизма проводилось на приборе Система генетического анализа PyroMark Q24 (производство "Qiagen", Германия), с использованием реагентов - выделение ДНК: "ДНК-сорб-В" (производство ФБУН ЦНИИ Эпидемиологии Роспотребнадзора), ПЦР и пиросеквенирование: "АмплиСенсПироскрин", форма 6 "Плазмо-скрин" (производство ФБУН ЦНИИ Эпидемиологии Роспотребнадзора) "PyroMarkGold Q96 Reagents" (производство "Qiagen", Германия).
Статистическую обработку результатов проводили с использованием пакетов компьютерных программ Statistica v 6.0 (StatSoftlnc), SPSS 13.0 for Windows, Office Excel 2007. Закономерности изменения содержания молекулярных маркеров в биоматериале исследовали методами описательной статистики (непараметрическая статистика с расчетом медианы, квартильного размаха, уровня достоверности различия между группами обследованных по критерию Манна - Уитни).
После оперативного вмешательства (на 2-3 день) всем пациентам назначали низкомолекулярный гепарин (НМГ) Эноксапарин («Клексан») в дозе 40 мг один раз в день подкожно и до момента выписки больного из стационара (на 7-10 день). Показаниями к применению «Клексана» были эндопротезирование тазобедренного сустава (49,7%), эндопротезирование коленного сустава (32,7%), а также другие оперативные вмешательства на тазобедренном и коленном суставах (17,6%). Средний возраст составил 53±3,0 года. Контрольную группу составили 20 практически здоровых человека: 11 женщин и 9 мужчин, которые сопоставимы по полу и возрасту с обследуемыми лицами.
Эффективность диагностики по анализу чувствительности и специфичности оценивалась с помощью построения характеристической кривой (ROC-анализ) при разных точках разделения значений лабораторных показателей [Власов В.В. Эффективность диагностических исследований. М.: Медицина, 1998. с. 134-139].
ROC-кривая построена для эффективности диагностики ФРЭС в сыворотке крови среди пациентов. Информативность показателя оценивалась по величине площади (AUC) под кривой. Чем ближе кривая к диагонали (AUC=0,5), тем ниже диагностическая ценность показателя, чем ближе площадь под кривой к 1, тем эффективнее диагностический тест [deJong B.W., Schut Т.С., Maquelin K., vanderKwast Т., Bangma С.Н., Kok D.J., Puppels G.J. Discrimination between nontumor bladder tissue and tumor by Raman spectroscopy. // Analytical Chemistry. - 2006. - Vol. 78(22). - P. 7761-9. Fernandez-Gomez J., Rodriguez-Martinez J.J., Barmadah S.E., Garcia Rodriguez J., Allende D.M., Jalon A., Gonzales R., Alvarez-Mugica M. Urinary CYFRA 21.1 is not a useful marker for the detection of recurrences in the follow-up of superficial bladder cancer. // Eur. Urol. - 2007 - Vol. 51(5). - P. 1267-74.].
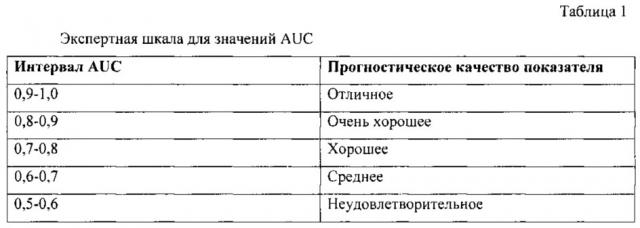
В литературе приводится следующая экспертная шкала для значений AUC (табл. 1), по которой можно судить о качестве показателя [Zweig М.Н. Campbell G. ROC Plots: A Fundamental Evaluation Tool in Clinical Medicine // Clinical Chemistry. - 1993. - Vol.39(4) -P.127-32.].
На характеристической кривой можно выбрать диагностический порог (точку отсечения), который соответствует максимально возможной чувствительности и специфичности выявления сосудистых нарушений исследованными показателями. Представленные результаты ROC-анализа представлены с указанием значения площади (AUC) под кривой, достоверности (р<0,05), 95% доверительного интервала. Ось Y отражает чувствительность показателя, ось X-(100%-специфичность). Критерий рассматривается как эффективный при нижней границе доверительного интервала площади <0,5, значения достоверности р<0,05.
Для выявления методом ROC-анализа эффективных диагностических показателей, построена кривая зависимости чувствительности и специфичности от уровня точки отсечения. Для выделенных эффективных диагностических тестов предложена точка отсечения, соответствующая максимально возможной чувствительности и специфичности выявления сосудистых нарушений (фиг. 1).
На фиг. 1. изображена ROC-кривая диагностической эффективности ФРЭС в сыворотке крови.
Анализ диагностической эффективности ФРЭС показал достоверную значимость данного маркера эндотелиальной дисфункции при тотальном эндопротезировании. Во всех случаях ФРЭС в сыворотке крови обладает высокими характеристиками чувствительности и специфичности. Диагностический порог подбирался в соответствии с наиболее актуальными клиническими запросами. В этой ситуации за критерий выбора порога был принят уровень показателя с максимальной суммой чувствительности и специфичности (табл. 2).
Полученные результаты также позволили выделить среди пациентов группу с повышенными значениями ФРЭС в сыворотке крови при поступлении (группа №1). Группу №2 составили пациенты с уровнем ФРЭС ниже 183,6 пг/мг в сыворотке крови (табл. 3). Как видно из табл. 3, в первой группе рост концентраций ФРЭС в сыворотке крови продолжается и в последующем, что подтверждается увеличением значений данного показателя при выписке больных по сравнению с их значениями при поступлении, во второй группе этот показатель остается в пределах значений до 183,6 пг/мл.
Несмотря на проводимую терапию с использованием низкомолекулярных гепаринов рост концентрации ФРЭС в сыворотке крови в группе №1 продолжается, а в группе №2 наблюдается тенденция к снижению концентрации ФРЭС к моменту выписки больных из стационара (табл. 3).
Все пациенты с повышенным уровнем ФРЭС в сыворотке крови были дообследованы методом пиросеквенирования по профилю «Плазмо-скрин. Плазменные системы свертывания крови». Показания к назначению следующие: тромбозы в анамнезе у пациента или у ближайших родственников, подготовка к хирургической операции.
Методом случайной выборки в группе пациентов с уровнем ФРЭС в сыворотке крови ниже диагностически значимого уровня (<183,6 пг/мл) так же было проведено генетическое исследование профилем «Плазмо-скрин».
Было проведено определение генетических полиморфизмов в генах, кодирующих плазменные факторы системы свертывания крови, таких как: А2-тромбин (фактор II свертывания крови), который кодирует предшественник тромбина, стимулирующего образование тромба; F7 (фактор VII свертывания крови), кодирующий белок, участвующий в образовании тканевой протромбокиназы, отвечает за превращение протромбина в тромбин; FGB - фибриноген (фактор I свертывания крови), кодирует предшественник тромбина, образующий основу фибринового тромба, а так же Серпин-1 (PAI-1) являющийся антогонистом тканевого активатора плазминогена, кодирующий витамин K-зависимый протеолитический фермент, который активируется под действием тромбина. Данное исследование предназначено для выявления генетической предрасположенности к тромбозам и тромбоэмболиям [Tsiatis А.С, Norris-Kirby A., Rich R.G. et al. Comparison of Sanger sequencing, pyrosequencing, and melting curve analysis for the detection of KRAS mutations: diagnostic and clinical implications // J. Mol. Diagn. 2010. Vol. 12, N4. P. 425-4].
Полученные данные позволили нам сделать заключение о том, что у больных с повышенным уровнем ФРЭС в сыворотке крови (>183,6 пг/мл) в 97,5% случаев был обнаружен полиморфизм гена РАМ, который приводит к снижению фибринолитической активности крови и повышает риск коронарных нарушений, что особенно актуально для пациентов в госпитальных условиях, имеющих большое количество факторов риска развития венозных тромбоэмболических осложнений в связи с длительной иммобилизацией конечности. В 2,5% случаев уровень ФРЭС в сыворотке крови был близким к референсному интервалу, при этом полиморфизм гена PAI-1 не был обнаружен.
Выполненное исследование позволило установить, что при значениях содержания ФРЭС до 183,6 пг/мл прогнозируется низкий риск возникновения тромбоэмболических осложнений, а при значениях выше 183,6 пг/мл - высокий.
Таким образом, предложенный способ является не менее точным, чем метод пиросеквенирования, однако наш метод более доступный, простой, дешевый, легкий в исполнении, доступен любому врачу-лаборанту, владеющему иммуноферментным методом исследования, быстрый и занимает от 2 до 2,5 часов, в зависимости от количества анализируемых проб.
Пример 1
Больная К., 77 лет, поступила в клинику на оперативное вмешательство в ФГБУ "СарНИИТО" Минздрава России 14.01.14 г., № истории болезни 408, с диагноз: коксартроз (артроз тазобедренного сустава).
До операции провели общеклиническое обследование, согласно стандартам обследования. Осуществили забор венозной крови и подготовили образцы проб сыворотки крови. Содержание в пробе сыворотки крови ФРЭС при поступлении составил 204,7 пг/мл, после чего пациента направили на дообследование методом пиросеквенирования по профилю "Плазмо-скрин. Плазменные факторы системы свертывания крови". Провели оперативное вмешательство: тотальное эндопротезирование тазобедренного сустава. На 2-3 день после операции уровень ФРЭС в сыворотке крови составил 310,1 пг/мл, в результате пиросеквенирования по профилю "Плазмо-скрин" №371233- из 5 исследованных полиморфизмов выявлен один неблагоприятный аллель - в гене антагонисте тканевого активатора плазминогена PAI-l -rsl799768, гомозигота, таким образом был обнаружен полиморфизм гена PAI-1, который приводит к снижению фибринолитической активности крови и повышает риск коронарных нарушений. Несмотря на проводимую терапию уровень ФРЭС в сыворотке крови к моменту выписки составил 343,7 пг/мл, что подтверждает необходимость индивидуального подбора низкомолекулярных гепаринов.
Доказана высокая эффективность использования взаимосвязи ФРЭС и PAI-1 в сыворотке крови, играющую одну из ведущих ролей в развитии предрасположенности к тромбозам (генетически обусловленное нарушение коагуляции или функционирования противосвертывающей - антикоагуляционной или фибринолитической систем).
Пример 2
Больной К., 69 лет, поступил в клинику на оперативное вмешательство 13.02.2014 г., № истории болезни 914, с диагноз: Другой первичный гонартроз 3 степени слева, болевой синдром. Состояние после ТЭП правого тазобедренного сустава (2010). Артериальная гипертензия. ИБС, атеросклеротический кардиосклероз, атеросклероз аорты, коронарных мозговых сосудов, предсердная экстрасистолия.
До операции осуществили забор венозной крови и подготовили образцы проб сыворотки крови, провели общеклиническое обследование с помощью стандартных методов, забор крови на генетическое исследование методом пиросеквенирования, а также определили содержание ФРЭС в сыворотке крови на момент поступления его уровень составил 200,8 пг/мл, после оперативного вмешательства - 231,9 пг/мл, а к моменту выписки рост концентрации ФРЭС в сыворотке крови продолжился и составил 289,7 пг/мл, несмотря на проводимую терапию с использованием низкомолекулярных гепаринов. При проведении генетического исследования "Плазмо-скрин. Плазменные факторы свертывания крови" №383146 получено следующее заключение: из 5 исследованных полиморфизмов выявлены два неблагоприятных аллеля - в гене фибриногена- rs 180079 (ген FGB), гетерозигота; в гене антагонисте тканевого активатора плазминогена- rs 1799768 (ген PAI-1), гетерозигота, наличие которого свидетельствует о том, что у данного пациента высокий риск тромбоэмболических осложнений, и требуется индивидуальный подбор низкомолекулярных гепаринов.
Пример 3
Больной Л., 46 лет, поступил 11.08.13 г. с диагнозом: Другой первичный коксартроз. Коксартроз справа 3 степени, № истории болезни 523. При поступлении помимо общеклинических исследований был произведен забор крови на генетическое исследование методом пиросеквенирования по профилю "Плазмо-скрин". Уровень содержания ФРЭС в сыворотке крови на момент поступления составил 106,7 пг/мл, после оперативного вмешательства- 124,1 пг/мл, а к моменту выписки 132,4 пг/мл. При генетическом исследовании №383147 было получено следующее заключение: при исследовании полиморфизмов в 5 генах аллели "риска" не выявлены.
В результате исследования у данного пациента не выявлен полиморфизм гена PAI-1, что подтверждает отсутствие возможного риска возникновения тромбоэмболических осложнений в послеоперационный период, и действительно соответствует низкому диагностическому уровню ФРЭС в сыворотке крови.
К преимуществам данного метода относится:
1. Универсальность: используются стандартные наборы реактивов и фотометрических анализаторов. Это обуславливает универсальность выполнения лабораторного исследования. Полностью отсутствует субъективизм.
2. Специфичность и чувствительность: высокие значения специфичности 83% и чувствительности 100% свидетельствуют о качестве предлагаемого способа.
3. Актуальность ответа (быстрота получения результата: высокая технологичность и автоматизация способа позволяет получить результаты исследования в день проведения анализа).
4. Простота выполнения: исследование доступно любому врачу-лаборанту, владеющему иммуноферментным методом исследования. Доступен любой лаборатории.
5. Для проведения анализа требуется небольшой объем крови: 0,25 мл.
6. Несмотря на то, что исследование является инвазивным, оно не опасно для больного, так как полностью исключает осложнения.
7. Частота определения: использование венозной крови больного позволяет проводить такое лабораторное исследование в динамике с той частотой, как это будет требоваться.
8. Заявляемый способ позволяет в сравнении с известными технологиями повысить объективность прогноза риска возникновения тромбоэмболических осложнений и осуществить более раннее прогнозирование.
9. Разработанный способ расширяет арсенал средств контроля состояния больных, которым предстоит оперативное вмешательство.
10. Предложенный метод прогнозирования тромбоэмболических осложнений способствует своевременной и адекватной коррекции тромбоэмболических состояний.
Способ прогнозирования тромбоэмболических осложнений у больных с повреждениями или заболеваниями опорно-двигательного аппарата, которым предстоит операционное вмешательство, включающий исследование венозной крови, отличающийся тем, что определяют фактор роста эндотелия сосудов (ФРЭС) и при значении ФРЭС выше 183,6 пг/мл прогнозируют высокий риск тромбоэмболических осложнений у больных с повреждениями или заболеваниями опорно-двигательного аппарата, которым предстоит операционное вмешательство.