Композиция для регенерации кожи и слизистых оболочек
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Согласно изобретению композиция для регенерации кожи и слизистых оболочек включает в себя культуральную питательную среду, кондиционированную продуктами жизнедеятельности и ростовыми факторами мезенхимальных стволовых клеток человека при многократных циклах культивирования на стадиях фазы ускоренного роста и логарифмической фазы роста стабильной клеточной культуры мезенхимальных стволовых клеток человека, а также костномозговые мезенхимальные стволовые клетки человека с концентрацией от 102 клеток/мл до 107 клеток/мл и/или дифференцирующий фактор, представляющий собой полностью транс-ретиноевую кислоту и/или гиалуроновую кислоту в виде гиалуроната натрия и/или диметилсульфоксид. Культуральная питательная среда каждого последующего цикла культивирования представляет собой кондиционированную среду, полученную на предыдущем цикле культивирования. Композиция включает в себя факторы роста с молекулярной массой от 6 кДа до 80 кДа, биологически активные соединения на основе цитокинов с молекулярной массой от 5 кДа до 50 кДа, низкомолекулярные пептиды длиной от 20 до 140 аминокислотных остатков и стероидные гормоны с молекулярной массой от 280 Да до 370 Да. При этом мезенхимальные стволовые клетки человека, продуктами которых кондиционирована питательная культуральная среда, входящие в состав композиции для регенерации кожи и слизистых оболочек, получены при заборе аутологичных клеток костного мозга. Изобретение позволяет уменьшить длительность технологического процесса создания композиции и повысить показатели эффективности лечебного действия. 9 з.п. ф-лы. 4 ил., 9 пр.
Реферат
Изобретение относится к области биотехнологии, конкретно, к средствам для регенерации кожи и слизистых оболочек.
Изобретение может быть использовано при лечении глубоких и обширных ожогов, отморожений, травм опорно-двигательного аппарата, трофических язв на фоне хронической венозной недостаточности, хронических ран после длительных нагноительных процессов, трофических язв на фоне сахарного диабета, гнойно-некротических процессов, хронических незаживающих ран различного генеза (чистые раны, раны с гнойным или серозным отделяемым), угревой болезни и ее последствий, келоидных, атрофических и гипертрофических рубцов кожи, трещин, ссадин, пролежней.
Известна композиция для стимуляции роста и регенерации клеток, которая содержит разрушенные клетки лейкоцитов периферической крови и стволовых и/или прогениторных клеток в кондиционированной среде их культивирования с тканеспецифическим антигеном, соответствующим поврежденному органу, регенерацию которого следует осуществить, и фармацевтически приемлемый носитель. Культуральная среда для культивирования клеток может быть любой средой для культивирования клеток, которая соответствует потребностям культивируемых клеток в питательных элементах, а длительность процесса культивирования может достигать 60 суток. Кондиционирование может быть осуществлено стромальными клетками, клетками костного мозга, паренхиматозными клетками, резервными клетками печени, стволовыми нервными клетками, стволовыми клетками поджелудочной железы и/или эмбриональными стволовыми клетками (RU, №2341270, A61K 35/12, 10.07.2008).
Также известна композиция, предназначенная для стимуляции заживления ран и лечения ожогов, содержащая питательную среду, кондиционированную трехмерной клеточной культурой при культивировании in vitro в течение времени, достигающего 14 суток. Культивированные в трех измерениях клеточные культуры включают в себя стромальные и/или паренхимные клетки, в том числе генетически сконструированные клетки. Композиция содержит названную кондиционированную культуральную среду, из которой отделены клетки, использованные для кондиционирования этой среды. В композиции кондиционированная клеточная среда культивирования может быть объединена с фармацевтически приемлемым носителем и другими соединениями (RU, №2280459, A61K 35/12, 27.07.2006).
Недостатками указанных композиций (RU, №2341270, A61K 35/12, 10.07.2008 и RU, №2280459, A61K 35/12, 27.07.2006) является то, что в них используются клеточные линии, не всегда до конца изученные в отношении влияния на организм человека. Также при создании композиций применяются сложные, затратные и недостаточно апробированные технологии, а получаемые кондиционированные среды содержат вещества неоднозначного действия на организм человека. Более того, как свойства, так и состав кондиционированных сред данных композиций, недостаточно определены и изучены, что, в конечном итоге, может привести к возможности проявления непредвиденных свойств фармацевтической композиции. Также процессы создания данных композиций характеризуются относительно большими длительностями этапов культивирования и, соответственно, кондиционирования культуральных питательных сред.
Также известна композиция для регенерации кожи и слизистых оболочек, включающая в себя культуральную питательную среду, кондиционированную продуктами жизнедеятельности и ростовыми факторами мезенхимальных стволовых клеток. Кондиционированная среда получена на стадиях логарифмической фазы и стационарной фазы роста стабильной клеточной культуры мезенхимальных стволовых клеток и содержит биологически активные соединения на основе низкомолекулярных пептидов и низкомолекулярных веществ, соответствующих активным цитокинам. В состав композиции также входят костномозговые мезенхимальные стволовые клетки человека (RU, №2455354, C12N 5/0775, A61K 35/12, А61Р 17/00, 29.12.2010).
Недостатками известной композиции являются:
- отсутствие данных о составе групп ростовых факторов, цитокинов и стероидных гормонов, входящих в состав кондиционированной среды, что не позволяет определить возможности клинического применении композиции и проводить обоснованный выбор методики терапии;
- усложнение технологического процесса создания композиции вследствие необходимости многократной замены культуральной питательной среды;
- значительные объемы культуральной питательной среды, необходимой для проведения процессов культивирования клеток и кондиционирования культуральной питательной среды, что приводит к ее необоснованному расходу и, соответственно, к увеличению затрат на ее приобретение;
- большое время на получение кондиционированной среды, значение которого достигает 40 суток;
- недостаточно высокий уровень эффективности применения композиции при ведении лечебного процесса;
- невозможность получения кондиционированных сред и композиций с повышенными уровнями концентраций продуктов жизнедеятельности мезенхимальных стволовых клеток и ростовых факторов.
В данной композиции результирующая кондиционированная среда представляет собой объединение сред, собранных на стадии логарифмической фазы роста (до формирования сплошного монослоя мезенхимальных стволовых клеток) и на стадии стационарной фазы (после формирования сплошного монослоя мезенхимальных стволовых клеток). Степень насыщения культуральной питательной среды продуктами жизнедеятельности и ростовыми факторами мезенхимальных стволовых клеток определяется интенсивностью пролиферации мезенхимальных стволовых клеток, которая значительно выше на стадии логарифмической фазы роста. Следовательно, после объединения кондиционированных сред, полученных на стадиях различных фаз роста клеточной культуры мезенхимальных стволовых клеток, концентрация результирующей среды будет априори меньше концентрации кондиционированной среды, собранной на стадии логарифмической фазы роста.
Задачей изобретения является повышение эффективности процессов создания и применения в лечебном процессе композиции, одним из компонентов которой является кондиционированная среда.
Техническим результатом, достигаемым при решении задачи, является уменьшение длительности технологического процесса создания композиции за счет проведения кондиционирования культуральной питательной среды только на стадиях фазы ускоренного роста и логарифмической фазы роста при снижении себестоимости композиции за счет уменьшения необходимого объема культуральной питательной среды и длительности технологического процесса создания композиции, повышении показателей эффективности лечебного действия вследствие увеличения в кондиционированной среде концентрации продуктов жизнедеятельности и ростовых факторов мезенхимальных стволовых клеток, а также при возможности снижения расхода компонентов композиции в лечебном процессе без снижения эффективности ее действия вследствие повышения активности трансдермального переноса.
Задача решается, а технический результат достигается при использовании композиции для регенерации кожи и слизистых оболочек, включающей в себя культуральную питательную среду, используемую для культивирования in vitro мезенхимальных стволовых клеток человека, кондиционированную продуктами жизнедеятельности и ростовыми факторами мезенхимальных стволовых клеток человека при многократных циклах культивирования на стадиях фазы ускоренного роста и логарифмической фазы роста стабильной клеточной культуры мезенхимальных стволовых клеток человека с использованием в качестве культуральной питательной среды при каждом последующем цикле культивирования кондиционированной среды, полученной на предыдущем цикле культивирования, а также костномозговые мезенхимальные стволовые клетки человека с концентрацией от 102 клеток/мл до 107 клеток/мл и/или дифференцирующий фактор, представляющий собой полностью транс-ретиноевую кислоту и/или гиалуроновую кислоту в виде гиалуроната натрия и/или диметилсульфоксид, при этом мезенхимальные стволовые клетки человека, продуктами которых кондиционирована питательная культуральная среда, входящие в состав композиции для регенерации кожи и слизистых оболочек, получены при заборе аутологичных клеток костного мозга донора, кондиционированная среда включает в себя факторы роста с молекулярной массой от 6 кДа до 80 кДа, биологически активные соединения на основе цитокинов с молекулярной массой от 5 кДа до 50 кДа, низкомолекулярные пептиды длиной от 20 до 140 аминокислотных остатков и стероидные гормоны с молекулярной массой от 280 Да до 370 Да, а содержание дифференцирующего фактора составляет, мас. %: полностью транс-ретиноевая кислота от 0,01 до 0,05; гиалуроновая кислота в виде гиалуроната натрия от 0,01 до 0,5; диметилсульфоксид от 2 до 10.
Решению поставленной задачи и достижению указанного технического результата способствуют также частные существенные признаки изобретения.
Композиция для регенерации кожи и слизистых оболочек, в которой кондиционированная среда в основном содержит следующие ингредиенты, г/л: дегидроэпиандростерон 0,000001; факторы роста 0,00001; цитокины 0,00002; L-глютамин 0,3; L-аргинин 0,2; L-аспарагин (безводный) 0,05; L-аспарагиновую кислоту 0,02; L-цистин 0,0652; L-глютаминовую кислоту 0,02; L-глицин 0,01; L-гистидин 0,015; L-гидроксипролин 0,02; L-изолейцин 0,05; L-лейцин 0,05; L-лизин HCl 0,04; L-метионин 0,015; L-фенилаланин 0,015; L-пролин 0,02; L-серин 0,03; L-треонин 0,02; L-триптофан 0,005; L-тирозин 0,02883; L-валин 0,02; биотин 0,0002; пантотенат 0,00025; холинхлорид 0,00362; фолиевую кислоту 0,001; инозит 0,035; никотинамид 0,001; РАВА 0,001; пиридоксин солянокислый 0,001; рибофлавин 0,0002; тиамин солянокислый 0,001; витамин В12 0,000005; нитрат кальция 0,1; хлорид калия 0,4; сульфат магния 0,04884; хлорид натрия 6,0; фосфат натрия 0,8; Д-глюкоза 2,0; глютатион 0,001; феноловый красный 0,0053.
Факторы роста представлены группой, содержащей фактор роста гепатоцитов (HGF), эпидермальный ростовой фактор (EGF), фактор роста фибробластов (FGF), гранулоцитарный колониестимулирующий фактор (G-CSF), фактор роста макрофагов (M-CSF), инсулиноподобный фактор роста-1 (IGF-1), трансформирующий фактор роста бета1 (TGF-β1), тромбоцитарный фактор роста (PDGF) и фактор роста эндотелия сосудов (VEGF).
Цитокины представлены группой, содержащей IL-1α, IL-1β, IL-2, IL-3, IL-4 IL-5, IL-6, IL-8, IL-10, IL-12, IFN-γ и лептин.
Стероидные гормоны представляют собой дегидроэпиандростерон (DHEA) или дегидроэпиандростерон-сульфат (DHEA-S).
Культуральная питательная среда представляет собой среду RPMI-1640 ("Gibco").
Культуральная питательная среда представляет собой среду RPMI-1640 ("Gibco"), дополнительно содержащую пенициллин (100 ЕД/мл), стрептомицин (100 мкг/мл), амфотерицин (100 нг/мл), L-глютамин 2 mM.
Культуральная питательная среда представляет собой среду RPMI-1640 ("Gibco"), дополнительно содержащую пенициллин (100 ЕД/мл), стрептомицин (100 мкг/мл), амфотерицин (100 нг/мл), L-глютамин 2 mM, 5-10% эмбриональную телячью сыворотку ("HyClone").
Культуральная питательная среда кондиционирована продуктами жизнедеятельности и ростовыми факторами мезенхимальных стволовых клеток, исходная плотность посева которых составляет не менее 104 клеток на один кв.см.
Культуральная питательная среда кондиционирована при многократных циклах культивирования, минимальное количество которых равно двум.
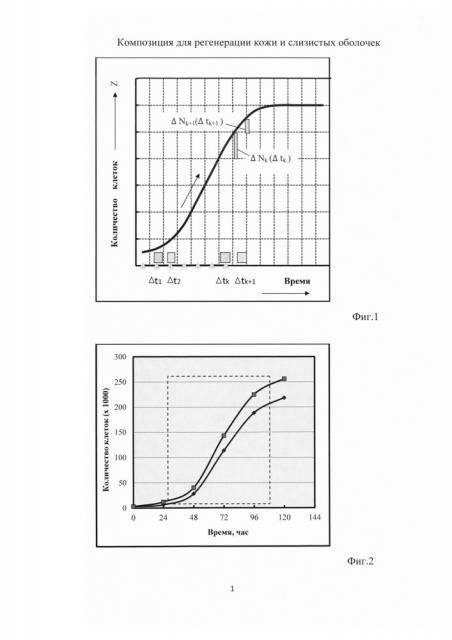
На фиг. 1 представлена графическая зависимость, иллюстрирующая условие выбора момента окончания процесса кондиционирования питательной среды.
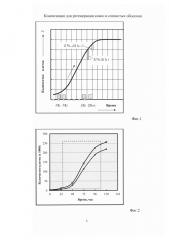
На фиг. 2 - виды S-образных кривых роста количества мезенхимальных стволовых клеток, полученных на последовательных циклах кондиционирования питательной среды и сглаженных методом наименьших квадратов.
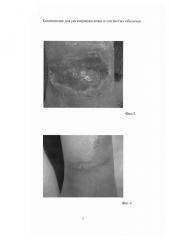
На фиг. 3 - вид раны до начала лечебного процесса.
На фиг. 4 - вид раны после проведения лечебного процесса с применением композиции.
Композиция для регенерации кожи и слизистых оболочек включает в себя культуральную питательную среду, используемую для культивирования in vitro мезенхимальных стволовых клеток человека, кондиционированную продуктами жизнедеятельности и ростовыми факторами мезенхимальных стволовых клеток человека при многократных циклах культивирования на стадиях фазы ускоренного роста и логарифмической фазы роста стабильной клеточной культуры мезенхимальных стволовых клеток человека с использованием в качестве культуральной питательной среды при каждом последующем цикле культивирования кондиционированной среды, полученной на предыдущем цикле культивирования, а также костномозговые мезенхимальные стволовые клетки человека с концентрацией от 102 клеток/мл до 107 клеток/мл и/или дифференцирующий фактор, представляющий собой полностью транс-ретиноевую кислоту и/или гиалуроновую кислоту в виде гиалуроната натрия и/или диметилсульфоксид, при этом мезенхимальные стволовые клетки человека, продуктами которых кондиционирована питательная культуральная среда, входящие в состав композиции для регенерации кожи и слизистых оболочек, получены при заборе аутологичных клеток костного мозга донора, кондиционированная среда включает в себя факторы роста с молекулярной массой от 6 кДа до 80 кДа, биологически активные соединения на основе цитокинов с молекулярной массой от 5 кДа до 50 кДа, низкомолекулярные пептиды длиной от 20 до 140 аминокислотных остатков и стероидные гормоны с молекулярной массой от 280 Да до 370 Да, а содержание дифференцирующего фактора составляет, мас. %: полностью транс-ретиноевая кислота от 0,01 до 0,05; гиалуроновая кислота в виде гиалуроната натрия от 0,01 до 0,5; диметилсульфоксид от 2 до 10.
Кондиционированная среда композиции в основном может содержать следующие ингредиенты, г/л: дегидроэпиандростерон 0,000001; факторы роста 0,00001; цитокины 0,00002; L-глютамин 0,3; L-аргинин 0,2; L-аспарагин (безводный) 0,05; L-аспарагиновую кислоту 0,02; L-цистин 0,0652; L-глютаминовую кислоту 0,02; L-глицин 0,01; L-гистидин 0,015; L-гидроксипролин 0,02; L-изолейцин 0,05; L-лейцин 0,05; L-лизин HCl 0,04; L-метионин 0,015; L-фенилаланин 0,015; L-пролин 0,02; L-серин 0,03; L-треонин 0,02; L-триптофан 0,005; L-тирозин 0,02883; L-валин 0,02; биотин 0,0002; пантотенат 0,00025; холинхлорид 0,00362; фолиевую кислоту 0,001; инозит 0,035; никотинамид 0,001; РАВА 0,001; пиридоксин солянокислый 0,001; рибофлавин 0,0002; тиамин солянокислый 0,001; витамин В12 0,000005; нитрат кальция 0,1; хлорид калия 0,4; сульфат магния 0,04884; хлорид натрия 6,0; фосфат натрия 0,8; Д-глюкоза 2,0; глютатион 0,001; феноловый красный 0,0053.
Кроме того, факторы роста в композиции представлены группой, содержащей фактор роста гепатоцитов (HGF), эпидермальный ростовой фактор (EGF), фактор роста фибробластов (FGF), гранулоцитарный колониестимулирующий фактор (G-CSF), фактор роста макрофагов (M-CSF), инсулиноподобный фактор роста-1 (IGF-1), трансформирующий фактор роста бета1 (TGF-β1), тромбоцитарный фактор роста (PDGF) и фактор роста эндотелия сосудов (VEGF). Кроме того, цитокины в композиции представлены группой, содержащей IL-1α, IL-1β, IL-2, IL-3, IL-4 IL-5, IL-6, IL-8, IL-10, IL-12, IFN-γ и лептин.
В композиции стероидные гормоны представляют собой дегидроэпиандростерон (DHEA) или дегидроэпиандростерон-сульфат (DHEA-S). Культуральная питательная среда может представлять собой среду RPMI-1640 ("Gibco"). Также она может представлять собой среду RPMI-1640 ("Gibco"), дополнительно содержащую пенициллин (100 ЕД/мл), стрептомицин (100 мкг/мл), амфотерицин (100 нг/мл), L-глютамин 2 mM. Также она может представлять собой среду RPMI-1640 ("Gibco"), дополнительно содержащую пенициллин (100 ЕД/мл), стрептомицин (100 мкг/мл), амфотерицин (100 нг/мл), L-глютамин 2 mM, 5-10% эмбриональную телячью сыворотку ("HyClone"). Культуральная питательная среда кондиционирована продуктами жизнедеятельности и ростовыми факторами мезенхимальных стволовых клеток, исходная плотность посева которых составляет не менее 104 клеток на один кв.см. Культуральная питательная среда может быть кондиционирована при многократных циклах культивирования, минимальное количество которых равно двум. В качестве цикла культивирования принят процесс роста мезенхимальных стволовых клеток в соответствии с S-образной кривой роста с момента рассеяния клеток в питательной среде до момента окончания процесса кондиционирования на стадии логарифмической фазы роста мезенхимальных стволовых клеток и съема кондиционированной среды с клеток. В качестве основного компонента заявляемой композиции используется продукт культивирования именно мезенхимальных стволовых клеток, так как такие клетки не содержат фенотипические мембранные маркеры, характерные для гемопоэтических клеток (CD34, CD45, CD25, CD14, CD4), а также антигены гистосовместимости (HLA-DR, МН-II), и поэтому могут использоваться как для аутологичной, так и для аллогенной трансплантации. Наиболее часто для выделения чистой популяции мезенхимальных стволовых клеток используют такие маркеры, как CD 44, CD90, CD105, CD106, STRO-1, SH-4, H Oct-4, ABCG2.
Необходимо отметить то, что в настоящее время известен ряд культуральных питательных сред, которые могут быть использованы в процессах культивирования мезенхимальных стволовых клеток. К этим средам относятся, например, модифицированная по методу Дульбекко среда Игла (DMEM), среда Хэма F12, RPMI-1640, среда Исков, среда Маккой, а также другие композиции сред, известные из работ (Methods For Preparation of Media, Supplements and Substrate For Serum-Free Animal Cell Culture Alan R. Liss, New York (1984) и Cell & Tissue Culture: Laboratory Procedures, John Wiley & Sons Ltd., Chichester, England 1996). Результаты известных исследований показывают, что в кондиционированных культуральных средах могут содержаться различные комбинации биологически активных веществ, представленных ростовыми факторами, аминокислотами, поли-олигопептидами и нуклеиновыми кислотами. Однако качественный и количественный состав этих компонент является вариантным, что не позволяет без дополнительных исследований характеристик разработанной композиции экстраполировать на нее известные данные при выборе и оптимизации стратегии и тактики ее применения.
Ряд фрагментов исследования процесса синтезирования мезенхимальными стволовыми клетками биологически активных соединений на основе низкомолекулярных пептидов и цитокинов и выделения их в культуральную питательную среду отражен в работах заявителя, выполненных ранее (RU, №2455354, C12N 5/0775, A61K 35/12, A6IP 17/00, 29.12.2010).
Дальнейшие исследования заявителя в области клеточных технологий и последующая статистическая обработка результатов хроматографического анализа трех сред, а именно исходной культуральной питательной среды, кондиционированной культуральной питательной среды, собранной на стадии логарифмической фазы роста стабильной клеточной культуры мезенхимальных стволовых клеток, и кондиционированной культуральной питательной среды, собранной на стадии стационарной фазы роста стабильной клеточной культуры мезенхимальных стволовых клеток, в части распределения белковых фракций (пептиды и активные цитокины) показали следующее.
Доминирующая часть приращений белковых фракций (пептиды и активные цитокины) соответствует процессам на стадиях фазы ускоренного роста и логарифмической фазы роста стабильной клеточной культуры мезенхимальных стволовых клеток. На стадии логарифмической фазы роста за период генерации происходит интенсивная пролиферация клеток и, следовательно, процесс кондиционирования питательной среды. Характер роста клеточной структуры в значительной степени зависит от контактного ингибирования движения и контактного ингибирования роста, которое способствует образованию монослоя и препятствует образованию многослойных клеточных структур. При образовании культивируемыми клетками плотного монослоя возможно замедление процесса их деления. В состоянии покоя не все виды клеток могут сохранять жизнеспособность длительное время. [Y. Kikawa, K. Yoneda, Lab.Invest 30, 76 (1974); C.P. Terzic, A.M. Gacy, R. Bortolon, P.P. Dzeja, M. Puceat, M. Jaconi, F.G. Prendergast, A. Terzic, Circulation research 84 (11), 1292 (1999)]. Результаты экспериментальных исследований показывают, что остановка клеточного деления связана не только с образованием монослоя в результате контактного ингибирования размножения, но и с уменьшением клеток до некоторого предельного размера и увеличением степени их поляризации [Ю.В.Петров, Н.В. Цупкина. Особенности роста культуры клеток линии СНО. ж. Цитология. Институт цитологии РАН, Санкт-Петербург. 2012, т. 54. №10, с. 754-760]. Данные процессы соответствуют стадии стационарной фазы роста, которая характеризуется значительным замедлением роста количества клеток, прекращением процесса пролиферации и возможным уменьшением количества клеток. При этом длительность стадии стационарной фазы роста соизмерима с суммарной длительностью стадии фазы ускоренного роста и стадии логарифмической фазы роста. Это указывает на возможность отказа от кондиционирования культуральной питательной среды на стадии стационарной фазы роста мезенхимальных стволовых клеток и целесообразность использования для кондиционирования среды только стадии фазы ускоренного роста и стадии логарифмической фазы роста мезенхимальных стволовых клеток, что приводит к сокращению длительности процесса кондиционирования. Более того, с учетом стоимости культуральной питательной среды, например RPMI-1640, целесообразно в качестве культуральной питательной среды на последующих этапах культивирования мезенхимальных стволовых клеток использовать кондиционированную среду, полученную на предыдущих этапах культивирования. В этом случае в первоначальном объеме культуральной питательной среды синтезируется большее количество ростовых факторов и продуктов жизнедеятельности мезенхимальных стволовых клеток. Таким образом, имеет место получение более концентрированной кондиционированной среды, что позволяет в дальнейшем, понижая ее концентрацию, получать типовой ряд кондиционированных сред различных концентраций и, соответственно, типовой ряд композиций. Это дает возможность выбора кондиционированной среды необходимой концентрации или соответствующей ей композиции с учетом градации степени поражения, что особенно актуально в условиях проведения лечебного процесса при групповом множественном поражении в условиях применения видов вооружения, использующего комбинированные поля поражения противника.
Обработка совокупности реализаций и статистический анализ характеристик исследуемых процессов кинетики осуществлялись на основе математического аппарата теории случайных функций и методов интерполяции при различных степенях интерполирующих полиномов. На различных этапах создания композиции применялись методы дисперсионного и корреляционного анализа, а также математического планирования многофакторного эксперимента.
Композиция для регенерации кожи и слизистых оболочек может быть получена следующим образом.
Мезенхимальные стволовые клетки, предназначенные для кондиционирования культуральной питательной среды и использования в качестве одного из компонентов композиции, могут быть получены из известных банков клеток или при заборе аутологичных клеток костного мозга донора (пример №1) с последующей реализацией методов культивирования, применяемых в лаборатории клеточных культур заявителя. Для получения кондиционированной среды согласно изобретению мезенхимальные стволовые клетки высевают в культуральную питательную среду, возможные составы которых приведены выше, и осуществляют первый цикл культивирования. Для этого в пластиковый флакон с культуральной питательной средой и с площадью дна 175 см2 помещают свежерассеянные клетки костного мозга с исходной плотностью посева 104 клеток на 1 кв.см дна пластикового флакона. Культивирование проводят в инкубаторе в атмосфере газовой смеси, содержащей 5% углекислого газа при 37°С. В процессе культивирования регулярно определяют рН питательной среды. Регистрируют изменение рН среды до значения не менее 6,8. Процесс кондиционирования начинается на стадии фазы ускоренного роста количества клеток, которая предшествует стадии логарифмической фазы роста и не может быть исключена из процесса формирования S-образной кривой роста клеток. В течение процесса кондиционирования с заданным шагом квантования по времени регистрируется количество клеток и определяется их приращение, соответствующее каждому шагу квантования. Момент времени окончания процесса кондиционирования среды на стадии логарифмической фазы роста первого цикла культивирования соответствует условию
[ΔNk+1(Δtk+1)]×[ΔNk(Δtk)]-1≤0,95,
где Δtk и Δtk+1, - последовательные шаги квантования по времени процесса кондиционирования питательной среды;
k=1, 2, 3, …, n - порядковый номер шага квантования;
ΔNk(Δtk) и ΔNk+1(Δtk+1) - приращения количества мезенхимальных стволовых клеток, соответствующие шагам квантования Δtk и Δtk+1.
Данный момент времени (фиг. 1) выбирается с учетом приращений количества клеток, соответствующих двум последовательным шагам квантования Δtk и Δtk+1 по времени при смещении приращений ΔNk(Δtk) и ΔNk+1(Δtk+1) количества клеток на S-образной кривой роста в направлении роста количества клеток. Начало отсчета времени процесса кондиционирования питательной среды соответствует началу стадии фазы ускоренного роста клеток, а выбор значения уровня, равного 0,95, обусловлен выходом процесса роста количества клеток на начальную стадию фазы замедления роста клеток с последующим переходом на стационарную фазу роста. На этапе предварительных экспериментальных исследований процесса пролиферации мезенхимальных стволовых клеток при последовательных циклах культивирования и вариации значениями исходной плотности посева клеток получены реализации S-образных кривых роста клеток, представленные на фиг. 2. и соответствующие интервалу процесса кондиционирования среды на каждом цикле. Количество шагов квантования Δt по времени определяется длительностью процесса кондиционирования питательной среды и величиной выбранного шага квантования. Повышение точности выбора момента времени окончания процесса кондиционирования среды может быть обеспечено за счет экстраполяции S-образной кривой роста с учетом полученных ранее значений числа клеток. При данных концентрациях мезенхимальных стволовых клеток через 3-4 суток образуется монослой. С целью увеличения в полученной кондиционированной среде концентрации биологически активных веществ, выделенных клетками в питательную среду на этапе интенсивной пролиферации при первом культивировании, проводится второй цикл культивирования. Для этого среда, кондиционированная на первом цикле культивирования, снимается с клеток и добавляется во флакон со свежерассеянными клетками, исходная плотность посева которых составляет 104 клеток на 1 кв.см дна пластикового флакона. После этого осуществляется инкубирование в течение 3-4 суток в атмосфере газовой смеси, содержащей 5% углекислого газа, при 37°С до образования монослоя. В процессе культивирования регулярно определяют рН питательной среды. Процесс кондиционирования также происходит на стадии фазы ускоренного роста и стадии логарифмической фазы роста клеток, а момент времени окончания процесса кондиционирования среды определяется в соответствии с введенным выше условием. После этого обогащенная на этапах двух последовательных культивирований различными биологически активными веществами среда собирается в емкости для хранения, а клетки могут быть заморожены для последующего использования. Культуральная питательная среда может быть кондиционирована при многократных последовательных циклах культивированиях мезенхимальных стволовых клеток, при этом минимальное количество циклов культивирования равно двум. С учетом проведения кондиционирования среды только на указанных фазах роста клеток и выбора моментов времени окончания кондиционирования суммарная длительность технологического процесса получения кондиционированной среды, по меньшей мере, в два раза меньше, чем длительность подготовки кондиционированной среды в известном решении, принятом в качестве прототипа.
Для обеспечения стабильной активности кондиционированной питательной среды ее дополнительно обогащают костномозговыми мезенхимальными стволовыми клетками человека, количество которых выбирается на основании анализа результатов проведенных хроматографических исследований и статистических данных, характеризующих показатели эффективности лечебного процесса. Максимальное значение концентрации вводимых клеток, используемых в составе разработанной композиции, принимается равным 107 клеток/мл. Увеличение концентрации до указанного значения приводит к увеличению скорости регенерации тканей, что, в свою очередь, сокращает длительность лечебного процесса. Использование концентрации клеток выше указанного значения нецелесообразно вследствие увеличения себестоимости композиции. При значении концентрации костномозговых мезенхимальных стволовых клеток менее 102 клеток/мл их введение не влияет существенно на эффективность терапевтического действия композиции, вследствие чего данное значение концентрации выбирается в качестве ее нижнего порогового значения.
Необходимые дифференцирующие факторы добавляются в состав композиции непосредственно перед проведением лечебного процесса. Для увлажнения поверхности участков кожи в композиции используется гиалуронат натрия - натриевая соль гиалуроновой кислоты (Hyalyronic acid, LMW, полисахарид из семейства глюкозаминогликанов, являющийся компонентом соединительной ткани), хорошо растворяющийся в воде, способствующий регенерации тканей и обладающий способностью стимулирования клеточной миграции и пролиферации. Введение в состав композиции дифференцирующего фактора в виде гиалуроната натрия приводит к повышению показателей эффективности лечебного процесса вследствие увеличения противовоспалительных, дезинфицирующих и ранозаживляющих свойств композиции. При исследованиях состава и свойств композиции принято во внимание то, что недостаточность или избыточность гиалуроновой кислоты могут привести к нарушению регуляции метаболизма и регенерации клеточных структур дермы. В качестве дифференцирующего фактора, повышающего характеристики трансдермального переноса, в состав композиции вводится диметилсульфоксид (ДМСО), являющийся антисептиком, обладающим противовоспалительным, обезболивающим свойствами и способностью проникновения через клеточные мембраны. При использовании диметилсульфоксида в составе композиции увеличивается проницаемость клеточных мембран, вследствие чего увеличивается проводимость в системе "калий - натриевого "насоса", происходит реполяризация клеточных мембран, увеличиваются электропроводность клетки и степень диффузии активных ингредиентов композиции к месту назначения. Следствием протекания данных процессов является активизация метаболизма клетки. Для усиления лечебных свойств в заявляемой композиции используется полностью транс-ретиноевая кислота (all trans retinoic acid), которая является активной формой ретинола или витамина А. Введение данной кислоты в состав композиции обусловлено ее биологическим эффектом регулирования эпителиальной ткани с целью ее нормализации. В случае наружного применения ретиноевой кислоты лекарственные дозы с ее повышенной концентрацией позволяют изменять патологические формы, приводя их к нормальным.
Проведенные в процессе создания композиции экспериментальные исследования позволили установить оптимальное содержание дифференцирующих факторов, входящих в состав композиции и обеспечивающих максимальную эффективность ее действия. Так, с учетом лечебных свойств гиалуроната натрия его содержание в композиции должно находиться в пределах от 0,01 до 0,5 мас. %. Увеличение количества гиалуроната натрия в композиции выше 0,5 мас. % приводит к дозозависимому снижению выживаемости фибробластов, а уменьшение количества гиалуроната натрия менее 0,01 мас. % снижает эффективность действия композиции в целом. Содержание диметилсульфоксида в композиции выбрано с учетом сохранения его полезных биологических функций при минимизации возможного токсического действия на клетки и находится в диапазоне от 2 до 10 мас. %. При работе с клеточными культурами в случае увеличения содержания диметилсульфоксида свыше 10 мас. % возможно увеличение количества дегенеративных форм клеток, а уменьшение диметилсульфоксида ниже 2 мас. % приводит к снижению местного противовоспалительного, обезболивающего действия и уменьшению эффективности трансдермального переноса действующих веществ. Выбор уровня содержания транс-ретиноевой кислоты в составе композиции обусловлен наибольшей эффективностью ее воздействия на рану. При увеличении ее содержания выше 0,05 мас. % могут наблюдаться проявления симптомов гипервитаминоза А, а при содержании транс-ретиноевой кислоты ниже 0,01 мас. % снижается поддержка нормальной функции кожи и эпителиального слоя.
В процессе апробации разработанной композиции при лечении широкого спектра заболеваний и различных степенях поражения были использованы возможные комбинации дифференцирующих факторов и других существенных признаков, определяемых формулой изобретения, что позволило обеспечить синергетический эффект лечебных свойств компонентов композиции. Например, совместное действие транс-ретиноевой кислоты и гиалуроната натрия в составе композиции повышает эффективность проведении лечебного процесса вследствие того, что гиалуронат натрия, увеличивая степень увлажнения кожи, позволяет сбалансировать вызываемую использованием указанного ретиноида сухость. Увеличение степени диффузии (следствие применения ДМСО) активных ингредиентов композиции сквозь кожный покров позволяет минимизировать объем или концентрацию используемой кондиционированной среды, минимально-необходимое количество костномозговых мезенхимальных стволовых клеток, вводимых в кондиционированную среду, что, в конечном итоге, приводит к экономии компонентов композиции и снижению уровня риска возникновения нежелательных побочных эффектов при ведении лечебного процесса.
Одним из результатов, полученных при создании композиции с учетом стоимости всех ее компонентов, является снижение, по меньшей мере, в три раза ее себестоимости вследствие уменьшения, по меньшей мере, в четыре раза необходимого объема культуральной питательной среды, а также сокращение времени технологического процесса ее кондиционирования, описанного выше.
Для определения состава среды, кондиционированной на стадиях фазы ускоренного роста и логарифмической фазы роста мезенхимальных стволовых клеток, были проведены экспериментальные исследования, в процессе которых были использованы методы визуального, органолептического, потенциометрического, биологического анализа, методы мембранной фильтрации, потенциометрического титрования и денситометрического анализа. Исследуемые параметры также определялись методами спектрометрии в УФ и видимой областях частот, ионной хроматографии, тонкослойной хроматографии (спектроденситометрический комплекс для ТСХ «CAMAG») и методом гель-фильтрации при высоком давлении (ГФ - ВЭЖХ). Установлено, что состав кондиционированной среды включает в себя ингредиенты, приведенные выше в описании композиции и соответствующие формуле изобретения.
Возможности клинического применения композиции и входящей в ее состав кондиционированной среды должны учитывать особенности присутствующих в составе кондиционированной среды цитокинов, в частности то, что интерлейкины IL-1α и IL-1β обладают провоспалительным действием, способствуют активации специфического иммунитета, интерлейкины IL-2 и IL-4 стимулируют дифференцировку, пролиферацию и функциональные свойства различных типов лимфоцитов, ДК, НК клеток, макрофагов и др. Интерлейкины IL-3 и IL-5 способствуют активации кроветворения, а также стимулируют процессы пролиферации и дифференцировки различных типов клеток предшественников в костном мозге. Интерлейкин IL-5 является основным регулятором накопления эозинофилов в тканях, а интерлейкин IL-6 представляет собой как воспалительный, так и противовоспалительный цитокин, является медиатором лихорадки и острой фазы иммунного ответа, стимулирует мобилизацию энергии в мышцах и жировой ткани, что ведет к повышению температуры, а также способствует росту В-клеток и улучшает поведени