Фармацевтическая композиция для лечения рака, содержащая конъюгат интерферона-альфа
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к фармацевтической композиции, содержащей конъюгат интерферона-альфа с полимером и ингибитор Raf, и может быть использовано в медицине. Полученную фармацевтическую композицию применяют для лечения рака с мутацией k-ras. Изобретение позволяет получить фармацевтическую композицию, обладающую более продолжительным периодом полувыведения in vivo и более высокой противораковой активностью, чем интерферон-альфа, что позволяет снизить вводимую дозу противоракового агента, уменьшая его побочные эффекты. 2 н. и 21 з.п. ф-лы, 6 ил., 5 табл., 6 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической композиции для предупреждения или лечения рака, содержащей интерферон-альфа или его конъюгат, и ее применению в лечении рака совместным введением с противораковыми агентами.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Человеческий интерферон, являющийся разновидностью цитокинов, представляет собой белок, ингибирующий пролиферацию вирусов, раковых клеток и тому подобного, активируя иммунные ответы организма и апоптоз раковых клеток. В зависимости от типа клеток, образующих интерферон, интерфероны делят на три подкласса, то есть интерферон-альфа, интерферон-бета и интерферон-гамма. В частности, интерферон-альфа образуют В-лимфоциты, нулевые лимфоциты и макрофаги, и он обладает противовирусной и противоопухолевой активностью, активирует NK-клетки (натуральные клетки-киллеры) и обладает супрессивными свойствами в отношении клеток костного мозга.
По данным недавних клинических исследований, рекомбинантный человеческий интерферон-альфа обладает терапевтическим потенциалом для лечения широкого спектра солидных опухолей, при этом в продаже имеются два типа интерферонов, полученных методом рекомбинантных ДНК (рекомбинантный интерферон-α-2b (интрон A (Intron-A), Schering Corp.); рекомбинантный интерферон-α-2а (роферон (Roferon), Hoffmann-La Roche, Inc.). Интрон А показан для применения в лечении злокачественной меланомы в комбинации с хирургическим лечением, агрессивной фолликулярной неходжкинской лимфомы в комбинации с химиотерапией антрациклинами, местного лечения остроконечных кондилом, лечения волосатоклеточного лейкоза и связанной с AIDS саркомы Капоши. Роферон показан для применения в лечении хронического миелогенного лейкоза (CML) с филадельфийской хромосомой и связанной с AIDS саркомы Капоши. Также известна их эффективность при раке мочевого пузыря (Torti, F.M. et al., J. Clin. Onco., 3, 506-512, 1985) и раке почки (Vugrin, D. et al., Cancer treat. Rep., 69, 817-820, 1985). Недавно интерферон, модифицированный полиэтиленгликолем (PEG), был утвержден для применения в лечении злокачественной меланомы. Однако нативный интерферон-альфа или PEG-модифицированный интерферон-альфа, как сообщалось, демонстрируют слабый противораковый эффект по причине короткого периода полувыведения и низкой эффективности.
Рак представляет собой аномальный рост клеток, обусловленный множеством изменений экспрессии генов, приводящих к нарушению баланса пролиферации клеток и гибели клеток, что ведет к инвазии и разрушению близлежащих тканей, отдаленным метастазам и, в конечном счете, к летальному исходу. Известно, что раковые клетки проходят аномальное деление и дифференцировку, возникают в любой ткани организма, что обусловлено одним фактором или их комбинацией. Этими факторами являются средовые факторы, такие как широкий спектр химических веществ или радиация, инфекционные заболевания, такие как вирусные инфекции, и наследственные факторы. Рак можно классифицировать на несколько сотен типов в зависимости от пораженных органов и клеток, составляющих раковую ткань.
Для лечения рака применяют хирургическое лечение, лучевую терапию и химиотерапию, но химиотерапия и лучевая терапия связаны с проблемой тяжелых побочных эффектов, таких как рвота и тошнота, цитопения, инфекция, кахексия, воспаление слизистой оболочки, выпадение волос и так далее. В частности, побочные эффекты химиотерапии могут существенно влиять на жизнь пациента и быстро снижают соблюдение схемы лечения пациентом.
В то же время прогноз 5-летней выживаемости при раке поджелудочной железы неблагоприятен и составляет менее 5%. Поскольку рак поджелудочной железы обычно диагностируют на поздних стадиях, оперативное лечение показано менее чем у 20% пациентов. Несмотря на резекцию, рецидивы, обусловленные микрометастазами и поражением лимфатических узлов, возникают почти у 50% пациентов, чаще всего в течение 2 лет. Известно, что из всех видов рака желудочно-кишечного тракта рак поджелудочной железы является одним из видов рака с наиболее высокой летальностью, и что он представляет собой злокачественную опухоль, являющуюся четвертой по распространенности причиной смерти от рака в странах Запада, и шестой - в Корее. Несмотря на наличие рака поджелудочной железы лишь у 2-3% пациентов с раковым заболеванием им обусловлены 6% всех летальных исходов, связанных с раком. Независимо от типа химиотерапии средняя выживаемость при местнораспространенном раке поджелудочной железы и метастатическом раке поджелудочной железы составляет 8-12 месяцев и 3-6 месяцев соответственно, и, таким образом, летальность при раке поджелудочной железы очень высока.
В настоящее время эффективным способом лечения поздних стадий рака поджелудочной железы является внутривенное введение гемцитабина (Lilly), аналога нуклеозида 2'-дезоксицитидина, способного индуцировать гибель клеток рака поджелудочной железы человека и ингибировать рост и прогрессирование опухоли. Тем не менее, эффективность введения гемцитабина самого по себе является низкой со средней общей выживаемостью 5,7 месяца. Недавно эрлотиниб (Tarceva) в комбинации с гемцитабином был одобрен для лечения метастатического рака поджелудочной железы, и комбинированная терапия гемцитабином и эрлотинибом увеличила 1-годовую выживаемость пациентов с раком поджелудочной железы с 18% до 24% по сравнению с введением гемцитабина самого по себе. Тем не менее, важный при химиотерапии показатель, средняя общая выживаемость, был повышен лишь на 0,33 месяца. Эрлотиниб является низкомолекулярным ингибитором тирозинкиназы рецептора эпидермального фактора роста (EGFR) и оказывает одинаковое действие на раковые клетки и на быстро делящиеся нормальные клетки. Поэтому он более токсичен, чем введение гемцитабина самого по себе, и приводит к резистентности при длительном применении.
По этой причине были предприняты попытки комбинированной терапии гемцитабином/интерфероном-альфа, гемцитабином/цисплатином, гемцитабином/капецитабином и гемцитабином/авастином, помимо комбинации гемцитабина с эрлотинибом. Однако полученные терапевтические эффекты являются неудовлетворительными.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Таким образом, авторы настоящего изобретения обнаружили, что конъюгат интерферона-альфа, полученный связыванием интерферона-альфа с константной областью иммуноглобулина через непептидильный полимер, демонстрирует более продолжительный период полувыведения in vivo и более высокую противораковую активность, чем обычный интерферон-альфа, и, в частности, его совместное введение с противораковым агентом, таким как гемцитабин, оказывает синергические ингибирующие эффекты, демонстрируя очень высокую противораковую активность, что позволило сделать настоящее изобретение. Они также обнаружили, что совместное введение противоракового агента и конъюгата интерферона-альфа, имеющего высокую противораковую активность, позволяет снизить вводимую дозу противораковых агентов, уменьшая побочные эффекты противораковых агентов и повышая приверженность пациентов к лечению.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Задачей настоящего изобретения является обеспечение фармацевтической композиции для предупреждения или лечения рака, содержащей интерферон-альфа или его конъюгат с полимером.
Другой задачей настоящего изобретения является обеспечение фармацевтической композиции для предупреждения или лечения рака, содержащей конъюгат интерферона-альфа, полученный связыванием интерферона-альфа с константной областью иммуноглобулина через непептидильный полимер, выбранный из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля-пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, полимолочной кислоты, полимолочной-гликолевой кислоты, липополимеров, хитинов, гиалуроновой кислоты и их комбинации.
Другой задачей настоящего изобретения является обеспечение фармацевтической композиции, дополнительно содержащей противораковый агент, выбранный из ингибитора Ras, ингибитора Raf, ингибитора MAP/ERk киназы (MEK) и ингибитора митоген-активируемой протеинкиназы (MAPK), совместно с конъюгатом интерферона-альфа.
Другой задачей настоящего изобретения является обеспечение способа лечения рака, включающего введение субъекту указанной фармацевтической композиции.
ПРЕИМУЩЕСТВА ИЗОБРЕТЕНИЯ
Конъюгат интерферона-альфа по настоящему изобретению демонстрирует более продолжительный период полувыведения in vivo и более высокую противораковую активность, чем обычный интерферон-альфа, и, в частности, его совместное введение с противораковым агентом, таким как гемцитабин, оказывает синергетические ингибирующие эффекты на рост и пролиферацию раковых клеток, демонстрируя очень высокую противораковую активность. Противораковая фармацевтическая композиция по настоящему изобретению имеет длительный период полувыведения in vivo и высокую противораковую активность, что позволяет существенно снизить частоту введения. Совместное введение противораковых агентов и конъюгата интерферона-альфа, имеющего высокую противораковую активность, позволяет снизить вводимую дозу противораковых агентов, уменьшая побочные эффекты противораковых агентов и повышая соблюдение режима лечения пациентами.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
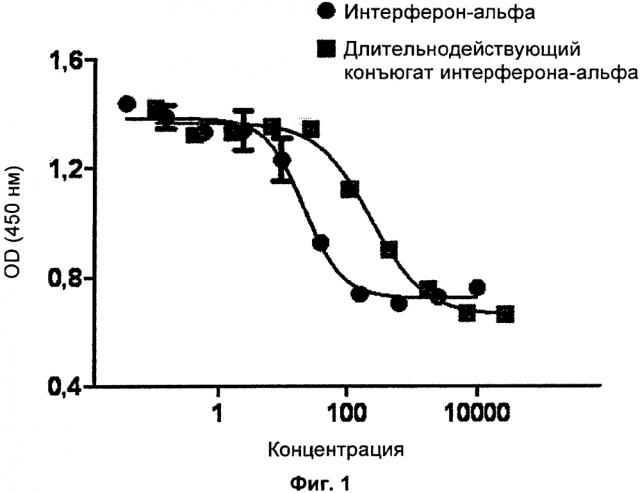
На ФИГ. 1 представлена диаграмма, на которой показаны ингибирующие эффекты интерферона-альфа и конъюгата интерферона-альфа по одному воплощению настоящего изобретения на пролиферацию раковых клеток in vitro у клеток Дауди.
На ФИГ. 2 представлена диаграмма, на которой показаны изменения размера опухоли после введения конъюгата интерферона-альфа по одному воплощению настоящего изобретения бестимусной мыши (бестимусной BALB/c), которой была проведена подкожная трансплантация клеток рака яичника человека (SK-OV-3).
На ФИГ. 3 представлена диаграмма, на которой показаны изменения размера опухоли после совместного введения гемцитабина и конъюгата интерферона-альфа по одному воплощению настоящего изобретения бестимусной мыши (бестимусной BALB/c), которой была проведена подкожная трансплантация клеток рака поджелудочной железы человека (ВхРС-3).
На ФИГ. 4 представлена диаграмма, на которой показаны изменения размера опухоли после совместного введения гемцитабина и конъюгата интерферона-альфа по одному воплощению настоящего изобретения бестимусной мыши (бестимусной BALB/c), которой была проведена подкожная трансплантация клеток рака поджелудочной железы человека (Panc-1).
На ФИГ. 5 показаны изображения размера опухоли по данным аутопсий отдельных мышей после совместного введения гемцитабина и конъюгата интерферона-альфа по одному воплощению настоящего изобретения бестимусной мыши (бестимусной BALB/c), которой была проведена подкожная трансплантация клеток рака поджелудочной железы человека (Panc-1).
| Группа | Вводимые лекарственные средства |
| G1 | Наполнитель |
| G2 | Гемцитабин (40 мг/кг, Q3D, внутривенная инъекция) |
| G3 | Гемцитабин + длительнодействующий конъюгат интерферона-альфа (40 мг/кг, Q3D, внутривенная инъекция + 30 мкг/кг QW, подкожная инъекция) |
| G4 | Длительнодействующий конъюгат интерферона-альфа (30 мкг/кг QW, подкожная инъекция) |
| G5 | Длительнодействующий конъюгат интерферона-альфа (150 мкг/кг QW, подкожная инъекция) |
На ФИГ. 6 представлена диаграмма, на которой показаны изменения размера опухоли после совместного введения гемцитабина и конъюгата интерферона-альфа по одному воплощению настоящего изобретения бестимусной мыши (бестимусной BALB/c), которой была проведена подкожная трансплантация клеток рака поджелудочной железы человека (Miapaca-2).
ПРЕДПОЧТИТЕЛЬНЫЕ ВОПЛОЩЕНИЯ ИЗОБРЕТЕНИЯ
В одном аспекте согласно настоящему изобретению предложена фармацевтическая композиция для предупреждения или лечения рака, содержащая интерферон-альфа.
Интерферон-альфа по настоящему изобретению, являющийся разновидностью цитокинов, представляет собой белок, ингибирующий пролиферацию вирусов, раковых клеток и тому подобного, путем активации иммунных ответов организма и апоптоза раковых клеток. Интерферон-альфа продуцируется В-лимфоцитами, нулевые лимфоцитами и макрофагами, и он обладает противовирусной и противоопухолевой активностью, активирует NK-клетки (натуральные клетки-киллеры) и обладает супрессивными свойствами в отношении клеток костного мозга. Предпочтительно, интерферон-альфа может представлять собой интерферон-альфа-2b, интерферон-альфа-2а или тому подобное.
Человеческий интерферон-альфа имеет молекулярную массу от 17500 до 21000 и очень высокий титр внутренней активности, составляющий 2×108 ME на белок (мг). В организме интерферон-альфа представляет собой белок, содержащий 165 аминокислот, и интерферон-альфа-2а (SEQ ID NO:1) и интерферон-альфа-2b (SEQ ID NO:2) имеют лизин и аргинин в положении 23, соответственно.
При использовании здесь интерферон-альфа включает нативный интерферон-альфа, его агонисты, производные, фрагменты и варианты, и агонист означает вещество, связывающееся с рецептором интерферона-альфа in vivo, демонстрируя биологическую активность, идентичную или соответствующую биологической активности интерферона-альфа, безотносительно структуры интерферона-альфа, и производное означает пептид, аминокислотная последовательность которого по меньшей мере на 80% гомологична нативному интерферону-альфа, где некоторые группы аминокислотных остатков могут быть химически замещены, удалены или модифицированы, и который сохраняет функцию интерферона-альфа. Фрагмент означает пептид, где одна или более аминокислот добавлены или удалены на N-конце или С-конце нативного интерферона-альфа, в который могут быть добавлены искусственные аминокислоты (например, аминокислота D-типа), и который сохраняет функцию интерферона-альфа. Вариант означает пептид, имеющий одну или более аминокислотных последовательностей, отличающихся от аминокислотных последовательностей нативного интерферона-альфа, и сохраняющий функцию интерферона-альфа. Агонист, производные, фрагменты и варианты интерферона-альфа связываются с рецептором интерферона-альфа in vivo и демонстрируют биологическую активность, идентичную или соответствующую биологической активности нативного интерферона-альфа.
Способ получения интерферона-альфа, который можно использовать в настоящем изобретении, описан в патенте Кореи №10-0360594. Полное описание включено в настоящее изобретение в качестве ссылки. Тем не менее, интерферон-альфа не ограничен интерфероном-альфа в соответствии с патентом Кореи №10-0360594, и объем настоящего изобретения включает интерферон-альфа, который легко может получить специалист в данной области техники. Таким образом, в настоящем изобретении могут быть применены навыки специалистов в данной области техники по получению интерферона-альфа.
Кроме того, согласно настоящему изобретению, предложена фармацевтическая композиция для предупреждения или лечения рака, содержащая конъюгат с полимером, где интерферон-альфа связан с полимером.
При использовании здесь термин «конъюгат с полимером» представляет собой форму интерферона-альфа, конъюгированную с полимером. Полимер, используемый в конъюгате, включает все полимеры, которые могут увеличивать период полувыведения in vivo и терапевтическую эффективность. Например, полимер может представлять собой, без ограничения, полимер, такой как полиэтиленгликоль, и белок, такой как антитело, фрагмент антитела, фибронектин, альбумин, фрагмент иммуноглобулина или эластин.
В конъюгате с полимером интерферон-альфа и полимер могут быть связаны друг с другом непосредственно или связаны через пептидный линкер или непептидильный линкер, такой как, без ограничения, непептидильный полимер. Конъюгат с белковым полимером может быть получен в форме слитого белка из клетки или клеток с применением методик генной инженерии, или интерферон-альфа и белковый полимер могут быть получены по отдельности и затем связаны друг с другом ех vivo с применением химических методик. Конъюгат интерферона-альфа, где интерферон-альфа конъюгирован с полимером, может быть получен способом, описанным в патенте Кореи №10-0725315, и его полное описание включено в настоящее изобретение путем ссылки. Тем не менее, способ получения конъюгата интерферона-альфа не ограничен указанным патентом и включает все способы связывания полимера с интерфероном-альфа для увеличения периода полувыведения интерферона-альфа. Таким образом, объем настоящего изобретения включает конъюгаты интерферона-альфа, которые могут быть легко получены специалистами в данной области техники.
Кроме того, конъюгат с полимером может представлять собой конъюгат интерферона-альфа, где интерферон-альфа связан с константной областью иммуноглобулина через непептидильный полимер, выбранный из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля-пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, липополимеров, хитинов, гиалуроновой кислоты и их комбинации. В настоящем изобретении конъюгат с полимером, где интерферон-альфа связан с константной областью иммуноглобулина через непептидильный полимер, и конъюгат интерферона-альфа могут быть использованы взаимозаменяемо.
Константная область иммуноглобулина означает от одного до четырех доменов, выбранных из группы, состоящей из доменов CH1, CH2, CH3 и CH4, и свободна от вариабельных доменов тяжелой и легкой цепи, или константного домена 2 тяжелой цепи (CH2) и константного домена 3 тяжелой цепи (CH3), и свободна от константного домена 1 легкой цепи (CL1) и константного домена 1 тяжелой цепи (CH1). Кроме того, она может дополнительно содержать шарнирную область, и шарнирную область в константной области тяжелой цепи. Она может также представлять собой фрагмент с делецией относительно большой части аминокислотной последовательности CH2 и/или CH3. Конкретно, константная область иммуноглобулина по настоящему изобретению может представлять собой: (1) домен CH1, домен CH2, домен CH3 и домен CH4; (2) домен CH1 и домен CH2; (3) домен CH1 и домен CH3; (4) домен CH2 и домен CH3; (5) комбинацию одного или более доменов и шарнирной области иммуноглобулина (или части шарнирной области); и (6) димер каждого домена константных областей тяжелой цепи и константной области легкой цепи.
Константная область иммуноглобулина по настоящему изобретению может иметь происхождение от IgG, IgA, IgD, IgE или IgM, и каждый домен константной области иммуноглобулина может представлять собой гибрид доменов разного происхождения, имеющих происхождение от иммуноглобулина, выбранного из группы, состоящей из IgG, IgA, IgD, IgE и IgM. Гибрид означает, что последовательности, соответствующие двум или более константным областям иммуноглобулина разного происхождения, присутствуют в одноцепочечной константной области иммуноглобулина. В настоящем изобретении возможны различные типы гибридов. Например, гибриды доменов могут состоять из одного-четырех доменов, выбранных из группы, состоящей из CH1, CH2, CH3 и CH4 IgG, IgM, IgA, IgE и IgD, и могут содержать шарнирную область.
Кроме того, при образовании димера или мультимера, полипептиды, кодирующие одноцепочечные константные области иммуноглобулинов одинакового происхождения, связаны с одноцепочечным полипептидом другого происхождения. Например, димер или мультимер может быть получен комбинированием двух или более фрагментов, выбранных из группы, состоящей из фрагментов константных областей IgG, IgA, IgM, IgD и IgE.
Предпочтительно, это может быть константная область иммуноглобулина, полученная из IgG или IgM, являющихся наиболее распространенными белками в крови человека. В определенном воплощении настоящего изобретения была использована константная область иммуноглобулина, полученная из IgG. IgG могут также быть разделены на подклассы IgG1, IgG2, IgG3 и IgG4, и в настоящем изобретении возможны их комбинации или гибриды. Предпочтительно, могут быть использованы подклассы IgG2 и IgG4, и в определенном воплощении настоящего изобретения был использован Fc-домен IgG4, свободный от эффекторных функций, таких как комплементзависимая цитотоксичность (CDC).
Соответственно, агликозилированный Fc-домен человеческого IgG4 является наиболее предпочтительным носителем лекарственного средства. Fc-домен, имеющий происхождение от человека, предпочтителен по сравнению с Fc-доменом, имеющим происхождение от источника, не являющегося человеком, поскольку последний может действовать в организме как антиген, индуцируя образование антител к нему.
Кроме того, константная область иммуноглобулина может быть представлена в форме, имеющей нативные углеводные цепи, увеличенные углеводные цепи по сравнению с нативной формой, или уменьшенные углеводные цепи по сравнению нативной формой, или может быть представлена в дегликозилированной форме. Увеличение, уменьшение или удаление углеводных цепей константной области иммуноглобулина может быть осуществлено способами, хорошо известными в данной области техники, такими как химический способ, ферментативный способ или генно-инженерный способ с использованием микроорганизма. В данном случае удаление углеводных цепей из константной области иммуноглобулина приводит к резкому снижению аффинности связывания с комплементом (c1q) и снижению или утрате антителозависимой клеточно-опосредованной цитотоксичности или комплементзависимой цитотоксичности, что позволяет избежать индукции ненужных иммунных ответов in-vivo. В этом отношении дегликозилированная константная область иммуноглобулина, полученная химическим или ферментативным удалением углеводной цепи, или агликозилированная константная область иммуноглобулина, полученная в прокариотах, предпочтительно в E. coli, может быть более подходящей для задачи настоящего изобретения в качестве носителя лекарственного средства.
Константная область иммуноглобулина по настоящему изобретению включает нативную аминокислотную последовательность и ее производные (мутанты). Производное аминокислотной последовательности представляет собой последовательность, отличающуюся от нативной аминокислотной последовательности делецией, вставкой, неконсервативной или консервативной заменой одного или более аминокислотных остатков или их комбинацией. Например, известно, что аминокислотные остатки в положениях 214-238, 297-299, 318-322 или 327-331 Fc IgG играют важную роль в связывании антител, и они могут быть использованы в качестве подходящей мишени для модификации. Кроме того, возможны различные производные, не имеющие остатка, образующего дисульфидную связь, или нескольких N-концевых остатков нативного Fc, или имеющие дополнительный метиониновый остаток на N-конце нативного Fc. Более того, эффекторные функции могут быть устранены удалением комплементсвязывающего мотива, например C1q-связывающего мотива, или мотива ADCC (антителозависимой клеточно-опосредованной цитотоксичности). Методики получения таких производных последовательности константной области иммуноглобулина раскрыты в публикациях международных заявок на патенты №№ WO 97/34631 и WO 96/32478.
В данной области техники известны аминокислотные замены в белках и пептидах, обычно не меняющие активность молекул (Н. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Наиболее типичны замены Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly.
По необходимости, возможна модификация аминокислот, такая как фосфорилирование, сульфатирование, акрилирование, гликозилирование, метилирование, фарнезилирование, ацетилирование, амидирование и так далее.
Указанные выше производные константной области представляют собой производные, обладающие биологической активностью, идентичной константной области по настоящему изобретению, и улучшенной структурной стабильностью, например, против нагревания, рН или тому подобного.
Кроме того, эти константные области иммуноглобулинов могут быть получены от человека или других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, предпочтительно от человека. Константная область, имеющая происхождение от человека, предпочтительна по сравнению с константной областью, имеющей происхождение от источника, не являющегося человеком, поскольку последняя может действовать в организме как антиген, индуцируя образование антител к ней.
Эти Fc-области могут быть получены из нативных форм, выделенных от людей и других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или могут представлять собой рекомбинантные области или их производные, полученные из трансформированных клеток животных или микроорганизмов. В данном случае они могут быть получены из нативного иммуноглобулина выделением полноразмерных иммуноглобулинов из организма человека или животных и их обработкой протеолитическим ферментом. Например, папаин расщепляет нативный иммуноглобулин на Fab- и Fc-области, а обработка пепсином приводит к получению pF'c- и F(ab)2-фрагментов. Эти фрагменты можно подвергнуть, например, гель-хроматографии для выделения Fc или pF'c.
В конкретном воплощении настоящего изобретения была использована агликозилированная Fc-область, имеющая происхождение от человеческого IgG4, представляющая собой рекомбинантную Fc-область иммуноглобулина, полученную из микроорганизма.
Непептидильный полимер по настоящему изобретению означает биологически совместимый полимер, содержащий две или более повторяющиеся единицы, связанные друг с другом любой ковалентной связью, за исключением пептидной связи.
Непептидильный полимер, который может быть использован в настоящем изобретении, может быть выбран из группы, состоящей из, без ограничения, полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированных полиолов, поливинилового спирта, полисахаридов, декстрана, поливинилэтилового эфира, биоразлагаемых полимеров, таких как PLA (полимолочная кислота) и PLGA (полимолочная-гликолевая кислота), липополимеров, хитинов, гиалуроновой кислоты и их комбинаций, предпочтительно полиэтиленгликоля. Кроме того, объем настоящего изобретения включает их производные, хорошо известные в данной области техники и легко получаемые специалистами в данной области техники.
Пептидный линкер, используемый в слитом белке, полученном обычным способом внутрирамочного слияния, имеет недостатки, заключающиеся в его легком расщеплении протеолитическим ферментом in vivo, что не позволяет носителю обеспечить достаточный ожидаемый эффект увеличения периода полувыведения активного лекарственного средства из крови. Тем не менее, в настоящем изобретении для поддержания периода полувыведения активного лекарственного средства из крови может быть использован непептидильный полимер, устойчивый к протеолитическому ферменту. Таким образом, непептидильный полимер может быть использован без каких-либо ограничений, при условии, что он устойчив к протеолитическому ферменту в организме. Предпочтительно, непептидильный полимер имеет молекулярную массу в диапазоне от 1 до 100 кДа и предпочтительно от 1 до 20 кДа. Кроме того, непептидильный полимер по настоящему изобретению может представлять собой один полимер или комбинацию полимеров разных типов.
Непептидильный полимер, используемый в настоящем изобретении, имеет реакционно-способную группу, способную связываться с константной областью иммуноглобулина и интерфероном-альфа, на обоих концах. Непептидильный полимер имеет реакционно-способную группу на обоих концах, которая может быть выбрана из группы, состоящей из альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы и сукцинимидного производного. Сукцинимидное производное может представлять собой сукцинимидилпропионат, сукцинимидилкарбоксиметил, гидроксисукцинимидил, сукцинимидилкарбоксиметил или сукцинимидилкарбонат.
Реакционно-способные группы на обоих концах непептидильного полимера могут быть одинаковыми или разными. Например, непептидный полимер может иметь малеимидную группу на одном конце и на другом конце, альдегидную группу, пропиональдегидную группу или бутиральдегидную группу.
В частности, когда непептидильный полимер имеет реакционно-способную альдегидную группу на обоих концах, он эффективно связывается на обоих концах с интерфероном-альфа и константной областью иммуноглобулина при минимальном неспецифичном взаимодействии. Конечный продукт, полученный восстановительным алкилированием через альдегидную связь, значительно стабильнее, чем при связывании амидной связью. Альдегидная реакционно-способная группа селективно связывается с N-концом при низком рН, и может связываться с лизиновым остатком с образованием ковалентной связи при высоком рН, таком как рН 9,0. Конъюгат интерферона-альфа по настоящему изобретению может предпочтительно представлять собой конъюгат, полученный специфичным связыванием непептидильного полимера с N-концом интерферона-альфа и связыванием непептидильного полимера с N-концевой аминогруппой или тиоловой группой интерферона-альфа. Авторы настоящего изобретения обнаружили, что активность интерферона-альфа повышена при связывании непептидильного полимера с N-концом интерферона-альфа. Получение N-концевого специфичного конъюгата проводят коррекцией рН, и предпочтительным диапазоном рН является диапазон от 4,5 до 7,5.
При использовании в качестве непептидильного полимера полиэтиленгликоля, имеющего реакционно-способную гидроксигруппу на обоих его концах, гидроксигруппа может быть активирована с получением различных реакционно-способных групп известными химическими реакциями, или может быть использован полиэтиленгликоль, имеющий коммерчески доступную модифицированную реакционно-способную группу.
Конъюгат интерферона-альфа по настоящему изобретению имеет форму конъюгата, полученного связыванием белка интерферона-альфа и константной области иммуноглобулина через непептидильный полимер, и эффективно поддерживает устойчивость и стабильность in vivo. Константная область иммуноглобулина достаточно стабильна для использования в качестве носителя лекарственного средства, поскольку она представляет собой биоразлагаемый полипептид, метаболизируемый in vivo. Кроме того, благодаря относительно небольшой молекулярной массе, константная область иммуноглобулина имеет преимущества по сравнению с полноразмерными молекулами иммуноглобулинов относительно получения, очистки и выхода конъюгата. Более того, поскольку она свободна от Fab, аминокислотная последовательность которого сильно варьирует от одного антитела к другому, она в значительной степени способствует однородности конъюгата и, предположительно, позволит уменьшить индукцию антигенности.
Конъюгат интерферона-альфа по настоящему изобретению имеет увеличенный период полувыведения in vivo и высокую противораковую активность по сравнению с нативным интерфероном-альфа. При введении конъюгат интерферона-альфа по настоящему изобретению связывается с рецептором интерферона-альфа, индуцируя апоптоз раковых клеток, приводя к уменьшению размера опухоли и ингибированию роста опухоли. Поэтому фармацевтическая композиция, содержащая интерферон-альфа или его конъюгат, может быть использована для предупреждения или лечения рака.
При использовании здесь термин «предупреждение» означает все действия, позволяющие ограничить или замедлить развитие рака путем введения композиции по настоящему изобретению, и термин «лечение» означает все действия, позволяющие облегчить или благоприятным образом изменить симптомы рака путем введения композиции по настоящему изобретению.
В одном конкретном воплощении настоящего изобретения, было проведено исследование антипролиферативной эффективности in vitro у клеточных линий лимфомы Ходжкина человека, клеток Дауди, и результат продемонстрировал, что конъюгат интерферона-альфа по настоящему изобретению оказывает сильные ингибирующие эффекты на пролиферацию раковых клеток по сравнению с нативным интерфероном-альфа (Таблица 1, ФИГ. 1). В одном конкретном воплощении настоящего изобретения, конъюгат интерферона-альфа по настоящему изобретению вводили бестимусной мыши, которой была проведена подкожная трансплантация клеточной линии рака яичника человека (SK-OV-3), после чего анализировали изменения размера опухоли. Результат продемонстрировал отсутствие изменений размера опухоли по сравнению с отрицательным контролем, нативным интерфероном-альфа и PEG-модифицированным интерфероном-альфа (Таблица 2, ФИГ. 2).
Кроме того, конъюгат интерферона-альфа по настоящему изобретению может демонстрировать высокую противораковую активность при совместном введении с противораковым агентом, выбранным из ингибитора Ras, ингибитора Raf, ингибитора MEK и ингибитора MAPK, предпочтительно гемцитабина или сорафениба (ингибитора Raf).
«Ингибитор Ras» по настоящему изобретению относится к соединениям, оказывающим направленное воздействие, снижающим или ингибирующим онкогенную активность Ras (включая H-Ras, K-Ras или N-Ras), например, ингибитору фарнезилтрансферазы, например, L-744832, DK8G557 или R115777 (Zarnestra).
«Ингибитор Raf» по настоящему изобретению относится к соединениям, оказывающим направленное воздействие, снижающим или ингибирующим Raf-киназу, играющую важную роль в качестве внеклеточной сигнальной регуляторной киназы при дифференцировке, пролиферации и апоптозе клеток, и мишень ингибитора Raf может включать, без ограничения, RAF1. Например, он может включать 3-(3,5-дибром-4-гидроксибензилиден)-5-йод-1,3-дигидроиндол-2-он; и бензамид, 3-(диметиламино)-N-[3-[(4-гидроксибензоил)амино]-4-метилфенил]-(9Cl).
«Ингибитор MEK» по настоящему изобретению относится к соединениям, оказывающим направленное воздействие, снижающим или ингибирующим киназную активность МАР-киназы, MEK и мишень ингибитора MEK могут включать, без ограничения, ERK и циклин D1. Примеры ингибитора MEK могут включать, без ограничения, бутандинитрил, бис[амино[2-аминофенил)тио]метилен]-(9Cl).
«Ингибитор МАРК» по настоящему изобретению относится к соединениям, оказывающим направленное воздействие, снижающим или ингибирующим MAP. МАР-киназы (MAPK) являются группой белков сериновых/треониновых киназ, активируемых в ответ на множество внеклеточных стимулов и опосредующих трансдукцию сигнала с поверхности клетки в ядро. Они регулируют ряд физиологических и патологических клеточных феноменов, включая воспаление, апоптотическую гибель клеток, онкогенную трансформацию, инвазию опухолевых клеток и метастазирование. Примеры ингибитора MAPK могут включать, без ограничения, бензолсульфонамид, N-[2-[[[3-(4-хлорфенил)-2-профенил]метил]амино]метил]-фенил]-N-(2-гидроксиэтил)-4-метокси-(9Cl).
Гемцитабин по настоящему изобретению представляет собой соединение, имеющее общее название 2'-дезокси-2',2'-дифторцитидин, является вицинальным дифторзамещенным аналогом дезоксицитидина и может включать его моногидрохлорид и β-изомер. Гемцитабин активирует RKIP (белок, ингибирующий Raf-киназу) и действует как ингибитор Raf. Традиционно полагают, что гемцитабин является лекарственным средством, демонстрирующим наиболее высокую клиническую активность при лечении рака поджелудочной железы. Тем не менее, гемцитабин обладает токсичностью, возникающей из-за недостатка специфичности между раковыми клетками и быстро делящимися нормальными клетками и предсуществующей или приобретенной резистентности большинства опухолевых клеток, и поэтому он не приводит к существенному улучшению состояния при раке поджелудочной железы. Также были предприняты попытки комбинир