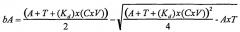Способы скрининга и их применения
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии и касается способа выделения антилиганда, представляющего собой антитело или его антигенсвязывающий вариант, производное или фрагмент, каркасную молекулу со сконструированными вариабельными поверхностями; рецептор или фермент, к дифференциально-экспрессирующемуся целевому лиганду. Представленный способ включает стадии: (а) выполнение дифференциального биопэннинга на библиотеке антилигандов с тем, чтобы выделить по меньшей мере один антилиганд; (b) выполнение секвенирования с высокой пропускной способностью на антилигандах, выделенных на стадии (а), и (c) выполнения подтверждающего скрининга на специфичность к антилиганду для дифференциально-экспрессирующегося лиганда. Представленное изобретение позволяет проводить скрининг библиотек антилигандов для идентификации антилигандов, специфичных для дифференциально и/или не часто экспрессирующихся лигандов. 17 з.п. ф-лы, 9 ил., 4 табл., 8 пр.
Реферат
Настоящее изобретение относится к улучшенным способам скрининга и, в частности, к способам скрининга библиотек антилигандов для идентификации антилигандов, специфичных для дифференциально и/или нечасто экспрессирующихся лигандов.
Библиотеки на основе белков или пептидов часто используются для селекции молекул антилигандов со специфичностью к определенным лигандам.
Такие библиотеки сконструированы таким образом, что молекула белка каким-то образом оказывается физически сопряженной с молекулой, содержащей генетическую информацию, кодирующую эту определенную белковую молекулу. Белковая молекула, таким образом, оказывается представлена вместе с кодирующим ее геном.
Обычно используемые форматы дисплеев основаны на клеточных или вирусных частицах-хозяевах, использующихся для представления белковой молекулы, и включают в себя бактериальный дисплей (Francisco et al., 1993) и фаговый дисплей (Smith, 1985; Smith and Scott, 1993; Winter et al.,). Такие системы экспонируют потенциальный антилиганд на поверхности частицы-хозяина, в то время как генетическая информация для отображаемой молекулы спрятана внутри частицы, и упомянутые способы были успешно использованы для селекции специфических антилигандов на белковой основе.
Существуют другие форматы дисплеев, основанные на системах трансляции in vitro; включая различные формы рибосомных дисплеев (Mattheakis et al., 1994; Hanes and Pluckthun, 1997; He and Taussig, 1997)), которые основаны на нековалентном связывании содержащей генетическую информацию молекулы с белковой молекулой, а также другие форматы дисплеев, также основанные на системах трансляции in vitro, причем молекула, содержащая генетическую информацию, связана ковалентной связью с белковой молекулой потенциального антилиганда, например Profusion (Weng et al., 2002) или Covalent Display Technology (Gao et al., 1997).
Библиотеки экспонируемых пептидных или белковых антилигандов могут быть полностью рандомизированными, например, когда используются пептидные библиотеки, или они могут быть основаны на каркасной (скаффолд, scaffold) структуре постоянной области и включать в себя дополнительную структуру, придающую изменчивость.
Часто используемые каркасные структуры имеют в основе на вариабельных доменах тяжелой и легкой цепей антител (McCafferty et al., 1990), но могут также иметь в основе и другие скаффолды, такие как фибронектин (Jacobsson and Frykberg, 1995; Koide et al., 1998), домены белка A (Stahl et al., 1989) или небольшие стабильные белковые домены, например, BPTI (Markland et al., 1991) 1991).
Селекция антилигандов, демонстрирующих определенную специфичность связывания, из библиотек дисплеев, часто осуществляется с помощью способов так называемого «биопэннинга».
Целевой лиганд может быть иммобилизован на твердой поверхности, и специфические антилиганды из библиотеки подвергают воздействию иммобилизованного целевого лиганда, чтобы дать возможность антилигандам, представляющим интерес, связаться с целевым лигандом. Не связавшиеся элементы библиотеки впоследствии смывают, а антилиганды, представляющие интерес, извлекают и амплифицируют.
Белковые частицы, иные чем элементы библиотеки антилигандов, например, экспрессируемые фагом фрагменты антител, могут «прилипать», приводя к связыванию и выделению некоторых нецелевых специфических молекул. Неспецифическое связывание может быть сведено к минимуму добавлением некоторых соединений, например, молока, бычьего сывороточного альбумина, сыворотки (человеческой/фетальной телячьей), желатина и для некоторых (не клеточных) приложений, детергента, к конструкции дисплея антилигандов/смеси лигандов для того, чтобы служить в качестве блокирующих агентов с целью уменьшения такого фонового связывания неспецифических антилигандов.
Был разработан ряд процедур промывки, чтобы уменьшить неспецифическое связывание входящих в библиотеку антилигандов с клетками и помочь отделению клеток от загрязняющих и/или неспецифически связавшихся элементов библиотеки.
Такие способы включают в себя промывку клеток, фиксированных магнитным образом на колонке (Siegel et al., 1997), с тем чтобы свести к минимуму сдвигающие воздействия и позволить повторное связывание диссоциированного фага. Другой способ промывки клеток заключается в центрифугировании в среде более высокой плотности, такой как Ficoll или Percoll, чтобы селективно удалить неспецифические антилиганды и антилиганды с низкой аффинностью и дополнительно пространственно отделить клетки и связанные с клетками антилиганды от свободных антилигандов и неспецифически связавшихся антилигандов (Carlsson et al., 1988; Williams and Sharon, 2002).
В зависимости от эффективности процесса селекции может потребоваться несколько раундов пэннинга, чтобы устранить или, по меньшей мере, значительно уменьшить содержание неспецифически связавшихся антилигандов до желаемого уровня (Dower et al., 1991).
В другом способе селекции целевой лиганд(ы) связывается со специфическими элементами библиотеки антилигандов, находясь в растворе. Связавшиеся антилиганды затем выделяют с использованием, например, извлекаемого тега, прикрепленного к целевому лиганду. Наиболее широко используемый тег представляет собой биотин, что позволяет извлечь комплекс между целевой молекулой и отображаемым специфическим элементом библиотеки с использованием авидина, соединенного с твердой подложкой, например, магнитным шариком (Siegel et al., 1997).
Данные способы используются, когда целевой лиганд хорошо известен и доступен в очищенной форме. Селекции по одному целевому лиганду за один раз являются обычными. Селекция по нескольким заданным целевым лигандам может быть выполнена одновременно. Целевые лиганды могут представлять собой один или несколько из небольших гаптенов, белков, углеводов, ДНК и липидов.
Специфические антилиганды против дифференциально экспрессирующихся лигандов представляют интерес для многих приложений. Например, белки могут по-разному экспрессироваться на клетках и тканях, происходящих от пациентов с болезнью, по сравнению с таковыми, полученными в качестве контролей от здоровых людей. К таким заболеваниям относятся микробные, вирусные или паразитарные инфекции, астма, хронические воспалительные и аутоиммунные расстройства, рак, неврологические, сердечно-сосудистые или желудочно-кишечные заболевания. Сходным образом, белковый состав жидкостей организма, например, плазмы, спинномозговой жидкости, мочи, спермы, слюны и слизи, может отличаться у пациентов с болезнью по сравнению с контрольной здоровой группой.
Следовательно, помимо их общей применимости в качестве исследовательских инструментов для идентификации дифференциально экспрессирующихся лигандов, антилиганды, специфичные для дифференциально экспрессирующихся лигандов, могут быть использованы в качестве инструментов для применения в диагностике, профилактике и/или лечении заболевания.
Последние достижения в областях геномики и протеомики указали на наличие множества еще не определенных дифференциально экспрессирующихся молекул, что подчеркивает важность способов генерации специфических антилигандов для таких потенциальных целевых лигандов.
Ожидается, что многие из таких дифференциально экспрессирующихся молекул присутствуют на клеточных поверхностях и, тем самым, представляют собой потенциальные мишени для целевых терапий с использованием, например, специфических антител, которые могут быть конъюгированы с биоактивными (например, цитотоксическими) агентами.
Большие и высокодиверсифицированные библиотеки дисплеев антилигандов предоставляют способы выделения антилигандов со специфичностью к неизвестным клеточным лигандам углеводного, белкового, липидного или объединенного происхождения.
Способы биопэннинга, имеющиеся в настоящее время, включают в себя способы, основанные на целых клетках, участках клеток и клеточной мембране, что, в принципе, позволяет выделить конструкции дисплеев, экспонирующие антилиганды, специфические к лигандам на клеточных мембранах в их нативной конфигурации.
Человеческие и гуманизированные терапевтические антитела все чаще используется для лечения различных заболеваний, включая острые и хронические воспалительные заболевания, иммунологические нарушения и расстройства центральной нервной системы и рак. Человеческие терапевтические антитела считаются наиболее привлекательными формами для лечения заболеваний человека в силу их полностью человеческой природы и связанного с этим отсутствия иммуногенности, оптимальной способности осуществлять эффекторные механизмы иммунного ответа хозяина, опосредованные Fc-фрагментом антител, и длительного in vivo времени полураспада по сравнению с их мышиными, химерными и гуманизированными дубликатами. На сегодняшний день человеческие антитела получают рутинным образом различными технологиями, включающими библиотеки антител гуманизированных мышей и высоко диверсифицированные фаговые библиотеки антител.
Большие (более 105 уникальных клонов антител) библиотеки человеческих антител являются достаточно диверсифицированными, чтобы содержать высокоаффинные антитела, специфические к значительному числу антигенов, включая практически все виды аутоантигенов. Аутоантигены представляют собой антигены, которые, несмотря на то, что они являются составляющей нормальной ткани, служат мишенью гуморального или клеточного иммунного ответа, как и в аутоиммунном заболевании, и представляют категорию антигена, вызывающего особый терапевтический интерес.
Дополнительно полагают, что библиотеки человеческих антител обеспечивают преимущества по сравнению с трансгенными мышами, несущими гены человеческого иммуноглобулина, при селекции на антитела, которые связываются с рецепторными эпитопами, которые являются структурно консервативными у человека и мыши, поскольку данная категория антител отрицательно селектирована в in vivo условиях механизмами аутотолерантности. Такие консервативные области вызывают особый терапевтический интерес, поскольку консервативные области являются часто функционально связанными (например, лиганд-связывающие домены, необходимые для связывания и присвоения индуцированных лигандом/рецептором клеточных ответов), и антитела, нацеленные на такие консервативные эпигоны, могут быть подвергнуты скринингу на in vivo терапевтическую активность в сингенных системах экспериментальной модели болезни.
Высокоаффинные антитела, специфичные для практически всех видов растворимых антигенов человека (таких как цитокины, хемокины, факторы роста, липиды, углеводы и конъюгированные молекулы и т.д.), а также рецепторов клеточной поверхности (например, охватывающие рецепторы 1ТМ, 4ТМ, 7ТМ и мульти-ТМ и т.д.) были успешно выделены из высокодиверсифицированных библиотек человеческих антител.
Рецепторы клеточной поверхности составляют одну категорию мишеней, вызывающих особый терапевтический интерес, и несколько антител, которые связываются с рецепторами, ассоциированными с различными раковыми клетками, были одобрены для лечения рака, включая ритуксимаб (анти-CD20), трастузумаб (анти-Her2) и цетуксимаб (анти-EGFR).
Однако терапевтическая эффективность не так легко предсказывается, исходя из специфичности антител к рецепторам; антитела к одному и тому же целевому рецептору могут значительно различаться по терапевтической эффективности независимо от их связывающей аффинности (Beers et al., 2008; Cragg and Glermie, 2004), и антитела против альтернативных молекулярных мишеней могут проявить перспективный, а иногда неожиданно терапевтический потенциал (Beck et al., 2010; Cheson and Leonard, 2008). Например, различные клоны специфических антител CD20, которые связываются со сходной аффинностью к антигену CD20 и несут константные области, идентичные мышиному IgG2a, принципиально отличаются в способности истощать В-клетки in vivo (Beers et al., 2008; Cragg and Glennie, 2004), и антитела против других опухолеассоциированных рецепторов клеточной поверхности, отличные от CD20, могут обладать значительной противоопухолевой активностью против раковых В-клеток (для обзора см. (Cheson and Leonard, 2008)).
Таким образом, в высокодиверсифицированной библиотеке антител наиболее терапевтически эффективные, сильнодействующие и наиболее переносимые антитела по отношению к любому данному типу рака, вероятно, являются специфичными для любого из нескольких различных рецепторов, и для определения клонов терапевтически оптимальных антител в высоко диверсифицированной библиотеке требуется функциональный скрининг многих, а в идеале всех, элементов библиотеки, которые являются специфичными для различных рецепторов, связанных с больными клетками.
Ранее заявитель разработал технологию скрининга (способ биопэннинга), позволяющую выявлять клоны связывающихся с различными поверхностными рецепторами антител, которые дифференциально экспрессируются на одной клеточной популяции (целевые клетки) по сравнению с другой (нецелевые клетки) из фаговых библиотек человеческих антител (WO 2004/023140, Fransson et al., 2006; Frendeus, 2006) (далее упоминается как дифференциальный биопэннинг). Раскрытие заявки WO 2004/023140 (и все национальные заявки, вытекающие из нее) включено в данный документ посредством ссылки в полном объеме.
Данный способ скрининга состоит из по существу шести стадий, как указано на фигуре 1. Важно отметить, что данный способ содержит стадии скрининга в следующем порядке:
1) дифференциальный биопэннинг с последующим
2) скринингом на мишень в сравнении с нецелевой специфичностью, после чего следует
3) обычное секвенирование способом Sanger меньшего числа клонов.
Используя данную технологию, было возможно генерировать пул антител, которые показали высокую специфичность для дифференциально экспрессирующихся поверхностных рецепторов целевых клеток в сравнении с дифференциально экспрессирующимися поверхностными рецепторами нецелевых клеток.
Секвенирование способом Sanger представляет собой пример способа, который в настоящее время используется для идентификации уникальных «связывателей» (binders) в режиме «низкой пропускающей способности» («low throughput»). Другие примеры включают в себя прогон ДНК генов антител в гелях до и после расщепления ферментами рестрикции для выявления уникальных размеров и, через различную чувствительность к различным ферментам рестрикции, непрямым путем, различных последовательностей.
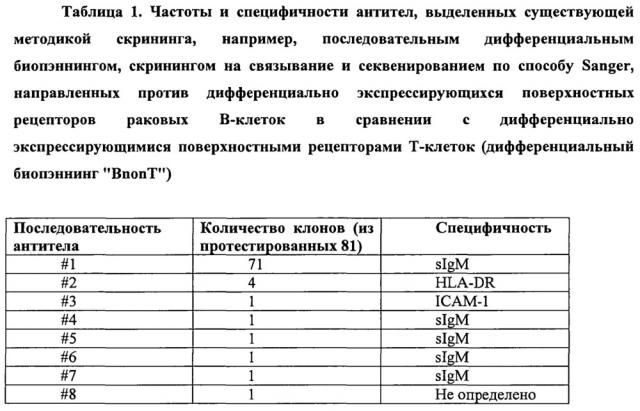
Когда данный способ применили для выделения антител, направленных против дифференциально экспрессирующихся поверхностных рецепторов раковых В-клеток (целевые) в сравнении с дифференциально экспрессирующимися поверхностными рецепторами Т-клеток (нецелевые) (дифференциальный биопэннинг «BnonT»), то были идентифицированы антитела, специфичные для различных дифференциально экспрессирующихся поверхностных рецепторов клеток-мишеней, включая HLA-DR, поверхностный Ig и ICAM-1 (таблица 1).
Однако, все целевые рецепторы экспрессировались на относительно высоком уровне (от 50000 до 400000 рецепторов на клетку), и число уникальных последовательностей антител, определенных (скринировано 8 из 81) данным способом, было ограничено.
В то время как было секвенировано лишь ограниченное количество клонов, специфичных для дифференциально экспрессирующихся поверхностных рецепторов целевых клеток, высокая частота одного клона антитела указывала на ограниченное разнообразие антител в пуле антител, извлеченном способом «BnonT». Таким образом, в то время как данный способ обеспечил значительное улучшение по сравнению с предыдущими способами пэннинга, основанными на клеточном подходе, в том смысле, что способом ограниченного скрининга (limited screening) (Fransson et al., 2006) были идентифицированы антитела с терапевтическим потенциалом к нескольким различным дифференциально экспрессирующимся рецепторам, данное наблюдение показало, что требуются дополнительные улучшения, поскольку, в соответствии с преобладающей общей точкой зрения, пэннинг только генерировал пул антител ограниченного разнообразия, состоящий из антител против относительно высокоэкспрессирующихся и строго дифференциально экспрессирующихся поверхностных рецепторов (Hoogenboom, 2002) (Liu et al., 2004; Mutubema et al., 1999; Osboum et al., 1998).
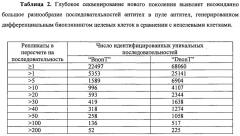
Расчеты in silico, выполненные, как описано в более раннем способе биопэннинга (WO 2004/023140 и Frendeus, 2006), выявили, что пул дифференциально селектированных антител «BnonT» должен содержать гораздо большее количество антител против каждого из нескольких дифференциально экспрессирующихся поверхностных рецепторов (фигура 2).
Возможности секвенирования того времени делали секвенирование значительно большего числа клонов антител в пуле крайне тяжелым (практически невозможным), поэтому гипотеза о том, что пул дифференциально селектированных антител должен быть гораздо более диверсифицированным, чем явствует из начальных скринингов, была проверена с использованием непрямого подхода. Таким образом, используя иммуногранулы, конъюгированные с рекомбинантным белком ICAM-1 (ICAM-1 представляет собой рецептор клеточной поверхности и является мишенью для одного клона антител из первоначально 81 секвенированных клонов в пуле дифференциально селектированных антител из таблицы 1), пул антитела, дифференциально селектированного способом «BnonT», был проверен на наличие дополнительных клонов антител, специфичных для ICAM-1. Скрининг выявленных 1260 клонов антител, с последующим пэннингом пула дифференциально селектированных антител против рекомбинантного ICAM-1, идентифицировал двадцать одну (21) дополнительные последовательности/клоны антител, специфичных для ICAM-1.
Данные наблюдения показали, что первоначальным способом дифференциального биопэннинга было возможно идентифицировать клоны антител к дифференциально экспрессирующимся антигенам, но пул дифференциально селектированных антител был гораздо более диверсифицированным, чем явствует из таких первоначальных скриннингов, а также значительно больше, чем если бы это было определено традиционными подходами скрининга.
В настоящее время заявитель разработал способ повышения точности способа дифференциального биопэннинга для обнаружения множества различных антилигандов к лиганду, представляющему интерес. Таким образом, настоящее изобретение описывает методику, позволяющую извлекать из библиотеки человеческих антител (и других молекулярных библиотек) пул высокоаффинных антилигандов, таких как человеческие антитела, которые являются специфичными для различных лигандов (например, рецепторов), дифференциально экспрессирующихся в нативной конфигурации, которую они имеют на поверхности клеток, с уровнями экспрессии от низкого до высокого в популяции целевых клеток, по сравнению с другой клеточной популяцией(ми).
Настоящее изобретение отличается от ранее разработанных методик скрининга в нескольких отношениях (фигура 8). Во-первых, объединяя уникально мощную методику дифференциального биопэннинга с глубоким секвенированием (deep sequencing) нового поколения и последующим подтверждающим скринингом в отношении специфичности антитела для дифференциально экспрессирующихся поверхностных рецепторов целевых клеток – «обратным скринингом», настоящее изобретение позволяет получать пул антител, который является 1) качественно и 2) количественно уникальным.
Важно отметить, что антилиганды, такие как клоны антител, идентифицированные с помощью такого подхода, могут все иметь терапевтический потенциал, основанный, во-первых, на их высокоаффинном связывании с рецепторами, которые a) дифференциально экспрессируются на целевых клетках по сравнению с нецелевыми клетками и b) экспрессируются на целевых клетках в нативной конфигурации, которую они имеют на поверхности клеток, и, во-вторых, на задокументированной способности антител с данными свойствами опосредовать терапевтические эффекты в соответствующих in vitro и in vivo системах экспериментальных моделей болезни (Beck et al., 2010; Fransson et al., 2006).
Таким образом, следовательно, настоящее изобретение позволяет:
1. Генерацию дифференциальным биопэннингом пула антител, содержащего антитела, специфические к дифференциально экспрессирующимся поверхностным рецепторам, экспрессируемым на высоком, промежуточном и низком уровнях.
2. Существование более низкого порогового значения для числа клонов секвенированных антител, которое должно быть превышено в целях выявления антител, специфичных для поверхностных рецепторов, экспрессирующихся на промежуточном и низком уровне.
3. Секвенирование увеличивающего числа клонов антител, превышающего данное более низкое пороговое значение, увеличивает количество выявленных антител, специфичных для поверхностных рецепторов, экспрессирующихся на промежуточном и низком уровне.
4. Комплексную идентификацию антител, специфичных для поверхностных рецепторов, экспрессирующихся на промежуточном и низком уровне, в пуле дифференциально экспрессирующихся антител, которая требует глубокого секвенирования.
Таким образом, первый объект настоящего изобретения относится к способу выделения по меньшей мере одного антилиганда к по меньшей мере одному дифференциально экспрессирующемуся целевому лиганду, содержащему следующие стадии:
(a) выполнение дифференциального биопэннинга на библиотеке антилигандов с тем, чтобы выделить по меньшей мере один антилиганд; и
(b) выполнение секвенирования с высокой пропускной способностью на антилигандах, выделенных на стадии (a).
Данный способ может дополнительно содержать стадию:
(c) выполнения подтверждающего скрининга на специфичность антитела для дифференциально экспрессирующегося лиганда.
Стадия дифференциального биопэннинга способа по изобретению может содержать подстадии:
(i) получение библиотеки антилигандов;
(ii) получение первой популяции лигандов, содержащей лиганд, фиксированный к или встроенный в конструкцию субтрактивного лиганда;
(iii) получение второй популяции лигандов, содержащей тот же лиганд со стадии (ii), фиксированный к или встроенный в конструкцию целевого лиганда;
(iv) определение количества конструкций субтрактивного лиганда и конструкций целевого лиганда в популяциях с использованием одного или более уравнений, полученных из всеобщего закона действующих масс ,
где:
A, B, C&D=представляют собой участники реакции (реагенты и продукты)
a, b, c&d=представляют собой коэффициенты, необходимые для сбалансированного химического уравнения
так, чтобы обеспечить выделение антилиганда к дифференциально экспрессирующемуся целевому лиганду;
(v) предоставление конструкции субтрактивного лиганда в количестве, как определено на стадии (iv);
(vi) предоставление конструкции целевого лиганда в количестве, как определено на стадии (iv);
(vii) предоставление средств разделения для отделения антилиганда, связанного с конструкцией целевого лиганда, от антилиганда, связанного с конструкцией субтрактивного лиганда;
(viii) подвергание библиотеки (i) воздействию конструкций лигандов, являющихся продуктами стадий (v) и (vi), с тем, чтобы сделать возможным связывание антилигандов с лигандами; и
(ix) использование средств разделения для выделения антилиганда, связавшегося с лигандом, фиксированным к или включенным в конструкцию целевого лиганда.
Не предполагается, что стадии по изобретению обязательно должны быть выполнены в любом определенном порядке.
Под «предоставлением определенного количества» авторы понимают предоставление количества лиганда, которое уже было известно, так что уравнения по изобретению были использованы для проверки того, что предоставляемое известное количество является подходящим для выделения желаемого антилиганда(ов).
Параметры реакции, которые используются для данного способа селекции, могут быть оптимизированы в соответствии с настоящим изобретением расчетами, применяющими закон действующих масс и уравнения, полученные из него, а также с учетом таких параметров как разнообразие молекулярной библиотеки, число копий антилиганда, желаемый предел обнаружения позитивной регуляции, аффинность желаемого антилиганда и концентрация лиганда.
Стадия секвенирования с высокой пропускной способностью способа по первому объекту изобретения может проводиться секвенированием 454 (454 sequencing), Illumina, способами SOLiD, системой Helicos system или таковыми от Complete Genomics и Pacific Biosciences.
Появление секвенирования нового поколения («next generation sequencing») позволило проводить секвенирование большого числа (от 1000 до 1000000) генов-кандидатов в режиме высокой пропускной способности (здесь и далее упоминается как «глубокое секвенирование»).
Способ секвенирования 454 описан (и включен в настоящее описание посредством ссылки) у Margulies et al. (2005). При способе 454 ДНК, подлежащая секвенированию, либо фракционируется и снабжается адаптерами, либо сегменты ДНК могут быть амплифицированы посредством ПЦР с использованием праймеров, содержащих адаптеры. Адаптеры представляют собой последовательности из 25 нуклеотидов, необходимые для связывания с шариками DNA Capture Beads и для отжига эмульсии PCR Amplification Primers и Sequencing Primer. Фрагменты ДНК делают одноцепочечными и прикрепляют к шарикам захвата ДНК (DNA Capture Beads) таким образом, чтобы к одному шарику был присоединен только один фрагмент ДНК. Далее шарики, содержащие ДНК, эмульгируют в смеси вода-в-масле, в результате чего получаются «микрореакторы», содержащие только один шарик.
Фрагмент ПЦР-амплифицируется внутри микрореактора, в результате чего число копий достигает нескольких миллионов на шарик. После выполнения ПЦР эмульсию разрушают и шарики загружают в пико-титровальный планшет (pico titer plate). Каждая лунка пико-титровального планшета может содержать только один шарик. В лунки добавляют секвенирующие ферменты и нуклеотиды пропускают через лунки в определенном порядке. Встраивание нуклеотида приводит к высвобождению пирофосфата, который катализирует реакцию, приводящую к появлению хемилюминесцентного сигнала. Данный сигнал регистрируется с помощью ПЗС(ССВ)-камеры, и программное обеспечение используется для перевода сигналов в последовательность ДНК.
При способе Illumina (Bentley (2008)) одноцепочечные, снабженные адаптерами фрагменты прикрепляют к оптически прозрачной поверхности и подвергают «мостовой амплификации» (bridge amplification). Данная процедура приводит к появлению нескольких миллионов кластеров, каждый из которых содержит копии уникального фрагмента ДНК. Добавляют ДНК-полимеразу, праймеры и четыре меченых нуклеотида, представляющих собой обратимые терминаторы, и поверхность визуализируется с помощью лазерной флуоресценции для определения местоположения и характера меток. Защитные группы затем удаляют и способ повторяют в течение нескольких циклов.
Способ SOLiD (Shendure (2005)) аналогичен способу 454 sequencing, фрагменты ДНК амплифицируются на поверхности шариков. Секвенирование включает в себя циклы лигирования и обнаружения меченых зондов.
В настоящее время разрабатываются несколько других способов для секвенирования с высокой пропускной способностью. Примерами таких способов являются Helicos system (Харрис (2008)), Complete Genomics (Drmanac (2010)) и Pacific Biosciences (Lundquist (2008)). Поскольку это чрезвычайно быстро развивающаяся техническая область, возможность приложения к настоящему изобретению способов секвенирования с высокой пропускной способностью будет очевидна для специалиста в данной области техники.
В то время как приборы, способные секвенировать длинные участки ДНК, такие как участки, кодирующие последовательности вариабельных доменов антител (Fv), scFv или Fab, находятся только на стадии прототипа, имеющиеся в настоящее время приборы в действительности позволяют проводить секвенирование более коротких участков ДНК, таких как последовательности, кодирующие и охватывающие от CDRH1- до CDRH3-домены scFv. Однако, поскольку технология секвенирования улучшается с тем, чтобы позволить секвенирование длинных участков ДНК, данные способы будут также хорошо работать в способах по изобретению.
Стадия подтверждающего скрининга способа по изобретению может проводиться детектированием специфического лигандного связывания выделенного пула антилигандов и/или отдельных клонов антилигандов с целевой конструкцией в сравнении с субтрактивной конструкцией с помощью любого анализа, предназначенного для детектирования связывания лиганд/антилиганд, такого как проточная цитометрия (Flow-cytometry), FMAT (Fluorescent Microvolumetric Assay Technology), твердофазный иммуноферментный анализ ELISA (Enzyme-linked immunosorbent assay), MSD (Meso Scale Discovery) and CBA (Cytometric Bead Array).
В одном варианте осуществления лиганд по настоящему способу не экспрессируется как на целевой конструкции так и на субтрактивной конструкции, т.е. он экспрессируется либо на целевой конструкции, либо на субтрактивной конструкции.
В другом варианте осуществления лиганд по настоящему способу экспрессируется на более высоких уровнях как на целевой конструкции, так и на субтрактивной конструкции.
Способ дифференциального биопэннинга может содержать дополнительную подстадию высвобождения антилиганда от лиганда.
Предпочтительно, стадии от (ii) до (ix) стадии дифференциального биопэннинга проводят параллельно, чтобы выделить множество антилигандов к множеству различных лигандов.
Стадии от (ii) до (ix) стадии дифференциального биопэннинга повторяют один или более раз.
Предпочтительно, количество одной субтрактивной конструкции или целевой конструкции на стадии дифференциального биопэннинга предоставляется в избытке по сравнению с количеством другой субтрактивной конструкции или целевой конструкции. Превышение лиганда может составлять от 10 до 1000 раз, но также может составлять от 2 до 10 раз, или 1000 и 100000 раз.
Степень избытка популяции субтрактивных лигандов определяет максимально возможное «разрешение» (то есть, насколько хорошо вы сможете различить антилиганды со специфичностью для лигандов, активность которых позитивно регулируется на низком уровне, на умеренном уровне, на высоком уровне, или которые являются уникально экспрессирующимися), которое вы сможете детектировать, и насколько хорошо вы сможете различать дифференциально экспрессирующиеся лиганды. Например, если вы используете библиотеку со 100 антилигандами, специфическими к целевым лигандам, и вы добавляете достаточно большие концентрации позитивного лиганда, так что весь антилиганд будет связан с лигандом в равновесных условиях, то 10-кратный избыток популяции субтрактивных лигандов позволит вам уменьшить частоту антилигандов со специфичностью к обычно экспрессирующимся лигандам на 90%, в то время как 200-кратный избыток (удвоенное количество специфических связывателей антилигандов) позволит вам удалить общие связыватели (см. WO 2004/023140, фигура 5 и самый последний абзац примера 4 для данных, показывающих это).
В одном варианте осуществления уравнение на стадии (iv) стадии дифференциального биопэннинга представляет собой:
где
bA представляет собой связанный антилиганд (Bound anti-ligand)
А представляет собой общее число антилиганда
T представляет собой общее число лигандов
C представляет собой постоянную Авогадро (6,022×1023 частиц/моль)
V представляет собой реакционный объем (литры)
Kd представляет собой равновесную константу диссоциации
И в альтернативном варианте осуществления уравнение на стадии (iv) стадии дифференциального биопэннинга представляет собой:
где
bAp представляет собой связанный антилиганд (Bound anti-ligand)
Tp представляет собой число лигандов на Cp
Ts представляет собой число лигандов на Cs
Cp представляет собой число конструкций целевых лигандов
Cs представляет собой число конструкций субтрактивных лигандов
A представляет собой общее число антилиганда
T представляет собой общее число лигандов
C представляет собой постоянную Авогадро (6,022×1023 частиц/моль)
V представляет собой реакционный объем (литры)
Kd представляет собой равновесную константу диссоциации
Средство разделения со стадии дифференциального биопэннинга может быть выбрано из по меньшей мере одного из твердой подложки, клеточной мембраны и/или ее участков, синтетической мембраны, шариков, химических меток (тегов) и свободного лиганда. Средство разделения субтрактивных и целевых конструкций может иметь различную плотность. Средство отделения субтрактивной конструкции может представлять собой предпочтительно мембранную везикулу или мембрану целой клетки.
Стадия (ix) способа дифференциального биопэннинга может быть выполнена по меньшей мере одним из способов разделения, причем данный способ представляет собой одно из: плотностное центрифугирование (Williams and Sharon, 2002), секвестрация на твердой подложке, секвестрация на магнитном шарике (Siegel et al., 1997), связывание через химическую метку (тег) и разделение в водной фазе.
Более предпочтительно, способ разделения представляет собой плотностное центрифугирование, проводимое в градиенте плотности, например, Ficoll; Percoll; йодированной градиентной среды, где во время центрифугирования первый и второй целевые лиганды перемещаются в разной степени через градиент Ficoll, в результате чего первый и второй целевые лиганды могут быть выделены из их различных конечных точек.
Наиболее предпочтительно способ разделения использует градиент полисахарида, например, Ficoll.
Библиотека со стадии (а) предпочтительно представляет собой библиотеку дисплеев, содержащую множество элементов библиотек, которые экспонируют антилиганды. Примером такой библиотеки может служить библиотека фагового дисплея, где антилиганд экспонируется на поверхность бактериофага.
Экспонирование белков и полипептидов, слитых с одним из белков фаговой оболочки, на поверхности бактериофага (фага) служит мощным инструментом для селекции специфических лигандов. Такой способ «фаговового дисплея» первоначально был использован Смитом (Smith) в 1985 году, чтобы создать большие библиотеки антител для целей селекции антител с высокой аффинностью к определенному антигену. Совсем недавно данный способ был использован для экспонирования пептидов, доменов белков и интактных белков на поверхности фага с тем, чтобы идентифицировать лиганды, имеющие желаемые свойства.
Принципы, лежащие в основе технологии фагового дисплея, таковы:
(i) Нуклеиновую кислоту, кодирующую белок или полипептид для дисплея, клонируют в фаг;
(ii) Клонированная нуклеиновая кислота экспрессируется слитно с крепящейся к оболочке «якорной» частью одного из белков фаговой оболочки (обычно белки Р3 или Р8 оболочки в случае нитчатых фагов), так что чужеродный белок или полипептид экспонируется на поверхности фага;
(iii) Фаг, экспонирующий белок или полипептид с желаемыми свойствами, затем селектируют (например, аффинной хроматографией), тем самым получая генотип (связанный с фенотипом), который может быть секвенирован, умножен и перенесен в другие системы экспрессии.
Альтернативно, чужеродный белок или полипептид можно экспрессировать, используя фагмидный вектор (то есть вектор, содержащий точки начала (ориджины) репликации, полученные из фага и плазмиды), который может быть упакован в виде одноцепочечной нуклеиновой кислоты в оболочке бактериофага. При использовании фагмидных векторов используется «фаг-помощник» для обеспечения функций репликации и упаковки фагмидной нуклеиновой кислоты. Полученный фаг будет экспрессировать как белок оболочки дикого типа (кодируется фагом-помощником), так и модифицированный белок оболочки (кодируемый фагмидом), тогда как при использовании фагового вектора экспрессируется только модифицированный белок оболочки.
Использование фагового дисплея для выделения лигандов, которые связываются с биологически релевантными молекулами, было рассмотрено у Felici et al. (1995), Katz (1997) и Hoogenboom et al. (1998). Было сконструировано несколько рандомизированных комбинаторных пептидных библиотек, чтобы селектировать полипептиды, которые связывают различные цели, например, рецепторы клеточной поверхности или ДНК (Kay and Paul, (1996)).
Белки и мультимерные белки были успешно экспониров