Способ моделирования локализованного метафизарного хронического остеомиелита у кролика
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и может быть использовано для изучения особенностей течения остеомиелита, разработки и оценки эффективности различных способов его лечения. Для этого моделируют локализованный метафизарный хронический остеомиелит у кролика. В области проксимального метаэпифиза большеберцовой кости формируют костный дефект, в который укладывают заранее заготовленную стерильную гемостатическую губку размером, соответствующим размеру дефекта. После чего ее инфицируют введением 0,5 микробной взвеси суточной культуры золотистого стафилококка, содержащей 106 КОЕ/мл. Затем рану ушивают, и животное содержат в обычных условиях не менее 21 суток. Способ обеспечивает создание локализованного очага хронического метафизарного остеомиелита за счет купирования кровотечения и ограничения распространения инфицирующего агента на смежные сегменты, что приводит к низкому риску генерализации инфекционного процесса и развитию летальных исходов экспериментального животного в результате сепсиса. 6 ил., 1 пр.
Реферат
Изобретение относится к медицине и может быть использовано для изучения патогенеза остеомиелита и разработки методов его профилактики и лечения.
В экспериментальной медицине в качестве подопытных животных чаще всего используют самок кроликов. Это связано с рядом преимуществ, а именно малой степенью фенотипического полиморфизма, относительной простотой воспроизведения популяции, меньшей агрессивностью самок в сравнении с самцами, что не приводит к дополнительному травматизму среди экспериментальных животных. Известно множество способов получения экспериментальным путем модели остеомиелита, таких как способ моделирования травматического остеомиелита, в котором грубо механически нарушают целостность кости и вводят инфицирующий материал в зону сформированного ишемического некроза (авт. свид. СССР №829101). При этом костномозговой канал герметизируют и на конечность накладывают давящую гипсовую повязку. Также, описан способ моделирования инфицированной костной раны, состоящий в нанесении открытого перелома большеберцовой кости и через сутки его инфицирования путем орошения раны суспензией золотистого стафилококка ("Комплексное лечение больных посттравматическим остеомиелитом длинных трубчатых костей", Н.П. Грицай, дис., с. 104-178, 1992). Следует отметить, что данные способы позволяют создать модель острого остеомиелита.
Кроме того, существуют способы моделирования свищевых форм хронического остеомиелита, с возможностью поддержания воспалительного процесса длительное время, которое необходимо для изучения и объективной оценки течения патологического процесса при разработке средств и методов его лечения. К таким моделям хронического остеомиелита относят способ моделирования остеомиелита длинной трубчатой кости путем использования физических факторов для нарушения целостности кости путем воздействия постоянным электрическим током силой 50 мкА и напряжением 1,5 В (пат. РФ №2049434), а также способ создания хронического очага остеомиелита путем формирования по передней поверхности большеберцовой кости четырех трепанационных отверстий с обнажением костномозгового канала и последующим их соединением продольными пропилами кости и инфицированием образованного дефекта (Моделирование хронического остеомиелита С.В. ЛАДОНИН, А.Г. СОНИС, Д.Г. АЛЕКСЕЕВ, Е.А. БЕЛОЗЕРЦЕВА, Е.А. ВОВК, ВЕСТНИК ЭКСПЕРИМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ ХИРУРГИИ, ТОМ IV, №2, с. 344-348, 2011). Надо отметить, что представленные модели остеомиелита не всегда позволяют создать локальный хронический воспалительный процесс. Зачастую, процесс обширно распространяется на окружающие ткани, что приводит к нежелательным последствиям, ослаблению животного, генерализации инфекционного процесса вплоть до развития сепсиса и последующей гибели экспериментального животного.
Известен способ моделирования туберкулезного омартрита (патент №RU 2265891 С2), где авторы вносят взвесь возбудителя иглой, прокалывая губчатую кость и закрывая отверстие гемостатической губкой. Данный способ не предполагает создание именно костного дефекта. Помимо этого, патогенез туберкулезного артрита отличается от патогенеза остеомиелита. Туберкулезное заболевание костей и суставов является следствием лимфогематогенной диссеминации. По современным представлениям преимущественность локализаций первичных поражений в губчатом веществе суставных концов костей объясняется повышенной чувствительностью ретикулоэндотелиальных элементов красного костного мозга и обилием его кровоснабжения (Беллендир Э.Н. Костно-суставной туберкулез, 1995 N 6. - С. 7-13; Васильев А.В. Внелегочный туберкулез, 1997. - С. 10-11. Гарбуз А.Е. Внелегочный туберкулез, 1997, С. 11-12).
Задачей описанного способа является создание модели костного туберкулезного поражения, последовательно распространяющегося из субхондрально расположенного очага на плечевой сустав, адекватно развитию туберкулезного омартрита у человека, а также предотвращения инфицирования культурой МВТ окружающих мягких тканей операционной раны, что не отвечает требованиям, предъявляемым к созданию локализованного метафизарного очага остеомиелита, без вовлечения в инфекционный процесс сустава.
Наиболее близким к заявленному является способ моделирования остеомиелита челюсти, когда у животного удаляют резец нижней челюсти, в лунку удаленного зуба вводят культуру золотистого стафилококка на углеродном волокнистом адсорбенте, после чего лунку обтурируют фрагментом корня удаленного зуба (Соловьев М.М. СПОСОБ МОДЕЛИРОВАНИЯ ОСТЕОМИЕЛИТА. Стоматология, 1969, М 6, с. 40-4З. (54)). К недостаткам этого способа можно отнести то, что указанный способ можно использовать только для моделирования остеомиелита в области зубных лунок. Помимо этого, описанный в данном способе в качестве носителя инфекции адсорбент в виде углеродного волокна не подвергается резорбции в костной ране. Это обстоятельство отдаляет данный способ моделирования остеомиелита от классической клинической картины.
Цель изобретения - создание адекватной модели локализованного хронического остеомиелитического дефекта трубчатых костей, с возможностью нанесения минимальной экспериментальной травмы животному, что позволит минимизировать распространение инфекционного процесса на смежные сегменты, снизит риск генерализации инфекции и повысит выживаемость животных.
Технический результат состоит в:
- получении модели локализованного метафизарного очага хронического остеомиелита, пригодной для изучения особенностей клинического течения остеомиелита, разработки и оценки эффективности различных способов его лечения, в том числе для изучения процессов репаративного остеогенеза и реакции костной ткани на имплантацию различных костных трансплантатов и остеозамещающих материалов в указанных условиях,
- снижении риска генерализации инфекционного процесса и повышении выживаемости животных.
Результат изобретения достигается за счет формирования костного дефекта в области проксимального метаэпифиза большеберцовой кости, в который укладывают рассасывающийся материал (гемостатическая губка) и затем инфицируют его патогенной микрофлорой, что обеспечивает купирование диффузного кровотечения из кости и вымывание инфицирующего агента из области костного дефекта. Это способствует ограничению распространения инфекции на смежные сегменты и приводит к низкому риску генерализации инфекционного процесса и отсутствию летальных исходов экспериментального животного в результате сепсиса.
На чертежах изображены макропрепараты, рентгенограммы и микропрепараты морфологического исследования локализованного метафизарного хронического остеомиелитического дефекта у животных основной группы, а также костного дефекта в контрольной группе и в группе сравнения - классическая модель остеомиелита без использования заселенной патогенной микрофлорой гемостатической губки:
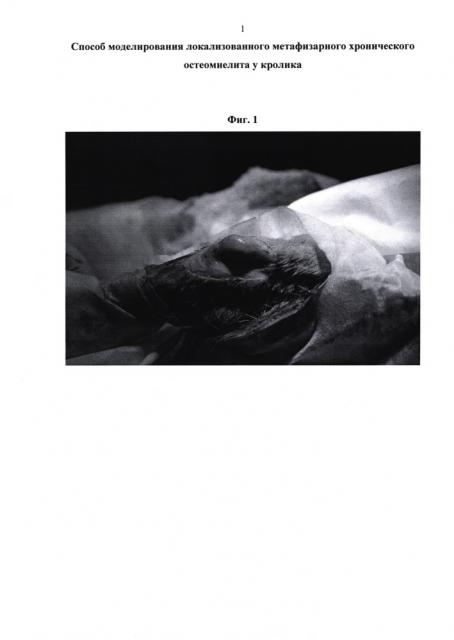
Фиг. 1: общий вид экспериментальной модели на 21-е сутки после укладки в костный дефект гемостатической губки с последующим инфицированием. В области верхней трети голени, по наружной поверхности, в проекции костного дефекта, визуализировано локальное эластическое образование, возвышающееся над кожей с гиперемированными краями, содержащее гнойно-серозную жидкость.
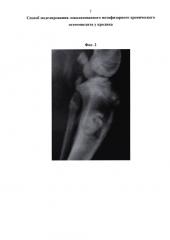
Фиг. 2: рентгенологическая картина экспериментальной модели на 21-е сутки после укладки в костный дефект инфицированной гемостатической губки. В зоне дефекта определяется четкая секвестрация.
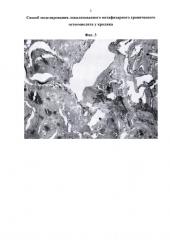
Фиг. 3: микропрепарат: морфологическая картина локализованного метафизарного хронического остеомиелитического дефекта на 21-е сутки после формирования остеомиелитического дефекта предлагаемым способом (окраска гематоксилином, ув. х 100). Визуализируется дефект, заполненный лейкоцитами и костными секвестрами. Надкостница и эндоост инфильтрированы лейкоцитами, между ними и подлежащей костной тканью видны клеточные элементы формирующейся соединительной ткани.
Фиг. 4: общий вид голени кролика при формировании асептического дефекта (контроль). Кожный покров без признаков воспаления, рана зажила первичным натяжением, отечности в области оперативного вмешательства нет.
Фиг. 5: микропрепарат: морфологическая картина при формировании асептического дефекта (контроль). Отмечены остаточные полости в центральной зоне дефекта. Происходит дифференцировка жирового костного мозга в кроветворный от периферии к центру, что говорит о нормальном течении репаративных процессов. Признаков воспаления не выявлено (окраска гематоксилином, ув. х 100).
Фиг. 6: общий вид голени кролика при моделировании остеомиелита без использования заселенной патогенной микрофлорой гемостатической губки. В области операционного вмешательства кожные покровы и подлежащие ткани ярко гиперемированы и инъецированы. Околосуставные ткани заполнены гнойным содержимым с распространением по фасциальным влагалищам в смежные сегменты конечности. В области оперативного вмешательства - множественные свищевые ходы.
Способ осуществляется следующим образом: в асептических условиях кроликам породы «шиншилла» весом 2,5-3,5 кг под внутривенной анестезией (кетамин) проводят оперативное вмешательство по общепринятой методике, при этом на латеральной поверхности в области проксимального метаэпифиза большеберцовой кости стоматологическим бором под углом 45° относительно поверхности кости круговыми движениями формируют трепанационное отверстие округлой формы диаметром 8 мм. В сформированный костный дефект помещают заранее заготовленную стерильную гемостатическую губку размером, соответствующим размеру костного дефекта. После чего в костный дефект, в область лежащей на дне костной раны гемостатической губки шприцом вносят 0,5 мл микробной взвеси (суточная культура золотистого стафилококка 106 КОЕ/мл), далее костный дефект укрывают подлежащими тканями и ушивают послойно, после чего животных содержат в обычных условиях не менее 21 суток, что приводит к формированию локализованного метафизарного очага хронического остеомиелита за счет купирования кровотечения и ограничения распространения инфицирующего агента на смежные сегменты, что приводит к низкому риску генерализации инфекционного процесса и развитию летальных исходов экспериментального животного в результате сепсиса.
ПРИМЕР
С целью изучения различных осложнений, летальности животных, а также трудоемкости воспроизведения моделей остеомиелита, было проведено сравнение разработанной модели локализованного хронического метафизарного остеомиелитического дефекта (основная группа, n=10) и классической модели остеомиелита без использования заселенной патогенной флорой гемостатической губки (группа сравнения, n=10), контрольную группу составили 3 животных с костным дефектом без инфицирования. Исследование проводили на самках кроликов породы «шиншилла» весом 2,5-3,5 кг.
Животным основной группы под внутривенным наркозом (кетамин) в асептических условиях фиксировали задние конечности. Продольным разрезом обнажали большеберцовую кость, далее на латеральной поверхности в области проксимального метаэпифиза большеберцовой кости стоматологическим бором под углом 45° относительно поверхности кости круговыми движениями формировали трепанационное отверстие округлой формы диаметром 8 мм. В сформированный костный дефект помещали заранее заготовленную стерильную гемостатическую губку размером, соответствующим костному дефекту. После чего, в костный дефект в область лежащей на дне костной раны гемостатической губки шприцом вносили 0,5 мл микробной взвеси (суточная культура золотистого стафилококка 106 КОЕ/мл), далее костный дефект укрывали подлежащими тканями, ушивали послойно и обрабатывали раствором йода.
Животным группы сравнения также формировали костный дефект (по приведенной выше схеме), но взвесь микроорганизмов вносили прямо в область дефекта, без использования гемостатической губки.
Животным контрольной группы также моделировали костный дефект (по приведенной выше схеме), но взвесь микроорганизмов не вносили.
В послеоперационном периоде кроликов помещали по трое в клетки габаритами 100×100×50 см.
В первые сутки и на 21 сутки после операции выполняли рентгенологическое исследование области сформированного костного дефекта. На 7-е, 14-е и 21-е сутки после операции выполняли контрольные пункции послеоперационной раны с последующим микробиологическим исследованием аспирата. В результате микробилогического исследования, в основной группе и группе сравнения во всех полученных аспиратах выявлен рост патогенной флоры заселенной ранее - S. aureus, с аналогичным профилем чувствительности.
У животных основной группы область оперативного вмешательства имела отграниченные очаги воспалительного процесса с гнойным отделяемым из свищевых ходов. Инфекционный процесс не распространялся на смежные сегменты конечности (фиг. 1). На рентгенограммах, выполненных на 21-е сутки с момента операции, выявлена секвестрация зоны костной раны (фиг. 2). При морфологическом исследовании тканевых блоков из области хирургического вмешательства подтверждено наличие хронического инфекционного процесса в области сформированного 3 недели назад дефекта костной ткани (остеомиелита): определялся дефект костной ткани, заполненный лейкоцитами и костными секвестрами. Надкостница и эндоост были инфильтрированы лейкоцитами, между ними и подлежащей костной тканью определялись клеточные элементы формирующейся соединительной ткани (фиг. 3). Таким образом, получена модель локализованного хронического остеомиелитического дефекта (см. фиг. 1, 2, 3).
При исследовании контрольной группы (не инфицированный костный дефект) во все сроки наблюдения, не отмечено признаков воспаления в области оперативного вмешательства (фиг. 4). При морфологическом исследовании у животных контрольной группы, определяли остаточные полости с тонкими стенками и единичными костными балками без признаков воспалительного процесса, на фоне процесса восстановления костного мозга (фиг. 5).
В группе сравнения при воспроизведении классической модели остеомиелита без использования заселенной патогенной флорой гемостатической губки у большинства животных (n=8) развивались разлитые очаги инфекционного процесса с распространением на смежные сегменты конечности (фиг. 6). В связи с этим зачастую развивалась генерализация инфекции, что в 6 случаях (60%) привело к гибели экспериментального животного. При использовании разработанной модели локализованного метафизарного хронического остеомиелитического дефекта морфологическая картина области остеомиелитического дефекта не отличалась от классической модели остеомиелита без применения заселенной патогенной флорой гемостатической губки и от описанных моделей остеомиелита в литературе. Гибели животных, а также распространения очага инфекции на смежные сегменты при создании оригинальной модели локализованного метафизарного хронического остеомиелитического дефекта не отмечено.
Способ моделирования локализованного метафизарного хронического остеомиелита у кролика, отличающийся тем, что в области проксимального метаэпифиза большеберцовой кости формируют костный дефект, в который укладывают заранее заготовленную стерильную гемостатическую губку размером, соответствующим размеру дефекта, после чего ее инфицируют введением 0,5 микробной взвеси суточной культуры золотистого стафилококка, содержащей 106 КОЕ/мл, затем рану ушивают, и животное содержат в обычных условиях не менее 21 суток.