Калмангафодипир, новое химическое соединение и другие смешанные комплексные соединения с металлами, способы получения, композиции и способы лечения
Иллюстрации
Показать всеИзобретение относится к смешанному комплексному соединению с металлами, содержащему кальций и марганец в виде комплекса с соединением формулы I или его фармацевтически приемлемой солью:
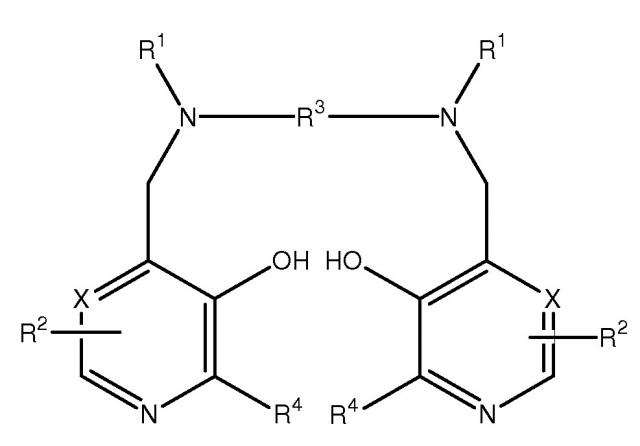
В формуле I значения радикалов следующие: X представляет собой СН, каждый R1 независимо представляет собой -CH2COR5, R5 представляет собой гидрокси, каждый R2 независимо представляет собой ZYR6, где Z представляет собой C1-3алкиленовую группу, Y представляет собой связь, R6 представляет собой OR8 или ОР(O)(OR8)R7, R7 представляет собой гидрокси или незамещенную C1-6алкильную или аминоалкильную группу, R8 представляет собой атом водорода или C1-6алкильную группу, R3 представляет собой этиленовую группу и каждый R4 независимо представляет собой водород или C1-3алкил. Также предложены фармацевтическая композиция, способ получения смешанного комплексного соединения с металлами и способ лечения. Смешанное комплексное соединение обеспечивает улучшенное лечение патологических состояний, обусловленных наличием образуемых из кислорода свободных радикалов. 4 н. и 22 з.п. ф-лы, 35 ил., 11 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к смешанному комплексному соединению с металлами соединения дипиридоксила, например N,Nʹ-бис(пиридоксаль-5-фосфат)-этилендиамин-N,Nʹ-диуксусной кислоты (DPDP или фодипиру) или другим соединениям формулы I (далее производные пиридоксилэтилдиамин или производные PLED), где смешанные металлы включают переходный металл III-XII группы и металл II группы. В конкретных вариантах осуществления смешанное комплексное соединение с металлами представляет собой комплексное соединение с кальцием и марганцем. Настоящее изобретение также относится к композициям, содержащим такое смешанное комплексное соединение с металлами, способам получения такого смешанного комплексного соединения с металлами, например, в одностадийной кристаллизации, и способам лечения, в которых применяют такое смешанное комплексное соединение с металлами. Такие способы лечения включают способы, в которых общепринято применяют комплексные соединения марганец-DPDP для терапевтического действия. В конкретном варианте осуществления композиции можно использовать при лечении патологических состояний, обусловленных наличием образуемых из кислорода свободных радикалов в организме, т.е. окислительного стресса. Смешанные комплексные соединения с металлами и, в частности, смешанное комплексное соединение с кальцием-марганцем калмангафодипир, описываемое в настоящем описании, представляют собой новые химические соединения.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
[0002] Окислительный стресс начинается с генерации активных форм кислорода (ROS) и реактивных форм азота (RNS) в ходе нормального клеточного функционирования. Существует много клеточных источников образования ROS, но наиболее значительные источники представляют собой комплексы I и III переноса электронов митохондрий, ферменты P450 в эндоплазматическом ретикулуме и мембранно-связанную NADPH-оксидазу. Продукция ROS каждым из этих источников может быть стимулирована цитокинами, воспалением, вирусными белками и посредством других механизмов, таких как химиотерапевтические лекарственные средства, ишемия-реперфузия и перегрузка железом и медью. Следует отметить, что в этих процессах изначально генерируется свободный радикал супероксид ((O2-), который последовательно восстанавливается с образованием пероксида водорода, гидроксильного радикала и в конечном итоге воды. В условиях сильного окислительного стресса и, таким образом, высокой продукции супероксида эти реакционноспособные промежуточные соединения, тем не менее, легко взаимодействуют с другими молекулами с образованием вторичных вредных ROS, таких как продукты перекисного окисления липидов и пероксинитриты (Singal et al., Liver Int., 2011, 31:1432-1448). Это свидетельствует о важности сохранения клеточного количества супероксида под строгим контролем. В нормальных условиях это достигается посредством супероксиддисмутаз (SOD). Хотя SOD имеют самую высокую скорость реакции среди известных ферментов в условиях сильного окислительного стресса, эти ферменты могут быть вытеснены на второй план и даже необратимо инактивированы ROS и RNS. Это, в свою очередь, открывает низкомолекулярные лекарственные средства, которые имитируют ферменты SOD, т.е. так называемые миметики SOD, для терапевтического применения для борьбы с патологическим окислительным стрессом.
[0003] Давно известно, что короткоживущие, но высокореакционноспособные образуемые из кислорода свободные радикалы участвуют в патологическом повреждении тканей, в частности во время лечения цитотоксическими средствами/цитостатическими средствами и лучевой терапией у пациентов со злокачественными опухолями (Towart et al., Arch. Pharmacol., 1998; 358 (Suppl 2):R626, Laurent et al., Cancer Res., 2005, 65:948-956, Karlsson et al., Cancer Res., 2006; 66:598, Alexandre et al., J. Natl. Cancer Inst., 2006, 98:236-244, Doroshow, J. Natl. Cancer. Inst., 2006, 98:223-225, Citrin et al, Oncologist, 2010, 15:360-371, Kurz et al., Transl. Oncol., 2012, 5:252-259), индуцированной ацетаминофеном печеночной недостаточностью (Bedda et al., J. Hepatol., 2003; 39:765-772, Karlsson, J. Hepatol., 2004, 40:872-873), при ишемической болезни сердца (Cuzzocrea et al., Pharmacol. Rev., 2001, 53:135-159) и при различных нейродегенеративных заболеваниях, включая болезнь Альцгеймера, боковой амиотрофический склероз (ALS), болезнь Паркинсона и рассеянный склероз (Knight, Ann. Clin. Lab. Sci., 1997, 27:11-25). Сверхпродукция образуемых из кислорода свободных радикалов также вовлечена в патологические состояния перегрузки железом (Rachmilewitz et al., Ann. NY Acad. Sci., 2005, 1054:118-23), например, при талассемии, серповидно-клеточной анемии и трансфузионном гемосидерозе. Образуемые из кислорода свободные радикалы также вовлечены в индуцируемый гепатитом цирроз печени (Farrell et al., Anat. Rec., 2008, 291:684-692) и в потерю слуха в результате воздействия шума (Wong et al., Hear. Res., 2010, 260:81-88).
[0004] В медицине известно применение хелатирующих средств на основе дипиридоксила и его хелатов металлов и определенных, содержащих марганец соединений, в частности хелаты марганца. См. EP 0910360, US 6147094, EP 0936915, US 6258828, EP 1054670, US 6310051, EP 1060174 и US 6391895, например, в которых описано, что определенные хелатирующие средства, в частности хелатирующие средства на основе дипиридоксила и его хелаты металлов, являются эффективными при лечении или профилактики индуцируемой антрациклином кардиотоксичности, индуцируемой облучением токсичности, индуцируемых ишемией-реперфузией повреждений и индуцируемой парацетамолом (ацетаминофеном) печеночной недостаточности или с более общей точки зрения любого патологического состояния, обусловленного наличием образуемых из кислорода свободных радикалов, т.е. окислительного стресса, у людей и животных. Кроме того, дополнительно и неожиданно было обнаружено, что соединение дипиридоксила мангафодипир (MnDPDP) обладает цитотоксическими эффектами в отношении злокачественных клеток (EP 16944338). Однако, как описано в WO 2009/078794 A1 и у Kurz et al., 2012, это является характерным свойством только фодипира (DPDP) или его дефосфорилированных аналогов DPMP и PLED, а не комплексного соединения с металлами MnDPDP или его дефосфорилированных аналогов MnDPMP и MnPLED.
[0005] Одно из производных MnPLED, а именно марганец-N,N'-бис(пиридоксаль-5-фосфат)-этилендиамин-N,N'-диуксусная кислота (дипиридоксилдифосфат марганца, MnDPDP), также известный как мангафодипир, одобрено для применения в качестве диагностического контрастного средства для MRI у людей. Следует отметить, что продемонстрировано, что мангафодипир защищает мышей от серьезных побочных эффектов некоторых цитотоксических/цитостатических лекарственных средств (доксорубицина, оксалиплатина, 5-фторурацила и паклитаксела), не оказывая отрицательного влияния на противоопухолевые эффекты этих лекарственных средств (Towart et al., 1998, Laurent et al., 2005, Karlsson et al., 2006, Alexandre et al., 2006, Doroshow, 2006, Kurz et al., 2012). Мангафодипир тестировали на одном пациенте с раком толстого кишечника, проходящего паллиативное лечение в комбинации с фолинатом, 5-фторурацилом и оксалиплатином (Yri et al., Acta Oncol., 2009; 48:633-635). Доклинические данные и результаты у этого единственного пациента являлись такими обнадеживающими, что было начато клиническое тестирование у пациентов со злокачественными опухолями. Однако, что касается наиболее опасного побочного эффекта оксалиплатина, а именно индуцированной оксалиплатином сенсорной нейротоксичности, насколько известно авторам, не существует доклинических данных, демонстрирующих защитные эффекты мангафодипира (Karlsson et al., Transl. Oncol., 2012, 5:32-38). Yri et al., 2009, описали пациента, получавшего 15 полных доз "Nordic FLOX". На 14 цикле пациент получал предварительное лечение мангафодипиром. Пациент получал суммарную дозу 1275 мг/м2 оксалиплатина, что представляет собой дозу, вероятно, вызывающую нейротоксические симптомы. Не детектировали нейротоксических симптомов за исключением пятнадцатого цикла, когда мангафодипир намеренно исключали, и пациент испытывал периферическую сенсорную нейропатию. Это позволяет предположить, что мангафодипир может защищать от периферической нейротоксичности. После пяти циклов общее состояние пациента существенно улучшалось, и потребность в анальгетиках значительно снижалась. Нейтропения не возникала во время любого из циклов химиотерапии.
[0006] Было проведено первое исследование экономической целесообразности (MANFOL I), и положительные результаты, включая миелопротекторные эффекты, были предоставлены Медицинскому агентству Швеции и опубликованы (Karlsson et al., 2012).
[0007] Также описано, что мангафодипир защищает мышей от индуцированной ацетаминофеном острой печеночной недостаточности у мышей (ALF) (Bedda et al., 2003, Karlsson, 2004). ALF характеризуется массовой гибелью гепатоцитов, состоянием, обусловленным снижением глутатиона, образуемыми из кислорода свободными радикалами и повреждением митохондрий.
[0008] Мангафодипир представляет собой пролекарство в том смысле, что, вероятно, метаболизируется в N,N'-дипиридоксилэтилендиамин-N,N'-диуксусную кислоту (MnPLED) до того, как он оказывает цитопротекторное действие в условиях in vivo (например, см. Karlsson et al., Acta Radiol., 2001, 42:540-547, Kurz et al., 2012). Марганец является основным, а также потенциально нейротоксичным металлом. В течение многих лет известно, что в условиях хронической экспозиции высокими уровнями марганца часто возникает синдром экстрапирамидальной недостаточности, сходный с синдром Паркинсона, хотя клинически является отличной нозологической единицей (см. Scheuhammer & Cherian, Arch. Environm. Contam. Toxicol., 1982, 11:515-520). Когда людям внутривенно инъецируют дозу мангафодипира для диагностической МР-томографии, высвобождается приблизительно 80% вводимого марганца (Toft et al., Acta Radiol., 1997, 38:677-689). Высвобождение парамагнитного марганца является фактически необходимым условием для свойств мангафодипира в отношении диагностической МР-томографии (Wendland, NMR Biomed., 2004, 17:581-594). Elizondo et al., 1991 (Radiology, 1991, 178:73-78) установили, что группа фодипира связывается с рецептором пиридоксил-5'-фосфата в гепатоцитах и обеспечивает высокую внутриклеточную концентрацию мангафодипира в печени. Недавно эту гипотезу также подтвердили в статье Coriat et al., (PLoS One, 2011, 6:1-6, e27005). Это хорошая гипотеза, но, к сожалению, недоказанная и очень маловероятная гипотеза, которая быстро перестала быть популярной после того, как была представлена. Когда мангафодипир инъецируют внутривенно (в/в), приблизительно 80% комплексного соединения с металлами теряется (Toft et al., Radiol., 1997), и в очень эквимолярной дозе Mn MnCl2 обладает равной или лучшей контрастной эффективностью для МР-томографии печени по сравнению с мангафодипиром (Southon et al., Acta Radiol., 1997). Кроме того, после инъекции мангафодипира практически весь фодипир обнаруживают в моче (основную его часть в виде), тогда как большую часть марганца обнаруживают в кале (Hustvedt et al., Acta Radiol., 1997; 38:690-699). С другой стороны, терапевтические эффекты мангафодипира (MnDPDP) и его дефосфорилированных аналогов MnDPMP (N,N'-дипиридоксилэтилендиамин-N,N'-диацетат-5-фосфат) и MnPLED зависят от целого комплексного соединения с металлами (Brurok et al., Biochem. Biophys. Res. Commun., 1999, 254:768-721, Karlsson et al., 2001, 42:540-547).
[0009] Производные PLED имитируют митохондриальный фермент марганцевую супероксиддисмутазу (MnSOD) (Brurok et al., 1999). MnSOD защищает клетку млекопитающего от супероксидного радикала, побочного продукта метаболизма кислорода, который продуцируется в достаточно больших количествах в нормальных аэробных условиях, ни одно млекопитающее не выживает без функциональной MnSOD. MnSOD обладает самым высоким числом оборотов (скоростью реакции с ее субстратом) любого известного фермента (>109 M-1 сек-1) (Fridovich, J. Exp. Biol., 1998, 201:1203-1209). Низкомолекулярные миметики MnSOD могут обладать скоростями оборота, близкими к скорости нативной MnSOD (Cuzzocrea et al., 2001). Следует отметить, что физиологические буферы, содержащие переходные металлы, такие как марганец, могут обладать аналогичными высокими числами оборотов (Culotta et al., Biochim. Biophys. Acta, 2006, 1763:747-758). Однако важность нативных ферментов SOD соответствует процессу отбора в пользу организмов, которые выработали средство, локализирующее катализатор на основе переходного металла для дисмутации супероксида в части клеток, где существует высокая потребность в такой дисмутации, например митохондрии. Кроме того, результаты ишемии-реперфузии миокарда на анестезированных свиньях неизбежно демонстрируют, что целый MnPLED, но не марганец сам по себе, защищает от окислительного стресса, что наблюдают как уменьшение размера инфаркта (Karlsson et al., 2001). Эффективная инактивация супероксида является существенной для предотвращения генерации очень опасных гидроксильных радикалов и пероксинитрита (Cuzzocrea et al., 2001). Во время патологического окислительного стресса образование супероксидных радикалов часто превышает эндогенную способность инактивации. Кроме того, супероксид стимулирует продукцию пероксинитрита, который нитрует эндогенную MnSOD. Этот белок нитруется пероксинитритом в Tyr-34 (Radi, Proc. Natl. Acad. Sci. USA, 2004, 101:4003-4008). После нитрования MnSOD теряет свою ферментативную активность, событие, способствующее накоплению супероксида и вызываемым супероксидом повреждениям (Muscoli et al., Br. J. Pharmacol., 2003; 140:445-460).
[0010] Последние результаты указывают на то, что инактивация MnSOD нитрованием является ранним событием при индуцируемой парацетамолом печеночной токсичности (Agarwal et al., J. Pharmacol. Exp. Ther., 2011, 337:110-116). Кроме того, полученные ранее результаты указывают на то, что нитрование и инактивация MnSOD вовлечены в хроническое отторжение трансплантированных почек у людей (MacMillan-Crow et al., Proc. Natl. Acad. Sci. USA, 1996, 93:11853-11858). Также может быть уместным отметить, что актин, который может составлять 5% или более клеточного белка, в значительной степени подвергается нитрованию при серповидно-клеточной анемии, и что наблюдаемая степень нитрования является достаточной для индукции полимеризации цитоскелета (Radi, 2004). Кроме того, уровни циркулирующего в крови 3-нитротирозина могут служить в качестве биомаркера для оценки рисков атеросклероза. Кроме того, в дополнение к атеросклерозу полагают, что пероксинитрит и 3-нитротирозин вовлечены в ишемию миокарда, септическое и пораженное легкое, воспалительное заболевание кишечника, боковой амиотрофический склероз (Beckman et al., Am. J. Physiol., 1996, 271:C1424-C1437) и диабет (Fonstermann et al., Br. J. Pharmacol., 2011, 164:213-223).
[0011] Ослабленные механизмы антиоксидантной системы защиты, включая сниженную активность SOD, а затем повышенную продукцию пероксинитрита, могут являться важным фактором в патогенезе неалкогольного стеатогепатита (NASH) (Koruk et al., Ann. Clin. Lab. Sci., 2004, 34:57-62). Очевидным является существенная эпидемиологическая и клиническая взаимосвязь инфекций вируса гепатита В или гепатита С и развития хронического гепатита и возникновения печеночноклеточной карциномы. Следует отметить, что индуцируемое пероксинитритом нитрование тирозина является заметно повышенным у пациентов с хроническим вирусным гепатитом (Garcia-Monzon et al., J. Hepatol., 2000, 32:331-338). В настоящее время, как правило, упоминаемый механизм развития патологии при болезни Вильсона включает окислительное повреждение, обусловленное перегрузкой меди. Генерация активных форм кислорода (ROS), а также окисление липидов и повреждения ДНК детектировали в печени, в частности, на поздних стадиях этого заболевания (Burkhead et al., Biometals, 2011, 24:455-466).
[0012] Производные MnPLED не являются мишенями для пероксинитрита, и добавление экзогенных производных MnPLED может в таких ситуациях восстановить защитный потенциал. Кроме того, производные PLED представляют собой сильные связывающее железо средства, как описано в EP 1054670, US 6310051 и Rocklage et al., (Inorg. Chem., 1989, 28:477-485), и некоторые производные MnPLED могут обладать активностью каталазы и глутатионредуктазы (Laurent et al., 2005), которые могут дополнительно увеличивать их антиоксидантную емкость.
[0013] Для использования в диагностической визуализации и других единичных применениях диссоциация марганца из мангафодипира не является основной токсикологической проблемой. Тем не менее, вследствие поглощения в ЦНС при более частом использовании, например в терапевтических способах, суммарная токсичность марганца может представлять собой серьезную нейротоксикологическую проблему (Crossgrove et al., NMR Biomed., 2004, 17:544-53). Таким образом, для более частого терапевтического применения следует избегать соединений, которые легко диссоциируют на марганец, и существует необходимость в разработке способов получения желаемых терапевтических эффектов, при этом снижая нежелательные побочные эффекты, ассоциированные с таким терапевтическим применением.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0014] Комплексные соединения, композиции и способы по настоящему изобретению обеспечивают улучшение получения и применения комплексных соединений с металлами производных PLED. В одном из вариантов осуществления изобретение относится к смешанному комплексному соединению с металлами соединения формулы I или его соли, где смешанные металлы включают переходный металл III-XII группы и металл II:
Формула I
где
X представляет собой CH или N,
каждый R1 независимо представляет собой водород или -CH2COR5,
R5 представляет собой гидрокси, необязательно гидроксилированный алкокси, амино или алкиламидо,
каждый R2 независимо представляет собой ZYR6, где Z представляет собой связь или C1-3алкиленовую или оксоалкиленовую группу, необязательно замещенную R7,
Y представляет собой связь, атом кислорода или NR6,
R6 представляет собой атом водорода, COOR8, алкильную, алкенильную, циклоалкильную, арильную или аралкильную группу, необязательно замещенную одной или более группами, выбранными из COOR8, CONR82, NR82, OR8, =NR8, =O, OP(O) (OR8)R7 и OSO3M,
R7 представляет собой гидрокси, необязательно гидроксилированную, необязательно алкоксиилированную алкильную или аминоалкильную группу,
R8 представляет собой атом водорода или необязательно гидроксилированную, необязательно алкоксилированную алкильную группу
M представляет собой атом водорода или один эквивалент физиологически приемлемого катиона,
R3 представляет собой C1-8алкилен, 1,2-циклоалкиленовую или 1,2-ариленовую группу, необязательно замещенную R7, и
каждый R4 независимо представляет собой водород или C1-3алкил или его соль.
[0015] В другом варианте осуществления изобретение относится к комплексному соединению с кальцием и магнием соединения формулы I. Смешанные комплексные соединения с металлами и, в частности, смешанное комплексное соединение с кальцием-марганцем калмангафодипир, описываемое в настоящем описании, представляют собой новые химические соединения.
[0016] Настоящее изобретение также относится к способам получения смешанного комплексного соединения с металлами, которые включают одностадийную кристаллизацию из раствора переходного металла III-XII группы, металла II группы и соединения формулы I.
[0017] В другом варианте осуществления изобретение относится к способу лечения патологического состояния у пациента, включающему введение пациенту смешанного комплексного соединения с металлами по изобретению, необязательно совместно с одним или более физиологически приемлемыми носителями и/или эксципиентами.
[0018] Комплексные соединения по изобретению являются предпочтительными по той причине, что металл II группы стабилизирует комплексное соединение, устраняя выделение переходного металла III-XII. Это снижает токсические эффекты, ассоциированные с использованием ранее получаемых комплексных соединений с переходными металлами III-XII группы, например, производных MnPLED, таких как мангафодипир. Комплексные соединения по изобретению также могут обеспечивать улучшенное лечение и/или защиту от патологических состояний, в частности состояний, обусловленных наличием образуемых из кислорода свободных радикалов, т.е. окислительного стресса. Дополнительные улучшения и преимущества по настоящему изобретению станут более очевидны в свете подробного описания, указанного ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0019] Следующее ниже подробное описание будет более полно понятно, принимая во внимание чертежи, где:
[0020] на фиг. 1 представлены порошковые рентгеновские дифрактограммы (XRPD) для трех кристаллических форм комплексного соединения фодипира (DPDP) с кальцием-марганцем с примерным молярным отношением Ca:Mn приблизительно 4:1, обозначаемым в настоящем описании как "калмангафодипир", получаемого способом одностадийной кристаллизации по изобретению, как описано в примере 1.
[0021] На фиг. 2 представлены дифрактограммы XRPD смесей кальция-фодипира (калфодипира) и марганца-фодипира (мангафодипир) в отличие от комплексного соединения по изобретению; эти дифрактограммы указывают, что все продукты являются аморфными, и было продемонстрировано, что они быстро абсорбируют воду, как описано в примере 2.
[0022] На фиг. 3 представлен спектр поглощения с преобразованием Фурье в инфракрасной области (FT-IR) калмангафодипира, партия № 7755-C-R0-01-30-01, с характерными полосами поглощения в инфракрасной области (волновое число) и соответствующими соотнесениями, описанными в примере 3.
[0023] На фиг. 4A и 4B представлен масс-спектр (фиг. 4A) и расширенный масс-спектр (фиг. 4B) калмангафодипира, партия № 7755-C-R0-01-30-01 (масса/заряд 660-850), как описано в примере 3.
[0024] На фиг. 5 представлена химическая структура калмангафодипира, как описано в примере 3.
[0025] На фиг. 6A представлено повышение содержания марганца (Mn) в моче через 0-24 часа, выраженное в виде общего содержания Mn минус фоновое содержание Mn, у крыс, которым инъецировали мангафодипир или калмангафодипир, содержащий 2,59 мкмоль и 2,52 мкмоль Mn соответственно. На фиг. 6B представлено повышение содержания Mn в моче, выраженное в виде процентного содержания инъецируемой дозы. На фиг. 6C представлено повышение содержания цинка в моче через 24 часа у тех же самых животных. Результаты выражают в виде среднего значения ± S. E. M., n=4 в каждой группе. Эти фигуры более подробно описаны в примере 4.
[0026] На фиг. 7A-7D представлены миелосупрессивные эффекты на лейкоциты (WBC), лимфоциты (LYM), нейтрофилы (NEU) и тромбоциты (PLC) соответственно, однократной внутривенной инъекции увеличивающихся доз (7,5, 10,0 и 12,5 мг/кг) оксалиплатина на 3 и 6 суток после инъекции. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 5.
[0027] На фиг. 8A-8D представлены WBC, LYM, NEU и PLC соответственно после обработки одним оксалиплатином или в комбинации с калмангафодипиром или мангафодипиром у мышей balb/c. Контроли получали только обработку носителем. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 5.
[0028] На фиг. 9A-9B представлена цитотоксическая активность различных производных PLED и CaCl2 в увеличивающихся концентрациях в отношении клеток CT26 рака толстого кишечника. Результаты выражают в виде среднего значения ± S. E. M., n=3, как описано в примере 6.
[0029] На фиг. 10A представлен противоопухолевый эффект высокой дозы оксалиплатина (20 мг/кг) у сингенных по CT26 мышей balb/c в отсутствие и в присутствии относительно высокой дозы калмангафодипира (50 мг/кг). На фиг. 10B представлен противоопухолевый эффект низкой дозы оксалиплатина (10 мг/кг) в отсутствие и в присутствии относительно низкой дозы калмангафодипира. Результаты выражают в виде среднего значения ± S. E. M., n=10 в группах носителя и оксалиплатина 20 мг/кг на фиг. 10A, n=5 во всех других группах, как описано в примере 7.
[0030] На фиг. 11A-11C представлено содержание Mn в головном мозге, поджелудочной железе и печени соответственно, после 39 доз NaCl (контроли), мангафодипира или калмангафодипира (соответствующих в обоих случаях суммарной дозе 2800 мкмоль/кг марганца). Результаты выражают в виде среднего значения ± S. E. M., n=17-18 в каждой группе, как описано в примере 8.
[0031] На фиг. 12A-12D представлены миелосупрессивыне эффекты на лейкоциты (WBC), лимфоциты (LYM), нейтрофилы (NEU) и тромбоциты (PLC) соответственно, однократной внутривенной инъекции увеличивающихся доз (75, 100 и 125 мг/кг) карбоплатина на 3 и 6 сутки после инъекции. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 9.
[0032] На фиг. 13A-13D представлены WBC, LYM, NEU и PLC соответственно, после карбоплатина в комбинации с калмангафодипиром у мышей balb/c. Контроли получали только обработку носителем. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 9.
[0033] На фиг. 14 представлен противоопухолевый эффект низкой дозы оксалиплатина (10 мг/кг) у несущих CT26 иммунокомпетентных мышей balb/c и у иммунодефицитных бестимусных мышей balb/c (nu/nu) в отсутствие и в присутствии относительно низкой дозы калмангафодипира. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 10.
[0034] На фиг. 15A и 15B представлена цитотоксическая активность калмангафодипира и мангафодипира на клетках U1810 и LLC1 немелкоклеточного рака легких соответственно. Результаты выражают в виде среднего значения ± S. E. M., n=3, как описано в примере 11.
[0035] Чертежи будут более полно понятны при рассмотрении примеров.
ПОДРОБНОЕ ОПИСАНИЕ
[0036] Комплексные соединения, композиции и способы по настоящему изобретению обеспечивают улучшение получения и применения комплексных соединений с металлами производных PLED, т. e. производных пиридоксилэтилдиамина, хотя установлено, что производные также действуют в качестве пролекарств PLED, т. к. они могут метаболизироваться с образованием PLED in vivo.
[0037] В WO 2011/004325 A1 продемонстрировано, как добавляемый избыток фодипира (DPDP) к мангафодипиру (MnDPDP) стабилизирует его, предотвращая выделение марганца после введения, и, таким образом, снижает поглощение в ЦНС и, таким образом, значительно снижает нейротоксический потенциал мангафодипира. Вследствие того что оно представляет собой содержащее интактный марганец комплексное соединение, которое оказывает имитирующее SOD и цитопротекторное действие, таким образом, избыток фодипира не только снижает нейротоксический потенциал, но он также значительно повышает цитопротекторную эффективность.
[0038] Выделение in vivo марганца из производных MnPLED, включая марганец-N,Nʹ-бис(пиридоксаль-5-фосфат)-этилендиамин-N,Nʹ-диуксусную кислоту (мангафодипир), зависит от наличия свободного или быстро диссоциируемого цинка в организме. Цинк обладает приблизительно в 1000 раз более высокой аффинностью, чем марганец для фодипира или его дефосфорилированных аналогов (Rocklage et al., 1989). Экспериментальные исследования позволяют предположить, что выделение марганца in vivo из мангафодипира насыщается при дозах, превышающих 5 мкмоль/кг (Southon et al., 1997). Визуализация сердца и печени с использованием мангафодипира у здоровых добровольцев указывает на аналогичную дозу насыщения у человека (Skjold et al., J. Magn. Reson. Imaging, 2004, 20:948-952, Toft et al., 1997).
[0039] В изобретении, описанном в WO 2011/004325 A1, предполагают, что конкретную терапевтическую композицию можно получать смешиванием двух активных фармацевтических ингредиентов (API), например мангафодипира и фодипира, в готовый к применению раствор или вводить их раздельно. Продемонстрировано, что фодипир при уровне дозирования приблизительно от 5 до 10 мкмоль/кг обладал значительным стабилизирующим эффектом in vivo на мангафодипир. Первый клинический опыт (Yri et al., 2009 и Karlsson et al., 2011) продемонстрировал, что мангафодипир является терапевтически эффективным при уровне дозирования приблизительно от 2 до 10 мкмоль/кг у человека. Принимая во внимание более высокую эффективность мангафодипира плюс фодипир, можно полагать, что мангафодипир является терапевтически эффективным у пациентов при уровне дозирования, близком к 1 мкмоль/кг. Это в свою очередь указывает, что отношение (фодипир + мангафодипир)/мангафодипир, близкое к 5, т.е. готового к применению состава, содержащего в 4 раза больше фодипира, чем мангафодипира, должно являться эффективным. Кроме того, это подтверждает, что готовый к применению состав, содержащий 40 мМ фодипира и 10 мМ мангафодипира - при введении от 0,1 до 0,2 мл этого состава на кг массы тела - приводит к дозе от 1 до 2 мкмоль/кг мангафодипира и от 4 до 8 мкмоль/кг фодипира.
[0040] Кальций имеет приблизительно в 109 раз более низкую аффинность к фодипиру по сравнению с цинком и приблизительно в 106 раз более низкую аффинность к фодипиру, чем марганец. Однако, принимая во внимание тот факт, что кальций содержится в гораздо более высоких внеклеточных концентрациях, чем цинк и марганец, быстрое внутривенное болюсное введение фодипира может вызывать резкое снижение внеклеточной концентрации свободного кальция вследствие того, что сердце полностью зависит от внеклеточного кальция вследствие его активности накачивать кровь; снижение внеклеточного содержания свободного кальция может в свою очередь вызывать острую сердечную недостаточность. Однако, как описано в WO 2011/004325 A1, эту проблему можно легко решать применением образующего комплекс с кальций DPDP, т.е. CaDPDP.
[0041] Неожиданно было открыто, что CaDPDP можно применять в комплексе с марганцем в производных PLED. Кроме того, неожиданно можно получать комплексные соединения кальция и марганца, например калмангафодипир, и комплексное соединение металлов II группы и переходных металлов III-XII группы.
[0042] Таким образом, по одному из аспектов изобретение относится к смешанному комплексному соединению с металлами соединения формулы I или его соли, где смешанные металлы содержат переходный металл III-XII группы и металл II группы:
Формула I
где
X представляет собой CH или N,
каждый R1 независимо представляет собой водород или -CH2COR5,
R5 представляет собой гидрокси, необязательно гидроксилированный алкокси, амино или алкиламидо,
каждый R2 независимо представляет собой ZYR6, где Z представляет собой связь или C1-3алкиленовую или оксоалкиленовую группу, необязательно замещенную R7,
Y представляет собой связь, атом кислорода или NR6,
R6 представляет собой атом водорода, COOR8, алкильную, алкенильную, циклоалкильную, арильную или аралкильную группу, необязательно замещенную одной или более группами, выбранными из COOR8, CONR82, NR82, OR8, =NR8, =O, OP(O) (OR8)R7 и OSO3M,
R7 представляет собой гидрокси, необязательно гидроксилированную, необязательно алкоксилированную алкильную или аминоалкильную группу,
R8 представляет собой атом водорода или необязательно гидроксилированную, необязательно алкоксилированную алкильную группу,
M представляет собой атом водорода или один эквивалент физиологически приемлемого катиона,
R3 представляет собой C1-8алкиленовую, 1,2-циклоалкиленовую или 1,2-ариленовую группу, необязательно замещенную R7, и
каждый R4 независимо представляет собой водород или C1-3алкил.
[0043] Как используют в настоящем описании, термины "алкил" и "алкилен" включают углеводы с неразветвленной и разветвленной цепью, насыщенные и ненасыщенные. Термин "1,2-циклоалкилен" включает цис- и транс-циклоалкиленовые группы и алкилзамещенные циклоалкиленовые группы, содержащие от 5-8 атомов углерода. Термин "1,2-арилен" включает фенильную и нафтильную группы и их алкилзамещенные производные, содержащие от 6 до 10 атомы углерода. Если не указано иное, любая алкильная, алкиленовая или алкенильная группа может подходящим образом содержать от 1 до 20, более конкретно 1-8, более конкретно 1-6 и даже более конкретно 1-4 атома углерода. Циклоалкильные группы могут подходящим образом содержать 3-18 атомов в кольце, в частности 5-12 атомов в кольце и даже более конкретно 5-8 атомов в кольце. Предпочтительными являются арильные группы, содержащие фенильные или нафтильные группы. В качестве аралкильных групп фенилС1-8алкил, в частности бензил, являются предпочтительными. В случаях, когда группы могут необязательно являться замещенными гидроксильными группами, они могут быть монозамещенными или полизамещенными, и в случае полизамещения алкокси- и/или гидроксильные заместители могут быть замещены алкоксизаместителями.
[0044] Соединение формулы I могут содержать аналогичные или различные группы R2 в двух пиридильных кольцах, и они могут быть присоединены в одних и тех же или различных положениях в кольце. В конкретном варианте осуществления замена происходит в положениях 5 и 6 или более конкретно положении 6, т.е. пара-положении по отношению к гидроксильной группе. В конкретном варианте осуществления группы R2 являются идентичными и идентично расположенными и более конкретно находятся в 6,6ʹ-положениях. В еще более конкретных вариантах осуществления каждый R6 представляет собой моно- или поли(гидрокси или алкоксилированную)алкильную группу или группу формулы OP(O)(OR8)R7.
[0045] В другом варианте осуществления изобретение относится к комплексному соединению с кальцием и магнием соединения формулы I. В одном из вариантов осуществления R5 представляет собой гидрокси, C1-8алкокси, этиленгликоль, глицерин, амино или C1-8алкиламидо, Z представляет собой связь или группу, выбранную из CH2, (CH2)2, CO, CH2CO, CH2CH2CO и CH2COCH2, Y представляет собой связь, R6 представляет собой моно- или поли(гидрокси или алкоксилированную)алкильную группу или группу формулы OP(O)(OR8)R7, и R7 представляет собой гидрокси или незамещенную алкильную или аминоалкильную группу. В более конкретном варианте осуществления R представляет собой этилен, и каждая группа R1 представляет собой -CH2COR5, в которой R5 представляет собой гидрокси. В дополнительном варианте осуществления соединение формулы I представляет собой N,Nʹ-бис(пиридоксаль-5-фосфат)-этилендиамин-N,Nʹ-диуксусную кислоту (DPDP) или ее фармацевтически приемлемую соль. В дополнительных вариантах осуществления фармацевтическое вещество представляет собой смешанной комплексное соединение с марганцем и кальцием N,Nʹ-бис(пиридоксаль-5-фосфат)-этилендиамин-N,Nʹ-диуксусной кислоты или ее соли.
[0046] Смешанное комплексное соединение с металлами может включать любую комбинацию металлов из указанных групп. В конкретном варианте осуществления переходный металл III-XII группы представляет собой Mn2+, Cu2+, Fe2+ и/или Ni2+, и металл II группы представляет собой Ca2+ и/или Mg2+. В более конкретном варианте осуществления переходный металл III-XII группы представляет собой Mn2+, и металл II группы представляет собой Ca2+ или смесь Ca2+ и Mg. В более конкретных вариантах осуществления металл II группы представляет собой смесь Ca2+ и Mg2+ с молярным отношением Ca2+/Mg2+ приблизительно 0,1-50, более конкретно приблизительно 0,1-10.
[0047] В дополнительных вариантах осуществления смешанное комплексное соединение с металлами содержит молярное отношение металла II группы к переходному металлу III-XII группы приблизительно 1-10. В конкретном варианте осуществления переходный металл III-XII группы представляет собой Mn2+, и металла II группы представляет собой Ca2+, и молярное отношение Ca2+/Mn2+ составляет приблизительно 4. В более конкретном варианте осуществления переходный металл III-XII группы представляет собой Mn2+, и металл II группы представляет собой Ca2+, и молярное отношение Ca2+/Mn2+ составляет приблизительно 4, и соединение формулы I представляет собой DPDP, т.е. комплексное соединение представляет собой соединение калмангафодипира, как описано в настоящем описании.
[0048] В другом аспекте изобретение относится к способу получения смешанного комплексного соединения с металлами по изобретению за одно получение/стадию кристаллизации. Способ включает одностадийную кристаллизацию из раствора переходного металла III-XII группы, металла II группы и соединения формулы I. В конкретном варианте осуществления проводят одностадийную кристаллизацию из раствора марганца, кальция и соединения формулы I. В более конкретном варианте осуществления раствор имеет отношение (Ca+Mn)/Mn, близкое к (4+1)/1=5, т.е. с композицией, стехиометрически близкой к Ca4Mn(DPDP)5.
[0049] Рентгеновская порошковая дифрактометрия (XRPD) наиболее широко используется для идентификации и характеристики кристаллических твердых веществ, каждое из которых дает отличную от других картину дифракционной решетки. Положения (соответствующие периодам ре