Производные n-ацилгидразона для использования в качестве селективных ингибиторов т-клеток и медикаментов для лечения лимфонеоплазии
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы 1, его (Е)-стереоизомеру или фармацевтически приемлемой соли:
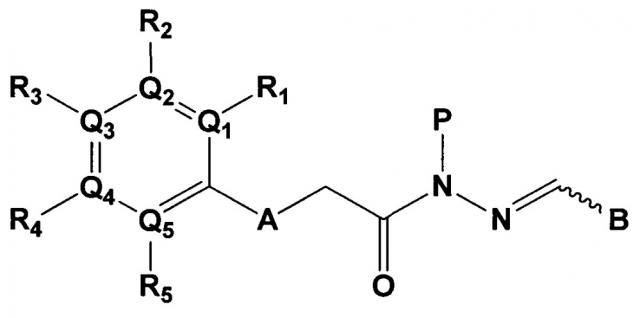
[Формула 1]
. Технический результат: получены новые соединения, обладающие ингибиторной активностью в отношении Т-клеток, которые могут быть использованы для приготовления фармацевтических композиций для предотвращения или лечения заболеваний, где заболевание является реакцией «трансплантат против хозяина» (РТПХ) после трансплантации органов или гематопоэтических стволовых клеток, множественным склерозом, ревматоидным артритом или лимфонеоплазией. 2 н. и 6 з.п. ф-лы, 16 табл., 143 пр., 5 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к новым производным N-ацилгидразона и, более конкретно, к новым производным N-ацилгидразона, обладающим ингибиторной активностью в отношении Т-клеток и/или активностью против лимфонеоплазии, их стереоизомерам и фармацевтически приемлемым солям, их использованию для приготовления фармацевтических композиций, фармацевтическим композициям, их содержащим, способам лечения с помощью этих композиций и способам получения новых производных N-ацилгидразона.
УРОВЕНЬ ТЕХНИКИ
Иммунодепрессивные медикаменты
Ключевой задачей трансплантологии является подавление иммунного ответа, ведущего к отторжению трансплантата. Таким образом, разработка иммунодепрессивных медикаментов, способных селективно и эффективно регулировать иммунный ответ по отношению к имплантату, является ключевой целью для повышения успешности трансплантаций. Т-клетки являются основными мишенями для предотвращения отторжения трансплантатов, и большинство клинически применяемых иммунодепрессивных медикаментов ингибируют ответ Т-клеток.
Азатиоприн является первым иммунодепрессивным агентом, применяемым при трансплантации органов. Однако азатиоприн ингибирует синтез ДНК, что приводит к развитию таких побочных эффектов, как лейкопения, макроцитоз и подавление роста костного мозга, по причине чего азатиоприн был переведен в терапию второй линии после введения циклоспорина. Циклоспорин и такролимус, ингибиторы кальциневрина, используются в настоящее время при трансплантации органов в качестве терапии первой линии.
Эти два медикамента блокируют экспрессию интерлейкина-2 (IL-2) путем ингибирования кальциневрина. Далее эти медикаменты могут подавлять активацию Т-клеток на ранней стадии, тем самым сильно подавляя иммунный ответ, приводящий к отторжению трансплантата. Однако, эти медикаменты необходимо принимать в течение длительного времени, и они вызывают такие побочные эффекты, как нефротоксичность, анемия и гипертония, а также инфекционные и онкологические заболевания в результате ослабления иммунной системы. В последние годы, с целью уменьшения побочных эффектов ингибиторов кальциневрина, в комбинации с ингибитором кальциневрина применяли мофетила микофенолат (ингибитор нуклеотидного синтеза), но он вызывает такие побочные эффекты, как болезни пищеварительного тракта, лейкопению и анемию.
Сиролимус и эверолимус, ингибиторы mTOR (мишень рапамицина в клетках млекопитающих), являются медикаментами, ингибирующими пролиферацию Т-клеток путем блокады сигнальных путей рецептора IL-2. Эти медикаменты в основном назначаются в комбинации с ингибитором кальциневрина, потому что эффективность этих медикаментов самих по себе невелика. Однако, эти медикаменты усиливают побочные эффекты ингибитора кальциневрина, такие как гиперлипидемия и тромбоцитопения.
FTY720, антагонист сфингозин-1-фосфата, является медикаментом, уменьшающим иммунные ответы путем блокировки миграции Т-клеток от лимфоидных органов к имплантатам, и в сравнении с другими медикаментами обладает низкой токсичностью. Однако FTY720 при приеме с другими медикаментами (например, анестетиками и бета-блокираторами общего действия) может вызывать инфаркт. В области трансплантации органов, комбинированная терапия с использованием циклоспорина находится в стадии клинических испытаний (см. N Engl J Med. 351, 2715-2729; N Engl J Med. 352, 1371-1373; Nat Med. 11, 605-613; Business Insights. 2010, BI 00022-067).
Как было описано выше, используемые в настоящее время для предотвращения отторжения трансплантатов иммунодепрессанты токсичны и вызывают такие побочные эффекты, как воспаления и онкологические заболевания, вследствие ослабления иммунной системы. Поэтому необходима разработка новых медикаментов, способных селективно разрушать Т-клетки, реагирующие на трансплантационные антигены.
Реакция "трансплантат против хозяина"
Аллогенная трансплантация гематопоэтических стволовых клеток (ТГСК, HSCT) является наиболее эффективным и постоянным способом лечения различных злокачественных заболеваний крови и иммунодефицитных заболеваний и используется для лечения более 20000 пациентов в год во всем мире (согласно отчету Центра международных исследований трансплантации крови и костного мозга, CIBMTR). В последние годы предпринимались попытки применения ТГСК при аутоиммунных заболеваниях, солидном раке и трансплантациях. Несмотря на быстрое развитие аллогенной трансплантации гематопоэтических стволовых клеток (например, разработка технологии идентификации антигенов лейкоцитов человека (HLA) и новых иммунодепрессантов) в последние 20 лет, реакция «трансплантат против хозяина» (РТПХ, GVHD), являющаяся осложнением, вызываемым Т-клетками донора, все еще остается главной причиной пост-трансплантационной смертности. Острая РТПХ (степени II-IV), которая развивается в основном в первые 100 дней после трансплантации, проявляется у 25-60% пациентов в случае идентичности HLA между кровными родственниками и у 45-70% пациентов в случае отсутствия кровной родственной связи, и 70% пациентов с этим заболеванием (III-IV степени) умирает. Острая РТПХ развивается в три стадии. Во время первой стадии, провоспалительные факторы (TNF-α и LPS), образующиеся после высоких доз химиотерапии и системной радиационной терапии перед трансплантацией, активируют дендритные клетки периферических лимфоидных органов. Во второй стадии, аллоантиген-специфичные Т-клетки, порождаемые активированными дендритными клетками, дифференцируют в эффекторные клетки. На последней стадии, аллоантиген-специфичные эффекторные Т-клетки мигрируют в кишечник, печень и кожу, которые являются главными мишенями, и вызывают там воспалительные повреждения тканей.
Доля положительного ответа на действие ингибитора кальциневрина, который применяется в качестве терапии первой линии для предотвращения острой РТПХ, составляет менее 50%, и таким образом доля предотвращения очень низка в сравнении с количеством трансплантаций. Лечение после развития РТПХ зависит от стероидной терапии, но стероидная терапия демонстрирует долю положительного ответа менее 50%, и поэтому классифицируется как терапия высокого риска с высокой смертностью (см. Annu Rev Immunol. 25, 139-170; Blood. 114, 4327-4336; Lancet. 373, 1550-1561, Curr Opin Immunol. 11, 509-515). Таким образом, срочно необходимо развитие новых эффективных медикаментов для предотвращения и лечения острой РТПХ.
Множественный склероз
Множественный склероз является воспалительным заболеванием центральной нервной системы (ЦНС), которое является аутоиммунным заболеванием, вызываемым реакцией Т-клеток на происходящий от миелина антиген. На начальной стадии заболевание развивается по рецидивно-ремиссионной схеме и затем прогрессирует во вторичный прогрессивный множественный склероз вследствие нарастающего накопления повреждений головного и спинного мозга. Нарастающее накопление повреждений головного и спинного мозга ведет к потере зрения, нарушению баланса и движений, нарушению речи и сенсорики, двустороннему параличу, нарушению половой функции и сложностям с мочеотделением и дефекацией; в тяжелых случаях приводит к общему параличу.
Терапия при лечении множественного склероза в основном делится на лечение обострений болезни, терапию, изменяющую течение заболевания, симптоматическую терапию и профилактическую терапию. Лечение обострений болезни проводят для снижения воспаления и создания иммунодепрессивного эффекта, а терапию, изменяющую течение заболевания применяют для задержки прогрессирования заболевания, т.е. для предотвращения развития прогрессирующего множественного склероза.
При лечении обострений болезни, с целью облегчения симптомов и предотвращения получения перманентных повреждений, в течение 3-5 дней внутривенно вводят высокие дозы (500-1000 мг/кг) глюкокортикоидов. Глюкокортикоиды ингибируют миграцию иммунных клеток в мозг и уменьшают отек, тем самым ингибируя воспаление, возникающее на острой стадии (см. Immunology and Cell Biology. 76, 55-64; Annu. Rev. Immunol. 20, 125-163). Хотя глюкокортикоиды оказывают крайне положительный эффект при применении во время острой стадии болезни, они не могут предотвратить прогрессирование заболевания в качестве терапии, изменяющей течение болезни.
В качестве терапии, изменяющей течение болезни, проводят иммунотерапию, призванную излечить заболевание и предотвратить его рецидивы. Медикаментами, одобренными Управлением по контролю продуктов питания и лекарственных средств США (US FDA) для применения в качестве иммунотерапии, являются интерферон-бета (IFN-β), глатирамер ацетат (GA), митоксантрон и натализумаб. Однако, они обладают следующими побочными эффектами (см. N Engl J Med. 362, 456-458):
IFN-β, наиболее популярный в настоящее время препарат, обладает противовоспалительным и антивирусным эффектом, ингибирует экспрессию антигенов и предотвращает активацию Т-клеток. Кроме того, IFN-β активирует костимуляторные молекулы для стимулирования апоптоза аутореактивных клеток. Однако, IFN-β можно вводить только внутримышечным или подкожным путем, и при его введении в течение длительного времени он вызывает эритему и отек в месте введения, а также такие побочные эффекты, как мышечную боль, озноб и аутоиммунные заболевания.
Митоксантрон (новатрон) имеет очень малую молекулярную массу, поэтому он проникает через мягкие мозговые оболочки и ингибирует пролиферацию Т-клеток, В-клеток и макрофагов в мягких мозговых оболочках и антиген-представляющую функцию антиген-представляющих клеток (APCs), тем самым облегчая симптомы множественного склероза. Однако, дозировка митоксантрона должна быть ограничена, так как он оказывает тяжелую нагрузку на сердце.
Глатирамер ацетат (ГА, GA) является аналогом основного миелинового белка (ОМБ, МВР). ГА образует ГА/ОМБ комплекс при связывании ОМБ с молекулой HLA класса II, тем самым ингибируя активацию ОМБ-реактивных Т-клеток путем конкурирования с ОМБ при его связывании с рецептором Т-клеток (TCR). ГА обладает эффектом снижения количества рецидивов во время рецидивно-ремиссионного множественного склероза и облегчает симптомы множественного склероза при его рецидивах, наподобие IFN-β, но также увеличивает частоту развития постоянных «черных дыр» в центральной нервной системе, по сравнению с IFN-β.
Натализумаб является гуманизированным моноклональным антителом, связывающимся напрямую с α4 подгруппой (CD49; адгезионная молекула на поверхности лейкоцитов) интегрина VLA-4 (very late antigen-4) для предотвращения связывания между лейкоцитами и васкулярными эндотелиальными клетками, тем самым предотвращая вхождение активных Т-клеток в центральную нервную систему. Он демонстрирует отличную эффективность в отношении рецидивно-ремиссионного множественного склероза, но обладает побочным эффектом в виде развития прогрессирующей мультифокальной лейкоэнцефалопатии (PML) у 0,3-0,9% пациентов после 2 лет приема.
Финголимод является синтетическим аналогом S1P (сфингозин 1-фосфат) рецептора мириоцина и является первым медикаментом для орального приема, недавно одобренным Управлением по контролю продуктов питания и лекарственных средств США (US FDA).
Финголимод предотвращает перемещение активированных лимфоцитов от вторичных лимфоидных тканей в центральную нервную систему путем связывания S1PR с поверхностью активированных хелперных Т-клеток 1 типа. Однако, сообщалось о таких побочных эффектах, как инфекция, макулярный отек, головная боль, грипп, диарея, люмбаго и повышения уровня печеночных ферментов (см. Nat. Rev. Neurol. 7, 255-262; Nat Rev Drug Discov. 11, 909-925).
Таким образом, существует потребность в разработке новых медикаментов, которые способны блокировать прогрессирование вторичного множественного склероза, демонстрируя при этом высокую терапевтическую эффективность при кратковременном оральном приеме (см. N Engl J Med. 362, 456-458).
Лимфонеоплазия
При употреблении в этом тексте, термин «лимфонеоплазия» относится к раку лимфатических клеток (В-клеток, Т-клеток и NK/T-клеток) в костном мозге и лимфоидной ткани. Лимфонеоплазия в целом подразделяется на лейкемию, лимфому и множественную миелому. Лимфоидная лейкемия является раком крови, при котором незрелые лимфоциты в костном мозге превращаются в раковые клетки, которые аккумулируются в ткани и распространяются системно через кровь. Лимфоидная лейкемия в целом подразделяется на острую лимфоидную лейкемию и хроническую лимфоидную лейкемию. Лимфома является раком крови, при котором лимфоциты в лимфоидной ткани превращаются в раковые клетки, аккумулируются в ткани и распространяются в периферическую кровь и костный мозг. Она подразделяется на лимфому Ходжкина и неходжкинскую лимфому. Множественная миелома является раком крови, при котором клетки плазмы в периферической лимфоидной ткани превращаются в раковые клетки, которые затем аккумулируются в костном мозге (см. see J Clin Invest. 2012; 122:3396-3397; Blood. 1994; 84:1361-1392; Lancet. 2012; 380:848-857).
Лечение лимфонеоплазии проводится с помощью стандартной химиотерапии с применением комбинации циклофосфамида, доксорубицина, винкристина и преднизона. В отношении начальной ответной эффективности этих медикаментов, ремиссия у взрослых пациентов наступает приблизительно в 85% случаев, однако также высока вероятность рецидива: пятилетний срок выживания без рецидива болезни составляет только 30-40%. Кроме того, при приеме этих медикаментов высок риск инфекции из-за их высокой цитотоксичности, также они часто вызывают такие побочные эффекты как нейротоксичность, проблемы с пищеварением и кровотечения (см. N Engl J Med. 1998; 339:21-26; N Engl J Med 2006; 354:166-78; Nat Rev Drug Discov. 2007; 6:149-165).
Согласно недавним сообщениям, медикаменты, обладающие цитотоксичным эффектом в отношении специфических клеток, также обладают противораковым эффектом, если эти клетки превращаются в раковые. Общалось, что иммунодепрессант В-клеток ибрутиниб, ингибирующий тирозинкиназу Брутона (BTK), являющуюся сигнальным медиатором рецептора В-клеток (BCR), обладает противораковым действием в отношении рецидивирующей или устойчивой к лечению лимфомы В-клеток. Бортезомиб, ингибитор NF-kB активности, используется в качестве иммунодепрессанта для ингибирования Т-клеток и В-клеток. Бортезомиб был одобрен Управлением по контролю продуктов питания и лекарственных средств США (US FDA) в качестве терапевтического агента для лечения множественного склероза и также недавно использовался в комбинации с ибрутинибом для лечения лимфомы В-клеток. Субероиланилид гидроксамовой кислоты (SAHA), являющийся ингибитором гистон деацетилазы (HDACi), обладает противораковым эффектом в отношении кожной лимфомы Т-клеток. Ингибиторный эффект SAHA в отношении заболевания «трансплантат против хозяина» (GVHD) был недавно обнаружен на животных моделях, вследствие чего SAHA вызвал интерес в качестве иммунодепрессанта (см. Semin Cancer Biol. 2011 Nov; 21:335-46; Br J Haematol. 2013; 161:43-56; N Engl J Med. 2008; 359:906-917; Nat Rev Drug Discov. 2006; 5:769-784; J. Clin. Invest. 2008; 118:2562-2573). Таким образом, иммунодепрессивные медикаменты, нацеленные на специфические иммунные клетки, можно клинически использовать в качестве новых противораковых агентов, способных специфично воздействовать на специфические формы рака.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
Целью данного изобретения является предоставление новых соединений, способных селективно и эффективно удалять трансплантационные антиген- и аутоантиген-специфичные Т-клетки, которые тем самым можно использовать в качестве агентов для предотвращения и лечения трансплантационного иммунного отторжения и/или лечения аутоиммунных заболеваний. Кроме того, целью данного изобретения является предоставление новых соединений, обладающих прекрасной апоптической эффективностью против лимфолейкозных клеток, и вследствие этого могут использоваться в качестве агентов для лечения лимфонеоплазии.
Таким образом, целью данного изобретения является предоставление новых производных N-ацилгидразона, обладающих селективной ингибиторной активностью в отношении Т-клеток и/или анти-лимфолейкозной активностью, их стереоизомеров, фармацевтически активных солей, фармацевтических композиций, их содержащих, способов лечения с использованием этих композиций, и способов получения новых производных N-ацилгидразона.
Техническое решение
Данное изобретение относится к соединению следующей формулы 1, его стереоизомерам или его фармацевтически приемлемой соли:
[Формула 1]
в котором
А является N-H, О, или S;
Q1, Q2, Q3, Q4 и Q5 каждый независимо являются С или N;
R1, R2, R3, R4 и R5 группы каждая независимо являются отсутствующей, или являются -Н, -CF3, -F, -Br, -Cl, цианидом, -СН2ОН группой, -(CO)NH2 группой, -(С1-С6)алкил группой, -(С1-3)алкокси группой, -NH2 группой, -N(CH3)2 группой, или 4, 5 или 6-членным гетероарилом или гетероциклоалкилом, содержащим от 1 до 3 членов выбранных из группы, состоящей из N, О и S (упомянутый гетероарил или гетероциклоалкил содержит по меньшей мере один заместитель выбираемый из -Н, галогена и амина);
Р является -Н, -(С1-С3)ОН группой, -(С1-С6)алкил группой, -(СО)(С1-С6)алкил группой;
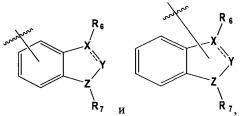
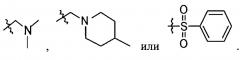
В выбирают из группы, состоящей из:
в которой, X, Y и Z каждый независимо являются С, N или S, и
R6 и R7 каждый независимо отсутствует, или является -Н, -Br, -(С1-С6)алкил группой, -(C1-С3)ОН группой,
В одном аспекте данного изобретения, соединения формулы 1 далее описываются следующим образом:
А является N-H, О или S;
Q1, Q2, Q3, Q4 и Q5 являются С;
R2 и R4 являются Н;
R1, R3 и R5 каждый независимо являются -Н, -F, -Br, -Cl, метилгруппой, этилгруппой, -СН2ОН группой, цианидом, -NH2 группой, или 4, 5 или 6-членным гетероарилом или гетероциклоалкилом, содержащим от 1 до 3 членов, выбранных из группы, состоящей из N, О и S;
Р является -Н, метилом, -CH2OH группой, -СН2СН2 ОН группой,
В выбирают из группы, состоящей из:
в которой Х и Y является С,
Z является N, и
R6 и R7 каждый независимо являются -Н, метилом или -СН2СН2ОН группой.
Соединения по формуле 1, согласно данному изобретению, могут в целом использоваться в виде фармацевтически приемлемой соли. Фармацевтически приемлемые соли включают фармацевтически приемлемые соли присоединения основания или соли присоединения кислоты, например, соли металлов, такие как соли щелочных и щелочноземельных металлов, соли аммония, соли присоединения органических аминов, соли присоединения аминокислот и сульфонатные соли. Соли присоединения кислоты включают соли присоединения неорганической кислоты, такие как соль хлористого водорода, соль серной кислоты и соль фосфорной кислоты; и соли присоединения органической кислоты, такие как алкил сульфонат, арил сульфонат, ацетат, малат, фумарат, тартрат, цитрат и лактат. Примеры солей металлов включают соли щелочных металлов, такие как соль лития, соль натрия и соль калия; соли щелочноземельных металлов, такие как соль магния, соль кальция, соль алюминия и соль цинка. Примеры солей аммония включают соль аммония и соль тетраметиламмония. Примеры солей присоединения органических аминов включают соли с морфолином и пиперидином. Примеры солей присоединения аминокислот включают соли с глицином, фенилаланином, глутаминовой кислотой и лизином. Примеры сульфонатных солей включают мезилат, тозилат и соли бензолсульфоновой кислоты.
Термин "стереоизомер" означает изомерные молекулы, имеющие одинаковую молекулярную формулу и связи, но отличающиеся своей трехмерной ориентацией.
Специфические примеры предпочтительных соединений формулы 1 по данному изобретению включают:
Соединение 065
(E)-N'-((1Н-индол-4-ил)метилен)-2-(мезитилокси)ацетогидразид;
Соединение 092
(Е)-N'-((1Н-индол-5-ил)метилен)-2-(4-бром-2,6-диметилфенокси)ацетогидразид;
Соединение 108
(E)-N'-((1Н-индол-6-ил)метилен)-2-(мезитилокси)ацетогидразид;
Соединение 109
(E)-N'-((1Н-индол-2-ил)метилен)-2-(мезитилокси)ацетогидразид;
Соединение 112
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(4-бром-2,6-диметилфенокси)ацетогидразид;
Соединение 133
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(4-бром-2,6-диметилфенокси)ацетогидразид;
Соединение 135
(E)-N'-((1Н-индол-4-ил)метилен)-2-(мезитиламино)ацетогидразид;
Соединение 137
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(2,6-диметил-4-(пиридин-3-ил)фенокси)ацетогидразид;
Соединение 139
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2,6-диметил-4-(пиридин-3-ил)фенокси)ацетогидразид;
Соединение 146
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(2-(пиридин-3-ил)фенокси)ацетогидразид;
Соединение 147
(E)-N'-((1Н-индол-4-ил)метилен)-2-(мезитилтио)ацетогидразид;
Соединение 149
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(2,6-диметил-4-(пиримидин-5-ил)фенокси)ацетогидразид;
Соединение 155
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(4-хлор-2,6-диметилфенокси)ацетогидразид;
Соединение 156
(Е)-N'-((1Н-индол-3-ил)метилен)-2-(4-хлор-2,6-диметилфенокси)ацетогидразид;
Соединение 157
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(4-хлор-2,6-диметилфенокси)ацетогидразид;
Соединение 158
(Е)-N'-((1Н-индол-3-ил)метилен)-2-(мезитилтио)ацетогидразид;
Соединение 159
(E)-N'-((1Н-индол-6-ил)метилен)-2-(мезитилтио)ацетогидразид;
Соединение 164
(Е)-2-(мезитилокси)-N-метил-N'-((1-метил-1Н-индол-4-ил)метилен)ацетогидразид;
Соединение 177
(Е)-N'-((1Н-индол-4-ил)метилен)-N-(2-гидроксиэтил)-2-(мезитилокси)ацетогидразид;
Соединение 180
(E)-N'-((1-(2-гидроксиэтил)-1Н-индол-4-ил)метилен)-2-(мезитилокси)ацетогидразид;
Соединение 182
(E)-N'-((1Н-индол-4-ил)метилен)-2-(2,4-диметил-6-(пиридин-3-ил)фенокси)ацетогидразид;
Соединение 183
(E)-N'-((1Н-индол-6-ил)метилен)-2-(2,4-диметил-6-(пиридин-3-ил)фенокси)ацетогидразид;
Соединение 184
(Е)-N'-((1Н-индол-5-ил)метилен)-2-(2,4-диметил-6-(пиридин-3-ил)фенокси)ацетогидразид;
Соединение 187
(E)-N'-((1Н-индол-4-ил)метилен)-2-((2-метилпиридин-3-ил)окси)ацетогидразид;
Соединение 195
(Е)-N'-((1Н-индол-6-ил)метилен)-N-(2-гидроксиэтил)-2-(мезитилокси)ацетогидразид;
Соединение 217
(E)-N'-((1Н-индол-6-ил)метилен)-2-(2,4-диметил-6-(пиридин-4-ил)фенокси)ацетогидразид;
Соединение 218
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2-(фуран-3-ил)-4,6-диметилфенокси)ацетогидразид;
Соединение 227
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(4-(гидроксиметил)-2,6-диметилфенокси)ацетогидразид;
Соединение 228
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(4-(гидроксиметил)-2,6-диметилфенокси)ацетогидразид;
Соединение 229
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2,4-диметил-6-(тетрагидрофуран-3-ил)фенокси)ацетогидразид;
Соединение 232
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(4-амино-2,6-диметилфенокси)ацетогидразид;
Соединение 233
(Е)-N'-((1Н-индол-6-ил)метилен)-N-(гидроксиметил)-2-(мезитилокси)ацетогидразид;
Соединение 236
(Е)-(2-((1Н-индол-6-ил)метилен)-1-(2-(мезитилокси)ацетил)гидразинил)метил 2-(диметиламино)ацетат;
Соединение 237
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(4-циано-2,6-диметилфенокси)ацетогидразид;
Соединение 238
(Е)-(2-((1Н-индол-4-ил)метилен)-1-(2-(мезитилокси)ацетил)гидразинил)метил 2-(диметиламино)ацетат;
Соединение 243
(Е)-N'-((1Н-индол-6-ил)метилен)-N-ацетил-2-(мезитилокси)ацетогидразид;
Соединение 244
(Е)-N'-((1Н-индол-4-ил)метилен)-N-(гидроксиметил)-2-(мезитилокси)ацетогидразид;
Соединение 245
(Е)-(2-((1Н-индол-4-ил)метилен)-1-(2-(мезитилокси)ацетил)гидразинил)метил 4-(морфолинометил)бензоат;
Соединение 252
(Е)-(2-((1Н-индол-6-ил)метилен)-1-(2-(мезитилокси)ацетил)гидразинил)метил ацетат;
Соединение 258
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2,6-диметилфенокси)ацетогидразид;
Соединение 259
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(2-бром-4,6-диметилфенокси)ацетогидразид;
Соединение 260
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2-бром-4,6-диметилфенокси)ацетогидразид;
Соединение 272
(Е)-(2-((1Н-индол-6-ил)метилен)-1-(2-(мезитилокси)ацетил)гидразинил)метил 4-(морфолинометил)бензоат;
Соединение 311
(E)-N'-((1Н-индол-6-ил)метилен)-2-(2-метил-6-(тетрагидрофуран-3-ил)фенокси)ацетогидразид;
Соединение 312
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(2-метил-6-(тетрагидрофуран-3-ил)фенокси)ацетогидразид;
Соединение 313
(E)-N'-((1Н-индол-6-ил)метилен)-2-(2-(фуран-3-ил)-6-метилфенокси)ацетогидразид;
Соединение 314
(E)-N'-((1Н-индол-4-ил)метилен)-2-(2-(фуран-3-ил)-6-метилфенокси)ацетогидразид;
Соединение 317
(E)-N'-((1Н-индол-4-ил)метилен)-2-(2-(фуран-2-ил)-4,6-диметилфенокси)ацетогидразид;
Соединение 319
(Е)-N'-((1Н-индол-4-ил)метилен)-2-((2-(фуран-3-ил)пиридин-3-ил)окси)ацетогидразид;
Соединение 320
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(2,4-диметил-6-(тетрагидрофуран-3-ил)фенокси)ацетогидразид;
Соединение 322
(E)-N'-((1Н-индол-6-ил)метилен)-2-(4-(фуран-3-ил)-2,6-диметилфенокси)ацетогидразид;
Соединение 323
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2,6-диметил-4-(тетрагидрофуран-3-ил)фенокси)ацетогидразид;
Соединение 329
(E)-N'-((1Н-индол-4-ил)метилен)-2-((2-этил-6-метилпиридин-3-ил)окси)ацетогидразид;
Соединение 331
(E)-N'-((1Н-индол-6-ил)метилен)-2-((2-(пирролидин-1-ил)пиридин-3-ил)окси)ацетогидразид;
Соединение 332
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2,4-диметил-6-(тетрагидрофуран-2-ил)фенокси)ацетогидразид;
Соединение 333
(E)-N'-((1Н-индол-4-ил)метилен)-2-(2-(фуран-3-ил)-4,6-диметилфенокси)ацетогидразид;
Соединение 336
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(4-(фуран-3-ил)-2,6-диметилфенокси)ацетогидразид;
Соединение 337
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(2,6-диметил-4-(тетрагидрофуран-3-ил)фенокси)ацетогидразид;
Соединение 343
(Е)-N'-((1Н-индол-6-ил)метилен)-2-((2-(тиофен-3-ил)пиридин-3-ил)окси)ацетогидразид;
Соединение 344
(E)-N'-((1Н-индол-4-ил)метилен)-2-(2,4-диметил-6-(тиофен-2-ил)фенокси)ацетогидразид;
Соединение 346
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(2-(фуран-2-ил)-4-метоксифенокси)ацетогидразид;
Соединение 375
(Е)-2-(2,4-диметил-6-(тетрагидрофуран-3-ил)фенокси)-N-метил-N'-((1-метил-1Н-индол-6-ил)метилен)ацетогидразид;
Соединение 378
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(4-фтор-2-метил-6-(тетрагидрофуран-3-ил)фенокси)ацетогидразид;
Соединение 379
(Е)-N'-((1Н-индол-4-ил)метилен)-2-(4-фтор-2-метил-6-(тетрагидрофуран-3-ил)фенокси)ацетогидразид;
Соединение 380
(Е)-2-(4-фтор-2-метил-6-(тетрагидрофуран-3-ил)фенокси)-N-метил-N'-((1-метил-1Н-индол-6-ил)метилен)ацетогидразид; и
Соединение 457
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2,4-диметил-6-(тетрагидро-2Н-пиран-4-ил)фенокси)ацетогидразид.
Специфические примеры более предпочтительных соединений формулы 1 по данному изобретению включают:
Соединение 065
(E)-N'-((1Н-индол-4-ил)метилен)-2-(мезитилокси)ацетогидразид;
Соединение 108
(E)-N'-((1Н-индол-6-ил)метилен)-2-(мезитилокси)ацетогидразид;
Соединение 229
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2,4-диметил-6-(тетрагидрофуран-3-ил)фенокси)ацетогидразид; и
Соединение 457
(Е)-N'-((1Н-индол-6-ил)метилен)-2-(2,4-диметил-6-(тетрагидро-2Н-пиран-4-ил)фенокси)ацетогидразид.
Данное изобретение также представляет фармацевтические композиции, включающие производные N-ацилгидразона формулы 1, их стереоизомеры или их фармацевтически приемлемые соли; и фармацевтически приемлемый носитель.
Предпочтительным образом, такая композиция используется для предотвращении или лечения заболевания, ассоциирующегося с ингибированием активности Т клеток. Специфические примеры таких заболеваний включают заболевание «трансплантат против хозяина» (GVHD) после трансплантации гематопоэтических стволовых клеток или после трансплантации органов, множественный склероз и ревматоидный артрит.
Предпочтительным образом, такая композиция используется для лечения лимфонеоплазии. Специфические примеры лимфонеоплазии включают Т лимфоидную лейкемию, В лимфоидную лейкемию, NK лейкемию, NKT лейкемию, множественную миелому, Т лимфому и В лимфому.
Полезные эффекты
Данное изобретение представляет новые соединения обладающие N-ацилгидразоновой структурой, которые можно использовать в качестве селективных ингибиторов Т клеток и/или анти-лимфолейкозых медикаментов.
Эти соединения эффективно ингибируют активные Т клетки. А именно, эти соединения селективно и эффективно удаляют Т-клетки, специфичные к трансплантационным антигенам и аутоантигенам, и тем самым могут использоваться для предотвращения и лечения реакции иммунного отторжения после трансплантации и лечения аутоиммунных заболеваний. Такими примерами служат заболевание «трансплантат против хозяина» (GVHD) после трансплантации гематопоэтических стволовых клеток или после трансплантации органов, множественный склероз и ревматоидный артрит, и др.
Кроме того, эти соединения обладают превосходным апоптическим эффектом по отношению к лимфолейкозным клеткам, и таким образом могут использоваться как агенты для лечения лимфонеоплазии. Такие примеры включают Т лимфоидную лейкемию, В лимфоидную лейкемию, NK лейкемию, NKT лейкемию, множественную миелому, Т лимфому и В лимфому, и др.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 и 2 изображены результаты теста ингибиторной активности соединений по данному изобретению против аллоантиген-специфичных Т клеток в условиях клеточной культуры.
На Фиг. 3 изображены результаты теста ингибиторной активности соединений по данному изобретению против аллоантиген-специфичных Т клеток.
На Фиг. 4 изображены результаты теста ингибиторной активности соединений по данному изобретению против острого заболевания «трансплантат против хозяина».
На Фиг. 5 изображены результаты теста терапевтической активности соединений по данному изобретению в отношении множественного склероза.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Получение соединений
Соединения формулы 1 по данному изобретению можно получить способами, известными из различных источников. Способы получения соединений формулы 1 будут далее подробно описаны с нижеследующими схемами и примерами.
[Схема 1]
Синтез соединения 1-2 (реакция с метил бромацетатом):
Соединение 1-1 и метил бромацетат растворили в ацетонитриле, и затем добавили карбонат цезия, после чего перемешивали. По окончании реакции, реакционную смесь отфильтровали сквозь цеолиты чтобы удалить карбонат цезия, упарили при пониженном давлении, и очистили с получением соединения 1-2,
Синтез соединения 1-3 (реакция с гидразином):
Соединение 1-2 и гидразин моногидрат растворили в этаноле, после чего перемешивали. По окончании реакции, реакционную смесь упарили при пониженном давлении, и очистили с получением соединения 1-3 в виде твердого вещества белого цвета.
Синтез соединения 1-4 (реакция с альдегидом):
Соединение 1-3 и альдегид растворили в этаноле, после чего перемешивали. По окончании реакции, реакционную смесь упарили при пониженном давлении чтобы удалить этанол, после чего очистили с получением соединения 1-4,
Тем же способом можно синтезировать соединения 013, 014, 034, 065, 083, 092, 100, 108, 109, 112, 118, 121, 127, 133, 135, 136, 137, 138, 139, 146, 147, 149, 152, 155, 156, 157, 158, 159, 180, 182, 183, 184, 187, 190, 191, 192, 193, 194, 196, 205, 206, 211, 217, 218, 227, 228, 229, 237, 256, 258, 259, 260, 279, 280, 286, 288, 291, 293, 301, 302, 303, 304, 310, 311, 312, 313, 314, 317, 318, 319, 320, 322, 323, 326, 327, 329, 330, 331, 332, 333, 336, 337, 343, 344, 345, 346, 347, 356, 358, 359, 378, 379 и 457,
Пример 1. Синтез соединения 013
Стадия 1. Получение метил 2-(о-тозилокси)ацетата: о-Крезол (5 г, 46,24 ммоль) растворили в диметилформамиде. Метил бромацетат (7,1 г, 46,24 ммоль) и карбонат калия (19 г, 138,42 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 1 часа. По окончании реакции, к реакционной смеси добавили воду, и проэкстрагировали с помощью этилацетата. Полученный органический слой промыли насыщенным водным раствором аммоний хлорида, высушили над сульфатом магния, и упарили при пониженном давлении с получением метил 2-(0-тозилокси)ацетата, который использовали в следующей стадии без очистки.
Стадия 2. Получение 2-(о-тозилокси)ацетогидразида: К метил 2-(о-тозилокси)ацетату (8,3 г, 46,24 ммоль) добавили избыточное количество гидразина моногидрата, после чего перемешивали при 90°С в течение 10 минут. По окончании реакции, к этой смеси добавили воду, получив при этом твердый осадок, который отфильтровали и промыли диэтиловым эфиром с получением 2-(о-тозилокси)ацетогидразида в виде твердого вещества белого цвета.
Стадия 3. Получение (E)-N'-((1Н-индол-4-ил)метилен)-2-(о-тозилокси)ацетогидразида: 2-(о-тозилокси)ацетогидразид (0,1 г, 0,55 ммоль) и 1Н-индол-4-карбальдегид (0,08 г, 0,55 ммоль) растворили в этаноле, после чего перемешивали при 90°С в течение 3 часов. По окончании реакции, реакционную смесь охладили до комнатной температуры. Добавили гексан. Образовавшийся осадок отфильтровали, и промыли диэтиловым эфиром с получением соединения 013 в виде твердого вещества белого цвета.
1H NMR (400 MHz, DMSO-d6): δ 11,51-11,37 (m, 2H), 8,51-8,25 (m, 0,7H), 7,50-7,46 (m, 2H), 7,23-6,97 (m, 5H), 6,91-6,79 (m, 2H), 5,22-4,68 (m, 1H), 2,26-2,22 (m, 3H).
Пример 2. Синтез соединения 014
2-(о-тозилокси)ацетогидразид (0,1 г, 0,55 ммоль) и 1Н-индол-5-карбальдегид (0,08 г, 0,55 ммоль) растворили в этаноле, после чего перемешивали при 90°С в течение 3 часов. По окончании реакции, реакционную смесь охладили до комнатной температуры, после чего удалили растворитель. Гексан и этил ацетат добавили к этой смеси. Образовавшийся осадок отфильтровали, и промыли диэтиловым эфиром с получением соединения 014 в виде твердого вещества белого цвета.
1H NMR (400 MHz, DMSO-d6): δ 11,38-11,28 (m, 2H), 8,33-8,07 (m, 1H), 7,80-7,79 (m, 1H), 7,54-7,52 (m, 1H), 7,44-7,38 (m, 2H), 7,17-7,11 (m, 2H), 6,88-6,83 (m, 2H), 6,49 (m, 1H), 5,15-4,63 (m, 2H), 2,24-2,21 (m, 3Н).
Пример 3. Синтез соединения 034
2-(о-тозилокси)ацетогидразид (0,1 г, 0,55 ммоль) и 1H-индол-6-карбальдегид (0,101 г, 0,67 ммоль) растворили в EtOH, после чего перемешивали при 90°С в течение 18 часов. По окончании реакции, реакционную смесь охладили до комнатной температуры, и упарили при пониженном давлении. Образовавшийся осадок отфильтровали, и промыли диэтиловым эфиром с получением соединения 034,
1H NMR (400 MHz, DMSO-d6): δ 11,41-11,20 (m, 1,6H), 8,33 (s, 0,3H), 8,06 (m, 0,4H), 7,69-7,41 (m, 4H), 7,18-7,06 (m, 2H), 6,90-6,80 (m, 2H), 6,45 (m, 1H), 5,14-4,63 (m, 2H), 2,23-2,16 (m, 3H).
Пример 4. Синтез соединения 065
Стадия 1. Получение метил 2-(мезитилокси)ацетата: 2,4,6-триметилфенол (1 г, 7,3 ммоль) растворили в диметилформамиде. Метил бромацетат (1,1 г, 7,3 ммоль) и карбонат калия (3 г, 22 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 16 часов. По окончании реакции, к реакционной смеси добавили воду, и проэкстрагировали с помощью этилацетата. Полученный органический слой трижды промыли водой, высушили над сульфатом магния, и упарили при пониженном давлении с получением 2-(мезитилокси)ацетата (1,5 г 100%).
Стадия 2. Получение 2-(мезитилокси)ацетогидразида: Метил 2-(мезитилокси)ацетат (1,5 г, 7,3 ммоль) растворили в тетрагидрофуране. Добавили гидразин моногидрат (5,16 г, 103 ммоль), после чего перемешивали при комнатной температуре в течение 1 часа. По окончании реакции, реакционную смесь упарили при пониженном давлении. Концентрат разбавили водой и отфильтровали. Фильтрат промыли водой и диэтиловым эфиром с получением 2-(мезитилокси)ацетогидразида (1,36 г, 89%) в виде твердого вещества белого цвета.
Стадия 3. Получение (E)-N'-((1Н-индол-4-ил)метилен)-2-(мезитилокси)ацетогидразида: 2-(мезитилокси)ацетогидразид (0,1 г, 0,48 ммоль) и 1Н-индол-4-карбальдегид (0,08 г, 0,53 ммоль) растворили в этаноле, после чего перемешивали при 90°С в течение 3 часов. По окончании реакции, реакционную смесь охладили до комнатной температуры. Добавили гексан. Образовавшийся осадок отфильтровали, и промыли этанолом с получением соединения 065 (58 мг, 36%) в виде твердого вещества белого цвета.
1Н NMR (400 MHz, DMSO-d6): δ 11,48-11,35 (m, 2H), 8,70 (s, 0,5H), 8,23 (s, 0,5H), 7,50-7,43 (m, 2H), 7,25-7,10 (m, 2,5H), 6,85-6,76 (m, 2,5H), 4,84 (s, 1H), 4,36 (s, 1H), 2,23 (s, 6H), 2,19 (s, 3H).
Пример 5. Синтез соединения 083
Стадия 1. Получение метил 2-(о-толуидин)ацетата: о-толуидин (1 г, 9,3 ммоль) растворили в диметилформамиде. Метил бромацетат (1,3 г, 9,3 ммоль) и карбонат калия (3,9 г, 28 ммоль) добавили к этой смеси, после чего перемешивали при комнатной температуре в течение 16 часов. По окончании реакции, к реакционной смеси добавили воду, и проэкстрагировали с помощью этилацетата. Полученный органический слой трижды промыли водой, высушили над сульфатом магния, и упарили при пониженном давлении с получением метил 2-(о-толуидин)ацетата, который использовали в следующей стадии.
Стадия 2. Получение 2-(о-толуидин)ацетогидразида: Метил 2-(о-толуидин)ацетат (1,7 г, 9,3 ммоль) растворили в тетрагидрофуране. Добавили гид