Способ лечения нейротравмы
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой применение композиции для получения продукта для лечения повреждения спинного мозга, где указанная композиция содержит: один или более из по меньшей мере одного уридина или его эквивалента, выбранного из группы, состоящей из следующих: уридин, т.е. рибозилурацил, дезоксиуридин, уридинфосфаты, выбранные из UMP, dUMP, UDP или UTP, или нуклеиновое основание урацила, липидную фракцию, содержащую по меньшей мере одну из докозагексаеновой кислоты (22:6; DHA), эйкозапентаеновой кислоты (20:5; ЕРА) и докозапентаеновой кислоты (22:5; DPA) или их сложные эфиры, где липидная фракция содержит менее чем 2 масс. % α-линоленовой кислоты (ALA), в пересчете на массу всех жирных кислот и холин или его соли и сложные эфиры, где указанная композиция дополнительно содержит по меньшей мере один витамин комплекса В, выбранный из витамина В6, витамина В12 и витамина В9 или их эквивалентов. Изобретение обеспечивает значительное меньший уровень вовлечения макрофагов в воспалительный процесс, значительное увеличение выживания нейронов после повреждения, заметное улучшение неврологических показателей. 2 н. и 13 з.п. ф-лы., 6 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к области лечебного питания, а конкретнее, к композиции для применения при лечении нейротравм, таких, как повреждение спинного мозга (SCI) и церебральный паралич (CP).
Предпосылки изобретения
В течение последнего десятилетия уридин, холин и Омега-3 жирные кислоты, такие как DHA, привлекали внимание в качестве активных компонентов при лечении когнитивной дисфункции и возрастного нарушения памяти (AAMI). Эти соединения являются предшественниками, ограничивающими скорость при мембранном фосфатидном синтезе.
WO2007/089703 (Массачусетский технологический институт) раскрывает уридин для лечения AAMI, гиппокампальной дисфункции, нарушений памяти и повреждения мозга, включая композицию, содержащую уридин. В одном варианте осуществления композиция, содержащая уридин, содержит липидную фракцию, включающую докозагексаеновую кислоту, эйкозапентаеновую кислоту, докозапентаеновую кислоту или их комбинацию. За исключением рыбьего жира, жировая фракция остается неопределенной. В одном варианте осуществления эта публикация раскрывает композицию, содержащую UMP, холин, рыбий жир, углевод и белок молока, без ее привязки к конкретному неврологическому расстройству.
WO 2009/059306 (Массачусетский технологический институт) предоставляет способ оценивания комплаентности субъекта с режимом диетического добавления уридина при помощи магнитно-резонансной томографии (МРТ). Диетическая добавка может также включать холин и Омега-3 жирные кислоты, такие как DHA. Эта публикация касается определения уровней цитидина в мозге, но сама по себе не предоставляет какого-либо лечения.
WO 2009/002165 (N.V. Nutricia) раскрывает липидную фракцию для улучшения работы головного мозга. Акцент делается на неврологические расстройства, такие как болезнь Альцгеймера и снижение когнитивной функции, в этом случае композиция может дополнительно содержать UMP. Липидная композиция предусматривает определенное соотношение среднецепочечных жирных кислот гексановой кислоты и октановой кислоты, и дополнительно содержит DHA и EPA. В ней должно присутствовать не менее 0,4 г альфа-линоленовой кислоты на 100 г жирных кислот. Кроме того, эта публикация указывает, что величина суммарного количества жирных кислот C6:0 + C7:0 + C8:0 к суммарному количеству C9:0 + C10:0 составляет по меньшей мере 2,5:1.
WO 2007/073178 (N.V. Nutricia) раскрывает композицию, содержащую а) DHA, DPA и/или EPA в сочетании с b) белковой фракцией, предоставляющей цистеин и/или таурин, а также c) минеральной фракцией, содержащей по меньшей мере один из марганца и молибдена, для использования при лечении неврологических расстройств, улучшения функции нервных клеток, уменьшения образования бляшек, нейропатии и улучшении функции нервной системы. Уридин и холин указаны в качестве дополнительных компонентов.
Действие медицинских продуктов, содержащих коктейль из DHA/EPA, уридина, холина, фосфолипидов и витаминов B, C и E, таких как раскрыто в WO 2007/073178, как упоминалось выше, на когнитивную функцию исследовали в клинических испытаниях у людей с болезнью Альцгеймера в легкой форме. Результаты представлены в Scheltens et al., Alzheimer's & Dementia 6 (2010), 1-10. Было отмечено значительное улучшение при задержках вербальных заданий на запоминание.
Если в прототипах лечебное питание разрабатывали для профилактики и лечения синдромов слабоумия и связанной с этим когнитивной дисфункции, то меньше внимания обращалось на другой класс неврологических расстройств, т.е. расстройств, которые вызваны нейротравмой. Нейротравма включает травматическое повреждение головного или спинного мозга. Ежегодно неврологические травмы приводят к тысячам смертей и необратимых разрушительных трагедий. Из-за того, что они поражают множество в остальном совершенно здоровых молодых людей, в продуктивные годы потери в результате их разрушительного действия являются особенно высокими. Несмотря на то, что эти неврологические расстройства имеют много общих причин, лежащих в основе нейродегенеративного механизма, наблюдаемого также при синдромах слабоумия, существуют определенные проблемы, связанные с отмеченной группой пациентов.
Проблема, которую следует разрешить, относится к способностям пациента, который страдает от SCI, CP или нейротравмы, и клинической необходимости улучшения восстановления функции поврежденной нервной ткани после нанесенного повреждения. У пациента могут возникнуть трудности в потреблении должным образом пищевого продукта (из-за частичного паралича мышц, необходимых для потребления), и многие пациенты, страдающие от симптомов SCI или нейротравмы, будут испытывать объемные ограничения, потерю аппетита и нарушение вкусовых ощущений. Для таких пациентов также является проблемой, что их активности в повседневной жизни, например, пользование ими ванной комнатой, являются ограниченными. Поэтому задачей изобретения является разрешение хотя бы одной из этих проблем и предпочтительно по меньшей мере 2 или даже 3 из этих проблем одновременно.
Следует отметить, что простое устранение (пищевых) ингредиентов из питательной композиции, рассматриваемой в данной области, для лечения пациентов с болезнью Альцгеймера, может привести к получению низкообъемной лекарственной формы, но, к сожалению, за счет нейродегенеративного эффекта. Недостаточно снизить количества активных ингредиентов для удовлетворения объемным критериям. Таким образом, в рассматриваемой области предпринимаются поиски других решений.
Сущность изобретения
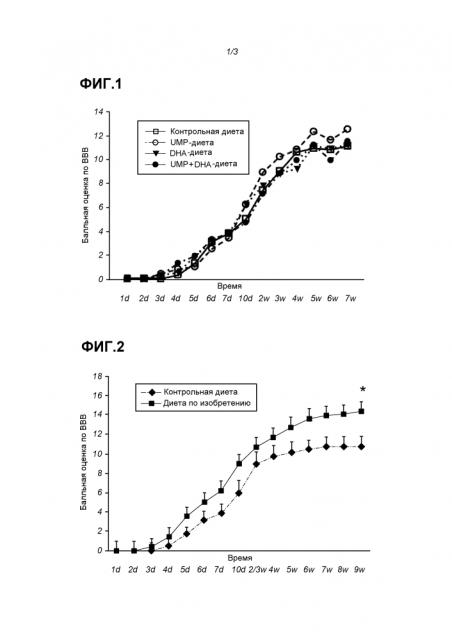
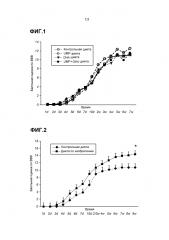
Заявители наблюдали, что после введения продукта, содержащего (i) один или более из уридина и цитидина, или их солей, фосфатов, ацильных производных или сложных эфиров, (ii) липидную фракцию, включающую по меньшей мере одну из докозагексаеновой кислоты (22:6; DHA), эйкозапентаеновой кислоты (20:5; EPA) и докозапентаеновой кислоты (22:5; DPA) или их сложных эфиров, в которой липидная фракция содержит менее 2 масс.% α-линоленовой кислоты (ALA), в пересчете на массу всех жирных кислот, (iii) холин или его соли или сложные эфиры, увеличивалось выживание нейронов после неврологического повреждения, вызванного внешним воздействием (Фиг.2). Это особенно актуально при состояниях, характеризующихся гибелью нейронов и недостаточным выживанием нейронов. Такие состояния включают нейротравму, черепно-мозговую травму, повреждение спинного мозга, церебральный паралич или другие механистические события, которые вызывают повреждение мозга, наподобие хирургических мер, например, которые имеют место после операции по удалению опухоли головного мозга. В рассматриваемой области опорно-двигательный тест "Открытое поле" Basso, Beattie и Bresnahan (BBB) представляет собой авторитетную модель, выступающую в качестве инструмента для изучения последствия травмы спинного мозга, и он был использован для демонстрации открытий.
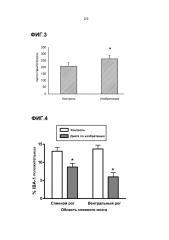
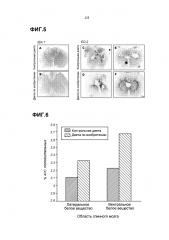
Кроме того, было отмечено, что с композицией в соответствии с изобретением привлечение макрофагов в участок повреждения значительно снижается после неврологической травмы, вызванной внешним воздействием. Хорошо известно, что макрофаги привлекаются в результате повреждения тканей и принимают участие в воспалительной реакции и иммунном ответе. Поэтому уменьшение скорости привлечения связано с наличием более слабой степени повреждения тканей и воспаления. Обращает внимание Фиг.4 в приложении. Более слабая степень воспаления после введения композиции по изобретению млекопитающему, которое испытало повреждение нервной ткани, также может быть продемонстрирована путем подсчета количества олигодендроцитов в зоне поражения нервной ткани. Как показано на прилагаемой Фиг.6, оказалось, это значительно увеличивается при помощи композиции по изобретению. Поэтому композиция, в соответствии с изобретением, может применяться при лечении воспалительного состояния поврежденной или нарушенной нервной ткани, предпочтительно ткани мозга или спинного мозга. Повреждение нервной ткани могут быть результатом механического воздействия на ткань, такого как во время боевых действий, во время рождения ребенка или из-за несчастного случая.
Результаты удивительны, особенно если отметить, что эффект сочетания уридина, DHA и холина, как указывается в рассматриваемой области для лечения слабоумия, был ограниченным. Такой вывод можно сделать из Фиг.1. Сравнение результатов на Фиг.1 и 2 возможно после корректировки для Контроля в "балльной оценке по ВВВ" в каждом конкретном случае. Из приведенных результатов делается также вывод о том, что обогащение продуктов источниками цистеина-таурина и дополнительными минеральными фракциями с содержанием Mn или Мо, как указывается в рассматриваемой области, не является обязательным для использования при лечении нейротравмы/SCI/CP.
Список фигур
На Фиг.1 показана балльная оценка по ВВВ (восстановление опорно-двигательной функции после SCI) в течение периода в 7 недель для контроля (квадраты), UMP-диеты (пустые кружки), DHA-диеты (треугольники) и UMP+DHA-диеты (черные кружки). Никаких существенных различий не наблюдается.
На Фиг.2 показана балльная оценка по ВВВ (восстановление опорно-двигательной функции после SCI) в течение 9 недель для контроля (квадраты) и "диеты по изобретению" (треугольники).
На Фиг.3 продемонстрировано выживание нейронов на 9 неделе после травмы для контроля и "диеты по изобретению".
На Фиг.4 продемонстрирована воспалительная реакция для контроля и "диеты по изобретению", определенная для спинного рога (слева) и вентрального рога (справа) области спинного мозга.
На Фиг.5 показан эффект SCI и диеты на IBA-1 и ED1 иммунореактивность IBA1 и ED1 мечения макрофагов и микроглии у животных, питаемых контрольным питанием и "диетой по изобретению", а затем умерщвленных на 9 неделе после травмы. Оказалось, что у животных с "диетой по изобретению", IBA1 и ED1 иммунореактивность была меньше по сравнению с контрольными животными (B vs. А для IBA1-иммунореактивности; D и F vs. C и E для ED1-иммунореактивности). Количественный анализ подтвердил, что IBA1-иммунореактивность в DH=спинном роге и VH=вентральном роге, была значительно уменьшена у животных, которых кормили "диетой по изобретению", по сравнению с контролем (*p<0,05).
Фиг.6 показывает олигодендроцитарный ответ для контроля и "диеты по изобретению".
СПИСОК ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
В соответствии с одним вариантом осуществления композиция включает:
i) один или более из уридина и цитидина, или их солей, фосфатов, ацильных производных или сложных эфиров;
ii) липидную фракцию, содержащую по меньшей мере одну из докозагексаеновой кислоты (22:6; DHA), эйкозапентаеновой кислоты (20:5; EPA) и докозапентаеновой кислоты (22:5; DPA), или их сложных эфиров, в которой липидная фракция содержит менее чем 2 масс.% α-линоленовой кислоты (ALA), в пересчете на массу всех жирных кислот;
iii) холин или его соли и сложные эфиры;
для применения в целях профилактики или лечения нейротравмы, травматического повреждения мозга, церебрального паралича и повреждения спинного мозга.
В соответствии с другим вариантом осуществления композиция по изобретению содержит липидную фракцию, включающую среднецепочечные жирные кислоты (MCT), где отношение количества MCT C6:0 + C7:0 + C8:0 к количеству C9:0 и С10:0 составляет менее чем 2:1.
В соответствии с другим вариантом осуществления указанная липидная фракция содержит менее 2 масс.% жирных кислот с менее чем 14 атомами углерода, в пересчете на общее количество жирных кислот.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретением дополнительно содержит менее 25 мг суммарного количества цистина и таурина на 100 мл композиции.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретением содержит линолевую кислоту (LA), которая присутствует в количестве менее 15 г/100 г жирных кислот.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретению, дополнительно содержит по меньшей мере один витамин B, выбранный из витамина В6, витамина В12 и витамина В9 или их эквивалентов, предпочтительно содержащих витамин В6, В9 и В12.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретением содержит липидную фракцию, содержащую от 9 до 300 мг/100 кДж DHA+EPA+DPA, предпочтительно DHA+EPA, в день.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретением включает от 1,5 до 130 мг/100 кДж одного или более из уридина, цитидин или их солей, фосфатов или сложных эфиров, рассчитанная как для уридина и цитидина.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретением содержит от 1 до 300 мг/100 кДж холина или его солей или сложных эфиров, рассчитанная как для холина.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретением дополнительно содержит один или несколько выбранных из группы, состоящей из витамина C или его эквивалентов, витамина Е или его эквивалентов и селена.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретением дополнительно содержит по меньшей мере один фосфолипид.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретением предоставлена в виде продукта питания.
В соответствии с другим вариантом осуществления композиция в соответствии с изобретением предоставлена в виде фармацевтического препарата.
В соответствии с другим вариантом осуществления предоставляется водная жидкая композиция в соответствии с изобретением, указанная композиция, содержащая в расчете на 100 мл жидкости:
100-500 мг EPA,
1000-1500 мг DHA,
80-600 мг фосфолипидов,
200-600 мг холина,
400-800 мг UMP (уридинмонофосфата),
20-60 мг витамина E (альфа-TE),
60-100 мг витамина C,
40-80 мкг селена,
1-5 мкг витамина B12,
0,5-2 мг витамина В6 и
200-600 мкг фолиевой кислоты.
В соответствии с другим вариантом осуществления предоставляется набор, содержащий:
i) один или более из уридина и цитидина, или их солей, фосфатов, ацильных производных или сложных эфиров;
ii) липидную фракцию, содержащую по меньшей мере одну из докозагексаеновой кислоты (22:6; DHA), эйкозапентаеновой кислоты (20:5; EPA) и докозапентаеновой кислоты (22:5; DPA), или их сложные эфиры, где липидная фракция содержит менее чем 2 масс.% α-линоленовой кислоты (ALA), в пересчете на массу всех жирных кислот;
iii) холин или его соли и сложные эфиры;
для применения в профилактике или лечении нейротравмы, травматического повреждения мозга, церебрального паралича и повреждения спинного мозга.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения композицию в соответствии с изобретением можно применять в качестве фармацевтического препарата, содержащего один или более фармацевтически приемлемых материалов-носителей.
В другом аспекте настоящего изобретения композицию в соответствии с изобретением можно применять в качестве продукта питания, например в качестве пищевой добавки, например, в качестве добавки к нормальной диете, в качестве обогатителя, добавляемого к нормальной диете, или в качестве сбалансированного питания.
Фармацевтический продукт, предпочтительно для энтерального применения, может представлять собой твердый или жидкий галенов состав. Примерами твердых галеновых составов являются таблетки, капсулы (например, жесткие или мягкие капсулы с желатиновой оболочкой), пилюли, саше, порошки, гранулы и т.п., которые содержат активный ингредиент вместе с традиционный галеновыми носителями. Может быть использован любого традиционный материал-носитель. Материал-носитель может представлять собой органический или неорганический инертный материал-носитель, подходящий для перорального применения. Подходящие носители включают воду, желатин, гуммиарабик, лактозу, крахмал, стеарат магния, тальк, растительные масла и т.п. Кроме того, добавки, например, ароматизирующие вещества, консерванты, стабилизаторы, эмульсирующие вещества, буферы и т.п., могут быть добавлены в соответствии с принятой практикой фармацевтической рецептуры. Несмотря на то, что отдельные активные ингредиенты надлежащим образом вводятся в единую композицию, их также можно вводить в индивидуальных дозовых единицах. Следовательно, изобретения дополнительно относится к набору, содержащему: i) один или более из уридина и цитидина или их солей, фосфатов, ацильных производных или сложных эфиров; ii) липидную фракцию, содержащую по меньшей мере одну из докозагексаеновой кислоты (22:6; DHA), эйкозапентаеновой кислоты (20:5; EPA) и докозапентаеновой кислоты (22:5; DPA) или их сложные эфиры, где липидная фракция содержит менее чем 2 масс.% α-линоленовой кислоты (ALA), в пересчете на массу всех жирных кислот; iii) холин или его соли и сложные эфиры; для применения в профилактике или лечении нейротравмы, травматического повреждения мозга, церебрального паралича и повреждения спинного мозга.
Если композиция представляет собой фармацевтический препарат, такой продукт может содержать суточную дозу в одной или более дозовых единицах. Дозовая единица может быть в жидкой форме или в твердой форме, при этом в последнем случае суточная доза может обеспечиваться одной или несколькими твердыми дозовыми единицами, например, в одной или нескольких капсулах или таблетках.
В другом аспекте настоящего изобретения, композицию, в соответствии с изобретением, можно использовать в пищевом продукте, содержащем по меньшей мере один компонент, выбранный из группы жиров, белков и углеводов. Подразумевается, что пищевой продукт отличается от фармацевтического препарата наличием питательных веществ, которые обеспечивают питание субъекта, которому вводят композицию, в частности, наличие белков, жиров, легкоусваимых углеводов и пищевых волокон. Он может дополнительно содержать ингредиенты, такие как минералы, витамины, органические кислоты и ароматизирующие вещества. Несмотря на то, что термин "нутрицевтический продукт" нередко используется в литературе, он обозначает пищевой продукт с фармацевтическим компонентом или фармацевтического назначения. Следовательно, питательная композиция, в соответствии с изобретением, также может использоваться в нутрицевтических продуктах.
Продукт по изобретению представляет собой энтеральную композицию, предназначенную для перорального применения. Его предпочтительно вводят в жидком виде. В одном варианте осуществления продукт содержит липидную фракцию и по меньшей мере один из углеводов и белков, где липидная композиция обеспечивает от 20 и 50% энергии пищевого продукта. В одном варианте осуществления пищевой продукт представляет собой жидкую композицию, содержащую от 0,8 до 1,4 ккал/мл.
Повреждение спинного мозга, нейротравма и церебральный паралич
Связанное с возрастом нарушение памяти (AAMI) представляет собой распространенное заболевание, характеризующееся очень мягкими симптомами ухудшения памяти, которые возникают как часть нормального процесса старения. Симптомы AAMI проявляются постепенно в результате нормального процесса старения. В отличие от этого, травматическое повреждение спинного мозга (SCI), нейротравма и церебральный паралич (CP) представляют собой состояния, при которых нервная ткань внезапно повреждается и вскоре после этого происходят нейродегенеративные процессы. Кроме того, функциональные расстройства в результате травмы появляются мгновенно и причиняют ущерб пострадавшим лицам в течение остатка своей жизни. Далее, большой контраст между SCI/нейротравмой/CP и AAMI состоит в том, что проблемы при AAMI, по определению, находятся только в когнитивной сфере, тогда как SCI/нейротравма/CP характеризуются наличием широкого спектра проблем, таких как двигательные нарушения, не связанные с когнитивной сферой. Из-за контраста между некогнитивными проблемами после травматического повреждения и когнитивными проблемами при AAMI, для специалиста не является очевидным рассмотрение использования прототипных композиций, предназначенных для применения, например, при болезни Альцгеймера (AD), ухудшении памяти и т.д., при SCI или нейротравме или CP, не говоря уже об ожидании какого-либо воздействия на некогнитивные аспекты, связанные с SCI/нейротравма/CP.
Способ по изобретению включает введение композиции, описанной ниже, лицу, которые в этом нуждаются, страдающему от или находящемуся в зоне риска от состояний, характеризующихся гибелью нейронов и недостаточным выживанием нейронов. Такие состояния включают нейротравму, травматическое повреждение мозга, травму спинного мозга или другие механистические события, которые вызывают повреждение мозга, как хирургические меры, например, такие, какие имеют место после операции по удалению опухоли головного мозга. Лица, подверженные риску развития таких состояний, представляют собой тех, кто связан, например, с боевыми действиями, например, военными действиями, у детей во время родов и из-за несчастного случая. Как представляется, черепно-мозговая травма является наиболее распространенным повреждением солдат в бою (например, среди американских войск в Ираке и Афганистане).
В соответствии с одним вариантом осуществления продукты, содержащие композицию, в соответствии с изобретением, предназначены для введения людям, в частности детям.
В одном аспекте изобретение относится к композиции, как описано в настоящем документе ниже, для применения в профилактике и/или лечении состояний, характеризующихся гибелью нейронов и недостаточным выживанием нейронов. Такие состояния включают нейротравму, травму головного мозга, церебральный паралич, травму спинного мозга или другие механистические события, которые вызывают повреждение мозга, как и хирургические меры, например, такие, которые имеют место после операции по удалению опухоли головного мозга.
Кроме того, изобретение направлено на применение композиции, как описано ниже, при получении композиция для профилактики и/или лечения состояний, характеризующихся гибелью нейронов и недостаточным выживанием нейронов. Такие состояния включают нейротравму, травму головного мозга, церебральный паралич, травму спинного мозга или другие механистические события, которые вызывают повреждение мозга, как и хирургические меры, например, такие, которые имеют место после операции по удалению опухоли головного мозга.
Изобретение, в частности, направлено на лечение нейротравмы, травмы головного мозга, церебрального паралича и травмы спинного мозга, предпочтительно на SCI.
DHA/EPA
Композиция содержит по меньшей мере одну ω-3 полиненасыщенную жирную кислоту (LC PUFA; обладающую длиной цепи 18 и более атомов углерода), выбранную из группы, включающей докозагексаеновую кислоту (22:6; DHA), эйкозапентаеновую кислоту (20:5; EPA) и докозапентаеновую кислоту (22:5; ω-3; DPA), предпочтительно по меньшей мере одну из DHA и EPA. Предпочтительно, настоящая композиция содержит по меньшей мере DHA, более предпочтительно DHA и EPA. EPA преобразуется DPA (ω-3), усиливая последующее преобразование DPA в DHA в мозге. Таким образом, настоящая композиция предпочтительно содержит значительное количество EPA, так, чтобы стимулировать образование DHA in vivo.
DHA и EPA и/или DPA предоставляются предпочтительно в виде триглицеридов, диглицеридов, моноглицеридов, свободных жирных кислот или их солей и сложных эфиров, фосфолипидов, лизофосфолипидов, сложных эфиров глицерина, липопротеинов, церамидов, гликолипидов или их комбинаций. Предпочтительно, настоящая композиция включает по меньшей мере DHA в форме триглицеридов.
В терминах суточной дозы, данный способ предпочтительно включает введение от 500 до 5000 мг DHA+EPA+DPA (предпочтительно DHA+EPA) в день, более предпочтительно от 750 до 4000 мг в день, наиболее предпочтительно от 1000 до 3000 мг в день. DHA предпочтительно вводят в количестве от 500 до 5000 мг в день, более предпочтительно от 750 до 4000 мг в день, наиболее предпочтительно от 1000 до 3000 мг в день. Если вообще, EPA предпочтительно вводят в количестве от 500 до 5000 мг в день, более предпочтительно от 750 до 4000 мг в день, наиболее предпочтительно от 1000 до 3000 мг в день. Эти количества EPA применяются, если она используется сама по себе или в комбинации с DHA.
В терминах единицы дозы, пропорция DHA+EPA+DPA (предпочтительно DHA+EPA) от общего количества жирных кислот предпочтительно составляет от 5 до 95 масс.%, более предпочтительно от 10 до 80 масс.%, наиболее предпочтительно от 15 до 70 масс.%. Настоящая композиция предпочтительно содержит от 5 до 95 масс.% DHA, в пересчете на общее количество жирных кислот, предпочтительно от 10 до 75 масс.% DHA на основе общих жирных кислот, более предпочтительно от 10 до 60 масс.% DHA, в пересчете на общее количество жирных кислот. Настоящая композиция предпочтительно содержит от 5 до 95 масс.% EPA, в пересчете на общее количество жирных кислот, предпочтительно от 10 до 75 масс.% EPA, наиболее предпочтительно от 15 до 60 масс.%, в пересчете на общее количество жирных кислот.
Отношение массы DHA к EPA составляет предпочтительно больше, чем 1, более предпочтительно от 2:1 до 10:1, более предпочтительно от 3:1 до 8:1. Вышеприведенные соотношения и количества учитывают и оптимизируют несколько аспектов, в том числе вкус (слишком высокие уровни LCP ослабляют вкус, в результате чего снижается комплаентность), баланс между DHA и ее предшественниками для обеспечения оптимальной эффективности при сохранении составов с небольшими объемами.
Источниками DHA являются возможные источники DHA: масло тунца (прочие) рыбьи жиры, богатые DHA алкиловые эфиры, масло водорослей, яичный желток или фосфолипиды, обогащенные n-3 LC PUFA, например, фосфатидилсерин-DHA.
ALA/LA
Предпочтительно, чтобы содержание альфа-линоленовой кислоты [ALA] композиции сохранялось на низких уровнях. Авторы изобретения считают, что из-за воспалительного характера нейротравмы, избыточное поступление в высокой степени ненасыщенных жирных кислот увеличивает риск дополнительного нарушения поврежденной ткани вследствие действия окисленного в перекисное соединение PUFA, несмотря на то, что было замечено, что поступление α-линоленовой кислоты in vivo является нейропротекторным при нейротравме (King et al., J. Neurosci. (26) 17:4672-4680). Несмотря на то, что в AD-продуктах отмечены "нормальные" уровни ALA, превышающие 3 масс.% от жирных кислот, т.е. около 5 масс.%, авторами изобретения было обнаружено, что концентрация ALA предпочтительно поддерживается на уровне, меньшем, чем 2,0 масс.%, более предпочтительно ниже 1,5 масс.%, в частности, ниже 1,0 масс.%, в пересчете на массу всех жирных кислот. В исследованиях на животных достигнутые уровни составляли около 0,8 г на 100 г жирных кислот. Такие низкие уровни ALA сами по себе ("Контроль") оказались при этом неэффективным.
Концентрации линолевой кислоты [LA] можно поддерживать на нормальном уровне, т.е. от 20 до 30 масс.%, хотя в одном из вариантов осуществления концентрация LA также значительно уменьшена до количества <15 г/100 г жирных кислот, и даже меньше, чем 10 масс.%. Концентрации LA предпочтительно составляют не менее 1 масс.% от жирных кислот.
В одном варианте осуществления массовое соотношение ω-3/ω-6 в композиция по изобретению предпочтительно находится в диапазоне от 0,3 до 7, предпочтительно в диапазоне от 1,4:1 до 5,9:1, более предпочтительно в диапазоне от 3:1 до 5,5:1, наиболее предпочтительно от 3:1 до 5:1, в частности, менее чем 5:1. Количество ω-6 LC PUFA составляет предпочтительно менее 50, предпочтительно от 5 до 40, более предпочтительно от 8 до 30 масс.% от жирных кислот в формуле.
MCT
В одном варианте осуществления композиция содержит менее 5 масс.%, предпочтительно менее чем 2 масс.% жирных кислот с числом атомов углерода, меньшим чем 14.
Среднецепочечные жирные кислоты [MCT] определяются как неразветвленные или разветвленные насыщенные карбоновые кислоты, имеющие шесть (C6:0), семь (С7:0), восемь (C8:0), девять (C9:0) или десять (С10:0) атомов углерода. Количество MCT предпочтительно составляет не более 2 масс.%, более предпочтительно менее чем 1,5 масс.%, наиболее предпочтительно ниже, чем 1,0 масс.% от общего количества жирных кислот. В одном варианте осуществления отношение суммарного количества среднецепочечных жирных кислот C6:0 + C7:0 + C8:0 к суммарному количеству C9:0 и С10:0 составляет меньше, чем 2:1, более предпочтительно менее чем 1,8:1, наиболее предпочтительно менее чем 1,6:1.
UMP
Настоящая композиция содержит уридин, цитидин и/или их эквивалент, включая соли, фосфаты, ацильные производные и/или сложные эфиры. В отношении уридина, композиция предпочтительно содержит по меньшей мере один уридин или его эквивалент, выбранный из группы, включающей уридин (т.е. рибозилурацил), дезоксиуридин (дезоксирибозилурацил), уридинфосфаты (UMP, dUMP, UDP, UTP), нуклеиновое основание урацила и ацилированные производные уридина. В одном варианте осуществления цитидин, CMP, цитиколина (CDP-холин), также могут быть применены. Предпочтительно, настоящая композиция содержит уридинфосфат, выбранный из группы, состоящей из уридинмонофосфата (UMP), уридиндифосфата (UDP) и уридинтрифосфата (UTP); и/или цитидинфосфата (CMP, CDP, CTP, предпочтительно CMP). Наиболее предпочтительно, настоящая композиция содержит UMP, поскольку UMP наиболее эффективно усваивается организмом. Предпочтительно, не менее 50 масс.% уридина в настоящей композиции обеспечивается UMP, более предпочтительно по меньшей мере 75 масс.%, наиболее предпочтительно не менее 95 мас.%. Дозы, которые должны вводиться, заданы в пересчете на UMP. Количество источников урацила можно рассчитать, принимая молярный эквивалент количества UMP.
Данный способ предпочтительно включает введение уридина (совокупное количество уридина, дезоксиуридина, уридинфосфатов, нуклеинового основания урацила и ацилированных производных уридина) в количестве (i) от 0,1 до 6 г в день, предпочтительно от 0,2 до 3 г в день, более предпочтительно от 0,4 до 2 г в день, и/или (ii) от 0,1 до 6 г на 100 мл (жидкой) композиции, предпочтительно от 0,2 до 3 г на 100 мл (жидкой) композиции, более предпочтительно от 0,4 до 2 г на 100 мл (жидкой) композиции. Указанные количества также рассчитываются для любых количеств цитидина, цитидинфосфатов и цитиколина, включенных в композицию или способ.
Предпочтительно, настоящая композиция содержит уридинфосфат, предпочтительно уридинмонофосфат (UMP). UMP очень эффективно усваивается организмом. Следовательно, включение UMP в настоящую композицию предоставляет высокую эффективность при минимальной дозировке и/или введении низкого объема субъекту.
Холин
Настоящая композиция содержит холин, холиновую соль и/или холиновый эфир. Холиновую соль предпочтительно выбирают из холинхлорида, битартрата холина или стеарата холина. Холиновый эфир, предпочтительно выбирают из фосфатидилхолина и лизофосфатидилхолина. Данный способ предпочтительно включает введения более чем 50 мг холина в день, предпочтительно от 80 до 3000 мг холина в день, более предпочтительно от 100 до 2000 мг холина в день, наиболее предпочтительно от 150 до 1000 мг холина в день. Настоящая композиция предпочтительно содержит от 80 мг до 3000 грамм холина на 100 мл жидкой композиции, предпочтительно от 100 мг до 2000 мг холина на 100 мл, предпочтительно от 200 до 1000 мг холина на 100 мл композиции, наиболее предпочтительно от 200 мг до 600 мг холина на 100 мл. Вышеприведенные числа основаны на холине, количества холиновых эквивалентов или источников можно рассчитать, принимая при расчете молярный эквивалент за холин.
Фосфолипиды
Предпочтительно включать по меньшей мере один фосфолипид в композицию. Термин "фосфолипидных" исключает РС, который уже учтен во фракции холина. Настоящая композиция предпочтительно включает по меньшей мере один фосфолипид в количестве от 0,01 до 1 г на 100 мл, более предпочтительно от 0,05 до 0,5 г на 100 мл, наиболее предпочтительно от 80 до 600 мг на 100 мл. По меньшей мере один из фосфолипидов предпочтительно предоставляется при помощи лецитина.
Витамины
Настоящая комбинация содержит по меньшей мере один комплекс витаминов группы B. Витамин B выбирают из группы витамина B1 (тиамин), витамина B2 (рибофлавин), витамина B3 (ниацин или ниацинамид), витамина В5 (пантотеновая кислота), витамина В6 (пиридоксин, пиридоксаль или пиридоксамин или пиридоксина гидрохлорид), витамина B7 (биотин), витамина В9 (фолиевая кислота или соль или сложный эфир фолиевой кислоты) и витамина В12 (различные кобаламины). Функциональные эквиваленты охватываются этими терминами.
Предпочтительно, по меньшей мере один витамин B выбирают из группы витамина В6, витамина В12 и витамина B9. Предпочтительно, настоящая композиция включает по меньшей мере два, выбранных из группы, содержащей витамин В6, витамин В12 и витамин B9. В частности, хорошие результаты были достигнуты с комбинацией, содержащей витамин В6, витамин В12 и витамин B9.
Витамин B подлежит введению в эффективной дозе, которая зависит от типа используемого витамина B. В качестве правила, подходящая минимальная или максимальная доза может быть выбрана на основании известных диетических рекомендаций, например, как рекомендуется Институтом Медицины (IOM) Национальной академии наук США или Научным Комитетом по пищевым продуктам (Научный комитет ЕС), информации, раскрытой в настоящем документе, и дополнительно ограниченного количества типовых испытаний. Минимальная доза может основываться на средней расчетной потребности (EAR), хотя меньшая доза уже может быть эффективной. Максимальная доза обычно не превышает верхний допустимый уровни приема (UL), как это рекомендовано IOM.
При наличии в пищевой композиции или лекарственного средства витамин В6 обычно присутствует в количестве для обеспечения суточной дозы в диапазоне от 0,1 до 100 мг, в частности, в диапазоне от 0,5 до 25 мг, в частности, в диапазоне от 0,5 до 5 мг. Настоящая композиция предпочтительно содержит от 0,1 до 100 мг витамина В6 в 100 г (жидкого) продукта, более предпочтительно от 0,5 до 5 мг витамина В6 в 100 г (жидкого) продукта, более предпочтительно от 0,5 до 5 мг витамина В6 в 100 г (жидкого) продукта.
При наличии в настоящей композиции или лекарственного средства, витамин В12 обычно присутствует в количестве для обеспечения суточной дозы в диапазоне 0,5-100 мкг, в частности, в диапазоне от 1 до 10 мкг, в частности, в диапазоне от 1,5 до 5 мкг. Настоящая композиция предпочтительно содержит 0,5-100 мкг витамина B12 в 100 г (жидкого) продукта, более предпочтительно от 1 до 10 мкг витамина В12 в 100 г (жидкого) продукта, более предпочтительно 1,5-5 мкг витамина В12 в 100 г (жидкого) продукта. Термин "витамин B12" включает все кобаламиновые эквиваленты, известные в рассматриваемой области.
При наличии в настоящей композиции или лекарственного средства, витамин В9 обычно присутствует в количестве для обеспечения суточной дозы в диапазоне от 50 до 5000 мкг, в частности, в диапазоне от 100 до 1000 мкг, в частности, в диапазоне от 200 до 800 мкг. Настоящая композиция предпочтительно содержит от 50 до 5000 мкг фолиевой кислоты на 100 г (жидкого) продукта, более предпочтительно от 100 до 1000 мкг фолиевой кислоты на 100 г (жидкого) продукта, более предпочтительно от 200 до 800 мкг фолиевой кислоты на 100 г (жидкого) продукта.
Фолаты включают фолиевую кислоту, формилтетрагидрофолиевую кислоту, метилированную, метиленированную и формилированную формы фолатов, их соли и сложные эфиры, а также их производные с одной или более глутаминовыми кислотами, и все либо в редуцированной, либо окисленной форме.
Витамины C, E
Витамин C или его функциональный эквивалент может присутствовать в количестве для обеспечения суточной дозы в диапазоне от 20 до 2000 мг, в частности, в диапазоне от 30 до 500 мг, в частности, в диапазоне от 75 до 150 мг. В одном варианте осуществления витамин C или функциональный эквивалент присутствует в количестве, находящимся в диапазоне от 20 до 2000 мг, в частности, в диапазоне от 30 до 500 мг, в частности, в диапазоне от 75 до 150 мг на 100 мл композиции.
Токоферол и/или его эквивалент (т.е. соединение, имеющее активность витамина Е) может присутствовать в количестве для обеспечения суточной дозы в диапазоне от 10 до 300 мг, в частности, в диапазоне от 30 до 200 мг, в частности, в диапазоне 35 до 100 мг, для предотвращения окислительного повреждения в травмированном участке, обусловленного поступающими с пищей PUFA. В одном варианте осуществления токоферол и/или его эквивалент присутствует в количестве в диапазоне от 10 до 300 мг, в частности, в диапазоне от 30 до 200 мг, в частности, в диапазоне 35 до 100 мг на 100 мл композиции. Термин "токоферол и/или его эквивалент", используемый в этом описании, включает токоферолы, токотриенолы, их фармацевтически приемлемые и/или приемлемые в плане пи