Ликсисенатид и метформин для лечения диабета типа 2
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается фармацевтической комбинации для снижения уровня глюкагона в плазме у пациентов с диабетом типа 2, содержащей desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, метформин и/или его фармацевтически приемлемую соль и сульфонилмочевину. При этом субъект, подвергаемый лечению, имеет постпрандиальную концентрацию глюкозы в плазме через 2 часа после приема пищи по меньшей мере 14 ммоль/л. Группа изобретений также касается способа снижения уровня глюкагона в плазме у пациентов с диабетом типа 2, включающего введение указанной комбинации. Группа изобретений обеспечивает снижение уровня глюкагона в плазме. 2 н. и 20 з.п. ф-лы, 11 ил., 29 табл., 2 пр.
Реферат
Объектом настоящего изобретения является фармацевтическая комбинация для применения с целью осуществления гликемического контроля у пациентов с диабетом типа 2, при этом указанная комбинация содержит (a) desPro36эксендин-4(1-39)-Lys6-NH2 (AVE0010, ликсисенатид) и/или его фармацевтически приемлемую соль, и (b) метформин и/или его фармацевтически приемлемую соль. Другой аспект относится к фармацевтической комбинации для применения с целью снижения уровней глюкагона у пациентов с диабетом типа 2, при этом указанная комбинация содержит (a) desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль и (b) метформин и/или его фармацевтически приемлемую соль.
У здорового пациента высвобождение инсулина поджелудочной железой строго сопряжено с концентрацией глюкозы в крови. Повышенный уровень глюкозы в крови, который появляется после приема пищи, быстро уравновешивается соответствующим повышением секреции инсулина. В условиях натощак уровень инсулина в плазме падает до исходного уровня, который достаточен для обеспечения непрерывного поступления глюкозы к чувствительным к инсулину органам и тканям и для поддержания продукции глюкозы в печени на низком уровне ночью.
В отличие от диабета типа 1, при диабете типа 2 обычно нет утраты инсулина, но во многих случаях, особенно в случаях прогрессирования, при необходимости лечение инсулином рассматривают как наиболее подходящую терапию в сочетании с перорально вводимыми противодиабетическими средствами.
Повышенный уровень глюкозы в крови на протяжении нескольких лет без начальных симптомов является существенным риском для здоровья. Было ясно показано в крупномасштабном исследовании DCCT в США (The Diabetes Control and Complications Trial Research Group (1993) N. Engl. J. Med. 329, 977-986), что хронически повышенные уровни глюкозы в крови являются основной причиной для развития осложнений диабета. Примерами осложнение диабета являются повреждения микро- и макрососудов, которые могут проявляться в ретинопатии, нефропатии или невропатии и приводить к слепоте, почечной недостаточности и потере конечностей и сопровождаются повышенным риском сердечнососудистых заболеваний. Таким образом, можно сделать вывод, что улучшенная терапия диабета, главным образом, нацелена на поддержание уровня глюкозы в крови как можно более близко к физиологическому диапазону.
Особый риск существует для пациентов с избыточной массой тела, страдающих диабетом типа 2, например, пациентов с индексом массы тела (BMI)≥30. У таких пациентов риск диабета перекрывается с рисками избыточной массы тела, приводящей, например, к повышению частоты сердечнососудистых заболеваний по сравнению с пациентами с диабетом типа 2, имеющими нормальную массу. Таким образом, особенно необходимо лечение диабета у таких пациентов с одновременным снижением избыточной массы тела.
Метформин является бигуанидным гипогликемическим средством, применяемым для лечения инсулиннезависимого сахарного диабета (сахарного диабета типа 2), не отвечающего на модификацию диеты. Метформин улучшает гликемический контроль за счет повышения чувствительности к инсулину и уменьшения всасывания глюкозы в кишечнике. Метформин обычно вводят перорально. Однако контроль сахарного диабета типа 2 у пациентов с ожирением с использованием метформина может быть недостаточным. Таким образом, для таких пациентов могут требоваться дополнительные меры борьбы с сахарным диабетом типа 2.
Соединение desPro36эксендин-4(1-39)-Lys6-NH2 (AVE0010, ликсисенатид) является производным эксендина-4. AVE0010 раскрыт в виде последовательности SEQ ID NO: 93 в WO 01/04156:
SEQ ID NO: 1: AVE0010 (44 аминокислоты)
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-S-K-K-K-K-K-K-NH2
SEQ ID NO: 2: эксендин-4 (39 аминокислот)
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-P-S-NH2
Эксендины представляют собой группу пептидов, которые могут снижать концентрацию глюкозы в крови. Аналог эксендина AVE0010 характеризуется C-концевым укорочением нативной последовательности эксендина-4. AVE0010 содержит шесть C-концевых остатков лизина, отсутствующих в эксендине-4.
В контексте настоящего изобретения AVE0010 включает его фармацевтически приемлемые соли. Специалисту в данной области известны фармацевтически приемлемые соли AVE0010. Предпочтительной фармацевтически приемлемой солью AVE0010, используемой в настоящем изобретении, является ацетат.
В примере 1 настоящего изобретения показано, что у пациентов с диабетом типа 2 ликсисенатид (AVE0010) в виде дополнительной терапии к лечению метформином значимо улучшал гликемический контроль:
- Ликсисенатид (AVE0010) значимо снижал скорректированный уровень глюкозы в плазме AUC0:30-4:30 час (час*мг/дл) по сравнению с исходным уровнем: -227,25 по сравнению с -72,83 в группе с использованием лираглутида.
- Ликсисенатид уменьшал повышение уровня глюкозы в плазме после стандартизованного завтрака в намного большей степени, чем лираглутид.
- Имела место значимая модификация постпрандиального прироста уровня глюкозы в крови (прироста ППГ) на 28 день в группе лечения ликсисенатидом, при этом значимый эффект на максимальные уровни ППГ (мг/дл) составляли: -70,43 в группе лечения ликсисенатидом по сравнению с -24,93 в группе лечения лираглутидом со средней оценкой разницы в лечении -45,50 для ликсисенатида по сравнению с лираглутидом. Такое различие было статистически значимым (p<0,0001).
- Количество пациентов, имеющих уровни глюкозы в плазме через два часа после приема пищи ниже 140 мг/дл через 4 недели лечения (28 день), было больше в группе лечения ликсисенатидом.
- На 24-часовых профилях глюкозы в плазме в случае лечения ликсисенатидом и лираглутидом на 28 день по сравнению с днем -1 наблюдали общее снижение уровня глюкозы в плазме со снижением пиковых уровней глюкозы, которые имели место в ответ на прием пищи.
- Средние уровни HbA1C снижались в обеих группах лечения.
- Уменьшенное значение AUC для уровня глюкагона в плазме было более выраженным в группе лечения ликсисенатидом по сравнению с группой лечения лираглутидом.
Пример 2 настоящего изобретения относится к гликемическому контролю у пациентов с диабетом типа 2 в азиатских странах (Китай, Малайзия, Таиланд и Гонконг). Такие пациенты не поддаются адекватному контролю только метформином. Было обнаружено, что у таких пациентов монголоидной и/или ориентальной расы на 24 неделе исследования может быть достигнуто значимое улучшение гликемического контроля в результате использования сочетания ликсисенатида и метформина по сравнению с плацебо (отдельно метформин):
- Эффективность ликсисенатида по сравнению с плацебо была продемонстрирована по значимому снижению HbA1c в группе лечения ликсисенатидом (-0,83%) по сравнению с группой плацебо (-0,47%). Различие средних значений, рассчитанных с применением способа наименьших квадратов, при сравнении с плацебо составляло -0,36% (таблица 10 в примере 2). В таблице 28 показан сходный эффект в подгруппе пациентов китайского происхождения.
- Анализ HbA1c-респондеров показал статистически значимое различие в лечении между группами лечения ликсисенатидом и плацебо. 32,4% пациентов в группе лечения ликсисенатидом достигали HbA1c ≤6,5%, тогда как в группе плацебо только 18,1% достигали такого значения. 53% пациентов в группе лечения ликсисенатидом достигали HbA1c <7% по сравнению с 38,8% в группе плацебо (таблица 11 в примере 2).
- В отношении постпрандиального уровня глюкозы (ППГ) через 2 часа после стандартизованного приема пищи в группе лечения ликсисенатидом наблюдали статистически значимое улучшение по сравнению с группой плацебо с различием средних значений, рассчитанных с применением способа наименьших квадратов, составляющим -4,28 ммоль/л (таблица 12 в примере 2). Анализ колебаний уровня глюкозы показал различие средних значений, рассчитанных с применением способа наименьших квадратов, -3,99 ммоль/л в группе лечения ликсисенатидом по сравнению с плацебо (таблица 17 в примере 2).
- Межгрупповое различие по уровню глюкозы натощак (УГН) по сравнению с плацебо также было статистически значимым в случае группы ликсисенатида с различием средних значений, рассчитанных с применением способа наименьших квадратов, -0,48 ммоль/л (таблица 13 в примере 2).
- Общая безопасность комбинации ликсисенатида и метформина было удовлетворительным у пациентов монголоидной/ориентальной расы.
Первым аспектом настоящего изобретения является фармацевтическая комбинация для применения с целью осуществления гликемического контроля у пациентов с диабетом типа 2, при этом указанная комбинация содержит
(a) desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, и
(b) метформин и/или его фармацевтически приемлемую соль.
Как показано в примерах настоящего изобретения, комбинацию, которая описана в настоящей публикации, можно применять для улучшения гликемического контроля. В настоящем изобретении «улучшение гликемического контроля» или «гликемический контроль», в частности, относится к улучшению постпрандиальной концентрации глюкозы в плазме, улучшению концентрации глюкозы в плазме натощак и/или улучшению значения HbA1c.
Вторым аспектом настоящего изобретения является фармацевтическая комбинация для применения с целью снижения уровня глюкагона в плазме у пациентов с диабетом типа 2, при этом указанная комбинация содержит
(a) desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, и
(b) метформин и/или его фармацевтически приемлемую соль.
Как показано в примере 1 настоящего изобретения, комбинацию, которая описана в настоящей публикации, можно применять для снижения уровня глюкагона в плазме.
Метформин является международным непатентованным названием 1,1-диметилбигуанида (CAS, номер 657-24-9). В настоящем изобретении термин «метформин» включает его любую фармацевтически приемлемую соль.
В настоящем изобретении метформин можно вводить перорально. Специалисту известны препараты метформина, подходящие для лечения диабета типа 2 посредством перорального введения. Метформин можно вводить субъекту, нуждающемуся в таком введении, в количестве, доставочном для индукции терапевтического эффекта. Метформин можно вводить в дозе, составляющей, по меньшей мере, 1,0 г/сутки или, по меньшей мере, 1,5 г/сутки. Для перорального введения метформин может быть приготовлен в твердой дозированной форме, такой как таблетка или пилюля. Метформин может быть приготовлен в виде препарата с подходящими фармацевтически приемлемыми носителями, адъювантами и/или вспомогательными веществами.
В настоящем изобретении desPro36эксендин-4(1-39)-Lys6-NH2 и/или фармацевтически приемлемую соль можно вводить в виде дополнительной терапии к введению метформина.
В настоящем изобретении термины «дополнение», «дополнительное лечение» и «дополнительная терапия» относятся к лечению сахарного диабета типа 2 метформином и AVE0010. Метформин и AVE0010 можно вводить в пределах интервала времени, составляющего 24 часа. Каждый из препаратов, метформин и AVE0010, можно вводить в дозе, вводимой один раз в сутки. Метформин и AVE0010 можно вводить разными путями введения. Метформин можно вводить перорально, а AVE0010 можно вводить парентерально.
Комбинация согласно настоящему изобретению может дополнительно содержать сульфонилмочевину. В комбинации сульфонилмочевину можно вводить перорально. Специалисту известны подходящие препараты сульфонилмочевины. Сульфонилмочевину можно вводить в виде дополнительной терапии, дополняющей комбинацию desPro36эксендин-4(1-39)-Lys6-NH2 и метформина, которая описана в настоящей публикации.
Сульфонилмочевина может быть выбрана из глибенкламида, глибенкламида MR, гликлазида, гликлазида LM, глимепирида, глипизида, глипизида XL, гликвидона и толбутамида. В конкретных вариантах любую из конкретных сульфонилмочевин, описанных в настоящей публикации, можно сочетать с конкретным аспектом комбинации desPro36эксендин-4(1-39)-Lys6-NH2 и метформина, описанной в настоящей публикации.
Предпочтительная доза глибенкламида составляет ≤10 мг/сутки, 10-20 мг/сутки или ≥20 мг/сутки.
Предпочтительная доза глибенкламида MR составляет ≤6 мг/сутки, 6-12 мг/сутки или ≥12 мг/сутки.
Предпочтительная доза гликлазида составляет ≤160 мг/сутки, 160-320 мг/сутки или ≥320 мг/сутки.
Предпочтительная доза гликлазида LM составляет ≤60 мг/сутки, 60-120 мг/сутки или ≥120 мг/сутки.
Предпочтительная доза глимепирида составляет ≤4 мг/сутки, 4-8 мг/сутки или ≥8 мг/сутки.
Предпочтительная доза глипизида составляет ≤20 мг/сутки, 20-40 мг/сутки или ≥40 мг/сутки.
Предпочтительная доза глипизида XL составляет ≤10 мг/сутки, 10-20 мг/сутки или ≥20 мг/сутки.
Предпочтительная доза гликвидона составляет ≤60 мг/сутки, 60-90 мг/сутки или ≥90 мг/сутки.
Предпочтительная доза толбутамида составляет ≤1500 мг/сутки или ≥1500 мг/сутки.
Субъектом, подвергаемым лечению комбинацией согласно настоящему изобретению, может быть субъект монголоидной и/или ориентальной расы. В примере 2 настоящего изобретения было обнаружено, что у пациентов монголоидной и/или ориентальной расы может быть достигнуто значимое улучшение гликемического контроля с использованием комбинации ликсисенатида и метформина по сравнению с плацебо (только метформин).
Субъектом, подвергаемым лечению лекарственным средством или комбинацией согласно настоящему изобретению может быть субъект, страдающий от диабета типа 2. Пример показывает, что у таких пациентов введение AVE0010 в сочетании с метформином обеспечивает эффективную терапию.
Субъектом, подвергаемым лечению лекарственным средством или комбинацией согласно настоящему изобретению, страдающим от диабета типа 2, может быть субъект, страдающий от диабета типа 2, когда диабет типа 2 адекватно не контролируется при лечении только метформином отдельно, например, в дозе, составляющей, по меньшей мере, 1,0 г/сутки метформина или, по меньшей мере, 1,5 г/сутки метформина в течение 3 месяцев. В настоящем изобретении субъект с диабетом типа 2, который адекватно не контролируется, может иметь значение HbA1c в диапазоне от 7% до 10%.
Субъектом, подвергаемым лечению лекарственным средством или комбинацией согласно настоящему изобретению, страдающим от диабета типа 2, может быть субъект с ожирением. В настоящем изобретении субъект с ожирением может иметь индекс массы тела, по меньшей мере, 30 кг/м2.
Субъект, подвергаемый лечению лекарственным средством или комбинацией согласно настоящему изобретению, страдающий от диабета типа 2, может иметь нормальную массу тела. В настоящем изобретении субъект, имеющий нормальную массу тела, может иметь индекс массы тела в диапазоне от 17 кг/м2 до 25 кг/м2 или от 17 кг/м2 до <30 кг/м2.
Субъект, подвергаемый лечению лекарственным средством или комбинацией согласно настоящему изобретению, может быть взрослым субъектом. Субъект может иметь возраст, по меньшей мере, 18 лет или может иметь возраст в диапазоне от 18 до 80 лет, от 18 до 50 лет или от 40 до 80 лет, или от 50 до 60 лет. Субъект может быть моложе 50 лет.
Субъект, подвергаемый лечению лекарственным средством или комбинацией согласно настоящему изобретению, предпочтительно не получает противодиабетического лечения, например инсулина и/или родственных соединений.
Субъект, подвергаемый лечению лекарственным средством или комбинацией согласно настоящему изобретению, может страдать от сахарного диабета типа 2 в течение, по меньшей мере, 1 года или, по меньшей мере, 2 лет. В частности, у субъекта, подвергаемого лечению, сахарный диабет типа 2 был диагностирован, по меньшей мере, за 1 год или, по меньшей мере, за 2 года до начала терапии лекарственным средством или комбинацией согласно настоящему изобретению.
Субъект, подвергаемый лечению, может иметь значение HbA1c, составляющее, по меньшей мере, приблизительно 8% или, по меньшей мере, приблизительно 7,5%. Субъект также может иметь значение HbA1c приблизительно от 7 до приблизительно 10%. Пример настоящего изобретения показывает, что лечение AVE0010 приводит к снижению значения HbA1c у пациентов с диабетом типа 2.
В еще одном аспекте настоящего изобретения комбинацию, которая описана в настоящей публикации, можно применять для улучшения значения HbA1c у пациента, страдающего от диабета типа 2. Улучшение значения HbA1c означает, что значение HbA1c снижается и становится ниже 6,5% или 7%, например, после лечения в течение, по меньшей мере, одного месяца, по меньшей мере, двух месяцев или, по меньшей мере, трех месяцев.
В еще одном аспекте настоящего изобретения комбинацию, которая описана в настоящей публикации, можно применять для улучшения показателя толерантности к глюкозе у пациента, страдающего от диабета типа 2. Улучшение показателя толерантности к глюкозе означает, что постпрандиальная концентрация глюкозы в плазме снижается активным средством согласно настоящему изобретению. Снижение означает, в частности, что концентрация глюкозы в плазме достигает нормогликемических значений или, по меньшей мере, приближается к таким значениям.
В настоящем изобретении нормогликемическими значениями являются концентрации глюкозы в крови, составляющие, в частности 60-140 мг/дл (соответствующие 3,3-7,8 мМ/л). Такой диапазон относится, в частности, к концентрациям глюкозы в крови в условиях натощак и постпрандиальным условиям.
Субъект, подвергаемый лечению, может иметь концентрацию глюкозы в плазме через 2 часа после приема пищи, составляющую, по меньшей мере, 10 ммоль/л, по меньшей мере, 12 ммоль/л или, по меньшей мере, 14 ммоль/л. Такие концентрации глюкозы в плазме превышают нормогликемические концентрации.
Субъект, подвергаемый лечению, может иметь колебания уровня глюкозы, составляющие, по меньшей мере, 2 ммоль/л, по меньшей мере, 3 ммоль/л, по меньшей мере, 4 ммоль/л или, по меньшей мере, 5 ммоль/л. В настоящем изобретении колебания уровня глюкозы представляют собой, в частности, разницу между концентрацией глюкозы в плазме через 2 часа после приема пищи и концентрацией глюкозы в плазме за 30 минут перед тестовым приемом пищи.
Термин «постпрандиальная» является термином, который хорошо известен специалисту в области диабетологии. Термин «постпрандиальная», в частности, описывает фазу после приема пищи и/или воздействия глюкозы в экспериментальных условиях. У здорового человека такая фаза характеризуется повышением и последующим снижением концентрации глюкозы в крови. Термин «постпрандиальная» или «постпрандиальная фаза» обычно заканчивается к 2 часам после приема пищи и/или воздействия глюкозы.
Субъект, подвергаемый лечению, которое раскрыто в настоящем описании, может иметь концентрацию глюкозы в плазме натощак, составляющую, по меньшей мере, 8 ммоль/л, по меньшей мере, 8,5 ммоль/л или, по меньшей мере, 9 ммоль/л. Такие концентрации глюкозы в плазме превышают нормогликемические концентрации.
В другом аспекте настоящего изобретения комбинацию, которая описана в настоящей публикации, можно применять для улучшения (т.е. снижения) уровня глюкозы в плазме натощак у пациента, страдающего от диабета типа 2. Снижение, в частности, означает, что концентрация глюкозы в плазме достигает нормогликемических значений или, по меньшей мере, приближается к таким значениям.
Комбинацию согласно настоящему изобретению можно применять для лечения одного или нескольких медицинских показаний, описанных в настоящей публикации, например, для лечения пациентов с диабетом типа 2, или для лечения состояний, ассоциированных с диабетом типа 2, например, для улучшения гликемического контроля, снижения концентрации глюкозы в плазме натощак, для улучшения колебаний глюкозы, снижения постпрандиальной концентрации глюкозы в плазме, улучшения показателя толерантности к глюкозе, улучшения значения HbA1c, снижения уровня глюкагона в плазме, потери массы тела и/или предотвращения увеличения массы.
В настоящем изобретении desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить субъекту, нуждающемуся в таком введении, в количестве, достаточном для индукции терапевтического эффекта.
В настоящем изобретении desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемая соль могут быть приготовлены в виде препарата с фармацевтически приемлемыми носителями, адъювантами и/или вспомогательными веществами.
Соединение desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить парентерально, например, посредством инъекции (такой как внутримышечная или подкожная инъекция). Подходящие устройства для инъекции, например, так называемые «карандаши», состоящий из картриджа, содержащего активный ингредиент, и иглы для инъекции, известны. Соединение desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить в подходящем количестве, например, в количестве в диапазоне от 10 до 15 мкг на дозу или от 15 до 20 мкг на дозу.
В настоящем изобретении desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить в суточной дозе в диапазоне от 10 до 20 мкг, в диапазоне от 10 до 15 мкг или в диапазоне от 15 до 20 мкг. DesPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль можно вводить, используя одну инъекцию в сутки.
В настоящем изобретении desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемая соль могут быть представлены в виде жидкой композиции. Специалисту известны жидкие композиции AVE0010, подходящие для парентерального введения. Жидкая композиция согласно настоящему изобретению может иметь кислое или физиологическое значение pH. Кислый pH предпочтительно находится в диапазоне pH 1-6,8, pH 3,5-6,8, или pH 3,5-5. Физиологический pH предпочтительно находится в диапазоне pH 2,5-8,5, pH 4,0-8,5 или pH 6,0-8,5. Значение pH можно корректировать, используя фармацевтически приемлемую разбавленную кислоту (обычно HCl) или фармацевтически приемлемое разбавленное основание (обычно NaOH).
Жидкая композиция, содержащая desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, может содержать подходящий консервант. Подходящий консервант может быть выбран из фенола, м-крезола, бензилового спирта и сложного эфира п-гидроксибензойной кислоты. Предпочтительным консервантом является м-крезол.
Жидкая композиция, содержащая desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, может содержать средство для поддержания тоничности. Подходящее средство для поддержания тоничности может быть выбрано из глицерина, лактозы, сорбита, маннита, глюкозы, NaCl, соединения, содержащие кальций и магний, такие как CaCl2. Концентрация глицерина, лактозы, сорбита, маннита и глюкозы может быть в диапазоне 100-250 мМ. Концентрация NaCl может составлять до 150 мМ. Предпочтительным средством для тоничности является глицерин.
Жидкая композиция, содержащая desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, может содержать метионин в концентрации от 0,5 мкг/мл до 20 мкг/мл, предпочтительно от 1 мкг/мл до 5 мкг/мл. Предпочтительно жидкая композиция содержит L-метионин.
Следующим аспектом настоящего изобретения является способ улучшения гликемического контроля у пациентов с диабетом типа 2, при этом указанный способ включает в себя введение субъекту, нуждающемуся в таком введении, desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемой соли в сочетании с метформином. В частности, может быть введена комбинация, которая описана в настоящей публикации. В способе согласно настоящему изобретению субъектом может быть субъект, который определен в настоящем описании.
Следующим аспектом настоящего изобретения является способ снижения уровня глюкагона в плазме у пациентов с диабетом типа 2, при этом указанный способ включает в себя введение субъекту, нуждающемуся в таком введении, desPro36эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемой соли в сочетании с метформином. В частности, может быть введена комбинация, которая описана в настоящей публикации. В способе согласно настоящему изобретению субъектом может быть субъект, который определен в настоящем описании.
Еще один аспект настоящего изобретения относится к применению комбинации, которая описана в настоящей публикации, для производства лекарственного средства для лечения медицинского показания, которое описано в настоящей публикации. Например, комбинацию согласно настоящему изобретению можно применять для производства лекарственного средства для лечения пациентов с диабетом типа 2 или для лечения состояний, ассоциированных с диабетом типа 2, например, для улучшения гликемического контроля, снижения концентрации глюкозы в плазме натощак, для улучшения значений колебаний уровня глюкозы, снижения постпрандиальной концентрации глюкозы в плазме, улучшения значения HbA1c и/или улучшения показателя толерантности к глюкозе. Комбинацию согласно настоящему изобретению также можно применять для производства лекарственного средства для снижения уровня глюкагона в плазме у пациентов с диабетом типа 2. Лекарственное средство может быть приготовлено в виде препарата, как описано в настоящей публикации. Например, лекарственное средство может включать парентеральный препарат AVE0010 и/или его фармацевтически приемлемой соли и пероральный препарат метформина и/или его фармацевтически приемлемой соли. Лекарственное средство может дополнительно включать препарат сульфонилмочевины, который описан в настоящей публикации. В частности, препарат сульфонилмочевины представляет собой пероральный препарат.
Изобретение дополнительно проиллюстрировано следующими далее примерами и фигурами.
Надписи к фигурам.
Фигура 1: Профиль скорректированных средних значений (±SEM) постпрандиальных уровней глюкозы в плазме в день -1 и на 28 день при разных типах лечения.
Фигура 2: Дизайн исследования в примере 1.
Фигура 3: Постпрандиальный провокационный тест - значения инсулина в плазме (мкМЕ/мл) в день -1 и на 28 день.
Фигура 4: Тест с провокационным приемом пищи - данные определения изменения уровня инсулина в плазме (мкМЕ/мл) по сравнению со значением до приема пищи в день -1 и на 28 день.
Фигура 5: Тест с провокационном приемом пищи - значения глюкагона (пг/мл) в день -1 и на 28 день.
Фигура 6: Уровни глюкозы в плазме (мг/дл) в день -1 и на 28 день.
Фигура 7. Дизайн исследования в примере 2.
Фигура 8: График Каплана-Мейера периода времени до прерывания лечения по любой причине - рандомизированная популяция.
Фигура 9: График изменения средних значений HbA1C (%) по сравнению с исходным уровнем во время визита и на 24 неделе - популяция mITT. LOCF=перенос данных последнего наблюдения вперед. Примечание: в анализе исключали измерения после введения препарата неотложной терапии и/или после прекращения лечения плюс 3 дня.
Фигура 10: График изменения средних значений уровня глюкозы в плазме натощак (ммоль/л) по сравнению с исходным уровнем во время визита и на 24 неделе - популяция mITT. LOCF=перенос данных последнего наблюдения вперед. Примечание: в анализе исключали измерения после введения препарата неотложной терапии и/или после прекращения лечения плюс 1 день.
Фигура 11: График изменения средних значений массы тела (кг) по сравнению с исходным уровнем во время визита и на 24 неделе - популяция mITT. LOCF=перенос данных последнего наблюдения вперед. Примечание: в анализе исключали измерения после введения препарата неотложной терапии и/или после прекращения лечения плюс 3 дня.
Пример 1
Название исследования: открытое рандомизированное исследование в двух параллельных группах с целью сравнения влияния 4-недельного лечения с использованием введения один раз в сутки ликсисенатида или лираглутида на постпрандиальные уровни глюкозы в плазме у пациентов с диабетом типа 2, у которых не удается адекватный контроль метформином (PDY10931)
Центры исследования: 7 центров в Германии
Публикации (ссылка): нет
Фаза разработки: фаза 2a
Цели:
Основная: исследовать влияние многократных подкожных доз 20 мкг ликсисенатида по сравнению с 1,8 мг лираглутида на снижение постпрандиальных уровней глюкозы в плазме (ППГ), оцениваемых по площади под кривой концентрации глюкозы в плазме (AUC) после стандартизованного завтрака, в конце 4-недельного периода лечения у пациентов с диабетом типа 2.
Дополнительные:
(1) Оценить влияние ликсисенатида по сравнению с лираглутидом после 4-недельного периода лечения у пациентов с диабетом типа 2:
- на максимальное колебание ППГ и на изменения концентраций инсулина, проинсулина, C-пептида и глюкагона в плазме после стандартизованного завтрака;
- на 24-часовой профиль уровня глюкозы в плазме;
- на HbA1c;
- на маркеры;
- на маркеры насыщения (обестатин, PYY-36 и оксинтомодулин).
(2) Оценить профиль клинической и лабораторной безопасности ликсисенатида и лираглутида на протяжении 4-недельного периода лечения у пациентов с диабетом типа 2.
Методика: многоцентровое открытое рандомизированное исследование в 2 параллельных группах с введение доз один раз в сутки в течение 4-недельного периода лечения (2-недельное титрование дозы и 2-недельная поддерживающая доза). Дизайн исследования см. на фигуре 1.
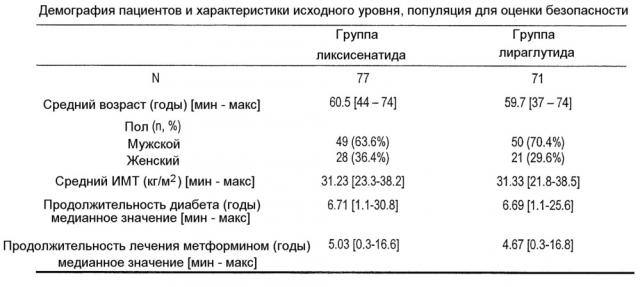
| Количество пациентов: | планируемое: 120 (60 в каждой группе);рандомизированное: 148 (77 в случае ликсисенатида и 71 в случае лираглутида); |
| Оцениваемое: | подвергнутое лечению: 148 (77 в случае ликсисенатида и 71 в случае лираглутида);фармакодинамика: 143 (75 в случае ликсисенатида и 68 в случае |
| лираглутида);безопасность: 148 (77 в случае ликсисенатида и 71 в случае лираглутида). |
Диагностика и критерии для включения: пациенты мужского и женского пола с сахарным диабетом типа 2, которые определены согласно требованиям ВОЗ (Всемирной организации здравоохранения): уровень глюкозы в плазме натощак ≥7 ммоль/л (126 мг/дл) или уровень глюкозы в плазме через 2 часа после приема пищи (постпрандиальный, ППГ) ≥11,1 ммоль/л (200 мг/дл), диагностированные, по меньшей мере, за 1 год до визита на скрининговое обследование, у которых отсутствовал адекватный контроль метформином в дозе, составляющей, по меньшей мере, 1,5 г/сутки, в течение, по меньшей мере, 3 месяцев перед скринингом; HbA1c (гликированный гемоглобин) ≥6,5% и ≤9% при скрининге.
Исследуемый продукт: ликсисенатид, раствор 100 мкг/мл для инъекции в стеклянном картридже объемом 3 мл
Доза: 10 мкг начальная доза при титровании; 20 мкг поддерживающая доза
Введение: подкожная инъекция один раз в сутки инжектором карандашного типа (OptiClik®), натощак
Номер партии: FRA-01282/40C008 C1005517
Продолжительность лечения: 10 мкг (доза для титрования) в течение 2 недель, затем 20 мкг (поддерживающая доза) в течение 2 недель
Продолжительность наблюдения: до 7 недель для каждого пациента
Сравнительная терапия: лираглутид, раствор 6 мг/мл для инъекций в предварительно заполняемом карандаше Victoza® объемом 3 мл
Доза: дозы для титрования 0,6 мг в течение 1 недели, затем 1,2 мг в течение 1 недели; поддерживающая доза 1,8 мг в течение 2 недель
Введение: подкожная инъекция один раз в сутки с использованием карандаша Victoza, натощак
Номер партии: YP50068
Критерии для оценки:
Фармакодинамические:
Основной конечный показатель: Изменение по сравнению с исходным уровнем области под кривой зависимости скорректированной концентрации глюкозы в плазме (т.е. относительно концентрации глюкозы до приема пищи) от времени, вычисленной посредством линейной апроксимации с использованием правила трапеций (GLU-AUC0:30-4:30), определяемой на основании оценок уровней глюкозы на 28 день от момента времени начала стандартизованного завтрака (через 30 минут после инъекции исследуемого лекарственного средства) до 4 часов после инъекции.
Дополнительные конечные результаты:
- Изменение по сравнению с исходным уровнем постпрандиального колебания уровня глюкозы в плазме (максимальное постпрандиальное изменение уровня глюкозы в плазме), определяемого от момента времени начала завтрака (через 30 минут после инъекции исследуемого лекарственного средства) до 4 часов после этого на 28 день относительно концентрации глюкозы в плазме до приема пищи;
- 24-часовой профиль уровня глюкозы в плазме исходного уровня и на 28/29 день;
- Профили концентраций проинсулина, инсулина, C-пептида и глюкагона в плазме в -1/1 дни и 28/29 дни;
- Изменение по сравнению с исходным уровнем скорректированного значения (т.е. относительно значения до приема пищи) AUC0:30-4:30 для постпрандиальных концентраций в плазме проинсулина, инсулина, C-пептида и глюкагона, определяемого от момента начала стандартизованного завтрака (через 30 минут после инъекции исследуемого лекарственного средства) до 4 часов после этого на 28 день (профиль, охватывающий 7 временных точек);
- изменение отношения проинсулина к инсулину по сравнению с исходным уровнем на 28 день;
- изменение HbA1c по сравнению с исходным уровнем на 29 день;
- изменение маркеров насыщения (PYY-36, оксинтомодулина и обестатина) по сравнению с совпадающим по времени исходным уровнем на 28 день;
В случае определения фармакодинамических конечных результатов проинсулин, инсулин и C-пептид анализировали в сыворотке, тогда как глюкозу, глюкагон, PYY-36, оксинтомодулин и обестатин анализировали в плазме.
Безопасность: нежелательные явления, о которых сообщал пациент или которые были отмечены исследователем; стандартная гематология и химия крови; автоматическая регистрация ЭКГ (электрокардиограммы), жизненно важные показатели.
Статистические способы
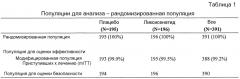
Фармакодинамика:
Основной популяцией для исследования фармакодинамики была модифицированная популяция приступивших к лечению (mITT), которая включает всех рандомизированных пациентов, которые получали, по меньшей мере, 1 дозу ликсисенатида или лираглутида и для которых была проведена как оценка исходного уровня, так и, по меньшей мере, 1 оценка после исходного уровня любой первичной или вторичной фармакодинамической переменной, независимо от соблюдения протокола и процедур исследования. Все непрерывные фармакодинамические параметры, включая основной конечный результат (изменения GLU-AUC0:30-4:30час по сравнению с исходным уровнем на 4 неделе) анализировали, используя модель дисперсионного анализа (ANOVA), при этом лечение и центр использовали в качестве фиксированных эффектов и значение исходного уровня соответствующего параметра в качестве ковариаты. Оценки средних (с соответствующим 2-сторонним 95% доверительным интервалом [ДИ]) для сравнения между ликсисенатидом и лираглутидом получали, используя линейные контрасты в рамках принятой модели. Статистический критерий для первичной фармакодинамической переменной был 2-сторонним, альфа-уровень 0,05.
Безопасность:
Анализы безопасности в случае 4-недельного рандомизированного лечения были описательными и были основаны на данных, полученных на популяции для оценки безопасности, определяемой как популяция, в которую входят все пациенты, которые были рандомизированы и подвергнуты воздействию, по меньшей мере 1 дозы ликсисенатида или лираглутида, независимо от количества введений при лечении. Пациентов, которые получали лечение, отличное от лечения, назначенного при рандомизации, анализировали в соответствии с получаемым лечением. Анализ безопасности был основан на анализе отдельных значений (клинически значимых аномалий) и описательной статистике (сводных таблицах и графиках, если только они отвечали требованиям по параметрам ЭКГ и жизненно важным показателям) по видам лечения. Возникающие во время лечения нежелательные явления (TEAE), классифицированные по системно-органным классам и терминам предпочтительного применения, сведены в таблицы, затем суммированы по количеству и проценту пациентов и количеству TEAE. Отдельные клинические лабораторные данные, жизненно важные показатели и данные ЭКГ вносили в список и отмечали потенциально клинически значимые отклонения от нормы (PCSA)