Экспресс-метод морфофункционального анализа тромбоцитов, пригодных для клинического использования
Иллюстрации
Показать всеИзобретение относится к области медицины и касается способа морфофунционального анализа тромбоцитов, содержащихся в богатой тромбоцитами плазме (БоТП) или тромбоцитном концентрате (ТК). Сущность способа заключается в том, что определяют концентрацию тромбоцитов (СТР, тыс./мкл) в БоТП или ТК. Проводят прижизненную окраску тромбоцитов красителем, приготовленным разведением 5-15 мг трипафлавина и 15-25 мг акридинового оранжевого при комнатной температуре в 100 мл фосфатного буфера при pH 7,2-7,4 посредством введения красителя в БоТП или ТК из расчета 200 мкл красителя на 1 мл тромбоцитного концентрата или 100 мкл красителя на 1 мл богатой тромбоцитами плазмы. После чего осуществляют исследование препарата с окрашенными тромбоцитами с помощью флуоресцентного микроскопа с последующим определением средней интенсивности свечения (ИСопыт) 1-го поля зрения микроскопа, кроме того, по калибровочной кривой или по формуле определяют теоретическую интенсивность свечения (ИСтеор), отражающую среднюю интенсивность свечения 1-го поля зрения микроскопа с витально окрашенными клетками пробы с заданной концентрацией тромбоцитов (СТР) при условии, что все клетки этой пробы (100%) будут содержать гранулы. Далее определяют относительное содержание тромбоцитов с гранулами (Dтр.гр.) по формуле Dтр.гр.(%)=ИСопыт/ИСтеор×100%, при этом пригодными для клинического использования считают тромбоциты, значение Dтр.гр. для которых составляет от 35 до 75%. Использование способа позволяет с высокой точностью анализировать популяцию витально окрашенных клеток. 7 з.п. ф-лы, 4 табл., 2 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины, а именно производственной и клинической трансфузиологии, и может быть использовано для отбора тромбоцитов, тромбоцитных концентратов, пригодных для трансфузии.
Уровень техники
Из уровня техники известен метод морфофункциональной оценки тромбоцитов с помощью метода витальной компьютерной морфометрии на основе отечественного фазово-интерференционного микроскопа «Цитоскан» [Колосова Е.Н., Василенко И.А., Ковалева Л.Г. Оценка морфофункционального состояния тромбоцитов у больных идиопатической тромбоцитопеничской пурпурой методом витальной компьютерной морфометрии. Бюллетень СО РАМН, 2011, 31, №2, с. 58-63].
Однако известный метод не позволяет оценить целостность внутреннего состава исследуемых тромбоцитов, различить клетки с высокой и низкой функциональной активностью, требует использования дорогостоящей уникальной микроскопической аппаратуры, а также требует длительного времени для обработки полученных экспериментальных данных и не пригоден для быстрого анализа большого количества проб с тромбоцитами.
Наиболее близким к заявляемому является способ оценки морфофункционального статуса тромбоцитов человека [патент РФ на изобретение №2485502 от 20.06.2013, авт. М.Ш. Хубутия, М.С. Макаров, В.Б. Хватов, И.В. Высочин, Е.Н. Кобзева, Н.В. Боровкова, О.И. Конюшко]. Тромбоциты крови, плазмы или тромбоцитарного концентрата окрашивают витальным (прижизненным) красителем на основе 0,01% трипафлавина и 0,02% акридинового оранжевого (или его аналогов) в течение 5-10 мин при комнатной температуре, затем окрашенные клетки переносят на предметное стекло, накрывают покровным стеклом и с помощью флуоресцентного микроскопа - объектив ×100, длина волны возбуждения 450-490 нм, длина волны эмиссии от 520 нм, оценивают количество тромбоцитов с гранулами, измеряют яркость свечения витально окрашенных трипафлавином и акридиновым оранжевым клеток, измеряют яркость свечения 100-200 витально окрашенных трипафлавином-АО клеток, суммируют значения яркости обследованных клеток, делят на количество обследованных тромбоцитов, рассчитывают среднюю величину интенсивности свечения тромбоцита и выражают в фут-канделах на 1 клетку, соответствующих одному баллу, характеризующую морфофункциональную активность тромбоцитов (МФАТ) анализируемого образца, далее препарат с витально окрашенными тромбоцитами помещают в термостат при 37°С на 5-15 мин, после чего с помощью флуоресцентного микроскопа подсчитывают число распластанных тромбоцитов с выходящими наружу гранулами, делят на общее число обследованных клеток и выражают в %, причем один процент соответствует одному баллу, характеризующих адгезивную активность тромбоцитов (ААТ) анализируемого образца, затем по сумме морфофункциональной и адгезивной активностей, выраженных в баллах, оценивают морфофункциональный статус тромбоцитов (МФСТ), который при 80-130 баллах считают нормальным, при 60-79 баллах - сниженным, при 41-59 баллах - низким, при менее чем 40 баллах - очень низким, при 131-150 баллах - высоким, при 151-170 баллах - очень высоким. Длительное исследование показало, что содержание тромбоцитов с гранулами (Dтр.гр., %) в крови здоровых людей в норме составляет 35-75%. Следовательно, такой уровень Dтр.гр. можно считать референтным для ТК, предназначенных для клинического использования.
Однако данный метод является трудоемким, требует анализа свечения клеток с помощью микроскопа, который возможен лишь путем выделения контуров каждой отдельной клетки (тромбоцита) при использовании максимального увеличения (объектив ×100), что затрудняет анализ большого числа тромбоцитов (более 500), не позволяет проанализировать более 5 проб в час или 30 проб в сутки.
Раскрытие изобретения
Задачей изобретения является модификация способа оценки морфофункционального статуса тромбоцитов человека с целью ускорения и упрощения анализа тромбоцитов доноров.
Техническим результатом, на достижение которого направлено заявленное изобретение, является значительное сокращение времени анализа одной пробы за счет оптимизации окраски клеток в зависимости от их количества, увеличение числа исследуемых клеток в ходе анализа путем оценки свечения всего поля зрения окрашенного препарата при среднем увеличении микроскопа (объектив ×40, увеличение в 400 раз), снижение роли человеческого фактора на получаемый результат, повышение достоверности и точности анализа всей популяции витально окрашенных клеток.
Поставленная задача решается тем, что способ морфофункционального анализа тромбоцитов, содержащихся в богатой тромбоцитами плазме (БоТП) или тромбоцитном концентрате (ТК), для определения их пригодности для клинического использования, включает следующие этапы:
определение концентрации тромбоцитов (СТР, тыс./мкл) в БоТП или ТК,
прижизненную окраску тромбоцитов красителем, приготовленным разведением 5-15 мг трипафлавина и 15-25 мг акридинового оранжевого при комнатной температуре в 100 мл фосфатного буфера при pH 7,2-7,4, посредством введения красителя в БоТП или ТК из расчета 200 мкл красителя на 1 мл тромбоцитного концентрата или 100 мкл красителя на 1 мл богатой тромбоцитами плазмы,
после чего осуществляют исследование препарата с окрашенными тромбоцитами с помощью флуоресцентного микроскопа с последующим определением средней интенсивности свечения (ИСопыт) 1-го поля зрения микроскопа,
кроме того, по калибровочной кривой или по формуле определяют теоретическую интенсивность свечения (ИСтеор), отражающую среднюю интенсивность свечения 1-го поля зрения микроскопа с витально окрашенными клетками пробы с заданной концентрацией тромбоцитов (СТР) при условии, что все клетки этой пробы (100%) будут содержать гранулы,
после чего определяют относительное содержание тромбоцитов с гранулами (Dтр.гр.) по формуле Dтр.гр.(%)=ИСопыт/ИСтеор×100%, при этом
пригодными для клинического использования считают тромбоциты, значение Dтр.гр. для которых составляет от 35 до 75%.
В частном варианте осуществления способа концентрацию тромбоцитов определяют посредством гематологического анализатора. Для исследования с помощью флуоресцентного микроскопа пробу с окрашенными тромбоцитами берут в количестве не менее 5 мкл. Окраску тромбоцитов осуществляют в пробирке в течение 2-5 минут. Оценку средней интенсивности свечения (ИСопыт) 1-го поля зрения микроскопа с витально окрашенными клетками пробы осуществляют посредством усреднения интенсивностей свечения, по крайней мере, четырех полей зрения исследуемой пробы, которые определяют по их цифровым изображениям, увеличенным, по крайней мере, в 400 раз. Используют флуоресцентный микроскоп с объективом ×40, числовой апертурой 0.6, длиной волны λ возбуждения 450-490 нм и λ эмиссии от 520 нм. Для оценки интенсивности свечения 1 поля зрения используют программу Adobe Photoshop. Теоретическую (стандартную) интенсивность свечения (ИСтеор) 1-го поля зрения микроскопа с витально окрашенными клетками пробы определяют по калибровочной кривой или по формуле: ИСтеор=0,0549×СТР+5,3784 при использовании для анализа тромбоцитов БоТП или ИСтеор=0,005×СТР+24,422 при использовании для анализа тромбоцитов клеток тромбоцитного концентрата.
За счет подбора адекватного количества красителя в зависимости от концентрации клеток в анализируемом образце (богатая тромбоцитами плазма доноров или тромбоцитный концентрат доноров) на первом этапе минимизируется свечение фона при сохранении исходного уровня свечения самих клеток. Отметим, что в прототипе окраска тромбоцитов витальным красителем на основе трипафлавина и акридинового оранжевого вызывает значительное свечение фона (пространства, свободного от клеток). При этом площадь фонового свечения значительно превышает площадь, занятую клетками - в среднем в 8 раз при концентрации клеток до 10000000/мкл (богатая тромбоцитами плазма) и в 4 раза - при концентрации более 1000000/мкл (тромбоцитный концентрат). В результате анализируемые образцы с разным содержанием биологически полноценных тромбоцитов (клетки с гранулами) имеют сходное свечение поля зрения микроскопа. Установлено, что минимальное значение свечения фона при сохранении интенсивности свечения 1-й окрашенной клетки достигается при соотношении объема стандартного витального красителя к объему анализируемой пробы 1:10 при исследовании образцов плазма богатой и 1:5 - в случае тромбоцитного концентрата. Найденное соотношение красителя и пробы позволило значительно сократить долю свечения фона и значительно увеличить долю свечения клеток. Это позволяет оценивать свечение окрашенных тромбоцитов по свечению всего поля зрения, что существенно сокращает время анализа (оценка свечения 100 тромбоцитов по отдельности занимает в среднем 12 мин, тогда как оценка свечения всего поля зрения - 0,2-1 мин).
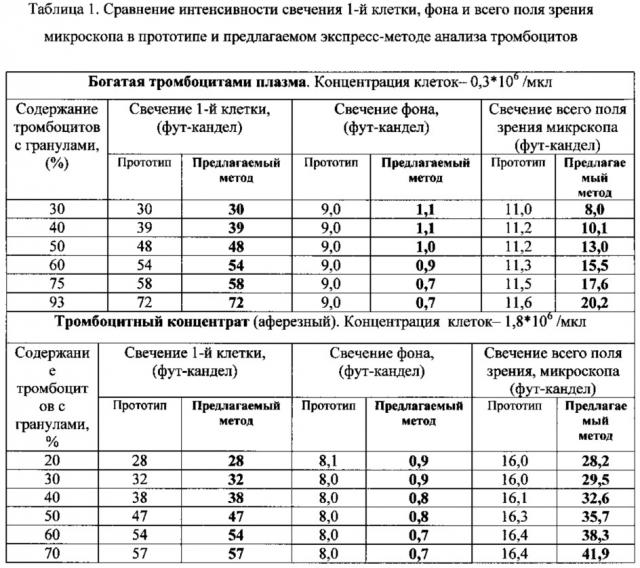
Для объективизации оценки цифровых изображений определяли среднюю интенсивность свечения 1-го поля зрения в зависимости от количества обследованных полей зрения микроскопа. Показано, что при обследовании 10 полей зрения коэффициент вариации, отражающий погрешность измерений, достигал минимального значения и не менялся при дальнейшем увеличении количества обследованных полей. В прототипе при большом увеличении (×1000-×2000) свечение 1-го поля зрения имеет очень высокую вариабельность (более 60%) вследствие неравномерного распределения клеток и их малого количества в поле зрения. В связи с этим в предлагаемом методе анализ свечения всего поля зрения необходимо проводить при меньшем увеличении и большем количестве клеток. Установлено, что оптимальное увеличение дает объектив ×40, при котором каждое поле зрение содержит 100-250 клеток при сохранении интенсивности свечения каждой отдельной клетки. Анализ 10 полей зрения при таком увеличении позволяет оценить 1000-2500 клеток, что существенно выше, чем в прототипе (150-200 клеток). При этом поля зрения с разным содержанием тромбоцитов с гранулами имеют достоверное различие по интенсивности свечения всего поля зрения (таблица 1).
На втором этапе заявляемого способа были разработаны модели оценки содержания тромбоцитов с гранулами (Dтр.гр.) отдельно для богатой тромбоцитами плазмы доноров и отдельно для тромбоцитного концентрата доноров. Для получения таких моделей проведена оценка интенсивности свечения поля зрения препаратов, где практически вся популяция тромбоцитов (95-100%) представлена клетками с гранулами с учетом общей концентрации клеток в пробе. В процессе исследования были выявлены пациенты, у которых относительное содержание тромбоцитов с гранулами (Dтр.гр., %) варьирует от 91 до 95%, при этом концентрация тромбоцитов с гранулами в крови таких пациентов составляла 250-350 тыс./мкл. Параллельно обследовали образцы плазмы доноров, у которых исходное содержание тромбоцитов с гранулами также составило 250-350 тыс./мкл. Препараты с тромбоцитами пациентов готовили по стандартной методике, при работе с материалом доноров необходимо было предварительно элиминировать из среды тромбоциты без гранул. Для этого стандартный объем окрашенной пробы вносили на предметное стекло, которое помещали в термостат при 37°С на 5 мин для запуска начальной стадии адгезии тромбоцитов с гранулами. Через 5 мин препарат вынимали из термостата, обрабатывали раствором антиагреганта тикагрелора (для остановки дальнейшей активации тромбоцитов с гранулами). Затем для удаления неадгезировавших тромбоцитов препарат промывали буферным раствором. В результате в таком препарате относительное содержание клеток с гранулами составляло 95-98%. Таким образом, нам удалось получить два типа витально окрашенных препаратов, где практически вся популяции тромбоцитов была представлена клетками, содержащими гранулы. Микроскопический анализ препаратов показал, что интенсивность свечения одного поля зрения микроскопа, интенсивность свечения одной клетки (в фут-канделах) у пациентов и у доноров при стабилизации тромбоцитов тикагрелором была сходной (таблица 2).
Это позволило получить калибровочные кривые для проб с концентрацией тромбоцитов от 300 до 1000 тыс./мкл (Богатая тромбоцитами плазма) и более 1000 тыс./мкл (тромбоцитный концентрат), которые позволяют определить интенсивность свечения 1-го поля зрения витально окрашенного препарата с учетом общей концентрации клеток в пробе при условии, что 100% тромбоцитов содержат гранулы.
Краткое описание чертежей
Изобретение поясняется чертежами, где на фиг. 1 представлена калибровочная кривая зависимости интенсивности свечения 1-го поля зрения витально окрашенного препарата от концентрации тромбоцитов в богатой тромбоцитами плазме доноров при условии, что 100% тромбоцитов содержат гранулы. На фиг. 2 представлена калибровочная кривая зависимости интенсивности свечения 1-го поля зрения витально окрашенного препарата от концентрации тромбоцитов в тромбоцитном концентрате доноров при условии, что 100% тромбоцитов содержат гранулы.
Осуществление изобретения
Процедура экспресс-анализа тромбоцитов в богатой тромбоцитами плазме доноров и готовых тромбоцитных концентратах доноров (ТК) включает следующие этапы:
1. Забор 5 мл венозной крови донора в стандартную пробирку с антикоагулянтом CPD (цитрат) в соотношении 7:1 или отбор 1 мл из дозы ТК, заготовленной с помощью аппарата автоматического афереза.
2. Подсчет общего количества тромбоцитов (СТР, тыс./мкл) в крови донора или ТК с помощью гематологического анализатора.
3. Приготовление витального красителя путем разведения 10 мг трипафлавина и 20 мг акридинового оранжевого при комнатной температуре в 100 мл фосфатного буфера (pH 7,2-7,4).
4. Выделение богатой тромбоцитами плазмы (БоТП), для получения которой образцы крови доноров центрифугируют при 300-400 g в течение 4-5 минут, после чего отбирают супернатант.
5. Окраска БоТП или ТК доноров витальным красителем.
Для окрашивания 1 мл БоТП (до 1000 тыс. клеток в мкл) требуется 100 мкл готового витального красителя, для окрашивания 1 мл ТК (более 1000 тыс. клеток в мкл) - 200 мкл. Окрашивание проводят в микропробирке в течение 2-5 мин при комнатной температуре, после чего 5 мкл пробы с окрашенными тромбоцитами переносят на предметное стекло и накрывают покровным стеклом
6. Оценка средней интенсивности свечения (ИСопыт в фут-канделах) препарата с витально окрашенными тромбоцитами.
ИСопыт отражает реальную интенсивность свечения витально окрашенных тромбоцитов в 1-м поле зрения микроскопа. ИСопыт оценивают как в богатой тромбоцитами плазме (БоТП), так и в тромбоцитном концентрате (ТК). Витально окрашенные препараты анализируют с помощью флуоресцентного микроскопа (объектив ×40, числовая апертура 0.6, λ возбуждения 450-490 нм, λ эмиссии - от 520 нм) в полуавтоматическом режиме. С помощью цифровой фотокамеры при экспозиции 0.25-0.5 сек получают цифровые изображения 10 разных полей зрения окрашенного препарата и переносят в компьютер. Для оценки интенсивности свечения 1 поля зрения используют программу Adobe Photoshop. ИСопыт (средняя величина) рассчитывают по формуле: ИСопыт = суммарная интенсивность свечения обследованных полей зрения : число обследованных полей зрения.
Например, интенсивность свечения 10 разных полей зрения составляла соответственно 10.1, 10.2, 10.5, 11.0, 10.4, 10.2, 9.0, 9.7, 10.0 и 10.5 фут-кандел. Рассчитывают среднюю величину:
ИСопыт=(10.1+10.2+10.5+11.0+10.4+10.2+9.0+9.7+10.0+10.5):10=10.16 фут-кандел.
7. Оценка теоретической (стандартной) интенсивности свечения (ИСтеор в фут-канделах) 1-го поля препарата с витально окрашенными тромбоцитами.
ИСтеор отражает среднюю интенсивность свечения 1-го поля зрения микроскопа с витально окрашенными клетками из пробы с известной концентрацией тромбоцитов (СТР) при условии, что все клетки этой пробы (100%) будут содержать гранулы.
ИСтеор определяют по калибровочной кривой (рис. 1, 2) или по формуле:
ИСтеор=0,0549×СТР+5,3784 для анализа тромбоцитов крови доноров.
ИСтеор=0,005×СТР+24,422 для анализа клеток тромбоцитного концентрата.
Например: Концентрация тромбоцитов (СТР) в крови донора составляет 240000 кл./мкл. Этому значению (СТР) на калибровочной кривой соответствует значение ИСтеор=18.5 фут-кандел или по формуле ИСтеор=0,0549⋅240+5,3784=18.6 фут-кандел (рис. 1).
Например: Концентрация тромбоцитов в ТК, полученном от того же донора составляет 2400000 кл./мкл. Этому значению (СТР) на калибровочной кривой соответствует значение ИСтеор=36.0 фут-кандел или по формуле ИСтеор=0,005⋅2400+24,422=36.4 фут-кандел (рис. 2).
8. Оценка относительного содержания тромбоцитов с гранулами (Dтр.гр.), в %.
Dтр.гр. отражает содержание в пробе тромбоцитов с гранулами, т.е. биологически полноценных тромбоцитов.
Dтр.гр. определяют как отношение ИСопыт к ИСтеор:
Dтр.гр. (доля)=ИСопыт/ИСтеор или
Dтр.гр. (%)=ИСопыт/ИСтеор×100%.
Например, в ходе обследования тромбоцитов крови донора значение ИСопыт составило 11 фут-кандел, ИСтеор равно 20 фут-кандел, Dтр.гр.=11:20×100%=55%.
Пригодными для клинического использования считаются тромбоциты с Dтр.гр. от 35 до 75%.
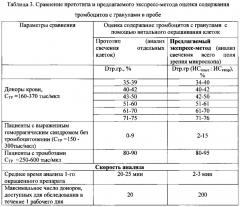
Проведено сравнение данных, полученных в ходе морфофункционального исследования тромбоцитов путем анализа отдельных клеток (прототип) и анализа интенсивности свечения всего поля зрения флуоресцентного микроскопа (предлагаемый экспресс-метод). Показана идентичность двух методов исследования, высокая воспроизводимость относительного содержания тромбоцитов с гранулами (Dтр.гр.), полученных при использовании предложенного экспресс-метода как в норме, так и при патологических состояниях (таблица 3). При этом экспресс-метод позволяет сократить среднее время анализа 1-го окрашенного препарата с 20-25 минут до 2-3 минут, увеличить количество обследуемых за 1 день доноров тромбоцитов в 10 раз.
Пример реализации изобретения.
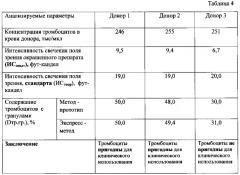
У 3 доноров крови проводили морфофункциональный анализ тромбоцитов с целью определения их пригодности для клинического использования. Результаты исследования показаны в таблице 4.
1. Способ морфофункционального анализа тромбоцитов, содержащихся в богатой тромбоцитами плазме или тромбоцитном концентрате, для определения их пригодности для клинического использования, включающий
определение концентрации тромбоцитов (CTP, тыс./мкл) в богатой тромбоцитами плазме или тромбоцитном концентрате,
окраску тромбоцитов витальным красителем, приготовленным разведением 5-15 мг трипафлавина и 15-25 мг акридинового оранжевого при комнатной температуре в 100 мл фосфатного буфера при рН 7,2-7,4, посредством введения красителя в богатую тромбоцитами плазму или тромбоцитный концентрат из расчета 200 мкл красителя на 1 мл тромбоцитного концентрата или 100 мкл красителя на 1 мл богатой тромбоцитами плазмы,
в полученном препарате с окрашенными тромбоцитами определяют среднюю интенсивность свечения (ИСопыт) 1-го поля зрения микроскопа,
кроме того, по калибровочной кривой или по формуле определяют теоретическую интенсивность свечения (ИСтеор), отражающую среднюю интенсивность свечения 1-го поля зрения микроскопа с витально окрашенными клетками пробы с заданной концентрацией тромбоцитов (СТР) при условии, что все клетки этой пробы (100%) будут содержать гранулы,
после чего определяют относительное содержание тромбоцитов с гранулами (Dтр.гр.) по формуле Dтр.гр.(%)=ИСопыт/ИСтеор×100%, при этом пригодными для клинического использования считают тромбоциты, значение Dтр.гр. для которых составляет от 35 до 75%.
2. Способ по п. 1, характеризующийся тем, что определение концентрации тромбоцитов осуществляют посредством гематологического анализатора.
3. Способ по п. 1, характеризующийся тем, что для исследования с помощью флуоресцентного микроскопа пробу с окрашенными тромбоцитами берут в количестве не менее 5 мкл.
4. Способ по п. 1, характеризующийся тем, что окраску тромбоцитов осуществляют в пробирке в течение 2-5 минут.
5. Способ по п. 1, характеризующийся тем, что оценку средней интенсивности свечения (ИСопыт) 1-го поля зрения микроскопа с витально окрашенными клетками пробы осуществляют посредством усреднения интенсивностей свечения, по крайней мере, четырех полей зрения исследуемой пробы, которые определяют по их цифровым изображениям, увеличенным, по крайней мере, в 400 раз.
6. Способ по п. 1, характеризующийся тем, что в качестве флуоресцентного микроскопа используют микроскоп с объективом ×40, числовой апертурой 0.6, длиной волны λ возбуждения 450-490 нм и λ эмиссии от 520 нм.
7. Способ по п. 5, характеризующийся тем, что для оценки интенсивности свечения 1 поля зрения используют программу Adobe Photoshop.
8. Способ по п. 1, характеризующийся тем, что теоретическую (стандартную) интенсивность свечения (ИСтеор) 1-го поля зрения микроскопа с витально окрашенными клетками пробы определяют по калибровочной кривой или по формуле: ИСтеор=0,0549×СТР+5,3784 при использовании для анализа тромбоцитов БоТП или ИСтеор=0,005×СТР+24,422 при использовании для анализа тромбоцитов клеток тромбоцитного концентрата.