Способ проведения иммунохроматографического анализа с высокой степенью выявления маркера
Иллюстрации
Показать всеИзобретение относится к аналитической химии и представляет собой способ проведения иммунохроматографического анализа. Предложенный способ проведения иммунохроматографического анализа отличается тем, что при изготовлении тест-полоски используют прозрачную подложку. После контакта тест-полоски с пробой и завершения движения реагентов вдоль мембран на нитроцеллюлозную мембрану наносят вещество, растворяющее нитроцеллюлозу, но не нарушающее структуру подложки, например ацетонитрил. После высыхания растворителя на поверхности подложки образуется стекловидная прозрачная масса. Детекция на просвет оставшегося в зонах связывания маркера дает возможность его полной (100%-ной) регистрации при малом уровне неспецифического окрашивания вне зон связывания, что, в конечном итоге, повышает достоверность регистрации результатов анализа и позволяет выявлять наличие в пробах контролируемого соединения в более низких концентрациях. 2 ил., 1 табл., 1 пр.
Реферат
Типичная иммунохроматографическая тест-система является мультимембранным композитом, состоящим из пластиковой подложки и зафиксированных на ней мембран: рабочей мембраны (как правило, нитроцеллюлозной), мембраны для конъюгата антитело-маркер (например, коллоидное золото), мембраны для анализируемой пробы и впитывающей мембраны.
Рабочая мембрана изготавливается из нитроцеллюлозы и имеет толщину 50-200 мкм. Чем больше толщина мембраны, тем большие объемы тестируемой пробы и маркера она поглощает, тем самым увеличивая их количество, проходящее через зоны связывания тест-полоски. Потенциально при этом должно происходить увеличение детектируемого сигнала - интенсивности окрашивания зон связывания. Однако это преимущество сводится на нет физическими ограничениями самой мембраны: из-за непрозрачности нитроцеллюлозы маркер виден, только если он находится вблизи поверхности мембраны.
В большинстве протоколов нанесения реагентов при изготовлении иммунохроматографических тест-систем антитела или иной связывающий иммунореагент, иммобилизуемый в аналитической и контрольной зонах, распределен по всей толщине мембраны. При этом маркер, связанный на глубине более ~10 мкм от поверхности (Rapid Lateral Flow Test Strips Considerations for Product Development. Bedford, MA: Millipore Corporation, 2001), становится невидимым, так как он закрыт вышерасположенными волокнами непрозрачной нитроцеллюлозной мембраны. Для материалов, используемых в иммунохроматографии, доля регистрируемого связывания маркера оценивается как 20% и менее (см. рис. 1).
Решением данной проблемы может быть использование иных маркеров, детектируемых неоптическими методами, например магнитных частиц (Shi, L., Wang, X.С, Liu, Y., Lu, Y., Rapid detection of shellfish major allergen tropomyosin using superparamagnetic nanoparticle-based lateral flow immunoassay. Advanced Materials Research 2011, Vol.311, pp. 36-445). Поскольку для регистрации магнитных свойств материал мембраны не является преградой, становится возможным детекция всей связанной метки. Однако этот метод требует специального регистрирующего оборудования, что сужает возможности его применения, особенно для внелабораторной диагностики.
Второй вариант - использование более тонких и крупнопористых мембран. При этом препятствия для визуализации действительно уменьшаются. Однако параллельно снижается объем впитываемой пробы и количество связывающих реагентов в аналитической зоне тест-полоски, что негативно сказывается на чувствительности анализа.
Нами предложен альтернативный вариант детекции маркера в иммунохроматографическом анализе, сохраняющий простоту оптической (в т.ч. визуальной) регистрации и позволяющий детектировать все связанные частицы маркера, а не только часть из них. Предлагаемая методика основана на растворении нитроцеллюлозной мембраны органическим растворителем непосредственно на поверхности подложки. Под действием растворителя (например, ацетонитрила) нитроцеллюлозная мембрана теряет пористую структуру, превращается в вязкий прозрачный гель, который сохраняет прозрачность после высыхания, а окрашенные частицы маркера не разрушаются и не вымываются с поверхности. Таким образом, вся часть тест-полоски, на которую была нанесена рабочая мембрана, становится прозрачной, и детектироваться могут все частицы связанного окрашенного маркера, независимо от глубины их расположения в исходной рабочей мембране.
Ближайший аналог предлагаемой разработки описан в публикации Vachereau, А. (1989). Transparency of nitrocellulose membranes with triton X-114. Electrophoresis, 10(7), 524-527 и заключается в заполнении пор мембраны соединением, повышающим ее прозрачность. Автор статьи описывает применение при проведении электрофореза и Western-блоттинга детергента Тритон Х-114. Однако в данном случае на мембрану наносится не высыхающий реагент, не изменяющий структуру мембраны, а лишь сближающий оптические характеристики волокон и пор. Кроме того, предложенная разработка не применялась в иммунохроматографии - ни в статье Vachereau, ни в более поздних публикациях.
Рассмотрим предлагаемую тест-систему и процедуру проведения анализа. В состав тест-полоски входят прозрачная пластиковая подложка (или прозрачная пленка), на которой зафиксирована рабочая мембрана, мембрана для конъюгата антитело-маркер (например, коллоидное золото), мембрана для анализируемой пробы и впитывающая мембрана. На рабочей мембране имеются две полосы с иммунореагентами - аналитическая и контрольная зоны. При проведении анализа тест-полоска контактирует с пробой. В результате последующего движения жидкости вдоль мембран и иммунохимических взаимодействий (как и в традиционной иммунохроматографии) в аналитической и контрольной зонах происходит связывание маркера, причем его количество в аналитической зоне отражает концентрацию определяемого соединения в пробе. После того как движение жидкости вдоль тест-полоски завершилось, на поверхность рабочей мембраны наносится несколько капель растворителя и выдерживается до высыхания, за время которого происходит растворение пористой структуры мембраны. Детекция результатов может проводиться при помощи фотометрического прибора (как специализированного, так и обычного офисного сканера со слайд-модулем) или визуально на просвет (оптимально - с использованием подсвечивающего матового столика).
Данное методическое решение обладает существенными преимуществами по сравнению с аналогами - известными разработками иммунохроматографических тестов, в которых связанный маркер также детектируется из всего объема аналитической зоны тест-полоски. Так, использование в качестве метки магнитных наночастиц и детекция их магнитных свойств описаны в ряде статей и технологизированных разработок, одним из примеров которых является работа Wang, Y., et al., Study of superparamagnetic nanoparticles as labels in the quantitative lateral flow immunoassay. Materials Science and Engineering, 2009. 29(3): p.714-718. Авторы предложили тест-полоску для количественной детекции хорионического гонадотропина. Тест-система позволяет проводить анализ за 20 мин, регистрируя связанную метку с помощью детектора магнитных частиц.
Принципиальный недостаток таких систем - невозможность бесприборной детекции результатов анализа. Для регистрации маркера необходимы специализированные приборы, способные выявлять магнитные частицы на очень небольших участках и тем самым корректно оценивать связывание маркера именно в аналитической зоне.
Реализуемость и практическая эффективность предложенного в патенте подхода подтверждается представленным ниже примером.
Пример 1. Иммунохроматографическое определение хлорамфеникола.
При изготовлении тест-полоски на прозрачной подложке (полипропиленовой пленке с клеевой основой производства 3М) фиксировали рабочую нитроцеллюлозную мембрану Millipore HF 120. При формировании аналитической зоны на рабочую мембрану наносили конъюгат хлорамфеникола с бычьим сывороточным альбумином из концентрации 0,25, 0,5 и 1 мг/мл и объема 0,1 мкл на 1 мм полосы. На мембрану для конъюгата наносили раствор коллоидного золота с иммобилизованными специфическими антителами (OD520=2) при расходе реагента 3,2 мкл/мм. Для нанесения реагентов использовали диспенсер «IsoFlow» фирмы «Imagene Technology» (США). С нижней части тест-полоски прикрепляли мембрану для анализируемой пробы, а с верхней - впитывающую мембрану. Полученные листы нарезали на индивидуальные тест-полоски шириной 3,5 мм.
При проведении анализа нижний край тест-полоски окунали в тестируемую пробу (раствор антибиотиков различной концентрации в фосфатном буфере). Через 10 мин тест-полоску помещали на горизонтальную поверхность, завершалось движение фронта жидкости вдоль тест-полоски, а последующая 15-минутная инкубация приводила к полному испарению жидкости. На поверхность рабочей мембраны наносили 200 мкл ацетонитрила (осч) и инкубировали 10 мин до полного высыхания. Для сравнения использовали такие же тест-полоски, не обрабатывавшиеся ацетонитрилом.
Результаты иммунохроматографического анализа представлены на рис. 2.
Окрашивание аналитической зоны детектировали визуально, а его интенсивность регистрировали с помощью сканера 9000А MarkII (Canon) с разрешением 1200 dpi, без автоматического контрастирования и цветокоррекции. На полученных цифровых изображениях выделяли прямоугольную область, захватывающую не менее чем 90% окрашенной зоны, и с помощью программы Total Lab (Nonlinear Dynamics, Великобритания) получали значение интенсивности окрашивания аналитической зоны.
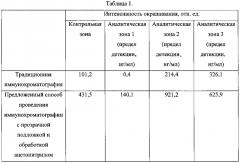
Количественные данные об уровнях специфического окрашивания тест-полосок после анализа представлены в таблице 1. Как видно из результатов, амплитуда сигнала при использовании нового подхода значительно превосходит традиционные решения, особенно в случае малых амплитуд сигналов, что может быть связано с экранированием избытка частиц маркера друг другом при больших его концентрациях в соответствующих зонах. Аналогичные эффекты были получены при иммунохроматографическом определении микотоксина фумонизина. Полученные результаты подтверждают улучшение аналитических характеристик тест-системы в результате предложенной обработки.
Краткое описание чертежей
На рис. 1 представлена схема иммунохроматографической тест-полоски с указанием слоя мембраны, в котором возможна детекция маркера., где 1 - рабочая мембрана, 2 - мембрана для конъюгата, 3 - мембрана для анализируемой пробы, 4 - впитывающая мембрана, 5 - подложка.
На рис. 2 представлен внешний вид одной и той же тест-полоски до (А) и после (Б) растворения рабочей мембраны, цифрами отмечены контрольная (1) и аналитические (2-4) зоны.
В Таблице 1 представлены данные об интенсивности связывания маркера в контрольной и аналитических зонах данных иммунохроматографической тест-полоски до и после ее обработки ацетонитрилом.
Способ проведения иммунохроматографического анализа и детектирования его результатов на основании интенсивности окрашивания в аналитической зоне тест-полоски, отличающийся тем, что рабочая мембрана предварительно иммобилизуется на прозрачной пластиковой подложке, после проведения анализа растворяется органическим растворителем, а маркер в аналитической зоне детектируется на просвет.