Способ получения 2,3,16,17,18,19-гексагидроолигомицина а и его применение для ингибирования роста дрожжей рода candida
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и касается нового производного макролидного антибиотика олигомицина А - 2,3,16,17,18,19-гексагидроолигомицина А, его структуры и способа его получения, а также применения для лечения заболеваний, вызванных дрожжевыми грибками рода Candida, поскольку это соединение обладает селективной активностью в отношении ряда штаммов Candida spp., а также низкой (по сравнению с исходным олигомицином А) цитотоксичностью и соответствует формуле. 3 н. и 2 з.п. ф-лы, 2 табл., 2 пр.
Реферат
Область техники
Изобретение относится к фармацевтической промышленности и касается способа получения нового полусинтетического производного макролидного антибиотика олигомицина А и его медицинского применения для ингибирования роста дрожжеподобных грибков рода Candida.
Уровень техники
Олигомицины относятся к классу макролидных антибиотиков, структура которых представляет собой 26-членный α,β-ненасыщенный лактон, сочлененный с бициклической спирокетальной структурой. Важнейшими представителями этой группы являются олигомицин А (1), олигомицин В (2), олигомицин С (3) [Carter G.T. J.Org.Chem., 1986, 51, 4264].
Общеизвестно, что механизм действия олигомицинов связан с ингибированием работы F0F1-АТФ-синтазы в клетках про- и эукариот. В субмикромолярных концентрациях олигомицин связывается с F0 субъединицей, блокируя работу OSCP (the oligomycin sensitivity conferring protein), что нарушает синтез АТФ [Jonckeere A.L. et al. J. Inherit. Metab. Dis., 2012, 35, 211]. Благодаря подавлению процессов окислительного фосфорилирования и нарушению энергетического обмена, олигомицины проявляют антифунтальную, антимикотическую и антипролиферативную активности, однако грамположительные и грамотрицательные бактерии устойчивы к их действию [Бибикова М.В. и др. Антибиотики и химиотерапия, 2003, 48, 33]. Основным недостатком антибиотиков этого ряда, ограничивающим их применение в клинической практике, является высокая токсичность в отношении клеток млекопитающих.
Химическая модификация природных антибиотиков является одним из основных способов получения полусинтетических производных с улучшенными фармакологическими свойствами. Однако, получение полусинтетических олигомицинов затруднено слабой изученностью химических свойств этого класса антибиотиков, сложностью их структуры и высокой лабильностью олигомицина в щелочной среде [Lysenkova L.N. et al. J. Antibiot., 2014, 67, 153]. Ранее описаны способы химической трансформации олигомицина А как по боковой цепи (33 положение) [Lysenkova L.N. et al., Bioorg. Med. Chem., 2013, 21, 2918; Lysenkova L.N. et al. Macroheterocycles, 2015, 8, 424], так и по макролактонному кольцу [Lysenkova L.N. et al. J. Antibiot., 2010, 63, 17; Lysenkova L.N. et al. J. Antibiot., 2012, 65, 223]. Установлено, что изменение структуры макролактона значительно снижает активность антибиотика.
В литературе имеются сведения о попытках восстановления олигомицинов. Так, показано, что при действии боргидрида натрия у олигомицина А восстанавливаются кето-группы в положениях 7 и 11 до соответствующих гидроксильных групп без изменения макролактонного цикла (формула 4) [Rfmires F. et al. Eur. J. Biochem., 1982, 121, 275]. Восстановленное соединение 4 так же, как и исходный антибиотик 1, ингибирует АДФ-зависимое дыхание и транспорт протонов, но не влияет на другие связанные с дыханием активности в интактных митохондриях печени крыс. Недавно было описано микробиологическое восстановление олигомицина А до 2,3-дигидроолигомицина А (5) и показано, что восстановление двойной связи в положениях 2, 3 макроцикла приводит к небольшому повышению активности в отношении дрожжей S. cerevisiae, поэтому 2,3-дигидроолигомицин А запатентован в качестве противогрибкового средства [Patent KR 2012016713, 2012].
Раскрытие изобретения
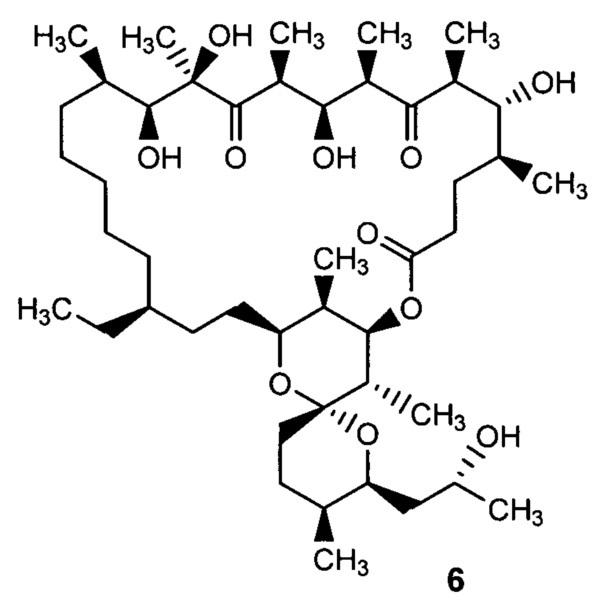
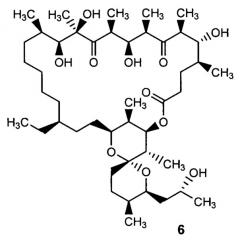
Авторами настоящего изобретения неожиданно было установлено, что при каталитическом гидрировании олигомицина А (1) образуется производное - 2,3,16,17,18,19-гексагидроолигомицин (6), обладающее селективной активностью в отношении дрожжеподобных грибков рода Candida, и менее токсичное для клеток млекопитающих, чем исходный антибиотик.
Реакцию, приведенную в описании заявки, проводят без нагревания, предпочтительно при 20-25°C, при давлении не более 14 psi, предпочтительный диапазон давления 3-6 psi.
Способ получения, заявленный в изобретении 2,3,16,17,18,19-гексагидроолигомицина (6), основан на гидрировании олигомицина А (1) на гетерогенном металлическом катализаторе. В предпочтительном варианте гидрирование проводят на Pd-содержащем катализаторе, более предпочтительно на палладии, нанесенном на активированный уголь (Pd/C). Гидрирование проводят в подходящем инертном органическом растворителе, предпочтительно в протонном растворителе, например метаноле или этаноле или смеси растворителей (схема 1).
Схема 1
Биологические исследования заявленного в изобретении полусинтетического антибиотика 6 выявили, что гидрирование двойных связей макроцикла неожиданно приводит к повышению селективности антибиотика в ингибировании ряда штаммов Candida spp. Поэтому настоящее изобретение относится к применению соединения 6 для ингибирования дрожжеподобных грибков Candida spp, являющихся возбудителями ряда грибковых заболеваний человека
Исходный антибиотик 1, катализаторы и растворители являются коммерческими химическими соединениями, поставляемыми фирмами, такими как Aldrich Chemical Co.
Если не указано иное, термины, используемые в описании заявки и в пунктах формулы изобретения, имеют значения, указанные ниже.
«Гетерогенный металлический катализатор» означает катализатор, образующий самостоятельную твердую фазу, отделенную границей раздела фаз от жидкой фазы реагирующих веществ. Катализатор представляет собой металл губчатой структуры, например палладий, платина, никель, или металл, например палладий, платина, никель, нанесенный на инертный носитель, например активированный уголь, сульфат бария, оксид алюминия.
«Инертный органический растворитель» означает растворитель, инертный в условиях описываемой в тексте реакции, например бензол, толуол, тетрагидрофуран, метанол, этанол, пропанол, изопропанол, трет-бутанол.
«Протонный растворитель» означает растворитель, способный при диссоциации образовывать ион водорода Н+, например метанол, этанол, пропанол, уксусная кислота, вода.
Примеры, описывающие получение и идентификацию 2,3,16,17,18,19-гексагидроолигомицина (6), являющегося предметом настоящего изобретения, а также его физико-химические свойства, антифунгальную активности и цитотоксичность для клеток млекопитающих, приведены ниже.
Пример 1
2,3,16,17,18,19-гексагидроолигомицин А (6)
К раствору 60.0 мг (0.075 ммоль) олигомицина А (1) в 4.0 мл метанола добавляют 48.0 мг (0.0225 ммоль) 5% Pd/C, предварительно суспензированного в смеси 0.5 мл МеОН и 0.05 мл H2Oдист., и гидрируют под давлением 0.4 атм при комнатной температуре 1 ч. Реакционную смесь фильтруют, промывают катализатор метанолом и концентрируют в вакууме. Остаток очищают колоночной хроматографией (гексан : ацетон 10:3→10:4, хлороформ : метанол 10:0.2→10:0.3). Выход 42.0 мг (69%). Аморфный порошок белого цвета. Т. пл. 83°C.
Найдено: m/z ESI 797.5593 (100%) [М+Н]+. C45H80O11.
Вычислено 796.5701. ИК (пленка) νmax см-1: 3416 с, 2971 ср, 2928 ср, 2857 ср, 1731 сл, 1698 с, 1458 с, 1382 ср, 1340 сл, 1264 сл, 1222 сл, 1191 сл, 1169 сл, 1135 сл, 1089 ср, 1048 ср, 982 с, 882 ср, 844 сл, 802 сл. УФ (метанол) λmax (lgε) нм: 207 (3.7), 268 (2.8). [α]20D (с 0.1, метанол) -80°. ВЭЖХ: Rt=23.2 (А-H2O, B-MeCN; конц. В - 80%→95% 10 мин, 95% - 30 мин) чистота 95.2%. Спектр ЯМР 1Н (600 МГц, CD3OD) δ, м. д., J (Гц): 4.99 (1Н, дкв, J1=11.8, J2=4.5); 4.16 (1H, дд, J1=7.4, J2=4.0); 4.03 (1Н, дт, J1=10.1, J2=2.8); 3.93 (1H, ддкв, J1=9.3, J2=3.7 J3=6.2); 3.90 (1Н, д, J=2.0); 3.85 (1H, ддд, J1=5.9, J2=0.9 J3=2.0); 3.65 (1H, ткв, J1=6.3, J2=4.7); 3.51 (1Н, дкв, J1=7.1, J2=6.9); 3.02 (1Н, дкв, J1=6.9, J2=6.7); 2.71 (1H, дкв, J1=4.0, J2=7.1); 2.46 (1H, ддд, J1=15.7, J2=6.6, J3=0.8); 2.37 (1H, ддд, J1=15.7, J2=6.6, J3=0.8); 2.16 (1Н, м); 2.11 (1Н, ддкв, J1=2.0, J2=0.9 J3=7.2); 1.93 (1Н, м); 1.78-1.77 (3H, м); 1.56-1.23 (24Н, м); 1.21 (3H, с); 1.19 (3H, д, J=6.2); 1.14 (3H, д, J=7.1); 1.14 (3H, д, J=6.9); 1.13 (3H, д, J=6.9); 0.97 (3H, д, J=6.9); 0.94 (3H, д, J=6.6); 0.94 (3H, д, J=6.9); 0.93 (3H, д, J=6.9); 0.91 (3H, д, J=7.2); 0.89 (3H, т, J=7.1). Спектр ЯМР 13С (150 МГц, CD3OD) δ, м.д.: 221.5 (С=O); 218.4 (С=O); 175.1 (O=СО); 100.6 (ОСО); 84.5 (С-О); 77.7 (СН); 75.9 (СН); 75.8 (СН); 72.9 (СН); 70.6 (СН); 68.8 (СН); 65.4 (СН); 49.9 (СН); 48.3 (СН); 44.1 (СН); 43.7 (СН2); 40.0 (СН); 39.3 (СН); 36.7 (СН); 36.5 (СН); 36.2 (СН2); 34.8 (СН); 33.1 (СН2); 32.6 (СН2); 31.8 (СН); 30.5 (СН2); 30.1 (СН2); 29.2 (СН2); 28.9 (СН2); 27.8 (СН2); 27.5 (СН2); 27.6 (СН2); 27.1 (СН2); 27.0 (СН2); 25.1 (СН3); 22.4 (СН3); 14.8 (СН3); 14.4 (СН3); 14.2 (СН3); 13.3 (СН3); 12.3 (СН3); 12.1 (СН3); 11.9 (СН3); 11.0 (СН3); 6.4 (СН3).
Примеры, подтверждающие наличие биологической активности
Пример 2
Антифунгальная активность в отношении Candida spp. и филаментозных грибов.
Сравнительное исследование антифунгальной активности олигомицина 1 и его пергидропроизводного 6 выполнено на контрольных штаммах дрожжевых культур Candida albicans АТСС 24433, Candida parapsilosis АТСС 22019, филаментозных грибов Aspergillus niger 137а, дерматофитов Microsporum canis В-200, Trichophyton rubrum 2002 и клинических изолятов Candida spp (табл. 1). При выборе штаммов учитывали чувствительность Candida spp. к противогрибковым препаратам. Так, С krusei обладает природной устойчивостью к флуконазолу, применяемого для системного и местного лечения грибковых инфекций. Большинство клинических изолятов С. albicans чувствительны к флуконазолу, С tropicalis занимает промежуточное положение, а 15% изолятов С. glabrata устойчивы к флуконазолу.
Оценку активности исследуемых образцов проводили в соответствии со стандартом [ГОСТ Р ИСО 16256-2015] и рекомендациями [Clinical and Laboratory Standards Institute. 2008. Reference method for broth dilution antifungal susceptibility testing of yeasts; approved standart, 3rd ed., M27-A3; Clinical and Laboratory Standards Institute. 2008. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi; approved standart, 2rd ed., М38-А2]. Для определения значения минимальной ингибирующей концентрации (МИК) использовали микрометод серийных разведений в среде RPMI 1640 с добавлением глюкозы до концентрации 0,2% (с глутамином и не содержащей карбонат, производства ПанЭко).
Для получения основных растворов тестируемых антибиотиков 1 и 6 с концентрацией 10000 мкг/мл навески растворяли в диметилсульфоксиде (ДМСО). Для получения рабочих растворов с концентрацией 64 мкг/мл основные растворы в количестве 0,064 мл переносили в 9,93 мл питательного бульона RPMI 1640 с глюкозой 0,2%, конечная концентрация ДМСО не превышала 0,3%.
Посевную суспензию Candida spp приготавливали в среде RPMI с 0,2% глюкозой по стандарту мутности 0,5 McFarland (~5×106 КОЕ/мл для дрожжевых культур), оценивали денситометрически (Densimat, Biomerieux), разводили 1:1000 до ~5×103 КОЕ/мл в среде RPMI с 0,2% глюкозой. Для каждого тест-штамма филаментозных грибов инокулят получали растиранием части колонии в физиологическом растворе в пробирке со стеклянными бусами. Сбор конидий и спор производили пипеткой через марлевый фильтр. Подсчет конидий и спор осуществляли с использованием камеры Горяева. Каждый инокулят доводили до рабочего титра в среде RPMI. В результате получали суспензию, содержащую 1,5-3,2×104 КОЕ/мл. Для контроля титра жизнеспособных колониеобразующих единиц (КОЕ), 10 мкл инокулята переносили на агаризованную питательную среду Сабуро.
В работе использовали 96 луночные планшеты для иммунологических исследований (Медполимер, С-Петербург). В лунки планшета вносили 100 мкл суспензии дрожжевых культур в питательной среде и растворы тестируемых соединений в диапазоне концентраций 32-0,25 мкг/мл. Каждый образец анализировали в трех повторениях.
Для соблюдения точности процедуры определения значений минимальной ингибирующей концентрации (МИК) в качестве внутреннего стандарта использовали флуконазол (Синерджин Эктив Инградиентс (Пи) ЛТД), диапазон активности которого в отношении эталонного штамма Candida parapsilosis АТСС 22019 составляет 1-4 мкг/мл [ГОСТ Р ИСО 16256-2015]. Для контроля роста все тест-культуры засевали в питательную среду без образцов.
Оценку чувствительности проводили визуально, после инкубации при 35°C в течение 24 и 48 часов для Candida spp и 48-96 часа для A. niger, М. canis В, Т. rubrum, сравнивая с плотностью роста в контроле без препарата. За МИК принимали наименьшую концентрацию образца, при которой видимый рост подавлен не менее чем на 80% в сравнении с контролем роста.
Как видно из представленных выше данных, активность пергидропроизводного 6, являющегося предметом настоящего изобретения, в отношении штаммов Candida spp.сохраняется на уровне исходного антибиотика 1, а в отношении A. niger и других микромицетов наблюдается снижение активности. Стоит отметить, что пергидроолигомицин 6, как и исходный антибиотик 1, проявляет активность в отношении резистентного штамма С. krusei, устойчивого к действию флуконазола.
Пример 3
Антипролиферативная активность в отношении линии клеток человека
Сравнительное исследование цитотоксичности для клеток млекопитающих олигомицина 1 и его производного 6 было проведено на клетках лейкемии человека К-562 с использованием МТТ-теста [Shchekotikhin А.Е. et al. Eur. J. Med. Chem., 2011, 46, 213].
Сравнение ингибирующих концентраций (IC50) олигомицина А (1) и его производного (6) показывает, что восстановление двойных связей приводит к снижению цитотоксичности в 8.5 раз (табл. 2).
Как видно из представленных данных, новый полусинтетический антибиотик 6, являющийся предметом данного изобретения, обладает специфической активностью в отношении штаммов дрожжевых грибов рода Candida, которая в отдельных случаях превосходит препарат сравнения флуконазол. Проведенная модификация макроцикла, заявленная в настоящем изобретении, не только повышает избирательность действия на Candida spp., но и вызывает снижение высокой цитотоксичности для клеток млекопитающих, характерной для олигомицина А.
1. Производное олигомицина А - 2,3,16,17,18,19-гексагидроолигомицин А, соответствующий формуле
2. Способ получения 2,3,16,17,18,19-гексагидроолигомицина А по п. 1, заключающийся в каталитическом гидрировании олигомицина А в инертном растворителе на гетерогенном катализаторе, содержащем металл, выбранный из платины, палладия или никеля.
3. Способ по п. 2, отличающийся тем, что в качестве катализатора гидрирования используется палладий, нанесенный на активированный уголь.
4. Способ по п. 2, отличающийся тем, что в качестве растворителя используется метанол.
5. Применение 2,3,16,17,18,19-гексагидроолигомицина А по п. 1 для лечения заболеваний, вызванных дрожжевыми грибками рода Candida.