Использование корня шалфея многокорневищного (radix salviae miltiorrhizae) (дань шэнь) или препаратов из него в приготовлении лекарственных средств для лечения заболеваний, связанных с фиброзом печени
Иллюстрации
Показать всеНастоящее изобретение относится к фармацевтической промышленности, а именно к препарату для лечения заболеваний, связанных с фиброзом печени. Лекарственный препарат, предназначенный для лечения болезней, связанных с фиброзом печени, который содержит водный экстракт корня шалфея многокорневищного (Radix Salviae Miltiorrhizae), полученный путем заливки водой в 7 раз больше веса корня шалфея, отваривания полученной смеси 2 раза по 2 часа, после комбинации отваров раствор фильтруют и концентрируют, супернатант экстракта центрифугируют и пропускают через макропористую смолу, затем смолу промывают водой, элюируют этанолом и полученный раствор концентрируют для получения экстракта корня шалфея многокорневищного (Radix Salviae Miltiorrhizae). Вышеописанное средство эффективно для лечения болезней, связанных с фиброзом печени, ингибирует высокую экспрессию α-RSM. 8 з.п. ф-лы, 3 ил., 5 табл., 5 пр.
Реферат
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области медицины, в частности к применению корня шалфея многокорневищного (Radix Salviae Miltiorrhizae) или препаратов из него при лечении заболеваний, связанных с фиброзом печени.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Фиброз печени рассматривается как неизбежный этап цирроза печени и, следовательно, лекарства от фиброза печени становятся очень важным методом лечения. В наше время эффективное лекарственное средство для борьбы с фиброзом печени - по-прежнему дефицит в клинике. Хотя несколько препаратов, включая цитокины и антиоксиданты, были изучены в клинических исследованиях, их клиническая эффективность была неудовлетворительной. В последнее время традиционная китайская медицина (ТКМ) быстро приобрела широкую известность в борьбе с фиброзом печени, показывая многообещающие перспективы применения.
Корень шалфея многокорневищного (Radix Salviae Miltiorrhizae) (Дань Шэнь) - горький на вкус, слегка холодный, имеет терапевтическую эффективность активации крови путем разгона застоя крови, питания крови, успокаивая «дух», охлаждения крови, удаляя карбункулы и продувки токсинов путем улучшения грануляции. Он расценивался как часто используемое лекарственное средство для активации крови и разгона застоя. Дань Шэнь содержит не только жирорастворимые дитерпеноиды и водорастворимые фенольные кислоты, но и другие компоненты, например, флавоноиды, тритерпены и стерины. Где дитерпеноиды со структурой хинона и кетона содержат таншинон I, таншинон IIA, таншинон IIR, таншинон V, таншинон VI, криптотаншинон, изотаншинон I, изотаншинон II, изотаншинон IIB и дегидротаншинон I и т.д. Водорастворимые фенольные кислоты включают Дань Шэньсу, протокатеховый альдегид, протокатеховую кислоту, кофейную кислоту и ее производные или депсиды загущенные с Дань Шэньсу и кофейной кислотой (например, сальвианоловая кислота A, сальвианоловая кислота B, сальвианоловая кислота C, сальвианоловая кислота D, сальвианоловая кислота E, сальвианоловая кислота G, литоспермовая кислота B, розмариновая кислота и метил розмаринат и т.д.). Вышесказанный таншинон IIA является одним из типичных компонентов дитерпеноидов, которые активируют кровь и разгоняют застои крови. Как подтвердили современные фармакологические исследования, Дань Шэнь имеет функцию расширения коронарной артерии, средства от миокардиальной ишемии, от образования тромбов, функции антикоагуляции, седативного эффекта, уменьшения боли, снижения липидов в крови и борьбы с атеросклерозом.
В настоящем изобретении, модель фиброза печени, индуцированная с коэффициентом наращения по CCl4, была создана и лечилась высокой, средней и низкой дозировкой тестируемых препаратов корня шалфея корневищного (Radix Salviae Miltiorrhizae) (RSM) в течение 7 недель. Биоактивность аланинаминотрансферазы (ALT), аспартатаминотрансферазы (AST), N-ацети1-β-D-глюкозаминидазы (NAG) и содержание общего белка (TP), альбумина (ALB) и коллагена типа IV были измерены в сыворотке крови. Биологическая активность супероксиддисмутазы (SOD), малондиальдегида (MDA), Hyp была измерена в печени. Патоморфологические изменения в печени наблюдалось с помощью окрашивания гематоксилин-эозином и по Массону. Экспрессия α-SMA была измерена с помощью иммуногистохимии. Как показано в результатах препараты RSM имеют эффект ингибирования биологической активности ALT, AST и NGA, понижая содержание коллагена типа IV в сыворотке, увеличивая содержание TP и ALB в сыворотке; уменьшая уровень Hyp и MDA в ткани печени, увеличивая биологическую активность SOD в ткани печени, ограничивая рост коллагеновых волокон в ткани печени, а также снижая экспрессию α-SMA в ткани печени.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение применения RSM или препаратов из него в производстве лекарственных средств для лечения фиброза печени.
Другой задачей настоящего изобретения является обеспечение применения RSM или препаратов из него в производстве лекарственных средств для лечения заболеваний, связанных с фиброзом печени, например, цирроз печени, гепатит или рак печени, и т.д.
Согласно настоящему изобретению указанный препарат RSM может включать свежый RSM лекарственный материал, обработанный RSM лекарственный материал или препарат, изготовленный из лекарственного вещества RSM. Например, RSM измельчают или получают из него экстракт для получения продукта, в котором способ вытяжки включает в себя метод водной вытяжки, метод этиловой вытяжки или методы водной вытяжки и этилового осаждения. Кроме того, шаги переработки, например, очистка смолой, могут быть включены.
Согласно настоящему изобретению указанные препараты RSM включают лекарства, которые сделаны из лекарственного вещества RSM. К настоящему времени вышеуказанные препараты RSM, которые уже в продаже, состоят из таблеток шалфея, капсул шалфея и драже шалфея.
Согласно настоящему изобретению указанные препараты RSM получают способом, включающим следующие стадии: во-первых лекарственные материалы перерабатывают в биологически активные компоненты, которые далее превращают в препараты.
В соответствии с настоящим изобретением, методы приготовления препаратов RSM относятся к уровню техники, который может быть получен из публикации китайского патента или опубликованного стандарта лекарственного средства.
В соответствии с настоящим изобретением указанный препарат RSM предпочтительно выбирают из драже RSM.
В соответствии с настоящим изобретением указанный препарат RSM является фармацевтической композицией, изготовленной из RSM. Указанная композиция содержит 0,1-99.9 wt % фармацевтически приемлемых носителей. Указанную фармацевтическую композицию получают в форме единичной дозы и упомянутая доза относится к индивидуальному препарату, например, каждая таблетка таблеток, каждая капсула капсул, каждая бутылка пероральных растворов, каждая оболочка гранул и каждая инъекция инъекций.
Согласно настоящему изобретению указанные препараты RSM могут быть получены в любой фармацевтически приемлемой лекарственной форме, в том числе таблетки, такие как таблетки с сахарным покрытием, таблетки с пленочным покрытием и таблетки с энтеросолюбильным покрытием, капсулы, такие как твердые и мягкие капсулы, пероральные растворы, буккальные таблетки, пилюли, порошки, таблетки, пасты, такие как мази и клеи, Дэнь, суспензии, растворы, такие как инъекции, суппозитории, крема, спреи, капли, драже и пластыри.
Согласно настоящему изобретению указанная пероральная лекарственная форма может включать обычно используемые наполнители, такие как адгезив, наполнитель, разбавитель, агент таблетирования, смазывающее вещество, дезинтегрирующий агент, краситель, вкусовой агент, смачивающий агент. При необходимости таблетки могут быть покрыты оболочкой.
В соответствии с настоящим изобретением, подходящие агенты заполнения включают целлюлозу, маннит, лактозу и другие аналогичные наполнители. Подходящие дезинтегрирующие агенты включают крахмал, поливинилпирролидон (PVP) и производные крахмала (например, натриевый гидроксиэтиловый крахмал). Подходящие смазывающие вещества включают стеарат магния. В качестве смачивающих агентов, которые являются фармацевтически приемлемыми, включают додецилсульфат натрия.
В соответствии с настоящим изобретением, пероральные твердые препараты указанной композиции могут быть получены с помощью обычно используемых методов, например, смешивание, заполнение и таблетирование. Смешивая неоднократно, можно сделать биоактивные компоненты (API), распределенные равномерно в большом количестве наполнителя.
В соответствии с настоящим изобретением, пероральные жидкие препараты - в дозированной форме, либо водорастворимые или жирорастворимые суспензии, растворы, эмульсии, сиропы или эликсиры, или сухие порошки, которые всегда разводятся в воде или другом подходящем растворителе до клинического применения. Этот жидкий препарат может содержать обычные добавки, такие как: суспендирующий агент, например, сорбит, сироп, метилцеллюлоза, желатин, гидроксиэтилцеллюлоза, гидроксиметилцеллюлоза, гель стеарата алюминия или гидрогенизированные пищевые жиры; эмульгирующие агенты, например, лецитин, сорбитанмоноолеат или аравийская камедь; неводные носители (в том числе пищевые масла), например, миндальное масло, фракционированное кокосовое масло, эфирное масло (такое как глицерид), пропиленгликоль или этиловый спирт; а также консервант, например, метилпарабен, нипазол, сорбиновая кислота. При необходимости, обычные вкусовые агенты или окрашивающие агенты могут быть включены.
Согласно настоящему изобретению указанные инъекции содержат биоактивные компоненты и асептические носители. Упомянутые биологически активные компоненты могут быть растворены или суспендированы в зависимости от типа и концентрации носителей. Как правило, раствор получают путем растворения биологически активного компонента в носителе, стерилизации, помещения в подходящий флакон или ампулу и герметизации. Некоторые вспомогательные вещества, например, местный анестетик, консервант и буферный агент, могут быть растворены в носителе. Для того чтобы улучшить его стабильность, после загрузки в пробирку, эта композиция по настоящему изобретению может быть заморожена и высушена в вакууме, чтобы удалить воду.
В соответствии с настоящим изобретением указанный препарат RSM может быть получены путем необязательного добавления фармацевтически приемлемых носителей. Указанные носители включают, но не ограничиваются ими, вещества, выбранные из: сахарного спирта, например, маннит, сорбит, ксилит; аминокислот, например цистеин гидрохлорид, метионин, глицин; Витамина C; двунатриевой ЭДТК, ЭДТК кальциевой двунатриевой соли; неорганической соли, например одновалентный щелочный карбонат, ацетат, фосфат или его водный раствор, хлорид натрия, хлорид калия, пиросульфит натрия, бисульфит натрия, тиосульфат натрия; карбонат кальция, бикарбонат кальция; стеарата, например стеарат кальция, стеарат магния; неорганических кислот, например гидрохлорид, сульфат, фосфорная кислота; органических кислот, например уксусная кислота, меркаптоуксусна кислота; солей органических кислот, например лактат натрия; олигосахарида, полисахарида, целлюлозы и ее производных, например, мальтоза, глюкоза, фруктоза, декстран, сахароза, лактоза, циклодекстрин (β-циклодекстрин), крахмал; производные кремния; альгината; желатина; PVP; глицерина; Твин-80, агар геля; поверхностно-активного вещества; полиэтиленгликоля (PEG); фосфолипидов; Каолина; талька и т.д.
В соответствии с настоящим изобретением, протокол и дозировка указанного препарата RSM зависит от состояния пациентов в клинике. Например, драже RSM, приготовленные по способу примера 1 назначаются пациенту так: 20 драже, 3 раза в день, 24-32 недель курс лечения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
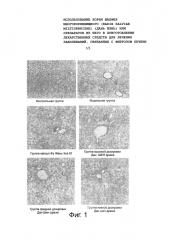
Фиг. 1 иллюстрирует влияние на экспрессию α-SM использования драже RSM при CCl4-индуцированном фиброзе печени у крыс (10×20).
Фиг. 2 иллюстрирует влияние на патологическую морфологию применения драже RSM при CCl4-индуцированном фиброзе печени у крыс (окраска гематоксилин-эозином, 10×10).
Фиг. 3 иллюстрирует влияние на патологическую морфологию применения драже RSM при CCl4-индуцированном фиброзе печени у крыс (окраска по Массону, 10×10).
ПРИМЕРЫ
Следующие примеры предлагаются только с целью иллюстрации и не предназначены для ограничения области изобретения любым путем.
Пример 1 Получение драже RSM
Композиция:
Было использовано 100 г корня шалфея многокорневищного (radix salviae miltiorrhizae) для получения 1000 таблеток.
Метод приготовления:
Крупномолотый корень шалфея многокорневищного (radix salviae miltiorrhizae) поместили в экстракционный резервуар, в который вылили воду в 7 раз больше веса неочищенного лекарственного средства корня шалфея многокорневищного (radix salviae miltiorrhizae) для отваривания 2 раза по 2 часа. После комбинации отваривания, раствор фильтровали и концентрировали до тех пор, пока не получили соотношение объема к весу 1 л: 1 кг для получения экстракта. Супернатант экстракта собирали центрифугированием и пропускали через макропористую смолу. Смолу промывали водой, элюировали этанолом, а растворитель концентрировали для получения экстракта RSM с относительной плотностью 1,31~1,38 (50-60°C) и концентрацией не менее 10 мг Дань Шеньсу в 1 г экстракта. Вышеупомянутый экстракт RSM был добавлен с надлежащим количеством PEG, хорошо перемешан, расплавлен на водяной бане и перенесен в бак капельной машины. Температура поддерживалась на уровне 75~85°C. Подходящая капельница выбиралась с учетом веса таблетки. Вышесказанный экстракт RSM капали в ледяной охлажденный жидкий парафин со скоростью 60-80 таблеток в минуту. После формирования, таблетки вынимали и очищали промокательной бумагой, чтобы удалить поверхностный жидкий парафин. Был получен продукт.
Пример 2 Получение таблеток RSM
Композиция:
RSM экстракт 262 г, крахмал 40 г, светло-оксид магния 60 г, стеарат магния 7 г, тальк 80 г для изготовления 1000 таблеток
Метод приготовления:
Крупномолотый корень шалфея многокорневищного (radix salviae miltiorrhizae) экстрагировали 95%-ным этанолом 3 раза по два часа. После восстановления этанола, экстракт концентрировали для получения густого экстракта. Полученный остаток препарата был отварен с водой 2 раза по 1 часу и далее профильтрован. Фильтрат концентрировали до надлежащего объема и смешивали с экстрактом вышеуказанной плотности, чтобы получить экстракт RSM.
Вышеупомянутый экстракт RSM нагревали (без открытого пламени) до 60°C - 70°C, расплавляли, перемешивая, добавляли световой оксид магния, тальк (60 г) и крахмал соответственно, хорошо смешивали и размещали на сушильной плите. Полученные материалы сушили при 60°C до влажности не более 3% и измельчали в гранулы (блоки) с помощью сита 14. Наконец, добавляли стеарат магния и тальк (20 г), все хорошо перемешивали для гранулирования с ситом 12, таблетировали, проверяли и покрывали сахаром.
Пример 3 Получение капсул RSM
Композиция:
Экстракт RSM 406 г, крахмал 40 г и 10% крахмальная суспензия для изготовления 1000 капсул
Метод приготовления:
Крупномолотый корень шалфея многокорневищного (radix salviae miltiorrhizae) экстрагировали 95%-ным этанолом 3 раза по два часа. После восстановления этанола, экстракт концентрировали для получения густого экстракта. Полученный остаток препарата был отварен с водой 2 раза по 1 часу и далее профильтрован. Фильтрат концентрировали до надлежащего объема и смешивали с экстрактом вышеуказанной плотности, чтобы получить экстракт RSM.
Вышеупомянутый экстракт RSM измельчали и пропускали через 80 сито, добавляли 10% крахмальную суспензию, чтобы сделать мягкий материал для гранулирования с помощью 14 нейлонового сита. Полученные гранулы сушили при 70°C с содержанием влаги не более чем 3%. Эти гранулы смешивали и загружали в # 1 оболочку капсулы для получения продукта.
Пример 4 Получение гранул RSM
Композиция:
RSM 100 г для изготовления 1000 гранул
Метод приготовления:
Крупномолотый корень шалфея многокорневищного (radix salviae miltiorrhizae) помещали в экстракционный резервуар с водой в 7 раз больше веса неочищенного препарата корня шалфея многокорневищного (radix salviae miltiorrhizae) для отваривания 2 раза по 2 часа. После комбинации отвара, раствор фильтровали и концентрировали до тех пор, пока не получили соотношение объема к весу 1 л : 1 кг для получения экстракта. Супернатант экстракта собирали центрифугированием и пропускали через макропористую смолу. Смолу промывали водой, элюировали этанолом и растворитель концентрировали для получения экстракта RSM с относительной плотностью 1,31~1,38 (50-60°C) и концентрацией Дань Шеньсу не менее 10 мг в 1 г экстракта. В вышеупомянутый экстракт RSM добавляли 5 раз сахарную пудру, хорошо смешивали, добавляли 7 0% этанола, чтобы сделать мягкий материал. Вышесказанный мягкий материал гранулировали с помощью нейлонового сита 14. Полученные влажные гранулы высушивали при 60°C. Высушенные гранулы просеивали сначала через сито 14 меш и сито №4 (65 меш), чтобы избавиться от мелкого порошка, загружали отдельно, запечатывали для получения продукта.
Пробный пример 5: Изучение эффективности препаратов RSM
Активация HSC (звездчатых клеток) и смещение внеклеточного матрикса (ECM), как полагают, являются решающими событиями в фиброзе печени. Всегда активированнные HSC являются пролиферированными, и преобразуются в миофибробласты, чтобы генерировать большое количество ECM. CCl4-индуцированный фиброз печени был использован в данном эксперименте, так как его механизм состоит в том, что он может непосредственно гидролизовать мембрану клетки печени, что приводит к дегенеративному некрозу клеток печени. Токсичность CCl4 в основном связана с активным метаболитом. CCl4 метаболизируется в активные радикалы без хлороформа и хлоридные радикалы с помощью оксидазы смешанной функции в клетках печени. Эти свободные радикалы могут сделать фермент функции потери клеток печени, мембрана перекисного окисления липидов и увеличения концентрации кальция, что приводит к некрозу клеток печени и фиброзу. Эта модель фиброза, однако, имеет тенденцию к самостоятельному излечению. Таким образом, исследование проводилось в порядке профилактического введения. Активность ALT и AST - это чувствительные биомаркеры для повреждений клеток печени. Снижение TP и ALB находится в пропорции с повреждением синтетической функции в клетках печени.
Одним из ключевых факторов фиброза печени является ECM смещение. Коллаген является основным компонентом внеклеточного матрикса, а Hyp является основной составляющей коллагена. Hyp клетки печени, изменяющейся с уменьшением/увеличением коллагена в ходе фиброза, определяется как важный маркер для оценки содержания коллагена и степени фиброза печени. NAG, протеолитический фермент лизосом, принимает участие в гидролизном метаболизме матрицы соединительной ткани. Его деятельность в сыворотке, как полагают, коррелирует с фиброзом печени, открывая разложение соединительной-ткани-коллагена. Аналогично, изменение содержания коллагена типа IV в сыворотке - крайне практичный маркер для определения степени фиброза печени.
В нормальных условиях, HSC остается в стационарном состоянии. В условиях патологии HSC активируется и выражает α-SMA (α-актин гладких мышц). SMA, которое выражается HSC, рассматривается как одна из значимых характеристик. Иммуногистохимическая техника и программное обеспечение для анализа изображений были использованы для анализа α-SMA, чтобы показать влияние лекарственных средств.
На основе вышеуказанных факторов, фармакологический эксперимент для подготовки RSM был разработан следующим образом:
1. Материал
1.1 Животные
Самцы крыс Вистар, весом 140-160 г, были приобретены у Tianjin Shanchuanhong Animal Co., Ltd. (номер сертификата: SCXK (JIN) 2009-0001).
1.2 Реагенты
ALT, AST, TP и ALB комплекты были получены у BioSino Biotechnology and Science Inc. SOD, MDA, Hyp и NGA комплекты были приобретены у Биохимического института Nanjing Jiancheng. Комплект коллагена типа IV был приобретен у Adlitteram diagnostic laboratories Inc. α-SMA мышиные моноклональные антитела были получены из комплекта моноклональных антител abcam Inc., комплект окрашивания DAB был приобретены у Beijing Zhongshanjinqiao Inc. CCl4 был приобретен у завода по производству реагентов Tianjin Tianhe. Капсула Fuzhenghuayu (FZHY) (№ партии: 100403) была приобретена у фармацевтической компании Shanghai Huanghai и разведена с дистиллированной водой для приготовления суспензии перед использованием. Драже RSM (№ партии: 100101) были произведены Tianjin Tasly Pharmaceutical Co., Ltd в соответствии с методом примера 1.
1.3 Аппарат
Низкоскоростная многотрубная центрифуга LXJ-IIB для больших емкостей была приобретена у Shanghai Anting Apparatus Inc. Инструмент маркирования ферментов SUNRISE был изготовлен SUNRISE, Австрия. Электронные весы PL 203 были изготовлены METTLER TOLEDO (Шанхай) Inc. Автохимический анализатор Hitachi 7080 был произведен Hitachi Inc., Япония. Обычный микроскоп Olympus BH-2 был приобретен у Olympus Inc., Япония.
2. Метод
2.1 Создание модели
Кроме контрольной группы, крысам в других группах вводили подкожно (п/к) чистый CCl4 5 мл/кг первый раз, а затем 40% п/к чистого CCl4-оливкового масла 3 мл/кг каждые 3 дня в течение 7 недель. Первые 2 недели крыс кормили диетой из 20% парафинового масла и 0,5% холестерина и простой кукурузно-мясной диетой с 3-й по 6-ю недели.
2.2 Разделение по группам и введение препарата
90 здоровых самцов крыс, весом 140 г ~ 160 г, были случайным образом разделены на 6 групп: контрольная группа (n=10), модельная группа (n=16), группа FZHY (1500 мг/кг, n=16), группы с высокой дозировкой драже RSM (700 мг/кг), средней дозировкой (350 мг/кг) и низкой (175 мг/кг) (n=16). Крысам вводили соответствующие препараты в день создания модели и с дистиллированной водой (10 мЛ/кг) контрольной и модельной группам в течение 7 недель. Через 1 час после последнего введения крыс анестезировали путем внутримышечной инъекции натрия пентобарбитала для сбора крови из брюшной аорты. Сыворотку собирали с помощью центрифуги для последующего использования. Ткани печени в той же позиции вынимались, фиксировали в 12% жидкости формалина для окрашивания гематоксилин-эозином и по Массону. Ткани печени в другой позиции фиксировали в 10% жидкости формалина для иммуногистохимического окрашивания, остальная ткань печени была подготовлена в 10% гомогенат ткани печени с помощью нормального физиологического раствора.
2.3 Измерение биомаркеров
Биомаркеры были измерены, например, активность ALT, AST, содержание TP, ALB, NAG и коллагена типа IV, активность печеночных SOD и содержание MDA и Hyp, экспрессия α-SMA по иммуногистохимическому окрашиванию, окрашиванию гематоксилин-эозином и по Массону. Окрашивание после парафинового среза.
2.4 Экспрессия α-SMA в ткани печени, измеренная иммуногистохимическим методом
Парафиновые срезы были депарафинированы обычным способом, гидратированы и промыты с помощью PBS в течение 15 мин. Внутренняя пероксидаза была закрыта с 3% H2O2, инкубирована при комнатной температуре в течение 10 мин и промыта с помощью PBS в течение 15 мин. Кроме того, они были помещены 0,01 моль/л буферного раствора натрцитрата для восстановления в течение 15 мин на электрической магнитной печи, промыты в течение 15 мин с PBS после самоохлаждения и ненужный раствор был удален. α-SMA моноклональное антитело (1:100) прокапали, инкубировали при 37°C в течение 1 часа и промыли с PBS в течение 15 мин. Полимер Helper прокапали, инкубировали при 37°C в течение 20 мин и промыли с PBS в течение 15 мин. Poly-HRP anti-Mouse IgG моноклональные антитела прокапали, инкубировали при 37°C в течение 2 0 мин и промыли с PBS в течение 15 мин., окрасили DAB, промыли водопроводной водой в течение 10 минут, вновь окрасили гематоксилином, дегидратировали, очистили и запечатали для микроскопического исследования. Окрашивание α-SMA было коричневато-желтым. Образ был проанализирован с помощью программного обеспечения для анализа изображений (Image-ProPlus 6.0) и 5 полей обзора были выбраны случайным образом для записи неотъемлемой оптической плотности (IOD). Чем больше значение IOD, тем сильнее положительные выразительные продукты.
2.5 Гистопатологическое исследование
После окраски гематоксилин-эозином и по Массону, степень фиброза печени исследовали под микроскопом и проанализировали полуколичественно. Нормы классификации фиброза печени присутствовали следующим образом:
"-" представлена нормальная печень, в которой наблюдается крайне мало фиброзной соединительной ткани в области портала, который находится в нормальном состоянии;
"+" представлена пролиферация коллагена в области портала и вокруг центральной вены в доле печени, где наблюдается распространение нескольких фиброзных узелков и облучение в центральной вене и воротной вене без образования фиброзной септы, доли почек без изменений;
"++" представлена пролиферация коллагена, где наблюдается распространение фиброзных узелков и облучение в центральной вене и воротной вене с образованием фиброзной септы, доли почек без изменений;
"+++" представлена массовая пролиферация коллагена, где небольшое количество ложных долей было сформировано с разрушением лобулярной структуры;
"++++" представлена сформированная утолщенная септальная и ложная доля.
2.6 Статистический анализ
Программный пакет SPSS11.5 был использован для анализа данных, а T-тест был использован для анализа разницы между различными группами. Данные выражали в виде . Степень поражения патологических тканей была проанализирована с SPSS11.5 по Npar и по критерию Манна-Уитни и проиллюстрирована в Excel.
3. Результаты
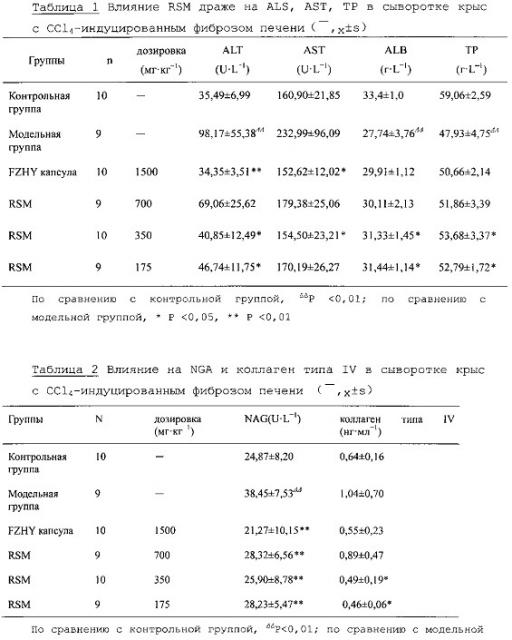
3.1 Влияние на ALS, AST, TP и ALB в сыворотке крыс с фиброзом печени
Как показано в таблице 1, по сравнению с контрольной группой, активность сывороточных ALT и AST была значительно увеличена (P<0,01), а содержание NG и ALB значительно уменьшено (P<0,01). По сравнению с модельной группой, содержание TP и ALB в группах средней и низкой дозировки драже RSM, было значительно увеличено (P<0,05) и активность сывороточных ALT и AST существенно снижена (p<0,05).
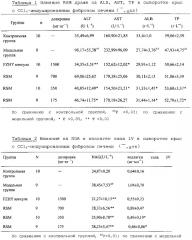
3.2 Влияние на NGA и коллаген типа IV в сыворотке крыс с фиброзом печени
Как показано в таблице 2, по сравнению с контрольной группой, активность сыворотки NGA была значительно увеличена (P<0,01) и коллаген типа IV увеличен. По сравнению с модельной группой, активность сыворотки NGA в группах 3 дозировок драже RSM был значительно сокращена (P<0,01) и содержание коллагена типа IV в группах средней дозировки и низкой дозировки RSM драже было снижено (P<0,05).
3.3 Влияние на активность SOD и уровень MDA и Hyp в ткани печени крыс с фиброзом печени
Как показано в таблице 3, по сравнению с контрольной группой, активность SOD в ткани печени модельных крыс была значительно сокращена (P<0,05), а уровень MDA и Hyp был значительно увеличен (P<0,01). По сравнению с модельной группой, активность SOD в группах 3 дозировок драже RSM была значительно увеличена (P<0,05), уровень MDA в RSM группы низкой дозировки драже значительно снизился (P<0,05), а уровень Hyp в группах 3 дозировок RSM драже значительно снизился (p<0,01).
3.4 Влияние на экспрессию α-SMA в ткани печени крыс с фиброзом печени
Как показано на Фиг. 1 и в таблице 4, положительное окрашивание в контрольной группе было обнаружено в стенке сосуда. По сравнению с контрольной группой, положительная экспрессия α-SMA в модельной группе была четко усилена. Положительное окрашивание было широко выражено в фиброзной септе, сосудистой стенке и области пролиферации фиброзной ткани. Там не было никакого выражения в ячейке желчных путей. Распределение α-SMA положительной экспрессии в группе 3 дозировок драже RSM было аналогично модельной группе, но области желтой склеры были несколько снижены. После проверки IOD, по сравнению с контрольной группой, значение IOD в было значительно увеличено (P<0,05). По сравнению с модельной группой, значения IOD в группах средней и низкой дозировки драже RSM были значительно снижены (P<0,05). Как показано в результатах, драже RSM могут сопротивляться усилению экспрессии α-SMA и ингибируют пролиферацию HSC в ткани печени крыс с фиброзом печени.
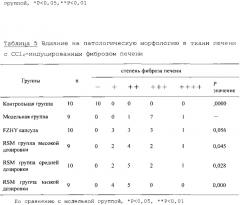
3.5 Влияние на патологическую морфологию в ткани печени крыс с фиброзом печени
Как показано в таблице 5, Фиг. 2 и Фиг. 3, было установлено, что печеночная доля в контрольной группе была цельной, ткани было чистыми, клетки печени морфологически обычно расположены, отцентрованы центральной веной, а пазухи печени были чистыми. Было крайне мало фиброзных тканей в большей области портала, который находится в нормальном состоянии. По сравнению с контрольной группой, печеночные доли крыс модельной группы были повреждены на разных уровнях, печеночные клетки расположены в беспорядке, фиброз тканей распространился на различных уровнях в области портала, центральной вены и воротной вены, что указывает на успешное моделирование. Вышеуказанные болезни были обнаружены у крыс групп, которым вводилось средство, значительно реже, чем в модельной группе. Фиброз крыс оценивался в свете патологического изменения и норм классификации фиброза дома и за рубежом. Тест для оценки достоверности был для сортировки результата. RSM драже 3 дозировок могут значительно улучшить фиброз печени (P<0,05, P<0,01). Как показано в результатах, RSM имеет значительно защитное действие на крыс с фиброзом печени.
Как показано в результатах, драже RSM могут существенно ингибировать повышение ALT и aAST и повысить синтез TP и ALB, особенно для средних и низких дозировок. Показано, что драже RSM имеют эффект защиты клеток печени и препятствуют повреждению печени.
Как показано в результатах, драже RSM могут ингибировать рост Hyp и коллагена типа IV и снижают активность NAG, особенно для средних и низких дозировок. Показано, что драже RSM имеют эффект ингибирующего осаждение коллагена, способствуя деградации коллагена, значительно улучшая степень фиброза печени. Изменение SOD и MDA отображает степень повреждения печени прямо или косвенно. Как показано в результатах, драже RSM могут повысить активность SOD, снижая уровень MDA, особенно для средних и низких дозировок. Указано, что драже RSM имеют эффект снижения свободных радикалов и снижение перекисного окисления липидов.
Как показано в результатах, драже RSM могут ингибировать более высокую экспрессию α-SMA, особенно для средних и низких дозировок. Показано, что драже RSM имеют эффект ингибирования пролиферации HSC. Их механизм анти-фиброза имеет отношение к ингибированию экспрессии α-SMA с помощью HSC. Как показано в результатах гистологического исследования, драже RSM могут значительно улучшить повреждения, вызванные фиброзом печени, особенно низкие дозировки, что указывает на защитный эффект для крыс с фиброзом печени.
ССЫЛКИ
[1] Adrian JE, Poelstra K, Scherphof GL, et al. Effects of a new bioactive lipid-based drug carrier on cultured hepatic stellate cells and liver fibrosis in bile duct-ligated rats [J]. J Pharmacol Exp Ther, 2007, 321(2): 536-543.
[2] Prud home GJ. Pathobiology of transforming growth factor beta in cancer, fibrosis and immunologic disease, and therapeutic consideration [J]. Lab Invest, 2007, 87(11): 1077-1091.
[3] Song M, Song Z, Barve S, et al. Tetrathiomolybdate protects against bile duct ligation-induced cholestatic liver injury and fibrosis [J]. J Pharmacol Exp Ther, 2008, 325(2): 409-416.
[4] Miao XD, Yan J, Ying BZ, et al. Emodin protects rat liver from CCL4-induced fibrogenesis via inhibition of hepatic stellate cells activation [J]. World J Gastroenterol, 2009, 15(38): 4753-4762.
[5] ZOU YH, Yang Y, Li J, Wu Q, et al. Potential therapeutic effects of a traditional Chinese formulation, BJ-JN, on liver fibrosis induced by carbon tetrachloride in rats [J]. J Ethnopharmacol, 2008, 120(3): 452-457.
[6] Yuan LP, Chen FH, Ling L, et al. Protective effects of total flavonoids of Bidens bipinnata L. against carbon tetrachloride-induced liver fibrosis in rats [J]. J Pharm Pharmacol, 2008, 60(10): 1393-1402.
[7] Qin Y, Yan L, Tang L, et al. Effect of tanshinone IIA on collagen expression in liver tissue of hepatic fibrosis ras [J]. Lishizhen Medicine and Materia Medica Research, 2010, 21(4): 782-784.
[8] Chen H, Zhang JH, Liu WQ, Effect of curcumin for anti-schistosomiasis hepatic fibrosis and the experimental study of its mechanism [J]. Chinese Traditional and Herbal Drugs, 2010, 40(8): 1274-1277.
[9] Xu SY, Bian RL, Chen X, Experimental Methodology of Pharmacology [M]. 3rd Edition, Peopleʹs Medical Publishing House, Beijing, 2005.
[10] Cai WM, Zhang BB, Weng HL et al., Comparison study of eight markers of hepatic fibrosis serum [J]. Chinese Journal of Hepatology, 2004, 12(4): 219.
[11] Chen LY, Dynamic effect of ShuGanRuanJian Decoction on NAG of hepatic fibrosis rats [J]. Journal of Shanxi College of Traditional Chinese Medicine, 2003, 4(3): 13-14.
[12] Wang GS, Han ZW, Effect of glycyrrhiza flavonoids on liver damage caused by ethanol [J]. Acta Pharmacologica Sinica, 1993, 9(4): 271-274.
[13] Zhou CY, Ai LY, Wang M, et al., Experimental study of Eucommia polysaccharide for anti hepatic fibrosis [J]. Chinese Traditional and Herbal Drugs, 2011, 42(2): 324-329.
1. Лекарственный препарат, предназначенный для лечения болезней, связанных с фиброзом печени, который содержит водный экстракт корня шалфея многокорневищного (Radix Salviae Miltiorrhizae), полученный путем заливки водой в 7 раз больше веса корня шалфея, отваривания полученной смеси 2 раза по 2 часа, после комбинации отваров раствор фильтруют и концентрируют, супернатант экстракта центрифугируют и пропускают через макропористую смолу, затем смолу промывают водой, элюируют этанолом и полученный раствор концентрируют для получения экстракта корня шалфея многокорневищного (Radix Salviae Miltiorrhizae).
2. Препарат по п. 1, отличающийся тем, что названный лекарственный препарат выполнен в форме таблетки корня шалфея многокорневищного (Radix Salviae Miltiorrhizae), капсулы корня шалфея многокорневищного (Radix Salviae Miltiorrhizae), драже корня шалфея многокорневищного (Radix Salviae Miltiorrhizae).
3. Препарат по любому из пп. 1, 2, отличающийся тем, что указанные заболевания, связанные с фиброзом печени, включают цирроз печени, гепатит, рак печени.
4. Препарат по любому из пп. 1, 2, отличающийся тем, что указанный препарат используют для ингибирования поражения печени, снижения увеличения уровня ALT, AST в сыворотке крови, вызванного повреждением клеток печени.
5. Препарат по любому из пп. 1, 2, отличающийся тем, что указанный препарат используют для защиты функции печени, увеличивая синтез TP и ALB, когда функция печени повреждена.
6. Препарат по любому из пп. 1, 2, отличающийся тем, что указанный препарат используют для ингибирования активации пролиферации звездчатых клеток печени, снижения экспрессии α-SMA в ткани печени.
7. Препарат по любому из пп. 1, 2, отличающийся тем, что указанный препарат используют для возрастания активности SOD в ткани печени, снижения экспрессии MDA, таким образом, чтобы ингибировать активацию звездчатых клеток печени.
8. Препарат по любому из пп. 1, 2, отличающийся тем, что указанный препарат используют для ингибирования смещения внеклеточного матрикса клеток печени и увеличения коллагена, уменьшения содержания коллагена типа IV в сыворотке, снижения уровня Hyp в ткани печени.
9. Препарат по любому из пп. 1, 2, отличающийся тем, что указанный препарат используют для включения ингибирования повреждения функции печени, повышения уровня NAG в сыворотке, способствования распаду коллагена внеклеточного матрикса клеток печени.