Участок связывания антигена (fab), в том числе гуманизированный fab, против ботулинического нейротоксина с (варианты), способ получения fab с использованием дрожжей, способ и набор для детекции ботулинического нейротоксина с
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описаны антиген-связывающие фрагменты (Fab), селективно связывающиеся с ботулиническим нейротоксином С, в частности гуманизированные Fab. Представлены клетки дрожжей, продуцирующие указанные гуманизированные Fab. Предложен способ получения описанных гуманизированных Fab. Также предложены способ детекции ботулинического нейротоксина С и набор для детекции ботулинического нейротоксина С. Изобретение позволяет получить реагенты для детекции ботулинического нейротоксина С, обладающие высокой специфичностью связывания с указанным нейротоксином. 8 н. и 1 з.п. ф-лы, 12 ил., 6 табл., 9 пр.
Реферат
Область техники
Настоящее изобретение относится к антителам, в частности к участкам связывания антигена (Fab), в том числе гуманизированным Fab, против ботулинического нейротоксина С, способу получения указанных Fab с использованием дрожжей, применению указанных Fab для детекции ботулинического нейротоксина С и к набору для указанного применения, содержащему указанные Fab.
Предшествующий уровень техники
Антитела обычно состоят из двух тяжелых цепей, связанных между собой дисульфидными связями, и легких цепей, ассоциированных с N-концом каждой из тяжелых цепей. Каждая тяжелая цепь содержит на N-конце вариабельный домен с константным доменом на другом конце. Каждая легкая цепь также содержит на N-конце вариабельный домен с константным доменом. Вариабельные домены каждой пары легкой и тяжелой цепей образуют антигенсвязывающий участок. Вариабельные домены легкой и тяжелой цепей обладают похожей общей структурой, и каждый домен включает каркас из четырех участков, последовательности которых являются относительно консервативными, связанных посредством трех участков, определяющих комплементарность (complementarity determining regions, CDRs). Четыре каркасных участка формируют конформацию типа бета-складчатого слоя, a CDRs образуют петли, связывающие конструкцию из бета-складчатого слоя. Участки CDRs расположены в непосредственной близости друг от друга благодаря каркасным участкам и вносят вклад в образование антигенсвязывающего участка. Участки CDRs и каркасные участки антител могут быть определены путем ссылки на нумерационную систем у Кабата (Kabat numbering system, Kabat et al., (1987) "Sequences of Proteins of Immunological Interest", US Dept. of Health and Human Services, US Government Printing Office) в сочетании in conjunction with x-ray crystallography, as set forth in WO 91/09967.
Для получения антитела, которое может связываться с каким-либо специфическим антигеном, обычно используют методику Kohler и Milstein (Kohler et al., (1976) Nature 256:495-497). Она включает в себя главным образом иммунизацию мыши антигеном, слияние клеток селезенки из иммунизированной мыши с клетками миеломы мыши и селекцию среди полученных таким образом гибридом одной или нескольких гибридом, которые секретируют моноклональное антитело, специфическое для целевого антигена.
Ботулотоксин (ботулинический токсин, токсин ботулизма) - нейротоксин белковой природы, вырабатываемый бактериями Clostridium botulinum. Ботулотоксин является сильнейшим ядом из известных науке органических токсинов и веществ в целом (Супотницкий М.В. Глава 1.5. Токсины патогенных бактерий // Микроорганизмы, токсины и эпидемии. М., 2000. 376 с.). Попадание ботулотоксина в организм вызывает тяжелое токсическое поражение - ботулизм, который в естественных условиях встречается у людей, лошадей, птиц, реже - у крупного рогатого скота, пушных зверей. Ботулотоксин по серовару возбудителя делят на типы А, В, C1, С2, D, Е, F, G, из них наиболее часто встречается тип А. Летальная доза LD50 у различных сероваров в среднем составляет 0,001 мкг/кг веса, наиболее ядовитым является тип D (0,0004 мкг/кг веса). Ботулотоксин является одним из самых сложных белков, синтезируемых живым организмом. Его масса составляет около 150 тысяч атомных единиц масс, что в три раза превосходит типичный размер белковой цепи, немногие белки (например, титин) превышают этот средний размер.
Clostridium botulinum, будучи строгими анаэробами, способны размножаться только в условиях полного отсутствия кислорода. Как правило, это консервированные и колбасные изделия (особенно консервированные жареные грибы и заготовленные большими кусками мясо и рыба с повреждениями на поверхности). Вырабатываемый бактериями при размножении экзотоксин попадает в организм вместе с пищей, всасываясь в желудочно-кишечном тракте и воздействуя при этом на нервную систему, вызывает нарушения в работе черепных нервов, скелетной мускулатуры, нервных центров сердца. Характерны глазная симптоматика (туман, мушки перед глазами, мидриаз и анизокория зрачков, косоглазие), позднее присоединяются бульбарные симптомы (нарушение речи и глотания, маскообразное лицо). Смерть наступает от гипоксии, вызванной нарушением обменных процессов кислорода, асфиксией дыхательных путей, параличом дыхательной мускулатуры и сердечной мышцы.
Ботулотоксин не имеет вкуса, цвета и запаха (изредка пораженный продукт приобретает запах прогорклого масла). Разрушается при кипячении в течение 25-30 минут, при автоклавировании в течение 10 мин при температуре 120°С, при замачивании в растворе 1% пищевой соды в течение часа. Токсин не разрушается при взаимодействии с пепсином и с соляной кислотой желудочного сока.
Биохимические исследования показали, что нейротоксины обладают цинк-зависимой эндопептидазной активностью и энзиматически расщепляют ряд белков нервных окончаний, важных для нормального высвобождения нейротрансмиттеров. Ботулотоксины А и Ε расщепляют белок SNAP-25, ботулотоксин С - НРС-1 (синтаксин), токсины D и F расщепляют изоформу VAMP-1 (синаптобревин-1), токсин В - VAMP-2 (синаптобревин-2) и т.д. Протеолитическое расщепление этих специфических белков в нервных окончаниях приводит к угнетению нормального высвобождения ацетилхолина и, в конечном счете, к появлению основных признаков ботулизма.
Известно применение специфических антител для диагностики ботулинической инфекций (патент РФ 2152036). В патенте описан способ определения ботулотоксинов А и В на основе специфических F(ab)2-фрагментов антител. Предложены Fab-фрагменты рекомбинантных антител, специфичных к ботулотоксинам типов А и В, однако их структура, последовательность аминокислот и свойства не раскрыты.
Известны гибридомы, продуцирующие мышиные моноклональные антитела к ботулиническому нейротоксину типа В, характеризующиеся стабильностью продукции антител, на основе которых разработан ряд высокочувствительных тест-систем в формате иммуноферментного анализа (Stanker, L.H. A Monoclonal Antibody Based Capture ELISA for Botulinum Neurotoxin Serotype B: Toxin Detection in Food / L.H. Stanker, M.C. Scotcher, L. Cheng, K. Ching, J. McGarvey, D. Hodge, and R. Hnasko // Toxins (Basel). 2013. V. 5. P. 2212-2226).
Описан штамм гибридных клеток Mus. musculus 3F11, продуцирующих моноклональные антитела, специфичные к ботулиническому токсину типа В (патент РФ №2566553). Указанный штамм депонирован в коллекцию микроорганизмов Федерального государственного учреждения науки Государственного научного центра прикладной микробиологии и биотехнологии (ФБУН ГНЦ ПМБ) под коллекционным номером Н-45. Структура антител, их последовательность аминокислот и свойства не раскрыты.
Наиболее близким аналогом настоящего изобретения являются Fab-фрагменты антител, которые могут использоваться в качестве иммуносенсоров для обнаружения ботулотоксинов в продуктах питания и для других нужд здравоохранения и министерства обороны (патент США №5932449).
Таким образом, разработка реагентов и экспресс-методов для детекции ботулинических нейротоксинов, в частности ботулинического нейротоксина С, остается актуальной проблемой как для медицины, так и для органов государственного санитарно-эпидемиологического контроля вследствие экстремальной токсичности и самой высокой летальности при пищевых отравлениях. Кроме того, в последнее время внимание к данной категории токсинов возросло во всем мире из-за угрозы биотерроризма.
Краткое описание изобретения
Целью настоящего изобретения было получение реагентов для детекции ботулинического нейротоксина С (BoNT/C). В качестве указанных реагентов для детекции BoNT/C предпочтительно использование рекомбинантных высокоаффинных антител против BoNT/C, которые могут применяться в экспресс-тестах для определения содержания BoNT/C в объектах окружающей среды, продуктах питания и кормах.
Указанная цель была достигнута путем выделения мышиных антител, обладающих способностью к связыванию с BoNT/C, определения последовательности аминокислот их участков связывания антигена (Fab), последующей гуманизации полученных Fab и демонстрацией их высокой специфичности в связывании BoNT/C. Также указанная цель была достигнута путем создания способа получения указанного функционального Fab с использованием клеток дрожжей.
Настоящее изобретение предоставляет новые изолированные фрагменты с участками связывания антигена (fragment antigen binding, Fab) моноклонального мышиного антитела, которое селективно связывается с BoNT/C и включает в себя вариабельный участок тяжелой цепи (VH) с последовательностью аминокислот SEQ ID NO: 1 или 5, и вариабельный участок легкой цепи (VL) с последовательностью аминокислот SEQ ID NO: 2 или 6.
Также настоящее изобретение предоставляет изолированные фрагменты ДНК, кодирующие фрагмент с антиген-связывающим участком (fragment antigen binding, Fab), описанный выше.
Также настоящее изобретение предоставляет гуманизированные моноклональные Fab, которые селективно связываются с BoNT/C. Последовательности аминокислот тяжелых цепей указанных гуманизированных Fab приведены в Перечне последовательностей под номерами SEQ ID NO: 9 и 10, последовательности аминокислот легких цепей указанных гуманизированных Fab приведены в Перечне последовательностей под номерами SEQ ID NO: 13 и 14.
Также настоящее изобретение предоставляет изолированные фрагменты ДНК, кодирующие гуманизированные Fab, описанные выше.
Также настоящее изобретение предоставляет клетку дрожжей, трансформированную описанным выше фрагментом ДНК, обладающую способностью к продукции указанных гуманизированных Fab.
Также настоящее изобретение предоставляет клетку дрожжей, описанную выше, где указанной клеткой дрожжей является Pichia pastoris.
Также настоящее изобретение предоставляет способ получения гуманизированных Fab, описанных выше, включающий выращивание указанных дрожжей в питательной среде и выделение указанных Fab из культуральной жидкости.
Также настоящее изобретение предоставляет способ детекции BoNT/C, включающий: (а) получение образца; (b) взаимодействие указанного образца с Fab, описанными выше; (с) детектирование комплекса, образованного указанным Fab и BoNT/C; и, необязательно, (d) определение количества BoNT/C, присутствующего в указанном образце на основании детектированного количества комплекса, образованного Fab и BoNT/C.
Также настоящее изобретение предоставляет набор для детекции BoNT/C, содержащего указанные выше изолированные Fab, которые селективно связываются с BoNT/C, и средства, позволяющие детектировать указанный BoNT/C с использованием указанных Fab.
Краткое описание чертежей
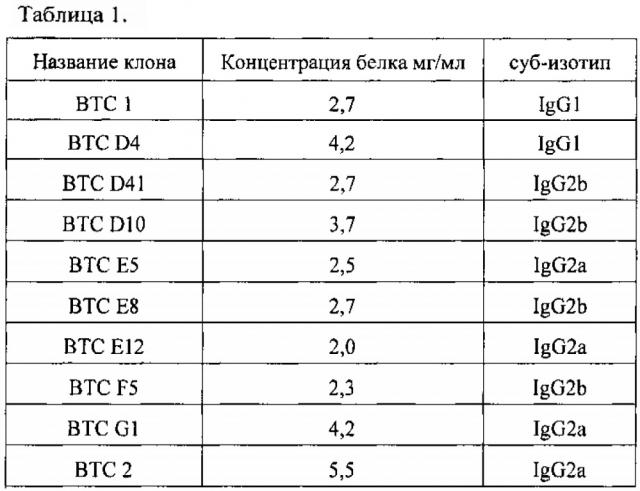
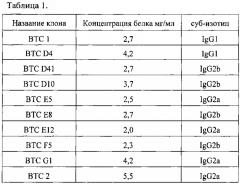
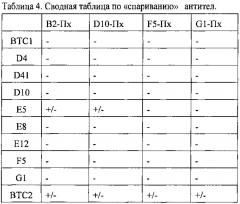
На Фиг. 1 показан 12% SDS-PAGE панели моноклональных антител в восстанавливающих условиях. Дорожка 1 - В ТС 1; Дорожка 2 - ВТС D4; Дорожка 3 - ВТС D41-; Дорожка 4 - ВТС DIO; Дорожка 5 - ВТС Е5; Дорожка 6 - ВТС Е8; Дорожка 7 - ВТС В2Е12; Дорожка 8 - ВТС F5; Дорожка 9 - ВТС G1; Дорожка 10 - ВТС 2; M - стандарты молекулярной массы.
На Фиг. 2 показаны калибровочные кривые для определения BoNT/Cis методом «сэндвич» ИФА.
На Фиг. 3 показана схема расположения адаптера ADAPT, праймеров для обратной транскрипции (M…RT), первичной (AD1, M…R1) и вторичной (AD2_1, M…R2) ПЦР.
На Фиг. 4 показаны нуклеотидные и транслированные аминокислотные последовательности VL:VH генов иммуноглобулинов мыши, а, в) гены тяжелых цепей клеточных линий ВТС1 и ВТС2, соответственно; б, г) гены легких цепей клеточных линий ВТС1 и ВТС2, соответственно. Указаны «framework regions» (FR) и «complementarity determining regions» (CDR).
На Фиг. 5 показана схема клонирования ПЦР-фрагментов вариабельных доменов генов тяжелых цепей в плазмиду pPICZαA-AR-H. Указаны сайты действия эндонуклеаз, промоторы и терминаторы генов, кодирующие области сигнального пептида, вариабельного и константного домена, гена устойчивости к антибиотику, а также область, ответственная за репликацию плазмиды в Е.coli.
На Фиг. 6 показана схема клонирования ПЦР-фрагментов вариабельных доменов генов легких цепей в плазмиду pPICZαA-ΔPmeI-AR-L. Обозначения аналогичны обозначениям на Фиг. 5.
На Фиг. 7 показаны карты экспрессионных плазмид pBTC1_H и pBTC1_L.
На Фиг. 8 показаны карты экспрессионных плазмид рВТС2_Н и pBTC2_L.
На Фиг. 9 показаны карты экспрессионных плазмид pBTC1 и рВТС2.
На Фиг. 10 показан 12% SDS-PAGE рекомбинантных гуманизированных Fab ВТС1.1, ВТС1.2, ВТС1.3 в невосстанавливающих (дорожки 1-3) и восстанавливающих (дорожки 4-6) условиях. Дорожки 1, 4 - ВТС1.1; дорожки 2, 5 - ВТС1.2; дорожка 3, 6 - ВТС1.3; дорожка M - стандарты молекулярной массы.
На Фиг. 11 показаны кривые титрования рекомбинантных гуманизированных Fab в непрямом ИФА с иммобилизованным BoNT/CiS.
На Фиг. 12 показаны результаты иммуноблоттинга рекомбинантных Fab фрагментов против BoNT/CiS в восстанавливающих (дорожки 1-5) и невосстанавливающих (дорожки 6-10) условиях после 12% SDS-PAGE: А - МоАт против Сκ, Б - МоАт против His6tag. Дорожки 1,5 - 1С5 Fab фрагмент (положительныйконтроль); дорожки 2, 6 - рекомбинантный Fab фрагмент ВТС2; дорожки 3, 7 - рекомбинантный Fab фрагмент ВТС1 (серия ВТС 1.3); дорожки 4, 8 - рекомбинантный Fab фрагмент ВТС1 (серия ВТС 1.2); дорожки 5, 10 - рекомбинантный Fab фрагмент ВТС1 (серия ВТС 1.1).
Подробное описание настоящего изобретения
Подходящий способ для выделения антител, эффективных для использования в рамках настоящего изобретения, включает: (а) назначение животному эффективного количества белка, пептида или его мимотопа с целью получения антител и (b) выделение указанных антител. В данном конкретном случае для иммунизации животных был использован нетоксичный аналог BoNT/C (BoNT/CiS), предоставленный компанией fzmb GmbH (Бад-Лагензальца, Германия). Затем были проведены эксперименты, подтверждающие, что антитела против нетоксичного аналога BoNT/CiS также эффективно связываются с BoNT/C.
Антитела, полученные против определенных белков или мимотопов, могут обладать некоторыми преимуществами, поскольку такие антитела не сильно загрязнены антителами против других соединений, что могло бы, в противном случае, повлиять на точность диагностического метода. Способы получения таких антител известны из предшествующего уровня техники и подробно описаны Harlow и др. (Antibodies, a Laboratory Manual, Cold Spring Harbor Labs Press, 1988) и включают в себя иммунизацию животных с целью получения препаратов антител, которые выделяют из, например, плазмы или асцитной жидкости и очищают способами, известными из уровня техники, с получением препаратов, дающих реакцию с антигеном. Множество видов имеют белки с близкими последовательностями и поэтому могут возникнуть сложности в ходе использования стандартных протоколов иммунизации при получении антител, которые узнают белок только одного вида. Поэтому также стоит рассмотреть модификации стандартных методов получения антител, таких как, например, разностные (вычитательные) гибридизационные методики. Такие модификации могут быть известны специалисту в данной области техники, также они описаны в настоящем описании. В других методах антитела, которые могут быть использованы в рамках настоящего изобретения, получают с использованием рекомбинантных методов, описанных Sambrook и др. (Molecular Cloning: A Laboratory Manual, (Cold Spring Harbor Labs Press, 1989)).
Вкратце, моноклональные антитела получают путем слияния клеток селезенки из иммунизированного животного и клеток миеломы с получением гибридомы. Гибридомы могут быть проверены на способность к продукции нужного антитела, затем гибридомы могут быть выращены, из них могут быть выделены указанные антитела. Термин «выращенные клетки», использованный в настоящем описании, означает гибридомы или другие линии клеток, которые производят антитела. Методы получения и проверки таких выращенных клеток описаны Harlow и др. (см. выше). Получение материала, использующегося в качестве антигена, для инъекций животных включают в себя методики, хорошо известные из уровня техники, например использование полноразмерного белка, использование пептида, выбранного из иммуногенных участков белка, модифицирование антигена такими способами, как, например, связывание с динитрофенолом, связывание с арсаниловой кислотой, денатурация антигена, связывание антигена с белком-переносчиком, таким как, например, keyhole limpet hemacyanin, с пептидами, содержащими участки связывания с рецепторами Т-клеток класса II, с бусинами, а также любыми другими методами, известными из уровня техники. См. Harlow и др. (см. выше).
В частности, Fab в соответствии с настоящим изобретением являются Fab мышиных моноклональных антител против BoNT/C. Указанные Fab являются Fab мышиных моноклональных антител, содержащих вариабельный участок тяжелой цепи антитела (VH) с аминокислотной последовательностью SEQ ID NO: 1 или 5, и вариабельный участок легкой цепи антитела (VL) с аминокислотной последовательностью SEQ ID NO: 2 или 6. Указанные новые Fab мышиных моноклональных антител селективно связываются с BoNT/C.
Далее, гуманизированными Fab в соответствии с настоящим изобретением также являются гуманизированные Fab против BoNT/C, которые были получены на основе описанных выше Fab мышиных антител путем их «гуманизации». Окончательные последовательности аминокислот тяжелых цепей указанных гуманизированных Fab против BoNT/C приведены в Перечне последовательностей под номерами SEQ ID NO: 9 и 10, последовательности аминокислот легких цепей указанных гуманизированных Fab против BoNT/C приведены в Перечне последовательностей под номерами SEQ ID NO: 13 и 14. Указанные новые гуманизированные Fab селективно связываются с BoNT/C.
Любая часть гуманизированных антител (и, следовательно, в широком смысле определения термина антитела), полученная в соответствии с настоящим описанием, не выходит за рамки настоящего изобретения, при условии, что специфичность связывания и аффинность к BoNT/C сохраняется. Таким образом, связывающие белки, полученные на основе указанных Fab, в частности полноразмерные антитела, содержащие указанные Fab, без сомнений находятся в рамках настоящего изобретения, как и другие фрагменты, которые способствуют проявлению из способности, по крайней мере, в степени, необходимой для терапевтического использования, как описано ниже.
В настоящем изобретении фраза «антитело или Fab, обладающий способностью к связыванию с BoNT/C» означает молекулу, которая связывается с BoNT/C и образует стабильный комплекс. Стабильным комплексом является комплекс, в котором связывание между партнерами происходит на период времени, достаточный для того, чтобы произвести детектирование указанного комплекса с использованием описанных здесь методов. Термин «селективно связывает BoNT/C» означает способность указанной молекулы предпочтительно связываться с BoNT/C в отличие от связывания с белками, не имеющими отношения к BoNT/C, или связывания с небелковыми компонентами, присутствующими в образце. Антителом или Fab, которое предпочтительно связывается с BoNT/C, является антитело или Fab, которое связывается с BoNT/C, но не связывается в существенной степени с другими молекулами или компонентами, которые могут присутствовать в образце. Существенная степень связывания предполагает, например, связывание антитела, связывающегося с BoNT/C, с молекулой, не являющейся в существенной степени, с аффиностью или силой, достаточной для того, чтобы помешать способности антитела, связывающегося с BoNT/C, определить уровень BoNT/C в образце. Примерами таких молекул и компонентов, которые могут присутствовать в образце, являются, но не ограничиваются ими, белки, не являющиеся BoNT/C, липиды и углеводы.
Способность антитела или Fab к связыванию с антигеном может быть определена специалистом в данной области с использованием методов, включающих, но не ограничивающимися методом ELISA и равновесным диализом. Методы определения аффинности и силы связывания хорошо известны специалисту в данной области техники, подробно описаны Janeway и др. (Immunobiology: The Immune System in Health and Disease (Garland Publishing Company, 1996)).
Fab, пригодный для осуществления настоящего изобретения, - это Fab, обладающий способностью к связыванию BoNT/C, когда концентрация BoNT/C составляет от около 10 нг/мл и около 10 пг/мл. В частности, пригодные в рамках настоящего изобретения антитела связывают антиген BoNT/C, когда концентрация BoNT/C составляет 10 нг/мл, около 1 нг/мл или менее, предпочтительно 100 пг/мл. Такие антитела и Fab описаны в сопутствующих Примерах.
Изолированным фрагментом ДНК, кодирующим гуманизированный Fab согласно настоящему изобретению, является экспрессирующийся фрагмент ДНК, содержащий промотор, сигнальную последовательность, последовательность нуклеотидов, кодирующую структурные части тяжелой и легкой цепей антитела, участок терминации транскрипции.
В частности, нуклеотидные последовательности, кодирующие структурные части тяжелой и легкой цепей Fab согласно настоящему изобретению, содержат фрагмент ДНК, кодирующий вариабельный участок тяжелой цепи (VH) (SEQ ID NO: 3 или 7) и вариабельный участок легкой цепи (VL) (SEQ ID NO: 4 или 8, соответственно), связанный с фрагментом ДНК, кодирующим консервативные участки обеих цепей, необходимые для функционирования указанного антитела.
Также, нуклеотидные последовательности, кодирующие Fab согласно настоящему изобретению, содержат фрагмент ДНК, кодирующий вариабельный участок тяжелой цепи (VH), например SEQ ID NO: 3 или 7, и фрагмент ДНК, кодирующий вариабельный участок легкой цепи (VL), например SEQ ID NO: 4 или 8.
Также, нуклеотидные последовательности, кодирующие структурные части тяжелой и легкой цепей гуманизированного Fab согласно настоящему изобретению, содержат фрагмент ДНК, кодирующий тяжелые цепи (VH), например SEQ ID NO: 9 или 10, и фрагмент ДНК, кодирующий легкие цепи (VL), например SEQ ID NO: 13 или 14.
Ввиду вырожденности трансляционного кода могут быть различия в последовательности ДНК. Фрагменты ДНК согласно настоящему изобретению не ограничены фрагментами, показанными в SEQ ID NO: 3 или 7, 4 или 8, 11 или 15, и 12 или 16, при условии, что они кодируют участки цепей антитела с аминокислотной последовательностью, показанной в SEQ ID NO: 1 или 5, 2 или 6, 9 или 13, и 10 или 14 соответственно.
Фрагмент ДНК, кодирующий антитело или Fab согласно настоящему изобретению, может быть получен любым методом, известным специалисту в данной области техники, включая ПЦР с использованием набора перекрывающихся праймеров, синтез по технологии Slonogene (Sloning Biotechnology GmbH), химическим способом и т.д.
Клетками дрожжей согласно настоящему изобретению являются клетки дрожжей, трансформированные фрагментом ДНК, описанным выше, и обладающие способностью к продукции Fab против BoNT/C.
Фраза «клетки дрожжей, трансформированные фрагментом ДНК» означает, что желаемый фрагмент ДНК был введен в клетку дрожжей с использованием методов, известных специалисту в данной области техники. Трансформация клетки дрожжей фрагментом ДНК приводит к увеличению экспрессии фрагмента ДНК, кодирующего антитело согласно настоящему изобретению. Присутствие сигнальной последовательности α-фактора приводит к секреции произведенного антитела в культуральную жидкость. Методы трансформации клеток дрожжей включают в себя все известные методы, например модифицированная версия процедуры, описанной для S.cerevisiae (Gietz and Schiesti, 1996).
Способом согласно настоящему изобретению является способ получения гуманизированных Fab против BoNT/C, включающий выращивание дрожжей в питательной среде и выделение полученных Fab из культуральной жидкости.
Примером клетки дрожжей, пригодной для продукции гуманизированных Fab согласно настоящему изобретению, являются клетки дрожжей Pichia pastoris, но не ограничивается ими. Фраза «дрожжи Pichia pastoris» означает, что указанные дрожжи классифицируют как Pichia pastoris (P.pastoris) в соответствии с классификацией, известной специалисту в данной области микробиологии. Примерами дрожжей Р.pastoris, применимых в рамках настоящего изобретения, являются дрожжи P.pastoris GS115 (Invitrogen), но не ограничиваются ими.
В настоящем изобретении выращивание, накопление и очистка Fab из культуральной жидкости и других жидкостей может быть осуществлена методом, сходным с традиционными методами ферментации, когда некий белок производится с использованием микроорганизма.
Питательная среда для выращивания может быть как синтетической, так и натуральной при условии, что указанная среда содержит источник углерода, источник азота, минералы и, если это необходимо, подходящее количество питательных веществ, в которых нуждаются дрожжи для их роста. К источникам углерода относятся углеводы, такие как глюкоза и сахароза, и различные органические кислоты. В зависимости от способа ассимиляции у указанного микроорганизма может быть использован спирт, включая метанол, этанол, глицерин. В качестве источника азота могут быть использованы различные соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, источники природного азота, такие как пептон, гидролизат соевых бобов, расщепленные ферментированные микроорганизмы. В качестве источника минералов могут быть использованы монофосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут быть использованы тиамин, дрожжевой экстракт и подобные им соединения.
Выращивание предпочтительно осуществляют в аэробных условиях, таких как культивирование с перемешиванием, взбалтывание с аэрацией, при температуре от 20 до 40°С, предпочтительно от 28 до 30°С. рН среды обычно поддерживают в диапазоне от 2 до 9, предпочтительно в диапазоне от 6 до 7.5. рН среды может быть скорректирован с помощью аммиака, карбоната кальция, различных оснований и буферов. Обычно выращивание в течение от 1 до 7 дней приводит к накоплению Fab в культуральной жидкости.
После выращивания твердые компоненты, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрации с использованием мембраны, а затем антитела или Fab могут быть выделены и очищены методом осаждения с солями, с использованием сульфата натрия или сульфата аммония, аффинной хроматографии, ионообменной хроматографии и т.п.
Моноклональные мышиные антитела в соответствии с настоящим изобретением, которые селективно связываются с BoNT/C, также могут быть получены с использованием подходящей гибридомы. Гибридомы могут быть выращены в питательной среде и накопленные антитела могут быть выделены. Здесь и далее термин "выращиваемые клетки" относится к гибридомам или другим линиям клеток, которые производят антитела. Способы получения и проверки таких выращиваемых клеток описаны Harlow и др. (см. выше). Методы получения антигенного материала для инъекций в животное включают в себя методы, известные из уровня техники, например использование полноразмерного белка, пептидов, выбранных из иммуногенного участка этого белка, модифицирование антигена такими способами, как, например, связывание с динитрофенолом, связывание с арсаниловой кислотой, денатурация антигена, связывание антигена с белком-переносчиком, таким как, например, keyhole limpet hemacyanin, с пептидами, содержащими участки связывания с рецепторами Т-клеток класса II, с бусинами, а также любыми другими методам, известными из уровня техники. Смотри Harlow и др. (см. выше).
Другим способом согласно настоящему изобретению является способ детекции BoNT/C. Указанный способ включает в себя: (а) получение образца; (b) взаимодействие указанного образца с Fab, описанными выше; (с) детектирование комплекса, образованного указанным Fab и BoNT/C; и, необязательно, (d) определение количества BoNT/C, присутствующего в указанном образце на основании детектированного количества комплекса, образованного Fab и BoNT/C. Присутствие в образце любого количества BoNT/C является свидетельством наличия токсина.
В одном из вариантов осуществления настоящего изобретения образец получают или выделяют из объектов окружающей среды, продуктов питания или кормов для того, чтобы протестировать на наличие BoNT/C. Специалист в данной области может без труда выбрать подходящие образцы.
Хотя это не является необходимым в рамках настоящего изобретения, образец может быть подвергнут желаемой предварительной обработке. Например, образец может быть нормирован до достижения желаемой степени специфической активности. Нормирование образца с использованием подходящего метода разведения, известного из уровня техники, позволяет определить количественное содержание BoNT/C независимо от начальной концентрации (например, удельного веса) в образце.
После получения образца определяют уровень BoNT/C в данном образце. Термины «определяют», «определяют уровень BoNT/C», «определяют количество BoNT/C» и подобные им, использованные здесь, используются для того, чтобы очертить круг методов, которые могут быть использованы для определения или измерения количества BoNT/C в образце. Такие методы могут дать качественные или количественные результаты. Уровень содержания BoNT/C может быть определен по содержанию целого белка BoNT/C или по содержанию фрагментов, продуктов деградации или продуктов реакции BoNT/C.
Антитела или Fab, связывающиеся с BoNT/C, пригодные в способах согласно настоящему изобретению, могут включать в себя многофункциональные антитела, например бифункциональные антитела или Fab, содержащие, по крайней мере, одну функциональную часть, которая специфически связывается с BoNT/C. Такие многофункциональные антитела или Fab могут включать в себя, например, химерные молекулы, включающие в себя молекулу, которая связывается с BoNT/C, и вторую часть, которая дает возможность данной химерной молекуле связываться с субстратом или позволяет детектировать ее способом, при котором связывание с BoNT/C не ухудшается. Примерами таких вторых частей являются фрагменты молекулы иммуноглобулина, флуоресцентный белок или фермент, но не ограничиваются ими.
Гибриды или слитые белки антител или Fab, которые сохраняют способность связываться с BoNT/C, также могут быть использованы. В таких гибридах часть, связывающая BoNT/C, может быть связана со второй частью, которая может связываться с субстратом или может быть детектирована. Примеры таких вторых частей включают в себя фрагменты молекул иммуноглобулина, эпитопы, флуоресцентные белки или ферменты, но не ограничиваются ими.
Антитело или Fab, обладающее способностью к связыванию с BoNT/C, использованное в рамках настоящего изобретения, может содержаться в составе для детекции. Например, антитело или Fab может содержаться в буфере, в котором это антитело или Fab растворено, и/или быть объединено с носителем. Подходящие буферы и носители известны для специалиста в данной области техники. Примеры подходящих буферов включают в себя любой буфер, в котором антитело или Fab может функционировать с селективным связыванием BoNT/C, такой как фосфатный солевой буфер, вода, буфер HEPES (буферная соль N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты), буфер TES (солевой буфер Трис-ЭДТА), буфер Трис и буфер ТАЭ (Трис-ацетат-ЭДТА), но не ограничиваются ими. Примеры носителей включают в себя полимерные матрицы, токсоиды, сывороточные альбумины, такой как бычий сывороточный альбумин, но не ограничиваются ими. Носители могут быть комбинированы с антителом или Fab, или конъюгированы (присоединены) к антителу или Fab способом, который существенно не изменяет способность антитела или Fab к связыванию BoNT/C.
Термин «взаимодействие», использованный здесь, означает введение, добавление образца, предположительно содержащего BoNT/C, к антителу или Fab, связывающему BoNT/C, например, путем объединения или смешения образца с антителом или Fab. В случае, если BoNT/C присутствует в образце, образуется комплекс BoNT/C с антителом или Fab; образование такого комплекса означает способность антитела или Fab селективно связываться с BoNT/C с образованием стабильного комплекса, который может быть детектирован. Детектирование может быть качественным, количественным или полуколичественным. Связывание BoNT/C из образца с антителом или Fab происходит в условиях, подходящих для формирования комплекса. Такие условия (например, подходящие концентрации, буферы, температура, время реакции), а также методы оптимизации таких условий хорошо известны специалисту в данной области техники. Связывание может быть обнаружено и измерено с использованием множества методов, являющихся стандартными в данной области техники, включая ферментативные методы иммунохимии (например, ELISA), иммунопреципитации, методы иммуноблотинга и другие методы иммунохимии, описанные, например, Sambrook и др. (см. выше) и Harlow и др. (см. выше), но не ограничиваются ими. Эти ссылки также описывают примеры условий, в которых образуется комплекс.
В рамках одного из воплощений настоящего изобретения комплекс BoNT/C и антитела или Fab может образовываться в растворе. В рамках другого воплощения настоящего изобретения может образовываться комплекс BoNT/C с антителом или Fab, в котором антитело или Fab иммобилизовано на подложке (например, нанесено на подложку). Методики иммобилизации хорошо известны специалисту в данной области техники. Подходящие материалы для подложки включают в себя, но не ограничиваются пластмассой, стеклом, гелем, целлулоидом, тканями, бумагой и другими материалами. Примеры материалов подложки включают в себя, но не ограничиваются латексом, полистиролом, нейлоном, нитроцеллюлозой, агарозой, хлопком, PVDF (поливинилиденфторидом) и магнитными смолами. Подходящие формы материала подложки включают в себя, но не ограничиваются углублениями (например, плашки для микротитрования), чашки для микротитрования, стержни, полоски, бусины, аппараты с ответвляющимся потоком, мембраны, фильтры, трубки, чашки, целлулоидный матрикс, магнитные частицы, другие макрочастицы. В частности, предпочтительными подложками являются, например, пластинки для ELISA, стержни, полоски для иммуноанализа, радиоиммунологические чашки, агарозные бусины, пластиковые бусины, бусины из латекса, гибки, хлопковые нити, пластиковые чипы, мембраны для иммуноблотинга, бумага для иммуноблотинга и проточные мембраны. В одном из вариантов воплощения изобретения подложка, указанная выше, может содержать маркер для детекции. Описание примеров материалов для подложки смотри, например, в Kemeny, D.M. (1991) A Practical Guide to ELISA, Pergamon Press, Elmsford, N.Y. pp 33-44, and Price, С.) и Newman, D. eds. (Principles and Practice of Immunoassay, 2nd edition (1997) Stockton Press, NY, N.Y.).
Антитело или Fab может быть иммобилизовано на подложке, такой как плашка для микротитрования, стержне, полоске для иммуноанализа, аппараты с ответвляющимся потоком. Образец наносят на подложку и инкубируют в условиях, подходящих (то есть, достаточных) для образования комплекса BoNT/C с антителом, связанным с подложкой.
В соответствии с настоящим изобретением комплекс BoNT/C с антителом или Fab детектируют. Термин «детектирование образования комплекса», использованный здесь, означает идентификацию присутствия антитела или Fab, связанного с BoNT/C. Если комплекс образуется, то количество образованного комплекса может быть оценено количественно, но это не является обязательным. Образование комплекса или селективное связывание между предполагаемым в образце BoNT/C с антителом или Fab может быть измерено (то есть, детектировано, определено) с использованием множества методов, являющихся стандартными в данной области (см., например, Sambrook и др., выше), примеры которых описаны здесь. Комплекс может быть детектирован множеством методов, включающих в себя, но не ограниченных использованием одного или нескольких методов: ферментоподобным иммунометодом, конкурентным ферментоподобным иммунометодом, радиоиммунным, флуоресцентным иммунометодом, хемилюминесцентным иммунометодом, методом с использованием аппаратов с ответвляющимся потоком, проточным методом, методом агглютинации, методом с использованием макрочастиц (например, с использованием частиц, таких как, но не ограниченных магнитными частицами или пластиковыми полимерами, такими как латекс или полистироловые бусины), методом иммунопреципитации, методом BioCore™ (например, с использованием коллоидного золота), методом иммунодота (например, Heska AG's Immunodot System, Фрибург, Швейцария) и методом иммуноблотинга (например, Вестерн-блотинг), методом фосфоресценции, проточным методом, методом хроматографии, методом с использованием полиакриламидного геля, методом поверхностного резонанса плазмонов, методом спектрофотометрии, методом с использованием частиц, методом электронных сенсоров. Указанные способы хорошо известны специалисту в данной области техники.
Эти методы могут быть использованы для получения количественных или качественных результатов в зависимости от того, как эти методы будут использованы. Результаты методов могут базироваться на детектировании нативной молекулы BoNT/C или его фрагментов, продуктов деградации или продуктов реакции BoNT/C. Некоторые методы, такие как агглютинация, разделение с использованием макрочастиц и иммунопр