Конструкции слияния и их применение для получения антител с повышенными аффинностью связывания fc-рецептора и эффекторной функцией
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к выделенной нуклеиновой кислоте, кодирующей полипептид слияния, обладающий активностью бета-1,4-N-ацетилглюкозаминилтрансферазы III (GnTIII) или бета-1,4-галактозилтрансферазы (GalT). Также раскрыты клетка-хозяин, содержащая указанную нуклеиновую кислоту, и вектор экспрессии, содержащий указанную выделенную нуклеиновую кислоту. Раскрыт способ модификации профиля гликозилирования полипептида указанной нуклеиновой кислотой. Изобретение позволяет модифицировать гликозилирование в клетке-хозяине с целью получения полипептидов с улучшенными терапевтическими свойствами. 6 н. и 18 з.п. ф-лы, 43 ил, 2 табл., 8 пр.
Реферат
Область техники изобретения
Настоящее изобретение относится к области модификации гликозилирования белков. Более конкретно, настоящее изобретение относится к молекулам нуклеиновой кислоты, включая конструкции слияния, обладающие каталитической активностью, и их применение для модификации гликозилирования в клетке-хозяине с целью получения полипептидов с улучшенными терапевтическими свойствами, включая антитела с повышенной аффинностью связывания Fc-рецептора и повышенной эффекторной функцией.
Уровень техники
Гликопротеины опосредуют многие важнейшие функции в организме человека, других эукариотических организмах и у некоторых прокариот, включая каталитиз и передачу сигналов, межклеточные взаимодействия, распознавание молекул и их ассоциацию. Они составляют большинство нецитозольных белков в эукариотических организмах (Lis et al, Eur. J Biochem. 218:1-27 (1993)). Многие гликопротеины были использованы в терапевтических целях, и в течение двух последних десятилетий основным продуктом биотехнологического производства были рекомбинантные варианты встречающихся в природе, секретируемых, гликопротеинов. Примеры включают: эритропоэтин (ЭП), терапевтические моноклональные антитела (терапевтические МКАТ, mAb), тканевой активатор плазминогена (TAII), интерферон-бета (ИФН-β), фактор, стимулирующий колонии гранулоцитов/макрофагов (GM-CSF), хорионический гонадотропин человека (ХГч) (Cumming et al., Glycobiology 1:115-130 (1991)).
Олигосахаридный компонент может существенно влиять на свойства, имеющие отношение к эффективности терапевтического гликопротеина, включая физическую стабильность, устойчивость к действию протеаз, взаимодействие с иммунной системой, фармакокинетику и специфическую биологическую активность. Такие свойства могут зависеть не только от присутствия или отсутствия олигосахаридов, но и от их специфической структуры. Можно провести параллели между структурой олигосахаридов и функцией гликопротеина. Например, определенные олигосахаридные структуры
опосредуют, путем взаимодействия со специфическими углевод-связывающими белками, быстрое выведение (клиренс) гликопротеина из кровяного русла, в то время как другие могут быть связаны антителами и запускать нежелательные иммунные реакции (Jenkins et al., NatureBiotechnol 14:975-81 (1996)).
Клетки млекопитающих являются предпочтительными хозяевами для получения терапевтических гликопротеинов благодаря своей способности гликозилировать белки наиболее подходящим для последующего введения в организм человека образом (Cumming et al., Glycobiology 1:115-30 (1991); Jenkins et al, Nature Biotechnol. 14:975-81 (1996)). Бактерии чрезвычайно редко гликозилируют белки и, подобно другим типам обычных клеток-хозяев, таких как дрожжи, мицелиальные грибы, клетки насекомых и растений, создают паттерны гликозилирования, ассоциированные с быстрым клиренсом из кровяного русла, нежелательными иммунными взаимодействиями и, в некоторых специфических случаях, со снижением биологической активности. В течение двух последних десятилетий наиболее часто используемыми клетками млекопитающих были клетки яичников китайского хомячка (СНО). В дополнение к подходящим паттернам гликозилирования, использование этих клеток позволяет неизменно получать генетически стабильные, высокопродуктивные линии клеточных клонов. Их культуры могут быть доведены до высоких плотностей в простых биореакторах (культиваторах) с использованием бессывороточной среды, при этом возможна разработка безопасного воспроизводимого биотехнологического процесса. Другие обычно используемые клетки включают клетки почек хомячка (ВНК), клетки миеломы мыши NSO и SP2/0. Более поздние исследования относятся к получению гликопротеинов с использованием трансгенных животных (Jenkins et al, NatureBiotechnol. 14:975-81 (1996)).
Все антитела содержат углеводные структуры в консервативных положениях константных областей тяжелой цепи, причем каждый изотип (класс) обладает особым набором N-связанных (присоединенных к остатку аспарагина) углеводных структур, который вариабельно влияет на сборку, секрецию или функциональную активность белка (Wright A., Morrison, S.L., Trends Biotech. 15:26-32 (1997)). Структура N-связанного углевода, связанного с антителом, может значительно варьироваться в зависимости от степени процессинга и может включать как сильноразветвленные олигосахариды с высоким содержанием маннозы, так и «двухантенные» сложные олигосахариды (Wright, А., Morrison, S.L., Trends Biotech. 15:26-32 (1997). Обычно имеет место гетерогенный процессинг коровых (каркасных) олигосахаридных структур, прикрепленных в определенном сайте гликозилирования, что приводит к тому, что даже моноклональные антитела существуют в виде множественных гликоформ. Также было показано, что имеют место существенные отличия в гликозилировании между различными клеточными линиями, и незначительные - между клетками одной линии, культивируемыми в разных условиях (Lifely, M.R. et al., Glycobiology 5 (8): 813-22 (1995)).
Неконъюгированные моноклональные антитела (mAbs, МКАТ) могут быть полезны в качестве лекарств для лечения рака, что подтверждается одобрением Администрацией по контролю за продуктами питания и лекарствами США (FDA) применения Rituximab'a (Rituxan™; IDEC Pharmaceuticals, Сан-Диего, Калифорния, и GenentechInc, Сан-Франциско, Калифорния), для лечения CD20-положительной В-клеточной низкозлокачественной или фолликулярной лимфомы, отличной от лимфомы Ходжкина, Trastuzumab'a (Herceptin; GenentechInc,) для лечения запущенного рака груди (Grillo-Lopez, A.-J., et al., Semis. Oncol. 26:66-73 (1999); Goldenberg, M.M., Clin. Ther. 21:309-18 (1999)), Gemtuzumab'a (Mylotarg™, Celltech/Wyeth - Ayerst) для лечения рецидивирующей острой миелоидной лейкемии, и Alemtuzumab'a (САМРАТН™, MilleniumPharmaceuticals/Schering AG) для лечения В-клеточной хронической лимфоцитарной лейкемии. Успех этих продуктов является результатом не только их эффективности, но и их выдающейся безопасностью (Grillo-Lopez, A.-J., et al, Semin. Oncol. 26: 66-73 (1999); Goldenberg, M.M., Clin. Ther. 21:309-18 (1999)). Несмотря на достижения этих лекарственных средств, в настоящее время существует заинтересованность в получении более высокой специфической активности антител, чем та, которую обычно можно достичь при помощи терапии с использованием неконъюгированных МКАТ.
Один из способов достигнуть повышения эффективности, сохранив при этом простоту процесса получения и, если возможно, избежав значительных нежелательных побочных эффектов, состоит в том, чтобы усилить естественные опосредуемые клетками эффекторные функции МКАТ путем модификации их олигосахаридного компонента (Umana, P. et al, Nature Biotechnol 17:176-180 (1999)). Антитела типа IgG1, наиболее часто применяемые в иммунотерапии рака, представляют собой гликопротеины, которые содержат консервативный сайт N-гликозилирования в положении Asn297 каждого из доменов СН2. Сложные «двуантенные» олигосахариды, присоединенные к Asn297, скрыты между двумя доменами СН2, образуя множественные контакты с белковым каркасом. Их присутствие необходимо для осуществления эффекторной функции антитела, такой как антителозависимая клеточная цитотоксичность (АЗКЦ) (Lifely, М.R., et al., number 4 Glycobiology 5:813-822 (1995); Jefferis, R., et al, Immunol Rev. 163:59-76 (1998); Wright, A., Morrison, S.L., Trends Biotechnol 15:26-32 (1997)).
Авторами настоящего изобретения было ранее показано, что повышенная экспрессия бета-1,4-N-ацетилглюкозаминилтрансферазы III (GnTIII), гликозилтрансферазы, катализирующей образование разветвленных (bisected) олигосахаридов, in vitro значительно увеличивает активность АЗКЦ антинейробластомного химерного моноклонального антитела (chCE7), продуцируемого модифицированными клетками СНО (См. Umana, P. et al, Nature Biotechnol. 17:176-180 (1999), Международная публикация No. WO 99/54342, полное содержание каждого из источников полностью включено в описание изобретения путем ссылки). Антитело chCE7 принадлежит к обширному классу неконъюгированных МКАТ, которые обладают высокой аффинностью и специфичностью к опухолям; однако эффективность этих антител при продуцировании их стандартными промышленными клеточными линиями, дефицитными по ферменту GnTIII, слишком низка для клинического применения (Umana, Р., et al., Nature Biotechnol. 17:176-180 (1999)). Это исследование впервые показало, что сильное повышение активности АЗКЦ может быть достигнуто путем модификации продуцирующих антитела клеток для экспрессии GnTIII, которая также приводит к увеличению доли связанных с константной (Fc) областью разветвленных (bisected) олигосахаридов (включая разветвленные нефукозилированные олигосахариды) по сравнению с уровнем, обнаруженным у встречающихся в природе антител.
Результаты ряда исследований позволяют предположить, что Fc-рецептор-зависимые механизмы вносят существенный вклад в действие противоопухолевых цитотоксических антител, а также показывают, что оптимальное противоопухолевое антитело должно предпочтительно связываться с активирующим Fc-рецептором и как минимум - с ингибирующим партнером FcγRIIB (Clynes, R.A., et al., Nature Medicine 6(4):443-446 (2000)); Kalergis, A.M., Ravetch, J.V., J. Exp. Med. 195(12):1653-1659 (Июнь 2002)). Например, результаты по меньшей мере одного исследования позволяют предположить, что, в частности, рецептор FcγRIIIa имеет сильное влияние на эффективность лечения антителами (Cartron, G., et al., Blood 99(3): 754-757 (Февраль 2002)). Это исследование показало, что пациенты, гомозиготные по (гену) FcγRIIIa, лучше реагируют на Rituximab, чем гетерозиготные пациенты. Авторы пришли к заключению, что повышенный ответ был результатом лучшего связывания антитела с FcγRIIIa in vivo, которое привело к лучшей активности АЗКЦ против клеток лимфомы (Cartron, G., et al., Blood 99(3):754-757 (Февраль 2002)).
Кроме АЗКЦ, успешные противораковые антитела часто индуцируют Fc-независимый прямой сигнальный механизм, который определяет выживание, пролиферацию или смерть клетки-мишени через активацию сигнальных каскадов клетки или блокирования доступа к факторам роста (Selenko, N., et al, J Clin. Immunol. 22(3): 124-130 (2002)). Например, было показано, что лечение CD20+ В-клеток Rituximab'ом индуцирует, помимо АЗКЦ, комплемент опосредованный лизис и Mab-индуцируемую индукцию апоптоза (Selenko, N., et al., J. Clin. Immunol. 22(3): 124-130 (2002)). Более того, индуцированный Rituximab’ом апоптоз клеток лимфомы не только убивает клетки, но и способствует захвату и кросс-презентации белков - производных клеток лимфомы антиген-презентирующими дендритными клетками, индуцирует созревание дендритных клеток и делает возможным появление специфических цитотоксических Т-лимфоцитов (ЦТЛ).
Краткое описание изобретения
Принимая во внимание огромный потенциал антител с повышенной аффинностью связывания Fc-рецептора и повышенной эффекторной функцией, авторы настоящего изобретения разработали способ получения таких антител, который включает модификацию профиля гликозилирования Fc-области антитела.
Настоящее изобретение предусматривает, в общих чертах, на создание способа гликомодификации клетки-хозяина с целью изменения профиля гликозилирования одного или более полипептидов, продуцируемых этой клеткой-хозяином. Способы изобретения возможно применять для получения терапевтических антител с измененным гликозилированием в Fc-области, включая сниженное фукозилирование (перенос на олигосахарид остатков фукозы), где, в результате модификации гликозилирования, антитела обладают повышенной эффекторной функцией и/или повышенным связыванием Fc-рецептора. Гликомодифицированные антитела настоящего изобретения особенно полезны в терапевтическом лечении рака у пациентов. В одном воплощении клетку-хозяин данного изобретения подвергают модификации гликозилирования посредством экспрессии молекулы нуклеиновой кислоты, кодирующей полипептид с каталитической активностью GnTIII либо GalT. В предпочтительном воплощении конструкты слияния коэкспрессируются совместно с молекулой нуклеиновой кислоты, кодирующей полипептид, обладающий каталитической активностью ManII и/или с молекулой нуклеиновой кислоты, кодирующей полипептид с каталитической активностью GnTII. В другом воплощении гликомодифицированные полипептиды настоящего изобретения продуцируются клеткой-хозяином, которая была модифицирована для повышения уровня экспрессии молекулы нуклеиновой кислоты, кодирующей полипептид с каталитической активностью ManII.
В другом аспекте настоящее изобретение предусматривает клетку-хозяина, содержащую описанный выше вектор экспрессии, содержащий изолированную нуклеиновую кислоту, содержащую последовательность, кодирующую рекомбинантный полипептид слияния, где указанный полипептид слияния обладает активностью бета-1,4-галактозилрансферазы и содержит отвечающий за локализацию в комплексе Гольджи домен какого-либо полипептида-резидента комплекса Гольджи. В одном воплощении вектор экспрессии кодирует полипептид слияния, содержащий каталитический домен бета-1,4-галактозилрансферазы III, а домен, ответственный за локализацию в комплексе Гольджи выбирают из группы, состоящей из домена локализации маннозидазы II, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы I, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы II, домена локализации маннозидазы I и домена локализации альфа 1-6 коровой фукозилтрансферазы или нуклеиновой кислотой, кодирующей полипептид слияния, содержащей каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III или бета-1,4-галактозилтрансферазы и отвечающий за локализацию в комплексе Гольджи домен гетерологического полипептида-резидента комплекса Гольджи.
В другом аспекте настоящее изобретение предусматривает клетку-хозяина, модифицированную для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей рекомбинантный белок слияния, обладающий активностью бета-1,4-N-ацетилглюкозаминилтрансферазы III («GnTIII»), в количестве, достаточном для модификации олигосахаридов в Fc-полипептида полипептида, продуцируемого клеткой-хозяином, где указанный полипептид, продуцируемый указанной клеткой-хозяином, выбирают из группы, состоящей из целой молекулы антитела, фрагмента антитела, содержащего Fc-область и белка слияния, содержащего область, эквивалентную Fc-области иммуноглобулина. В одном воплощении полипептид, обладающий активностью GnTIII, содержит каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III и отвечающий за локализацию в комплексе Гольджи домен какого-либо гетерологичного полипептида-резидента комплекса Гольджи, который выбирают из группы, состоящей из домена локализации маннозидазы II, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы I, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы II, домена локализации маннозидазы I и домена локализации альфа1-6 кор-фукозилтрансферазы.
В другом аспекте настоящее изобретение предусматривает клетку-хозяина, модифицированную для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей рекомбинантный белок слияния, обладающий активностью бета-1,4-галактозилтрансферазы («GalT»), в количестве, достаточном для модификации олигосахаридов в Fc-области полипептида, продуцируемого клеткой-хозяином, где указанный полипептид, продуцируемый указанной клеткой-хозяином, выбирают из группы, состоящей из целой молекулы антитела, фрагмента антитела, содержащего Fc-область, и белка слияния, содержащего область, эквивалентную Fc-области иммуноглобулина. В одном воплощении рекомбинантный полипептид, обладающий активностью GalT, содержит каталитический домен бета-1,4-галактозилтрансферазы и отвечающий за локализацию в комплексе Гольджи, домен какого-либо гетерологичного полипептида-резидента комплекса Гольджи, который выбирают из группы, состоящей из домена локализации маннозидазы II, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы I, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы II, домена локализации маннозидазы I и домена локализации альфа1-6 кор-фукозилтрансферазы.
Предпочтительно, отвечающий за локализацию в комплексе Гольджи домен представляет собой домен маннозидазы II или бета-1,2-N-ацетилглюкозаминилтрансферазы I, или, в качестве альтернативы, галактозилтрансферазы.
В другом аспекте настоящее изобретение предусматривает полипептид слияния, обладающий активностью бета-1,4-N-ацетилглюкозаминилтрансферазы III и содержащий отвечающий за локализацию в комплексе Гольджи домен какого-либо гетерологичного полипептида-резидента комплекса Гольджи. В одном воплощении полипептиды слияния согласно данному изобретению содержат каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III. В другом воплощении отвечающий за локализацию в комплексе Гольджи домен выбирают из группы, состоящей из домена локализации маннозидазы II, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы I, домена локализации маннозидазы I, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы II и домена локализации альфа 1-6 кор-фукозилтрансферазы.
В другом аспекте настоящее изобретение предусматривает полипептид слияния, обладающий активностью бета-1,4-галактозалтрансферазы и содержащий домен, отвечающий за локализацию в комплексе Гольджи, какого-либо гетерологичного полипептида-резидента комплекса Гольджи. В одном воплощении полипептиды слияния согласно данному изобретению содержат каталитический домен бета-1,4 галактозилтрансферазы. В другом воплощении отвечающий за локализацию в комплексе Гольджи домен выбирают из группы, состоящей из домена локализации маннозидазы II, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы I, домена локализации
маннозидазы I, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы II и домена локализации альфа 1-6 кор-фукозилтрансферазы.
Предпочтительно, отвечающий за локализацию в комплексе Гольджи домен представляет собой домен маннозидазы II или бета-1,2-N-ацетилглюкозаминилтрансферазы I («GnTI»), или, в качестве альтернативы, галактозилтрансферазы («GalT»).
В другом аспекте настоящее изобретение предусматривает способ получения рекомбинантного полипептида слияния, обладающего активностью бета-1,4-N-ацетилглюкозаминилтрансферазы III, включающий культивирование клетки-хозяина согласно данному изобретению в культуральной среде в условиях, делающих возможной экспрессию нуклеиновой кислоты, кодирующей указанный полипептид слияния, и получение (выделение) полипептида из полученной в результате культуры клеток. В одном воплощении полипептид слияния содержит каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III. Предпочтительно, полипептид слияния содержит отвечающий за локализацию в комплексе Гольджи домен какого-либо гетерологичного белка-резидента комплекса Гольджи, который выбирают из группы, состоящей из домена локализации маннозидазы И, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы I, домена локализации маннозидазы I, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы II и домена локализации альфа1-6 кор-фукозилтрансферазы.
В другом аспекте настоящее изобретение предусматривает способ получения рекомбинантного полипептида слияния, обладающего активностью бета-1,4-N-галактозилтрансферазы, включающий культивирование в среде клетки-хозяина согласно настоящему изобретению в условиях, делающих возможной экспрессию нуклеиновой кислоты, кодирующей полипептид слияния, и получение (выделение) полипептида слияния из полученной в результате культуры. В одном воплощении полипептид слияния содержит каталитический домен бета-1,4-N-галактозилтрансферазы. Предпочтительно, полипептид слияния содержит отвечающий за локализацию в комплексе Гольджи домен какого-либо гетерологичного белка-резидента комплекса Гольджи, который выбирают из группы, состоящей из домена локализации маннозидазы II, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы I, домена локализации маннозидазы Гдомена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы II и домена локализации альфа1-6 кор-фукозилтрансферазы.
Предпочтительно, отвечающий за локализацию в комплексе Гольджи домен представляет собой домен маннозидазы II, или бета-1,2-N-ацетилглюкозаминилтрансферазы I («GnTI»), илигалактозилтрансферазы («GalT»).
В дальнейшем аспекте изобретение предусматривает способ модификации профиля гликозилирования полипептида, продуцируемого клеткой-хозяином, содержащей введенную в нее по меньшей мере одну нуклеиновую кислоту или вектор экспрессии данного изобретения. Предпочтительно, полипептид представляет собой IgG или его фрагмент, содержащий Fc-область этого полипептида(IgG). В особенно предпочтительном воплощении полипептид представляет собой IgG или его фрагмент, содержащий Fc-область этого полипептида. В качестве альтернативы полипептид представляет собой белок слияния, который включает область, эквивалентную Fc-области IgG человека.
В другом аспекте настоящее изобретение предусматривает способ получения рекомбинантного полипептида слияния в клетке-хозяине, включающий: (а) культивирование клетки-хозяина, модифицированной для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид слияния, обладающий активностью бета-1,4-N-ацетилглюкозаминилтрансферазы III(«GnTIII») или, в качестве альтернативы, активностью бета-1,4-галактозилтрансферазы («GalT»), в культуральной среде в условиях, которые допускают продукцию полипептида, выбранного из группы, состоящей из целой молекулы антитела, фрагмента антитела, содержащего Fc-фрагмент и слитого белка, содержащего область, эквивалентный Fc-области иммуноглобулина, где указанный полипептид слияния экспрессируется в количестве, достаточном для модификации олигосахаридов в Fc-области полипептида, продуцируемого клеткой-хозяином; и (b) выделение указанного полипептида. Предпочтительно, полипептид слияния содержит каталитический домен бета-1,4-N-ацетилглюкозаминилтрансферазы III или бета-1,4-галактозилтрансферазы («GalT») и, дополнительно содержит отвечающий за локализацию в комплексе Гольджи домен какого-либо гетерологичного полипептида-резидента комплекса Гольджи, который выбирают из группы, состоящей из домена локализации маннозидазы II, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы I, домена локализации маннозидазы I, домена локализации бета-1,2-N-ацетилглюкозаминилтрансферазы II и домена локализации альфа 1-6 коровой фукозилтрансферазы. В предпочтительных воплощениях полипептид, продуцируемый клеткой-хозяином, обладает, в результате модификации, повышенной эффекторной функцией и/или повышенным связыванием Fc-рецептора. В особенно предпочтительных воплощениях повышенная эффекторная функция представляет собой повышенную Fc-опосредованную клеточную цитотоксичность, повышенное связывание NK-клеток, повышенное связывание макрофагов, повышенное связывание моноцитов, повышенное связывание полиморфноядерных клеток, повышенную прямую передачу индуцирующих апоптоз сигналов, повышенное созревание дендритных клеток и/или повышенную активность начально активизации Т-лимфоцитов (priming), а повышенное связывание Fc-рецептора представляет собой повышенное связывание активирующего Fc-рецептора, такого как рецептор FcγRIIIA. Предпочтительно полипептид, демонстрирующий повышенную эффекторную функцию и/или повышенное связывание Fc-рецептора, представляет собой антитело, фрагмент антитела или белок слияния, содержащий область, эквивалентную Fc-области иммуноглобулина, и обладает увеличенной долей нефукозилированных олигосахаридов в Fc-области.
В дальнейшем аспекте изобретение предусматривает фармацевтические составы, содержащие антитело, фрагмент антитела, содержащий Fc-область, или рекомбинантный полипептид слияния, содержащий Fc-область иммуноглобулина данного изобретения, и применение таких составов в лечении опухолей, таких как рак, или других расстройств. В одном воплощении лечение представляет собой снижение количества В-лимфоцитов путем назначения терапевтически эффективного количества такого фармацевтического состава пациенту, например, человеку, при необходимости. В дальнейшем аспекте изобретение предусматривает клетку-хозяина, содержащую вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид слияния, где указанный полипептид слияния обладает активностью бета-1,4-N-ацетилглюкозаминилтрансферазы III (GnTIII) и содержит отвечающий за локализацию в комплексе Гольджи домен какого-либо полипептида-резидента комплекса Гольджи, а также вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид, где указанный полипептид слияния обладает активностью маннозидазы II. В предпочтительных воплощениях полипептид слияния содержит каталитический домен GnTIII, а отвечающий за локализацию в комплексе Гольджи домен выбирают из группы, состоящей из домена локализации ManII, домена локализации GnTI, домена локализации GnTII, домена локализации ManI и домена локализации альфа1-6 кор-фукозилтрансферазы. В одном воплощении клетка-хозяин дополнительно содержит вектор экспрессии, кодирующий полипептид, обладающий активностью GnTII. Молекулы нуклеиновой кислоты, кодирующие полипептид слияния, обладающий активностью ManII полипептид и обладающий активностью GnTII полипептид, могут содержаться либо в разных векторах экспрессии, либо в одном векторе экспрессии. В дополнительном аспекте изобретение предусматривает клетку-хозяина, содержащую вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую рекомбинантный полипептид слияния, где указанный полипептид слияния обладает активностью бета-1,4-галактозилтрансферазы (GalT) и содержит отвечающий за локализацию в комплексе Гольджи домен полипептида-резидента комплекса Гольджи, а также вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид, где указанный полипептид обладает активностью маннозидазы II (ManII). В предпочтительных воплощениях полипептид слияния содержит каталитический домен GnTIII, а отвечающий за локализацию в комплексе Гольджи домен выбирают из группы, состоящей из домена локализации ManII, домена локализации GnT I, домена локализации GnTII, домена локализации ManI и домена локализации альфа1-6 кор-фукозилтрансферазы. В одном воплощении клетка-хозяин дополнительно содержит вектор экспрессии, кодирующий полипептид, обладающий активностью GnTII. Молекулы нуклеиновых кислот, кодирующие полипептид слияния, обладающий активностью ManII полипептид и обладающий активностью GnTII полипептид, могут содержаться либо в разных векторах экспрессии, либо в одном векторе экспрессии.
В дальнейшем аспекте изобретение предусматривает клетку-хозяина, модифицированную для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид слияния, обладающий активностью GnT III и по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью Man II, в количестве, достаточном для модификации олигосахаридов в Fc-области полипептида, продуцируемого клеткой-хозяином, где указанный полипептид, продуцируемый указанной клеткой-хозяином, выбирают из группы, состоящей из целой молекулы антитела, фрагмента антитела, содержащего Fc-фрагмент и слитого белка, который содержит область, эквивалентную Fc-области иммуноглобулина.
В дополнительном способе воплощения изобретение предусматривает клетку-хозяина, модифицированную для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей слитый полипептид, обладающий активностью GnT III, по крайней мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью Man II, и по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью GnT II, в количестве, достаточном для модификации олигосахаридов в Fc-области полипептида, продуцируемого указанной клеткой-хозяином, где указанный полипептид, продуцируемый указанной клеткой-хозяином, выбирают из группы, состоящей из целой молекулы антитела, фрагмента антитела и слитого белка, который содержит область, эквивалентную Fc-области иммуноглобулина.
В дальнейшем аспекте изобретение предусматривает клетку-хозяина, модифицированную для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид слияния, обладающий активностью GalT, и по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью Man II, в количестве, достаточном для модификации олигосахаридов в Fc-области полипептида, продуцируемого клеткой-хозяином, где указанный полипептид, продуцируемый указанной клеткой-хозяином, выбирают из группы, состоящей из целой молекулы антитела, фрагмента антитела и слитого белка, который содержит область, эквивалентную Fc-области иммуноглобулина. В дополнительном аспекте изобретение предусматривает клетку-хозяина, модифицированную для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей рекомбинантный полипептид слияния, обладающий активностью GalT, по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью Man II, и по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью GnT II, в количестве, достаточном для модификации олигосахаридов в Fc-области полипептида, продуцируемого указанной клеткой-хозяином, где указанный полипептид, продуцируемый указанной клеткой-хозяином, выбирают из группы, состоящей из целой молекулы антитела, фрагмента антитела и слитого белка, который содержит область, эквивалентную Fc-области иммуноглобулина.
В дальнейшем аспекте изобретение предусматривает способ продуцирования полипептида клеткой-хозяином, включающий культивирование клетки-хозяина, модифицированной для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид слияния, обладающий активностью GnT III, и по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью Man II, в условиях, которые допускают продуцирование полипептида, выбранного из группы, состоящей из целой молекулы антитела, фрагмента антитела и слитого белка, который содержит область, эквивалентную Fc-области иммуноглобулина, где указанный слитый полипептид экспрессируется в количестве, достаточном для модификации олигосахаридов в Fc-области указанного полипептида, продуцируемого клеткой-хозяином, а также выделение указанного полипептида.
В другом аспекте изобретение предусматривает способ продуцирования полипептида клеткой-хозяином, включающий культивирование клетки-хозяина, модифицированной для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид слияния, обладающий активностью GalT, и по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью Man II, в условиях, которые допускают продуцирование полипептида, выбранного из группы, состоящей из целой молекулы антитела, фрагмента антитела и слитого белка, который содержит область, эквивалентную Fc-области иммуноглобулина, где указанный полипептид слияния экспрессируется в количестве, достаточном для модификации олигосахаридов в Fc-области указанного полипептида, продуцируемого указанной клеткой-хозяином, а также выделение указанного полипептида.
В дополнительном аспекте изобретение предусматривает способ продуцирования полипептида, обладающего повышенной Fc-опосредованной клеточной цитотоксичностью, клеткой-хозяином, включающий культивирование клетки-хозяина, модифицированной для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей GalT, и по меньшей мере одной нуклеиновой кислоты, кодирующей Man II, в условиях, которые допускают продуцирование полипептида, выбранного из группы, состоящей из целой молекулы антитела, фрагмента антитела, который содержит Fc-область иммуноглобулина, где уровень экспрессии одного из ферментов GalT и Man II или их обоих достаточен для модификации олигосахаридов в Fc-области указанного полипептида, продуцируемого указанной клеткой-хозяином, и где указанный полипептид обладает, в результате указанной модификации, повышенной Fc-опосредованной клеточной цитотоксичностью.
В другом аспекте настоящее изобретение предусматривает способ продуцирования полипептида клеткой-хозяином, включающий: (а) культивирование клетки-хозяина, модифицированной для экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью альфа-маннозидазы И, в условиях, которые допускают продуцирование полипептида, выбранного из группы, состоящей из целой молекулы антитела, фрагмента антитела и белка слияния, который содержит область, эквивалентную Fc-области иммуноглобулина, где указанный полипептид, обладающий активностью альфа-маннозидазы II, экспрессируется в количестве, достаточном для модификации олигосахаридов в Fc-области указанного полипептида, продуцируемого указанной клеткой-хозяином; и (b) выделение указанного полипептида продуцируемого указанной клеткой-хозяином.
В другом аспекте изобретение предусматривает клетку-хозяина, модифицированную для экспрессии по крайней мере одной нуклеиновой кислоты, кодирующей полипептид, обладающий активностью альфа-маннозидазы II в условиях, которые допускают продуцирование полипептида, выбранного из группы, состоящей из целой молекулы антитела, фрагмента антитела и белка слияния, который содержит фрагмент, эквивалентный Fc-фрагменту иммуноглобулина, где указанный полипептид, обладающий активностью альфа-маннозидазы II, экспрессируется в количестве, достаточном для модификации олигосахаридов в Fc-фрагменте полипептида, продуцируемого клеткой-хозяином.
В еще одном аспекте настоящее изобретение предусматривает полипептиды, продуцируемые такой клеткой-хозяином, в частности - антитела, обладающие, в результате указанной модификации олигосахаридов, повышенной эффекторной функцией и/или повышенным связыванием Fc-рецептора.
Краткое описание рисунков
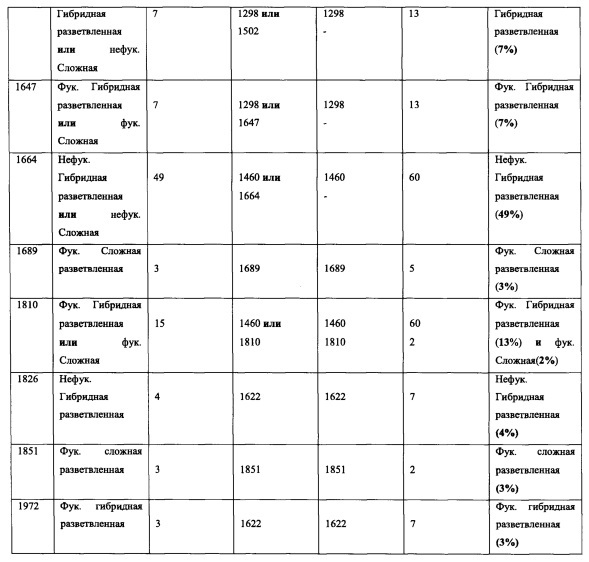
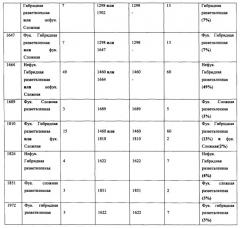
Фиг. 1: Полученный на масс-спектрометре MALDI/TOF-MS спектр смеси нейтральных олигосахаридов рекомбинантного неизмененного (негликомодифицированного) anti-CD20 антитела класса IgG1, продуцируемого клетками ВНК. Клетки были трансфецированы вектором экспрессии антитела pETR1502. Очистку антитела от культуральной среды, а также приготовление и анализ олигосахаридов проводили, как описано в разделе «Материалы и методы» Примера 1.
Фиг. 2: Полученный на масс-спектрометре MALDI/TOF-MS спектр смеси нейтральных олигосахаридов рекомбинантного гликомодифицированного анти-CD20 антитела класса IgG1, продуцируемого клетками ВНК, модифицированных нуклеиновой кислотой, кодирующей GnTIII дикого типа («wt»). Клетки были подвергнуты ко-трансфекции вектором экспрессии антитела pETR1502 и вектором экспрессии GnTIII pETR1166. Очистку антитела от культуральной среды, а также приготовление и анализ олигосахаридов проводили, как описано в разделе «Материалы и методы» примера 1.
Фиг. 3: Полученный на масс-спектрометре MALDI/TOF-MS спектр смеси нейтральных олигосахаридов рекомбинантного гликомодифицированного анти-CD20 антитела класса IgG1, продуцируемого клетками ВНК, модифицированными нуклеиновой кислотой, кодирующей полипептид слияния («Gl-GnTIII») с активностью GnTIII, содержащий функциональный отвечающий за локализацию в комплексе Гольджи домен GnTI. Клетки были подвергнуты ко-трансфекции вектором экспрессии антитела pETR1502 и вектором экспрессии GnTIII pETR1425. Очистку антитела от культуральной среды, а также приготовление и анализ олигосахаридов проводили, как описано в разделе «Материалы и методы» примера 1.
Фиг. 4: Полученный на масс-спектрометре MALDI/TOF-MS спектр смеси нейтральных олигосахаридов рекомбинантного гликомодифицированного анти-CD20 антитела класса IgG1, продуцируемого клетками ВНК, модифицированными нуклеиновой кислотой, кодирующей полипептид слияния ("M2-GnTIII") с активностью GnTIII и лсодержащий функциональный обеспечивающий локализацию в комплексе Гольджи доменмманнозидазы И. Клетки были подвергнуты ко-трансфекции вектором экспрессии антитела pETR1502 и вектором экспрессии GnTIII pETR1506. Очистку антитела от культуральной среды, а также приготовление и анализ олигосахаридов проводили, как описано в разделе «Материалы и методы» примера 1.
Фиг. 5: Полученный на масс-спектрометре MALDI/TOF-MS спектр смеси нейтральных олигосахаридов рекомбинантного неизмененного (негликомодифицированного) анти-CD20 антитела класса IgG1, продуцируемого клетками HEK293-EBNA. Клетки были трансфецированы вектором экспрессии антитела pETR1502. Очистку антитела культуральной среды, а также приготовление и анализ олигосахаридов проводили, как описано в разделе «Материалы и методы» Примера 1.
Фиг. 6: Полученный на масс-спектрометре MALDI/TOF-MS спектр смеси нейтральных олигосахаридов рекомбинантного гликомодифицированного ан