Вакцины и композиции против streptococcus pneumoniae
Иллюстрации
Показать всеИзобретения касаются вакцинных составов против Streptococcus pneumoniae и их применения. Представленные вакцинные составы содержат фармацевтически приемлемый носитель и первый полипептид, имеющий по меньшей мере 95% идентичность с аминокислотной последовательностью SEQ ID NO: 265, 266 или 268, и второй полипептид, имеющий по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 9, 10, 20, 21, 6, 7, 18 или 19. Изобретения могут быть использованы для профилактики или лечения заболеваний, вызванных S. pneumoniae. 3 н. и 55 з.п. ф-лы, 19 ил., 4 табл., 18 пр.
Реферат
Родственная заявка
Настоящая заявка испрашивает приоритет на основании даты подачи предварительной заявки на патент США №61/434818, поданной 20 января 2011 года. Полное содержание упомянутой заявки прямо включено в данный документ посредством ссылки.
Государственная поддержка
Настоящая работа была выполнена при государственной поддержке гранта AI066013, выданного Национальным Институтом Здоровья. Таким образом, правительство США обладает определенными правами на настоящее изобретение.
I. Предпосылки изобретения
Пневмококковая инфекция продолжает быть ведущей причиной заболеваемости и смертности в Соединенных Штатах и по всему миру. Ежегодно миллионы случаев пневмонии, менингита, бактериемии и среднего отита объясняются инфицированием патогенным Streptococcus pneumoniae. S.pneumoniae представляет собой грам-положительный инкапсулированный кокк, который колонизирует носоглотку у приблизительно 5-10% здоровых взрослых и 20-40% здоровых детей. Нормальная колонизация становится инфекционной, когда S.pneumoniae переносится в евстахиевы трубы, носовые синусы, легкие, кровоток, оболочки головного мозга, суставные щели, кости и брюшную полость. S.pneumoniae имеет несколько факторов вирулентности, которые позволяют этому организму обойти иммунную систему. Примеры включают полисахаридную капсулу, которая предотвращает фагоцитоз иммунными клетками хозяина, протеазы, которые подавляют комплемент-опосредованную опсонизацию, и белки, вызывающие лизис клеток хозяина. Наличие сложных полисахаридов в полисахаридной капсуле является основой для подразделения пневмококков на различные серотипы. На настоящий момент было идентифицировано 93 серотипа S.pneumoniae.
Различные фармацевтические композиции были использованы для приспособления иммунного ответа против инфицирования S.pneumoniae. Поливалентная пневмококковая вакцина PPV-23 была разработана для профилактики пневмонии и других инфекционных заболеваний, связанных с S.pneumoniae, у взрослой и пожилой групп населения. Вакцина содержит капсульные полисахариды (CP) от 23 серотипов S.pneumoniae. Будучи антигенами, независимыми от T-клеток, эти CP вызывают только кратковременное образование антител, что делает необходимым повторные дозы, которые увеличивают риск иммунологической толерантности. Антитела, индуцируемые против S.pneumoniae, названные антителами к капсуле, распознаются как защитные у взрослых и иммунокомпетентных индивидуумов. Однако у детей до 2 лет и индивидуумов с ослабленным иммунитетом, в том числе пожилых, реакция на антигены, независимые от T-клеток, не развивается, и, следовательно, PPV-23 не обеспечивает их оптимальную защиту. Другая вакцина против S.pneumoniae, Prevnar, включает бактериальные полисахариды от 7 штаммов S.pneumoniae, конъюгированные с белком дифтерийного анатоксина. Эта вакцина вызывает как B-, так и T-клеточные ответы. Однако, поскольку она защищает только от 7 серотипов пневмококков, замещение серотипа может сделать Prevnar неэффективной. Замещение серотипов уже было показано в нескольких клинических испытаниях и эпидемиологических исследованиях, что приводит к необходимости разработки отличающихся составов этих вакцин. Примером является представленный недавно Prevnar 13, направленный на 13 серотипов пневмококка. При этом, эти два состава Prevnar требуют больших затрат при производстве, что существенно ограничивает их доступность для развивающихся стран. PPV-23, которая состоит из 23 очищенных, но неконъюгированных полисахаридов, имеет более широкий охват, но не обеспечивает защиту детям до 2 лет, группе населения с наибольшим риском пневмококковой инфекции.
Таким образом, остается потребность в разработке более эффективных фармацевтических композиций, чем предлагают существующие стратегии. В частности, в такие композиции необходимо включать новые или специфичные антигены, которые вызывают иммунный ответ против S.pneumoniae.
II. Краткое описание
Streptococcus pneumoniae представляет собой основную проблему здравоохранения, особенно в отношении очень молодых, пожилых или пациентов с ослабленным иммунитетом. Хотя информация о ДНК и белковых последовательностях S.pneumoniae была известна уже некоторое время, и исследователи длительное время пытались получить вакцины против S.pneumoniae, главную проблему составляла идентификация защитных полипептидов среди приблизительно 2100 генов в геноме S.pneumoniae. Настоящая заявка представляет результаты полногеномного скрининга, разработанного для выявления наиболее иммуногенных белков в геноме S.pneumoniae. Было показано на мышиной модели, что некоторые «хиты» на основании скрининга защищают от колонизации S.pneumoniae и, в некоторых случаях, как от колонизации, так и от сепсиса, вызванного S.pneumoniae. Таким образом, настоящее раскрытие предусматривает, inter alia, определенные высокоэффективные вакцины против Streptococcus pneumoniae. Данные вакцины можно использовать терапевтически или профилактически. Настоящее раскрытие также предусматривает специфичные антигены и способы применения антигенов, чтобы вызвать иммунный ответ против S.pneumoniae.
В определенных аспектах настоящее раскрытие предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и полипептид, имеющий аминокислотную последовательность, содержащую (или состоящую из) SEQ ID NO: 265 или 268 или ее иммуногенный фрагмент. В некоторых вариантах осуществления полипептид содержит экзогенную сигнальную последовательность. Например, полипептид может иметь аминокислотную последовательность, содержащую SEQ ID NO: 266 или ее иммуногенный фрагмент. Полипептид может иметь аминокислотную последовательность, состоящую из SEQ ID NO: 265, 266 или 268.
В некоторых вариантах осуществления вакцинный состав дополнительно содержит первый полипептид, имеющий аминокислотную последовательность, содержащую (или состоящую из) одну из SEQ ID NO: 1-23, 267 и 269-270 или ее иммуногенный фрагмент. В определенных вариантах осуществления вакцинный состав дополнительно содержит второй полипептид, имеющий аминокислотную последовательность, содержащую любую из SEQ ID NO: 1-23, 267 и 269-270 или ее иммуногенный фрагмент.
В определенных вариантах осуществления первый и второй полипептиды принадлежат к различным группам (i)-(vi): (i) SEQ ID NO: 1 или ее иммуногенный фрагмент, (ii) одна из SEQ ID NO: 2-5 и 14-17 или ее иммуногенный фрагмент, (iii) одна из SEQ ID NO: 6-7 и 18-19 или ее иммуногенный фрагмент, (iv) SEQ ID NO: 8 или ее иммуногенный фрагмент, (v) одна из SEQ ID NO: 9-10 и 20-21 или ее иммуногенный фрагмент, и (vi) одна из SEQ ID NO: 11-13, 267 и 269-270 или ее иммуногенный фрагмент.
В некоторых таких вариантах осуществления вакцинный состав содержит полипептид, имеющий аминокислотную последовательность, содержащую SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 9 или SEQ ID NO: 10. В некоторых вариантах осуществления вакцинный состав содержит полипептид, состоящий из SEQ ID NO: 6 или 7, и полипептид, состоящий из SEQ ID NO: 9 или 10.
В любом из аспектов или вариантов осуществления в данном документе вакцинный состав может содержать полипептид с SEQ ID NQ: 265, 266 или 268, который представляет собой усеченный фрагмент с удалением 1-20 аминокислотных остатков с N-конца, C-конца или обоих. В некоторых вариантах осуществления вакцинный состав практически не содержит других полипептидов S.pneumoniae, кроме полипептидов, имеющих аминокислотную последовательность, содержащую любую из SEQ ID NO: 1-21 и 265-270.
В определенных вариантах осуществления вакцинный состав содержит один или несколько полипептидов, имеющих аминокислотную последовательность, содержащую SEQ ID NO: 22 или 23 или ее иммуногенный фрагмент.
В другом аспекте настоящее изобретение предусматривает вакцинные составы, содержащие известный антиген S.pneumoniae, такой как пневмолизоид, холин-связывающий белок A (CbpA) или пневмококковый поверхностный белок A (PspA), или их производные, а также один, два или три полипептида из таблицы 1 или таблицы 2. Иллюстративный вакцинный состав содержит: (i) полипептид, имеющий аминокислотную последовательность, содержащую (или состоящую из) одну или несколько из SEQ ID NO: 1-23 и 265-270 или ее иммуногенный фрагмент, (ii) пневмолизоид и (iii) фармацевтически приемлемый носитель. Дополнительный иллюстративный вакцинный состав содержит: (i) полипептид, имеющий аминокислотную последовательность, содержащую (или состоящую из) одну или несколько из SEQ ID NO: 1-23 и 265-270 или ее иммуногенный фрагмент, (ii) CbpA или его производное и (iii) фармацевтически приемлемый носитель. Дополнительный иллюстративный вакцинный состав содержит: (i) полипептид, имеющий аминокислотную последовательность, содержащую (или состоящую из) одну или несколько из SEQ ID NO: 1-23 и 265-270 или ее иммуногенный фрагмент, (ii) PspA или его производное и (iii) фармацевтически приемлемый носитель. В некоторых таких вариантах осуществления полипептид (i) содержит любую из SEQ ID NO: 2-5, 6, 7, 9-13 и 265-267. В некоторых вариантах осуществления вакцинный состав дополнительно содержит второй полипептид, имеющий аминокислотную последовательность, содержащую одну из SEQ ID NO: 1-23 и 265-270. В некоторых вариантах осуществления пневмолизоид представляет собой PdT, Pd-A, Pd-B, rPd2, rPd3, Ply8, Δ6PLY, L460D (см., например, патентный документ US 2009/0285846 и L. Mitchell, Protective Immune Responses to Streptococcus pneumoniae Pneumolysoids, ASM2011 conference abstract, 2011) или их вариант. В некоторых вариантах осуществления производное PspA содержит весь или фрагмент пролин-богатого участка PspA.
В определенных вариантах осуществления полипептид конъюгирован с иммуногенным носителем. В некоторых вариантах осуществления вакцинный состав содержит по меньшей мере один липидированный полипептид.
В некоторых вариантах осуществления вакцинный состав дополнительно содержит конъюгированные полисахариды S.pneumoniae. Конъюгированные полисахариды могут представлять собой, например, описываемые в патенте США №5623057, патенте США №5371197 или в патентном документе PCT/US 2011/023526.
В некоторых вариантах осуществления вакцинный состав дополнительно содержит адъювант. Адъювант может представлять собой, например, агонист толл-подобных рецепторов (TLR). Адъювант может представлять собой, например, квасцы. В некоторых вариантах осуществления вакцинный состав содержит 1-1000 мкг каждого полипептида и 1-250 мкг адъюванта.
В определенных вариантах осуществления вакцинный состав вызывает ТН17-клеточный ответ по меньшей мере в 1,5 раза больший, чем вызванный контрольным неродственным антигеном после контакта с ТН17-клетками. В некоторых вариантах осуществления вакцинный состав подавляет инфицирование S.pneumoniae у неинфицированного субъекта. В определенных вариантах осуществления вакцинный состав подавляет колонизацию S.pneumoniae у индивидуума. В некоторых вариантах осуществления вакцинный состав подавляет симптомы или осложнения, вызванные S.pneumoniae. Например, вакцинный состав подавляет сепсис, вызванный S.pneumoniae.
В определенных аспектах настоящее раскрытие предусматривает способ лечения субъекта, страдающего от инфекции S.pneumoniae или восприимчивого к ней, включающий введение эффективного количества любого из вакцинных составов, описанных в данном документе.
В некоторых вариантах осуществления при помощи способа препятствуют инфицированию S.pneumoniae неинфицированного субъекта. В некоторых вариантах осуществления при помощи способа подавляют колонизацию S.pneumoniae у субъекта. В некоторых вариантах осуществления при помощи способа подавляют симптомы или осложнения, вызванные S.pneumoniae. Иллюстративным осложнением является сепсис.
В определенных вариантах осуществления способа субъекта лечат одной дозой. В других вариантах осуществления способа субъекта лечат двумя или тремя дозами. В некоторых вариантах осуществления способа субъекта лечат тремя дозами.
В определенных вариантах осуществления субъект является человеком.
Настоящее раскрытие предусматривает, например, вакцинный состав, содержащий фармацевтически приемлемый носитель и один или несколько полипептидов, имеющих аминокислотную последовательность, содержащую любую из SEQ ID NO: 1-13, 265, 266 и 267 или ее иммуногенный фрагмент.
Настоящее раскрытие также предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и по меньшей мере один полипептид, имеющий аминокислотную последовательность, содержащую SEQ ID NO: 6, SEQ ID NO: 10 или SEQ ID NO: 265 или ее иммуногенный фрагмент. Настоящее раскрытие дополнительно предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и по меньшей мере один полипептид, имеющий аминокислотную последовательность, состоящую из SEQ ID NO: 7, SEQ ID NO: 9 или SEQ ID NO: 265 или ее иммуногенный фрагмент.
Кроме того, настоящая заявка предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и один или несколько полипептидов, имеющих аминокислотную последовательность, содержащую любую из SEQ ID NO: 14-23, 268, 269 и 270 или ее иммуногенный фрагмент.
Настоящее раскрытие дополнительно предусматривает иммуногенную композицию, содержащую фармацевтически приемлемый носитель и два или более полипептида, имеющих аминокислотные последовательности, содержащие любую из SEQ ID NO: 1-13, 265, 266 и 267 или ее иммуногенный фрагмент.
Настоящее раскрытие также предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и два или более полипептида, имеющих аминокислотные последовательности, содержащие SEQ ID NO: 6, SEQ ID NO: 10 или SEQ ID NO: 265 или ее иммуногенный фрагмент. Настоящее раскрытие дополнительно предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и два или более полипептида, имеющих аминокислотные последовательности, состоящие из SEQ ID NO: 7, SEQ ID NO: 9 или SEQ ID NO: 265 или их иммуногенного фрагмента. Настоящее раскрытие также предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и два или более полипептида, имеющих аминокислотные последовательности, содержащие SEQ ID NO: 6, SEQ ID NO: 9 и SEQ ID NO: 265 или ее иммуногенный фрагмент. Кроме того, настоящее раскрытие предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и два или более полипептида, имеющих аминокислотные последовательности, содержащие SEQ ID NO: 7, SEQ ID NO: 10 и SEQ ID NO: 265 или ее иммуногенный фрагмент. В некоторых вариантах осуществления аминокислотная последовательность, содержащая SEQ ID NO: 265, содержит экзогенную сигнальную последовательность.
Настоящее раскрытие также предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и три или более полипептида, имеющих аминокислотные последовательности, содержащие SEQ ID NO: 6, SEQ ID NO: 10 и SEQ ID NO: 265, соответственно, или ее иммуногенный фрагмент. Настоящее раскрытие дополнительно предусматривает вакцинный состав, содержащий фармацевтически приемлемый носитель и три или более полипептида, имеющих аминокислотные последовательности, состоящие из SEQ ID NO: 7, SEQ ID NO: 9 и SEQ ID NO: 265, соответственно, или их иммуногенного фрагмента.
III. Краткое описание графических материалов
На ФИГ.1 показана концентрация IL-17 на основании образцов крови от мышей, которых иммунизировали указанным белком(ами) и адъювантом, холерным энтеротоксином, которые затем стимулировали убитыми неинкапсулированными цельноклеточными S.pneumoniae, как описано в примере 5. На левой панели показаны данные в формате диаграммы рассеивания, а на правой панели показано среднее арифметическое и стандартное отклонение для каждого образца. Группа иммунизации "All 3" представляет животных, иммунизированных комбинацией SP2108, SP0148 и SP1634.
На ФИГ.2 показана концентрация IL-17 на основании образцов крови от мышей, которых иммунизировали указанным белком(ами) и адъювантом, холерным энтеротоксином, которые затем стимулировали комбинацией трех белков (SP2108, SP0148 и SP1634), как описано в примере 5.
На ФИГ.3 показано число колоний S.pneumoniae, полученных из носового смыва у мышей, которых иммунизировали указанным белком(ами) и адъювантом, холерным энтеротоксином, затем проводили их контрольное заражение путем интраназального введения S.pneumoniae, как описано в примере 5. 003 представляет собой контрольный неродственный антиген.
На ФИГ.4 показана концентрация IL-17 на основании образцов крови от мышей, которых иммунизировали указанным белком(ами) и адъювантом, холерным энтеротоксином, которые затем стимулировали убитыми неинкапсулированными цельноклеточными S.pneumoniae, как описано в примере 6.
На ФИГ.5 показана концентрация IL-17 на основании образцов крови от мышей, которых иммунизировали указанным белком(ами) и адъювантом, холерным энтеротоксином, которые затем стимулировали указанным белком(ами), как описано в примере 6.
На ФИГ.6 показано количество колоний S.pneumoniae, полученных из носового смыва у мышей, которых иммунизировали указанным белком(ами) и адъювантом, холерным энтеротоксином, затем проводили их контрольное заражение посредством интраназального введения S.pneumoniae, как описано в примере 6. Белок ICP47 от HSV-2 с названием гена US 12 (NP_044543.1, NC_001798.1; показан на фигуре как 003) и овальбумин (OVA) представляют собой контрольные антигены.
На ФИГ.7 показано число колоний S.pneumoniae, полученных из носового смыва у мышей, которых иммунизировали указанным белком(ами) и адъювантом, холерным энтеротоксином, затем проводили их контрольное заражение путем интраназального введения S.pneumoniae, как описано в примере 7.
На ФИГ.8 показано число колоний S.pneumoniae, полученных из носового смыва у мышей BALB/c, которых иммунизировали указанным белком(ами) и адъювантом, холерным энтеротоксином, затем проводили их контрольное заражение путем интраназального введения S.pneumoniae, как описано в примере 8.
На ФИГ.9 показана концентрация IL-17A на основании образцов крови от мышей, которых иммунизировали указанными белками и адъювантом, холерным энтеротоксином, которые затем стимулировали белком иммунизации (левая панель) или убитыми неинкапсулированными цельноклеточными S.pneumoniae (правая панель), как описано в примере 9.
На ФИГ 10. показано число колоний S.pneumoniae, полученных из носового смыва у мышей, которых иммунизировали указанными белками и адъювантом, холерным энтеротоксином, затем проводили их контрольное заражение путем интраназального введения S.pneumoniae, как описано в примере 10.
На ФИГ.11 показана выживаемость мышей, которых иммунизировали указанными белками и адъювантом, квасцами, затем подвергли аспирационному контрольному заражению S.pneumoniae, как описано в примере 11.
На ФИГ.12 показана выживаемость мышей, которых иммунизировали указанными белками и адъювантом, квасцами, затем подвергли аспирационному контрольному заражению S.pneumoniae, как описано в примере 12.
На ФИГ.13 показано число колоний S.pneumoniae, полученных из носового смыва у мышей, которых иммунизировали указанными белками и адъювантом, холерным энтеротоксином, затем проводили их контрольное заражение путем интраназального введения S.pneumoniae, как описано в примере 13.
На ФИГ.14 показана концентрация IL-17A на основании образцов крови от мышей, которых иммунизировали указанными белками и квасцами, которые затем стимулировали белками, указанными вверху слева, как описано в примере 14.
На ФИГ.15 показано число колоний S.pneumoniae, полученных из носового смыва у мышей, которых иммунизировали указанными белками и квасцами или убитыми неинкапсулированными цельноклеточными S.pneumoniae плюс квасцы (WCV), затем проводили контрольное заражение путем интраназального введения S.pneumoniae, как описано в примере 15.
На ФИГ.16 показано число колоний S.pneumoniae, полученных из носового смыва у мышей, которых иммунизировали указанными белками и квасцами или убитыми неинкапсулированными цельноклеточными S.pneumoniae плюс квасцы (WCV), затем проводили их контрольное заражение путем интраназального введения S.pneumoniae в двух объединенных исследованиях, как описано в примере 16.
На ФИГ.17 показано число колоний S.pneumoniae, полученных из носового смыва у мышей, которых иммунизировали указанными белками и квасцами или убитыми неинкапсулированными цельноклеточными S.pneumoniae плюс квасцы (WCB), затем проводили их контрольное заражение путем интраназального введения S.pneumoniae, как описано в примере 17.
На ФИГ.18 показана выживаемость мышей, которым инъецировали антитела или сыворотки, специфичные к указанным белкам, затем их подвергали аспирационному контрольному заражению S.pneumoniae, как описано в примере 18.
На ФИГ.19 показан процент животных, защищенных от сепсиса в шести отдельных исследованиях аспирационного контрольного заражения, два из которых описаны более подробно в примерах 12 и 18.
IV. Подробное описание
A. Специфичные полипептиды и нуклеиновые кислоты для применения в вакцинах и иммуногенных композициях против S.pneumoniae
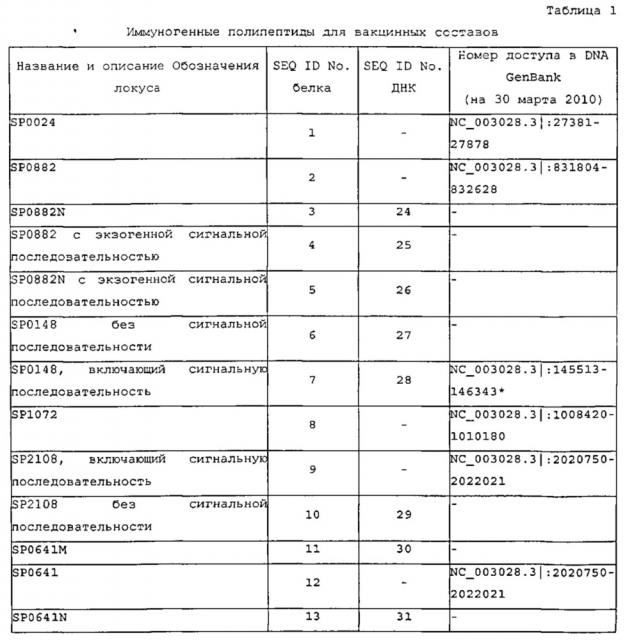
Настоящая заявка описывает вакцины против S.pneumoniae, которые включают один или несколько полипептидов или генов, перечисленных в таблице 1, или их варианты или фрагменты, как описано ниже. Вакцина может включать полипептид, который содержит последовательность из таблицы 1 или ее вариант или иммуногенный фрагмент, или полипептид, который состоит из последовательности из таблицы 1 или ее варианта или иммуногенного фрагмента. Последовательность ДНК и белка для каждого гена и полипептида можно найти с помощью поиска по Обозначению локуса в находящейся в свободном доступе базе данных Entrez Gene (на веб-сайте NCBI NIH во Всемирной паутине, www.ncbi.nlm.nih.gov/sites/entrez?db=gene), в геноме Streptococcus pneumoniae TIGR4, и указанные последовательности также включены в настоящую заявку.
Определенные полипептиды из таблицы 1 и их варианты описываются подробнее ниже.
1. SP1912 (SEQ ID NO: 265) и ее варианты
SP1912 представляет собой гипотетический белок из 99 аминокислот. Хотя функция белка окончательно не установлена, анализ последовательности позволяет предположить, что это предполагаемый тиоредоксин.
В некоторых вариантах осуществления вакцины или фармацевтические композиции, содержащие полипептид S.pneumoniae, содержат полипептид, содержащий по меньшей мере 20 последовательных аминокислотных остатков, выбранных из SP1912. Полипептид также может представлять собой вариант фрагмента по меньшей мере из 20 остатков. В определенных вариантах осуществления полипептид включает не более 90, 75, 60, 45 или 30 последовательных аминокислот из SP1912.
В некоторых вариантах осуществления композиции и способы в данном документе предусматривают применение варианта SP1912, который содержит экзогенную последовательность для липидизации. В некоторых вариантах осуществления липидизацией управляет сигнальная последовательность. Таким образом, сигнальная последовательность для липидизации может представлять собой, например, сигнальную последовательностью из SP2108 (SEQ ID NO: 275) или SP0148, или сигнальную последовательностью Е.coli. Иллюстративный вариант SP1912L, содержащий сигнальную последовательность гена RlpB Е.coli (SEQ ID NO: 276), представлен полипептидной последовательностью SEQ ID NO: 266. SP1912 (SEQ ID NO: 265) и SP1912L (SEQ ID NO: 266) могут кодироваться, соответственно, нуклеиновыми кислотами согласно SEQ ID NO: 271 и 272, хотя, вследствие вырожденности генетического кода, могут использоваться другие последовательности ДНК (включая кодон-оптимизированные последовательности).
Консенсусные последовательности, иллюстрирующие комбинации последовательностей SP1912 от различных серотипов, представлены как SEQ ID NO: 268. Таким образом, в определенных вариантах осуществления вакцинный состав содержит полипептид, имеющий аминокислотную последовательность, содержащую или состоящую из SEQ ID NO: 268 или ее иммуногенного фрагмента (например, вместо полипептида, имеющего аминокислотную последовательность, содержащую SEQ ID NO: 265).
2. SP0024 (SEQ ID NO: 1) и ее варианты
SP0024 представляет собой гипотетический белок из 165 аминокислот, содержащий консервативный домен карбоангидразы, который тянется от аминокислоты 27 до аминокислоты 163. Исходя из этого консенсусного мотива, SP0024 может представлять собой цинк-связывающий белок.
В некоторых вариантах осуществления вакцины или фармацевтические композиции, содержащие полипептид S.pneumoniae, содержат полипептид, содержащий по меньшей мере 20 последовательных аминокислотных остатков, выбранных из SP0024. Полипептид также может представлять собой вариант фрагмента по меньшей мере из 20 остатков. В определенных вариантах осуществления полипептид включает не более 150, 125 или 100 последовательных аминокислот из SP0024.
3. SP0882 (SEQ ID NO: 2) и ее варианты
SP0882 представляет собой консервативный гипотетический белок из 274 аминокислот. Большая часть белка (аминокислоты 2-270) образует эстеразо- или липазоподобный участок.
В некоторых вариантах осуществления вакцины или фармацевтические композиции, содержащие полипептид S.pneumoniae, содержат полипептид, содержащий по меньшей мере, 20 последовательных аминокислотных остатков, выбранных из SP0882. Полипептид также может представлять собой вариант фрагмента по меньшей мере из 20 остатков. В определенных вариантах осуществления полипептид включает не более 250, 275, 200, 175, 150, 125 или 100 последовательных аминокислот из SP0882.
Один конкретный усеченный вариант, названный SP0882N, состоит из 130 аминокислот N-конца SP0882 и показан как SEQ ID NO: 3. SP0882N включает участок, который чрезвычайно консервативен среди различных серотипов. В определенных вариантах осуществления полипептид, содержащий SP0882 или SP0882N или иммуногенный фрагмент любой из них, также содержит экзогенную сигнальную последовательность. В некоторых вариантах осуществления сигнальная последовательность является сигнальной последовательностью Е.coli или S.pneumoniae. Сигнальная последовательность может представлять собой, например, сигнальную последовательность из SP2108. Двумя примерами таких полипептидов являются SEQ ID NO: 4 и 5.
Варианты последовательностей ДНК и белка для SP0882 описаны, inter alia, в публикации заявки на патент США №2009/0215149 и в международных заявках WO 2002/077021, WO 98/18931 и WO 2007/106407. Вариант SP0882N раскрывается в международной заявке WO 2008/146164.
Между различными серотипами S.pneumoniae существует изменчивость последовательности на уровне белка, и консенсусные последовательности, иллюстрирующие комбинации последовательностей SP0882 от различных серотипов S.pneumoniae, представлены как SEQ ID NO: 14-17. В соответствии с этим, в определенных вариантах осуществления вакцинный состав содержит полипептид, имеющий аминокислотную последовательность, содержащую или состоящую из любой из SEQ ID NO: 14-17 или их иммуногенного фрагмента (например, вместо полипептида, имеющего аминокислотную последовательность, содержащую одну из SEQ ID NO: 2-5).
Последовательности нуклеиновых кислот, кодирующие различные варианты SP0882 (SEQ ID NO: 2-5), представлены как SEQ ID NO: 24-26, хотя из-за вырожденности генетического кода другие последовательности ДНК (включая кодон-оптимизированные последовательности) могут кодировать эти полипептиды.
4. SP0148 (SEQ ID NO: 7) и ее варианты
Белок SP0148 называется "ABC-транспортер, субстрат-связывающий белок". Белки этого класса, как правило, являются внеклеточными белками, которые временно взаимодействуют с трансмембранным белковым комплексом. Такие комплексы используют энергию, вырабатываемую при гидролизе АТФ, для перемещения специфических субстратов через клеточную мембрану. SP0148 представляет собой белок из 276 или 277 (в зависимости от изолята) аминокислот, который содержит консервативный домен PBPb (периплазматический связывающий белок), охватывающий аминокислоты 40-246 и типичный для мембраносвязанных транспортных комплексов. Кроме того, SP0148 содержит домен бактериальных внеклеточных белков, связывающих растворенное вещество, семейства 3, который в значительной степени совпадает с доменом PBPb и продолжается от аминокислоты 40 до 244. В некоторых вариантах осуществления вакцина или другая композиция содержит усеченный мутант SP0148, содержащий или не содержащий один или нескольких из указанных доменов и мотивов.
В некоторых вариантах осуществления вакцины или фармацевтические композиции, содержащие полипептид S.pneumoniae, содержат полипептид, содержащий по меньшей мере 20 последовательных аминокислотных остатков, выбранных из SP0148. Полипептид также может представлять собой вариант фрагмента по меньшей мере из 20 остатков. В определенных вариантах осуществления полипептид включает не более 250, 275, 200, 175, 150, 125 или 100 последовательных аминокислот из SP0148.
Эндогенный SP0148 содержит сигнальную последовательность, которая управляет его секрецией и потенциальной липидизацией. В некоторых вариантах осуществления сигнальная последовательность полипептида SEQ ID NO: 7 частично или полностью подвергается процессингу в экспрессирующем хозяине, например, Е.coli. В некоторых вариантах осуществления используется вариант SP0148, который не имеет сигнальной последовательности (SEQ ID NO: 6). Полипептид SEQ ID NO: 6 кодируется нуклеиновой кислотой SEQ ID NO: 27, хотя могут использоваться другие последовательности нуклеиновых кислот (включая кодон-оптимизированные последовательности). SEQ ID NO: 28 кодирует последовательность SP0148 полной длины, использованную в скринингах в данном документе.
Варианты аминокислотной последовательности и нуклеотидной последовательности SP0148 можно найти в публикации заявки на патент США №2005/0020813, патентах США №№7378514 и 7504110, и в заявках на европейский патент №№ EP 1572868 и EP 1855717.
Консенсусные последовательности, иллюстрирующие комбинации последовательностей SP0148 от различных серотипов S.pneumoniae, представлены как SEQ ID NO: 18 и 19. В соответствии с этим, в определенных вариантах осуществления вакцинный состав содержит полипептид, имеющий аминокислотную последовательность, содержащую или состоящую либо из SEQ ID NO: 18-19, либо из их иммуногенного фрагмента (например, вместо полипептида, имеющего аминокислотную последовательность, содержащую одну из SEQ ID NO: 6 или 7).
5. SP1072 (SEQ ID NO: 8) и ее варианты
SP1072, также известный как dnaG, представляет собой фермент ДНК-праймазу, катализирующий образование РНК-праймера, дающего возможность ДНК-полимеразе инициировать репликацию ДНК. SP1072, белок из 586 аминокислот, содержит несколько консервативных мотивов. Начиная от N-конца, аминокислоты 2-96 формируют домен «цинковый палец», каталитическое ядро ДНК-праймазы охватывает аминокислоты 122-250 и высоко консервативный участок нуклеотидилтрансферазного/гидролазного домена топоизомеразы-праймазы (TORPIM) продолжается от аминокислоты 258 до 330. В некоторых вариантах осуществления вакцина или другая композиция содержит усеченный мутант SP1072, содержащий или не содержащий одного или нескольких из указанных доменов и мотивов.
В некоторых вариантах осуществления вакцины или фармацевтические композиции, содержащие полипептид S.pneumoniae, содержат полипептид, содержащий по меньшей мере 20 последовательных аминокислотных остатков, выбранных из SP1072. Полипептид также может представлять собой вариант фрагмента по меньшей мере из 20 остатков. В определенных вариантах осуществления полипептид включает не более 550, 500, 450, 400, 350, 300, 250, 200, 150 или 100 последовательных аминокислот из SP1072.
6. SP2108 (SEQ ID NO: 9) и ее варианты
Полипептид SP2108 имеет длину 423 аминокислоты и альтернативно известен как MalX, ABC-транспортер мальтозы/мальтодекстрина, или мальтоза/мальтодекстрин-связывающий белок. Большая часть этого белка (аминокислоты 3-423) классифицируется как домен MalE (мальтоза-связывающий периплазматический). Кроме того, SP2108 содержит сигнальную последовательность, которая управляет его секрецией и потенциальной липидизацией. В некоторых вариантах осуществления сигнальная последовательность полипептида SEQ ID NO: 9 частично или полностью подвергается процессингу в экспрессирующем хозяине, например, Е.coli. В некоторых вариантах осуществления вакцина или другая композиция содержит усеченный мутант SP2108, содержащий один или несколько из указанных доменов и мотивов.
В некоторых вариантах осуществления композиции и способы в данном документе предусматривают применение варианта SP2108, который не имеет сигнальной последовательности. Этот вариант представлен полипептидной последовательностью SEQ ID NO: 10 и может кодироваться, например, нуклеиновой кислотой согласно SEQ ID NO: 29, хотя из-за вырожденности генетического кода могут использоваться другие последовательности ДНК (включая кодон-оптимизированные последовательности).
В некоторых вариантах осуществления вакцины или фармацевтические композиции, содержащие полипептид S.pneumoniae, содержат полипептид, содержащий по меньшей мере 20 последовательных аминокислотных остатков, выбранных из SP2108. Полипептид также может представлять собой вариант фрагмента по меньшей мере из 20 остатков. В определенных вариантах осуществления полипептид включает не более 400, 350, 300, 250, 200, 150 или 100 последовательных аминокислот из SP2108.
Консенсусные последовательности, иллюстрирующие комбинации последовательностей SP2108 от различных серотипов S.pneumoniae, представлены как SEQ ID NO: 20 и 21. Таким образом, в определенных вариантах осуществления вакцинный состав содержит полипептид, имеющий аминокислотную последовательность, содержащую или состоящую либо из SEQ ID NO: 20-21, либо из их иммуногенного фрагмента (например, вместо полипептида, имеющего аминокислотную последовательность, содержащую одну из SEQ ID NO: 9 или 10).
7. SP0641 (SEQ ID NO: 12) и ее варианты
SP0641, длиной в 2144 аминокислоты, также известен как PrtA, сериновая протеаза, связанная с клеточной стенкой. SP0641 полной длины содержит ряд консервативных мотивов: мотив PA_2, продолжающийся от аминокислоты 485 до 597, который может формировать белок-связывающую поверхность; Fn3-подобный домен (аминокислоты 800-939) и два прогнозированных каталитических домена типа S8 C5a, расположенных на аминокислотах 226-449 и 639-777. В некоторых вариантах осуществления вакцина или другая композиция содержит усеченный мутант SP0641, содержащий или не содержащий одного или нескольких из указанных доменов и мотивов.
В некоторых вариантах осуществления вакцины или фармацевтические композиции, содержащие полипептид S.pneumoniae, содержат полипептид, содержащий по меньшей мере 20 последовательных аминокислотных остатков, выбранных из SP0641. Полипептид также может представлять собой вариант фрагмента по меньшей мере из 20 остатков. В определенных вариантах осуществления полипептид включает не более 1000, 900, 800, 700, 600, 500, 400, 300, 200 или 100 последовательных аминокислот из SP0641.
Также могут использоваться некоторые другие усеченные мутанты SP0641. Например, полипептид, обозначенный SP0641N (SEQ ID NO: 13), состоит из 661 аминокислоты, что соответствует аминокислотам 24-684 в районе N-конца SP0641. Почти рядом с SP0641N (и что соответствует аминокислотам 686-1333 из SP0641) располагается участок из 648 остатков, занятый усеченным вариантом SP0641M (SEQ ID NO: 11). Полипептид, обозначенный SP0641.1 (SEQ ID NO: 267), состоит из 978 аминокислот, соответствующих аминокислотам 28-1006 из SP0641.
Варианты SP0641 раскрываются, например, в патентах США №№7338786, 6573082 и 7132107, а также в международной заявке WO 00/06738.
SEQ ID NO: 30, 31 и 273 представляют последовательности ДНК SP0641M (SEQ ID NO: 11), SP0641N (SEQ ID NO: 13) и SP641.1 (SEQ ID NO: 267), соответственно, хотя из-за вырожденности генетического кода эти варианты SP0641 могут кодироваться другими последовательностями ДНК (включая кодон-оптимизированные последовательности).
Консенсусные последовательности, иллюстрирующие комбинации последовательностей SP0641N и SP0641M от различных серотипов S.pneumoniae, представлены как SEQ ID NO: 269 и 270. В соответствии с этим, в определенных вариантах осуществления вакцинный состав содержит полипептид, имеющий аминокислотную последовательность, содержащую или состоящую либо из SEQ ID NO: 269 или 270, либо из их иммуногенного фрагмента (например, вместо полипептида, имеющего аминокислотную последовательность, содержащую одну из SEQ ID NO: 11 или 13).
Полипептиды, гомологичные полипептидам из таблицы 1 и 2 (например, SP1912, SP1912L, SP0024, SP0882, SP0882N, SP0148 с сигнальной последовательностью или без нее, SP1072, SP2108 с сигнальной последовательностью или без нее, SP0641, SP0641M, SP0641N или SP0641.1) также могут использоваться в композициях и способах, раскрытых в данном документе. Индивидуальные штаммы S.pneumoniae содержат многочисленные мутации относительно друг друга, и некоторые из них приводят в результате к отличающимся белковым последовательностям у различных штаммов. Специалист в данной области техники сможет легко заменить аминокислотную последовательность или ее часть гомологичной аминокислотной последовательностью от отличающегося штамма S.pneumoniae. В определенных аспектах настоящая заявка предусматривает иммуногенные полипептиды по меньшей мере с 90%, 95%, 97%, 98%, 99% или 99,5% идентичностью с полипептидами из таблиц 1 и 2 или их иммуногенным фрагментом. Сероти