Способ диагностики крови на наличие паразитарных заболеваний по изменению лейкограммы после ультразвукового воздействия
Иллюстрации
Показать всеИзобретение относится к диагностике, а именно к способу диагностики крови на наличие паразитарных заболеваний по изменению лейкограммы после ультразвукового воздействия, включающему: воздействие на образцы крови, помещенные в термостатируемую кювету, бегущей модулированной ультразвуковой волной; обработку образцов крови в абсолютно одинаковых условиях; поддержание постоянной температуры образцов в кюветах с проточным охлаждением и анализ морфологического состояния клеток методами световой микроскопии; при начале гемолиза эритроцитов через 18-30 с, уменьшении количества лимфоцитов в 1,7-3,5 раза, а сегментоядерных нейтрофилов в 1,5-4,0 раза, деформации и разрушении ядер и изменении структуры цитоплазмы, ее вакуолизации, а также при ядерном сдвиге влево диагностируют наличие паразитарного заболевания. Вышеописанный способ позволяет быстро и эффективно диагностировать наличие паразитарных заболеваний. 11 ил., 1 табл.
Реферат
Изобретение относится к ветеринарии и медицине и может использоваться при неинвазивном исследовании крови животных с помощью ультразвуковых волн.
Бабезиоз собак - протозойная природно-очаговая трансмиссивная болезнь, вызываемая простейшими отряда Piroplasmida, семейства Babesiidae, рода Babesia, протекающая сверхостро, остро и хронически. Заболевание широко распространено по всему миру и широта распространения определяется ареалом обитания иксодовых клещей, передающих заболевание через укус [1, 2, 3]. Род Babesia включает в себя большое количество видов. Для собак наиболее опасны: Babesia canis и менее распространенная в средней полосе России Babesia gibsoni. Бабезии являются внутриклеточными паразитами, поражающими эритроциты, иногда нейтрофилы. Возбудители внутри клеток имеют грушевидную, овальную или округлю форму и располагаются преимущественно попарно, но могут быть и одиночные бабезии в эритроцитах. Рамер Babesia canis составляет 3-5 мкм, Babesia gibsoni значительно меньше. У заболевания наблюдается сезонность, что в свою очередь, связано с циклом развития иксодового клеща [4, 5, 6,].
В последние 10 лет выявлена связь тяжести течения заболевания собак бабезиозом с формой, размером, расположением и количеством бабезий в клетках крови (эритроците, нейтрофиле) и плазме периферической крови. Не выявлено породной, половой и возрастной предрасположенности к бабезиозу [2, 4, 6-8]. Бабезии при лабораторном исследовании крови обнаруживают микроскопией окрашенных мазков по Романовскому-Гимзе [1, 6].
Дирофиляриоз - гельминтозное заболевание, вызываемое нематодами отряда Spirurida подотряда Filariata семейства Filariidae рода Dirofilaria. На территории Российской федерации распространены в основном D. immitis, половозрелая особь которой паразитирует в легочных артериях и сердце, вызывая сердечно-легочную форму заболевания; и D. repens, живущая в подкожной клетчатке и мышцах хозяина, вызывая кожную форму болезни. Длина взрослых особей доходит до 30-40 см. Дефинитивным хозяином для дирофилярий чаще всего бывают домашние собаки и другие псовые, также заболевание регистрируется и у представителей семейства кошачьих. Промежуточный хозяин - комары семейства Culicidae (роды Aedes, Culex, Anopheles) [9-11].
Кроме собак кровопаразитарным заболеваниям подвержены лошади и кошки. У лошадей встречается нутталиоз, вызываемый Nuttalliaequi из семейства Piroplasmatidae, и пироплазмоз, вызываемый Piroplasmacaballi из семейства Babesiidae. У кошек может быть диагностирован гемобартонеллез, вызываемый микоплазмами Mycoplasma haemofelis и Mycoplasma haemominutum. При диагностике гемобартонеллеза кошек микроскопия затруднена в связи с очень маленьким размером паразита. Дирофиляриоз у кошек вызывается теми же возбудителями, что и у собак.
Для постановки диагноза паразитарных заболеваний чаще всего используют методы непосредственной визуализации возбудителя, его яиц или личинок, реже - аллергические пробы, ПЦР диагностика.
При диагностике гельминтозов распространены следующее методы: гельминтоскопия, гельминтоовоскопия, гельминтолярвоскопия, а также внутрикожные пробы (эхинококкоз).
Для диагностики арахноэнтомозов используют непосредственную визуализацию паразита на теле животного или микроскопию соскоба кожи. Диагностика протозоозов сводится к исследованию нативного мазка смыва из прямой кишки, глаза или окрашенного мазка крови.
При локализации возбудителя инвазии в ЖКТ, мышцах, на коже при исследовании анализа крови общеклиническим методом также могут быть выявлены косвенные признаки, такие как анемия у молодых животных, эозинофилия. В случае, когда паразитирование происходит в клетках крови, анемия является непосредственным следствием патологического процесса [12].
Известен способ диагностики различных заболеваний, связанный с оценкой механической резистентности эритроцитов с использованием ультразвукового воздействия на суспензию эритроцитов (ультразвуковой гемолиз эритроцитов). Этот способ применяется для оценки патологических состояний организма по появлению на эритрограммах участков с высокоустойчивыми и низкоустойчивыми эритроцитами при различных патологиях. Недостатком данного способа является оценка состояния по одному виду клеток [13].
Известны также способы неинвазивного диагностического исследования, в которых широко применяются методы ультразвуковой диагностики, отражающие структурные изменения в исследуемых тканях животных и человека. Недостатками этих способов является разрешающая способность систем диагностики, ограниченная минимальной длиной волны, применяемой в аппаратуре.
Вопросам функционального изменения нормальных и патологически измененных клеток под действием ультразвука для использования этих изменений в качестве диагностического критерия уделено недостаточно внимания. Степень выраженности данных изменений зависит от типа излучателя, несущей частоты, интенсивности УЗ воздействия, времени воздействия.
Прототипом предлагаемого изобретения, наиболее близким ему по совокупности существенных признаков, является способ получения культуры клеток животных (SU 1597387 A1, опубл. 07.10.1990) при помощи воздействия на клетки ультразвуком с частотой 880 кГц и интенсивностью 0,02-0,08 Вт/см2 в течение 5-30 с с целью увеличения прироста клеточной массы.
Недостатком данного прототипа является невозможность проведения анализа функционального состояния всех типов клеток из-за последовательного воздействия ультразвука на разные типы клеток, находящиеся в питательных средах. При этом существенными отличиями заявленного изобретения от указанного аналога являются: обработка проб бегущей, а не стоячей акустической волной, импульсно модулированным, а не непрерывным УЗ, иная интенсивность применяемого УЗ, увеличение экспозиции и назначение способа не для получения большего количества клеток, а для избирательного и направленного воздействия на клетки и клеточные структуры только больных или инвазированных животных.
В заявленном способе проводится более глубокая и быстрая диагностика состояния клеток крови.
Целью предлагаемого изобретения является определение процентного соотношения клеток крови и их морфологических особенностей при оптимальных условиях воздействия импульсно модулированным УЗ терапевтической интенсивности, несущей частоты 880 кГц на живую систему in vitro, приводящих к изменению лейкограммы, которая является основой для определения состояния здоровья животного.
Поставленная цель осуществляется путем нахождения оптимальных условий ультразвукового воздействия, приводящего к изменению лейкограммы больных животных, избирательному разрушению клеточных структур у животных с интенсивностью инвазий разной степени тяжести и сохранению у здоровых животных клеток крови и лейкограммы в целом.
Показано, что в большинстве случаев получаемые эффекты воспроизводимы на практически всех тестируемых объектах. Результаты демонстрируют возможности и направления использования подобных методик в ветеринарной медицине.
Задачей заявляемого изобретения является создание способа экспресс-диагностики наличия/отсутствия паразитарных заболеваний в крови при помощи определения цитологических изменений в мазках крови и особенностей клеточного ответа на действие акустических (УЗ) волн терапевтической интенсивности in vitro. Выявление закономерностей взаимодействия клеток крови инвазированных и здоровых животных с УЗ безопасного диапазона: минимальной терапевтической интенсивности и предельно низкого времени экспозиции. Способ позволяет регистрировать ухудшение гематологических показателей и строения клеток крови животных с паразитемией при моноинвазиях и при смешанных инвазиях, а следовательно, диагностировать наличие или отсутствие заболевания по изменению лейкограммы, вызванному действием ультразвука определенных интенсивности и частот на клетки крови.
Указанная задача осуществляется тем, что на образцы крови объемом от 1 мл до 1,5 мл, помещенные в кювету, воздействуют бегущей импульсно модулированной УЗ волной с несущей частотой 880 кГц, диапазонами частот модуляции 10-20 Гц или 800-1000 Гц, интенсивностью 0,4 Вт/см2 с экспозицией воздействия на кровь животных от 10-30 с. Образцы крови обрабатывают в абсолютно одинаковых условиях, поддерживают постоянную температуру образцов в кюветах с проточным охлаждением, а также проводят анализ морфологического состояния клеток методами световой микроскопии. При начале гемолиза эритроцитов через 18-30 с, значительном уменьшении количества лимфоцитов и гранулоцитов, деформации и разрушении ядер и изменении структуры цитоплазмы, ее вакуолизации, а также при ядерном сдвиге лейкограммы влево диагностируют наличие паразитарного заболевания.
УЗ воздействие производится одновременно на все типы клеток крови различных животных, находящиеся в одинаковой среде культивирования. Это позволяет наблюдать наличие сдвига в лейкограмме, а также изменения вида лейкоцитов, эритроцитов и тромбоцитов здоровых и инвазированных животных и по этим изменениям прогнозировать состояние здоровья животных. Таким образом, предлагаемый нами способ позволяет получить объективную, многокомпонентную, важную и достоверную информацию для диагностики.
Техническим результатом заявленного изобретения является:
1) повышение надежности диагностики наличия заболевания на начальной стадии, когда клиническая картина еще не выражена, и лейкограмма находится в пределах нормы;
2) определение любой стадии паразитемии при моноинвазиях и при инвазиях смешанного типа;
3) быстрое получение результатов лабораторной диагностики, не требующих больших затрат на биологический материал (достаточно одной капли крови) и затрат на стоимость обработки;
4) одновременная, быстрая, дифференцированная окраска и мазка крови, и возбудителя после УЗ воздействия на пробу крови in vitro;
5) универсальность - возможность ее применения для всех видов животных и для выявления любой стадии заболевания (латентной, персистирующей, острой, подострой).
Заявленный способ осуществляется следующим образом.
Воздействовали ультразвуком in vitro (фиг. 1). Экспозиция УЗ: время от 10 с до 30 с, ISATA - средняя по пространству и времени интенсивность - 0,4 Вт/см2, с несущей частотой 880 кГц, диапазоны частот модуляции 10-20 Гц или 800-1000 Гц. Аппараты: УЗТ - 1-01Ф; Ультразвук Т-5 и УЗТ-1.02С (фиг. 1.5). Импульсный режим, амплитудная модуляция со скважностью 2, модулятор Г3-112 (или любой аналогичный генератор). Объем образцов крови 1-1,5 мл. Кровь брали из периферических вен: вены Сафена и подкожной вены предплечья. Образцы крови (собаки, кошки, лошади) озвучивались в абсолютно одинаковых условиях (площадь излучателя, охлаждение, циркуляция жидкости). Ультразвуковое воздействие на клетки крови (фиг. 1; 1.2), находящейся в кювете (1.1), термостатируемой с помощью водяного ультратермостата, осуществлялось с помощью терапевтического излучателя (1.4). Стенки кюветы выполнены из пластика или пластмассы, но могут быть изготовлены из любых, проводящих ультразвук, материалов. В качестве охлаждающей жидкости применялась непрерывно циркулирующая дистиллированная вода (1.3) (т.н. «проточное охлаждение»). Результат воздействия УЗ на клетки сразу же наблюдали в световой микроскоп. Число клеток в единице объема крови определяли с помощью камеры Горяева и светового микроскопа. Делали мазки и окрашивали по методу быстрого дифференциального окрашивания биопрепаратов ДИФФ-КВИК: мазки фиксировали в абсолютном метаноле 15 с, выдерживали в растворах красителей в течение 10 с, промывали в забуференной воде, высушивали и микроскопировали (микроскоп «Микмед-5», объектив 100х/1,25, окуляр 10х/18). Подсчет лейкоцитов вели по линии «Меандра»: 3-5 полей зрения вдоль края мазка, 3-5 полей зрения под прямым углом к середине мазка, потом 3-5 полей зрения параллельно краю мазка и вновь под прямым углом к краю мазка. Так продолжали до тех пор, пока не было подсчитано 100 целых клеток [14]. Считали все лейкоциты, находящиеся в 25 больших квадратах, содержащих по 16 малых квадратов (т.е. в 400 квадратах). Для расчета в 1 мл использовали формулу
,
где X - количество лейкоцитов в 1 мл крови; М - количество лейкоцитов, подсчитанное в 25 квадратах; 20 - разведение крови; 400 - количество квадратов [15]. Лейкограмма отражает соотношение между различными видами лейкоцитов периферической крови и в клинической практике выражается в процентах.
Статистическую обработку результатов проводили с использованием пакета прикладных программ «Statistica 6.0». Достоверность различий средних значений определяли, используя парный t-критерий Стъюдента; достоверными считали различия при р<0,05.
В результате данного этапа работы была отработана оптимальная схема озвучивания крови in vitro. Были определены восприимчивость и резистентность клеток крови здоровых и больных животных к УЗ воздействию, а также отслежены возможные изменения структуры и жизнеспособности клеток крови и гематологических показателей в поле бегущей ультразвуковой волны. Применяемый нами метод окраски Дифф-квик позволил выявить наличие возбудителей как микрофилярии D. repens, так и бабезиоза В. canis в крови животных. Поэтому необходимость использования более длительного метода окраски по Романовскому-Гимзе отпала, и мы во всех исследованиях пользовались набором для быстрого дифференцированного окрашивания мазков крови.
Изменения в лейкограмме у животных, зараженных дирофиляриозом и имеющих микрофиляремию, не выявлены. Число лейкоцитов могло превышать норму в 1,4 раза или "укладываться" в ее верхний предел. Лейкограмма у животных с бабезиозом также укладывалась в пределы физиологической нормы для данного вида животных. Таким образом, по лейкограмме диагностировать наличие инвазии у животных практически невозможно, если самого возбудителя не видно под микроскопом. В случае Babesia canis возбудитель виден при микроскопии внутри клеток. Dirofilaria repens может попасть в поле зрения микроскопа в мазке крови, а может нет, в зависимости от степени микрофиляремии, а при аскаридозе возбудитель в крови отсутствует.
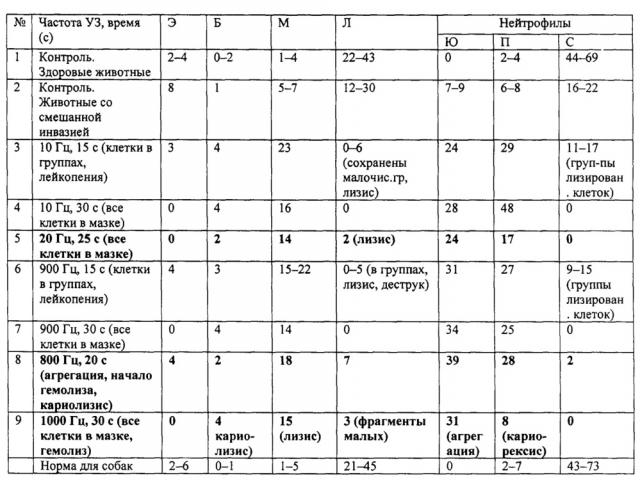
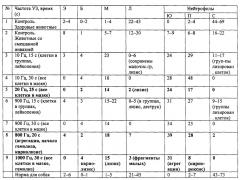
Изменение в анализах крови животных со смешанной инвазией (р<0,05) бабезиоз и дирофиляриоз. Количество лейкоцитов, эритроцитов - в пределах нормы, тромбоцитов - в 4-5 раз меньше нормы. Лейкограммы (таблица) отличались уменьшением в 2-4 раза количества сегментоядерных нейтрофилов, а лимфоцитов в 1,7-3,5 раз по сравнению со здоровыми животными (р>0,05). Сильный разброс данных объясняется значительными колебаниями референсного ряда для каждого вида животных и невозможностью в большинстве случаев сравнения лейкограмм одних и тех же особей до инвазирования и после лечения: большинство хозяев делают анализ крови питомцам только в острый период болезни и после выздоровления. У всех животных, наблюдаемых ранее с бабезиозом или дирофиляриозом, не выявлено такого выраженного сдвига ядра влево (юных форм нейтрофилов в лейкограмме более 25%), как у собак со смешанной инвазией. При микрофиляремии у больных животных наблюдался сдвиг ядра влево, но не так сильно выраженный.
Изменение в анализах крови животных со смешанной инвазией после УЗ обработки. При микроскопии окрашенных мазков были выявлены микофиляремия и бабезии в эритроцитах. После 10 с УЗ обработки проб крови больных животных смешанной инвазией в ряде случаев может наблюдаться изменение формы и структуры эритроцитов (фиг. 4, 5). Начало лизиса клеток белой крови регистрируется уже на 10-й секунде облучения, а через 15 с клеточная деформация и лизис отмечаются практически во всех лейкоцитах (фиг. 4, 5, 8, 10), что осложняет их идентификацию. Импульсная модуляция 800-1000 Гц в течение 15 с вызывает агрегацию лейкоцитов, разрыхление их ядер и цитоплазматических мембран. Увеличение экспозиции до 30 с приводит к появлению в мазках теней клеток и почти полному (>97%) лизису всех видов лимфоцитов. УЗ интенсивности 0,4 Вт/см2 УЗ с частотой модуляции 10-20 Гц также вызывает клеточную агрегацию, изменяя лейкограмму (таблица) и структуру лейкоцитов животных с паразитемией (фиг. 2, 3). Глубина изменений напрямую зависит от интенсивности инвазии. У нейтрофилов происходят последовательно «вакуолизация» цитоплазмы, деформация и разрыв ядер и цитоплазмы. Фотографии клеток крови животных с моноинвазиями после облучения УЗ даны на Фиг. 2, 3, 7, 9, 11. На Фиг. 2 показаны лизис юных и сегментоядерных нейтрофилов и деформация лимфоцита после 15-секундной УЗ обработки проб крови зараженных микрофиляриями D. repens животных (частота модуляции 10 Гц), а на фиг. 4 - «вспенивание» ядра палочкоядерного (4.1) и сегментоядерного (4.2) нейтрофила после воздействия 30 с. На Фиг. 9 показана кровь собаки, больной бабезиозом. Клетки после 25 с обработки УЗ. Частота модуляции 20 Гц. Лизис ядер лейкоцитов. На фиг. 11. Кровь собаки, больной микрофиляремией. Агрегация лейкоцитов и лизис ядер нейтрофилов в УЗ поле (Частота модуляции 800 Гц. 20 с) Фотографии изменений, вызываемых модуляционной частотой 900 Гц при экспозиции 30 с в крови больных бабезиозом собак, наблюдается лизис лейкоцитов, сложность клеточной идентификация из-за разрушений ядер (8.1), разрыва цитоплазмы (8.2), даны на фиг. 7, 8. В контроле (фиг. 6) в клетках крови здоровой собаки после 15 с обработки УЗ (сегментоядерные нейтрофилы в центре) изменений нет. Лейкограмма в целом претерпевала значительные изменения (таблица). После 15 с действия модулированного УЗ с частотой 800-1000 Гц количество сегментоядерных нейтрофилов по сравнению с контролем сокращалось в 1,5-2,4 раза, а число юных и палочкоядерных нейтрофилов составляло до 50% от общего числа лейкоцитов. Было обнаружено, что молодые и незрелые формы клеток (5.1 - юный нейтрофил без разрушений) в мазках больных животных сохраняются значительно дольше в поле бегущей УЗ волны (5.2 - группа из юных нейтрофилов и деформированного лимфоцита; 5.3, 5.4 - лизис сегментоядерных нейтрофилов. Смешанная инвазия. После 15 с обработки УЗ. Частота модуляции 900 Гц). Строение гранулоцитов меняется в зависимости от экспозиции, вплоть до полного лизиса клеток. Так, после 30 с у нейтрофилов (юный - 5.1; сегментоядерный - 5.2) отмечают разрыхление ядер и цитоплазмы. 10 Гц модуляция также приводит к существенному сдвигу лейкограммы влево. При этом клетки сложно идентифицировать, у >20% из них лизированы или разорваны ядра и/или цитоплазма, а их окраска неоднородна и неспецифична. Ядра могут быть "вакуолизированы" или содержать зернистость. На фиг. 10. Кровь собаки. Дирофилириоз и бабезиоз. Клетки после 19 с обработки УЗ. Частота модуляции 1000 Гц. Начало гемолиза. Во всех случаях отмечена иктеричность сыворотки крови, вызванная УЗ гемолизом эритроцитов. Во всех мазках крови, обработанной УЗ, в поле зрения микроскопа обнаружено большое количество тромбоцитов разного размера (Фиг. 4). По нашему мнению, это следствие более глубокой окраски клеток крови после УЗ воздействия, но возможно, и влияние процесса двойной инвазии. Начало УЗ гемолиза эритроцитов при обработке крови больных дирофиляриозом животных наступало через 25 с; бабезиозом - через 30 с, смешанной инвазией - через 18-20 с.
Библиография
1. Кошелева, М.И. Бабезиоз собак в условиях Московской области (эпизотоогия, иммунитет, терапия): автореф. дис. … кандидата вет. наук // Кошелева М.И. - М., 2006, 17 с.
2. Белименко, В.В. Бабезиоз собак в Оренбургской и Московской областях: дис. … канд. биол. наук. Защищена 16.00.03, 03.00.19 // В.В. Белименко. - М., 2008. - 141 с.
3. Taboada, J. Babesiosis of Companion Animals and Man / J. Taboada, S. Merchant // Veterinary Clinics of North America - 1991 Jan. - Vol. 21. - No. 1. - P. 103-123.
4. Белименко, В.В. Бабезиоз собак / В.В. Белименко, Заболоцкий В.Т., Саруханян А.Р., Христиановский П.И. // РВЖ. МДЖ. - 2012. - №2. - С. 42-46.
5. Василевич Ф.И., Есаулова Н.В., Акбаев P.M. Паразитарные болезни плотоядных животных. // Монография. - М., 2010. - 149 с.
6. Василевич Ф.И., Георгиу X., Белименко В.В., Гулюкин М.И. Практическое руководство по борьбе с кровопавразитарными болезнями домашних животных. - М.: ЗооВетКнига, 2015. - 86 с.
7. Ettinger, Stephen DVM, Edward С. Feldman DVM. "Canine Babesiosis". Textbook of Veterinary Internal Medicine. 6th Edition. Vol. 1. St. Louis, Missouri, 2005. - 700 p.
8. Wetzel, Linda Marie. "Vector-Transmitted Diseases in Companion Animals: Trends, Risks, Controls." DVM News. April 2007, p. 10-11.
9. Василевич Ф.И., Пьянова A.M. Особенности патогенеза при дирофиляриозе собак. // Ветеринарная медицина. 2008. №4. - С. 27-28.
10. Медведев А.Ю. Распространение дирофиляриоза собак в Краснодарском крае и разработка его диагностики иммуноферментной реакцией. Автореферат диссертации, 2010.
11. Ястреб В.Б. Морфологические и биохимические показатели крови при дирофиляриозе собак / Ястреб В.Б. // Тр. Всерос. ин-та гельминтол. - 2006. - Т. 42. - С. 468-473.
12. Антипин Д.Н., Егоров B.C., Золотарев Н.А., Саляев В.А. «Паразитология и инвазионные болезни сельскохозяйственных животных». С. 30, 34, 248, 346.
13. T.N. Pashovkin, D.G. Sadikova, M.S. Pashovkina, G.V. Shil'nikov // Use of ultrasonic standing wave in biological studies and cell technologies. // Bull ExpBiol Med 144(1): 118-22 (2007) PMID 18256768.
14. Кудрявцев, A.A. Клиническая гематология животных / A.A. Кудрявцев, Л.А. Кудрявцева. - М.: «Колос» 1974. - 399 с.
15. Бурмистров Е.Н. Шанс Био: Лабораторная диагностика. М., 2006. – 154 с.
Способ диагностики крови на наличие паразитарных заболеваний по изменению лейкограммы после ультразвукового воздействия, включающий: воздействие на образцы крови объемом от 1 мл до 1,5 мл, помещенные в термостатируемую кювету, бегущей модулированной ультразвуковой волной с несущей частотой 880 кГц и диапазонами частот модуляции 10-20 Гц или 800-1000 Гц, интенсивностью 0,4 Вт/см2, с экспозицией от 10 с до 30 с; обработку образцов крови в абсолютно одинаковых условиях; поддержание постоянной температуры образцов в кюветах с проточным охлаждением и анализ морфологического состояния клеток методами световой микроскопии; при начале гемолиза эритроцитов через 18-30 с, уменьшении количества лимфоцитов в 1,7-3,5 раза, а сегментоядерных нейтрофилов в 1,5-4,0 раза, деформации и разрушении ядер и изменении структуры цитоплазмы, ее вакуолизации, а также при ядерном сдвиге влево диагностируют наличие паразитарного заболевания.