Способ биохимического определения активности протеолитических ферментов в крови
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к ветеринарии, и может быть использовано для биохимического определения активности протеолитических ферментов в крови. Способ включает использование препарата энтерокиназы, инкубирование с последующей фотометрией. В качестве препарата энтерокиназы используют надосадочную жидкость, полученную следующим образом: при убое животных или птиц берут соскоб слизистой оболочки 12-перстной кишки, предварительно промытый холодным физиологическим раствором, смешивают с раствором Рингера в соотношении 1:10 и гомогенизируют до однородной консистенции. После этого центрифугируют при 5000 об/мин в течение пяти минут и отбирают надосадочную жидкость, полученный препарат энтерокиназы добавляется к плазме крови в следующих соотношениях, мл: плазма крови 2,0-3,0, препарат энтерокиназы 0,1-0,2. Содержимое пробирки в количестве 0,1 мл инкубируют субстратом в течение 5 минут, результат учитывают при фотометрии с длиной волны 450 нм по количеству гидролизованного субстрата ферментативной реакции и расчету протеолитической активности. Использование данного способа позволяет определять активность протеолитических ферментов в плазме крови для изучения состояния поджелудочной железы. 2 табл., 1 ил.
Реферат
Изобретение относится к области медицины и ветеринарии, а именно к биохимии, и представляет собой биохимический способ, который позволяет определить количество протеолитических ферментов в жидкой части крови (сыворотке и плазме) за счет активирования протеаз с помощью препарата энтерокиназы. Изобретение обеспечивает переход неактивных протеолитических ферментов в активную форму, в которой возможно их определение биохимическим методом.
Предложенный способ может применяться для определения состояния здоровья поджелудочной железы человека и животных, поскольку протеазы вырабатываются исключительно в этом органе и резкое их увеличение в крови связано с патологией железы.
Панкреатические ферменты выделяются в составе секрета в 12-перстную кишку после приема корма. Протеазы взаимодействуют с белковыми субстратами, расщепляя их до аминокислот. Как известно (см. Формирование ферментного компонента секретов пищеварительных желез (обзор) / Г.Ф. Коротько // Физическая культура, спорт - наука и практика, №1, 2013. - С. 51-57), ферменты при взаимодействии с субстратом не изменяются, а после его расщепления отделяются от субстрата и вновь оказываются в свободном состоянии в кишечнике. После этого часть ферментов поступает в кровь. Поскольку протеазы обладают способностью гидролизовать белки, то в крови они связываются ингибиторами трипсина и в неактивном состоянии циркулируют в ней. Поэтому определение протеаз поджелудочной железы в жидкой части крови биохимическими методами практически невозможно.
Определение активности трипсина и его ингибитора до настоящего времени не нашло применения в неотложной диагностике поражений поджелудочной железы, несмотря на кажущуюся органоспецифичность этого исследования, главным образом, в связи с тем, что субстрат для его определения труднодоступен. Кроме того, при этом необходимо определять параллельно активность ингибитора трипсина, что занимает много времени и требует использования биохимических методик, а получаемые результаты довольно спорны. Норма содержания трипсина в крови колеблется от 0 до 5 миллиединиц, активность ингибитора трипсина - 30-600 миллиединиц (Баиров Г.А. Хирургия поджелудочной железы у детей. - Медицина, 1978. - 168 с.), по данным зарубежных исследователей содержание трипсина в сыворотке крови здорового человека 300 нг/мл (Isenman L., Liebow С, Rothman S.,The endocrine secretion of mammalian digestive enzymes byexocrine glands //Am. J. Physiol. -1999. - Vol. 276. - P. 223-232). В научной литературе есть положительные примеры использования эспресс-тестов «Актим-панкреатитис» (Финляндия), который основан на определении трипсиногена в моче путем иммунохроматографии (Каджаева С.З., Беслекоев А.С., Асатрян А.С. К вопросам диагностики острого панкреатита /Кубанский научный медицинский вестник, №3 (145), 2014. - С. 58-61).
Важную роль для диагностики панкреатита играет выявление прямыми или косвенными методами активности панкреатических протеаз: трипсина, химотрипсина, эластазы и карбоксипептидазы. Следует учесть, что поджелудочная железа является единственным источником трипсина, поэтому определение его содержания может быть более важным для суждения о поражении поджелудочной железы, чем других ферментов (Лабораторная диагностика панкреатита / www.eurolab).
В крупных исследовательских центрах США и Европы количество трипсина в сыворотке крови измеряют радиоиммунным методом (с использованием моноклональных антител к антигенным детерминантам молекулы фермента). Указанный метод является наиболее точным, однако дорог и требует специально оборудованных лабораторий.
Из биохимических методов исследования протеаз известен способ определения эстеразной активности протеолитических ферментов (см. патент РФ 2027764 С1, МПК G01N 33/50, опубл. 27.01.1995). Однако этот метод достаточно сложен в выполнении, поскольку направлен на регистрацию прироста концентрации летучего продукта в газовой фазе во времени, и вряд ли может быть использован для определения протеолитических ферментов в крови. Кроме того, наличие широкого спектра ингибиторов сериновых протеаз, к которым относятся ингибиторы Кунитца и Казеля панкреоцитов, антитрипсин и макроглобулин крови и тканевой жидкости, приводит к тому, что трипсин, вышедший из разрушенных клеток, находится исключительно в комплексе с каким-либо из тканевых или сывороточных ингибиторов (Логинов А.С., 1982).
Сравнительно недавно предложен Высокочувствительный способ определения иммуноглобулин-протеиназной активности с использованием полимерных матриц (см. патент РФ 2519071 C1 МПК G01N 33/573, G01N 33/543, опубл. 10.06.2014), который требует дорогостоящих и сложных реактивов и компонентов. Учет двухуровневой ферментативной реакции ведется на спектрофотометре. Поэтому использование данного метода в широкой клинической и лабораторной практике маловероятно.
Целью предлагаемого изобретения является расширение биохимических способов определения активности протеолитических ферментов в крови человека и животных для изучения состояния поджелудочной железы.
Поставленная цель достигается способом биохимического определения активности протеолитических ферментов в крови, включающий использование препарата энтерокиназы, инкубирование с последующей фотометрией, отличающийся тем, что препарат энтерокиназы добавляется к плазме крови в следующих соотношениях, мл:
| Плазма крови | 2,0-3,0 |
| Препарат энтерокиназы | 0,1-0,2 |
при этом процесс инкубирования препарата энтерокиназы с протеазами и субстратом проходит в течение 3-10 минут, результат учитывают при фотометрии с длиной волны 450 нм по количеству гидролизованного субстрата ферментативной реакции и расчету протеолитической активности.
Способ осуществляют следующим образом. Отличительной особенностью предлагаемого способа является то, что для активирования протеаз плазмы крови используют фермент энтерокиназу, который выполняет в естественных условиях эту функцию в 12-перстной кишке. Для этого берут при убое животных или птиц соскоб слизистой оболочки 12-перстной кишки, предварительно промытый холодным физиологическим раствором. Смешивают с раствором Рингера в соотношении 1:10 и гомогенизируют до однородной консистенции. После этого центрифугируют при 5000 об/мин в течение пяти минут, в качестве препарата энтерокиназы используют надосадочную жидкость. С целью увеличения сроков хранения препарата с двух до 14 суток раствор Рингера заменяют 87% раствором глицерина, количество которого превышает массу слизистой оболочки кишки в два раза. Препарат хранят в холодильнике при температуре +2-4°С, а перед употреблением разбавляют раствором Рингера в 5 раз.
Протеолитическую активность плазмы крови определяют по уменьшению концентрации казеина при фотометрическом контроле (см. Фотометрическое определение активности протеолитических ферментов поджелудочного сока по уменьшению концентрации казеина [Текст] /Ц.Ж. Батоев // Сборник научных трудов Бурятского СХИ. - 1971. - №25. - С. 122-126).
Методика основана на определении уменьшения концентрации казеина при фотометрическом контроле на КФК-3.
Реактивы: 1) 0,1% раствор соды (NaHCO3); 2) 0,1% раствор очищенного казеина, раствор казеина сохраняется 2-3 дня, рН 8,0; 3) 15% раствор трихлоруксусной кислоты (ТХУ).
После инкубирования смеси раствор ТХУ приливали по стенке пробирки и ставили в штатив. Преждевременное встряхивание и помешивание уменьшает экстинкции растворов. По истечении 30-40 минут, перед наливанием растворов в кювету, производили размешивание пробы 3-4 разовым перевертыванием пробирки вверх дном и быстро определяли показатели оптической плотности. При исследовании на КФК-3 применяли синий светофильтр (длина волны 450), используя кюветы по 3 мл.
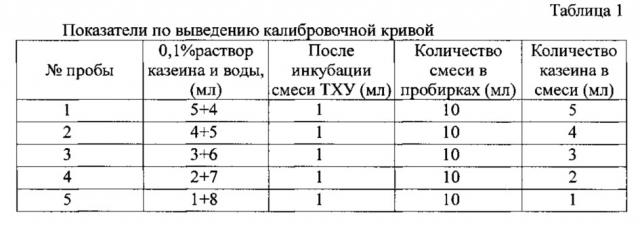
Калибровочная кривая выводится в соответствии с данными таблицы 1.
Для большей точности результаты отдельного опыта целесообразно сравнивать не с показателями калибровочной кривой, а с данными контрольных проб. Экстинкции контрольных проб закономерно могут отклоняться в ту или другую сторону от показателей калибровочной кривой в зависимости от условий, складывающихся в опыте.
Контрольные пробы выполняли по схеме опытов калибровочной кривой. Результаты контрольных проб сравнивали с данными калибровочной кривой. Рассчитывали среднюю разницу между показателями контрольных проб и калибровочной кривой. Эту разницу контрольных проб прибавляли к показателю первой пробирки калибровочной кривой (500), или вычитали, если она оказывалась со знаком минус. Таким путем находили максимальную экстинкцию для данного опыта.
Для всех проб опыта приготовленный раствор казеина, согласно прописи первой пробирки калибровочной кривой, разливали в пробирки для анализов. При этом учитывали изменение объема проб вследствие добавления ферментативного материала. При добавлениях на пробу больше 0,3 мл ферментативного субстрата увеличивали на столько же объем контрольных проб, или же производили уменьшение объема опытных проб за счет воды.
Для расчета единиц протеолитической активности панкреатического сока экстинкцию контроля принимали за 100%, а опыта за х%.
Так как в контрольной и опытной пробах содержится одинаковое количество субстрата, то 5 мл казеина принимаются за 100%, а разница между контролем и опытом в % равняется количеству мг казеина, расщепленного за опыт. По количеству сока, взятого для гидролиза субстрата и времени инкубации, рассчитывали количество казеина, расщепленного 1 мл сока в течение 1 минуты.
Результаты исследований показывают, что без добавления к плазме крови препарата энтерокиназы активность протеаз не выявляется. С учетом того, что в плазме крови протеазы связаны с ингибиторами фермента, то экстинкция раствора в опытной пробе оказывается выше, чем контроль. Это можно использовать для расчета ингибитора, но целью нашей работы было определить количество протеаз в плазме крови, поэтому мы добавляли к плазме крови препарат энтерокиназы из расчета 0,1 мл на 2,0-3,0 мл плазмы крови. В дальнейшем содержимое пробирки в количестве 0,1 мл добавляем к рабочему раствору, содержащему казеин, и помещаем в термостат на 3-5 минут. В контрольной пробирке используется плазма крови, поскольку там гидролиза субстрата не происходит, то экстинкция раствора контрольной пробы всегда выше, чем в опытной пробирке.
Экспериментально были изучены разные варианты инкубации (3, 5 и 10 минут) плазмы крови с рабочим раствором (субстратом). Результаты представлены в табл. 2.
Из данной таблицы видно, что наиболее оптимальным временем инкубации фермента и субстрата является 5 минут. Увеличение или уменьшение времени инкубации приводит к снижению показателя активности протеолитических ферментов в плазме крови.
Количество плазмы крови, которое добавляли к рабочему раствору, находилось в пределах 0,1-0,2 мл. При добавлении 0,1 мл плазмы крови экстинкция раствора соответствовала 600-700 единицам, а увеличение до 0,2 мл повышало экстинкцию раствора до 800-1000 единиц (рис. 1). Выполнение расчетов показывает, что наиболее оптимальным количеством плазмы крови является 0,1 мл, так как активность фермента в этом случае составляет 0,6 мг/мл/мин, а увеличение до 0,2 мл снижает активность протеаз до 0,2 мг/мл/мин.
Таким образом, предложенный метод позволяет активировать протеазы плазмы и сыворотки крови и определять их биохимическими методами для изучения состояния поджелудочной железы человека и животных.
Способ биохимического определения активности протеолитических ферментов в крови, включающий использование препарата энтерокиназы, инкубирование с последующей фотометрией, отличающийся тем, что в качестве препарата энтерокиназы используют надосадочную жидкость, полученную следующим образом: при убое животных или птиц берут соскоб слизистой оболочки 12-перстной кишки, предварительно промытый холодным физиологическим раствором, смешивают с раствором Рингера в соотношении 1:10 и гомогенизируют до однородной консистенции, после этого центрифугируют при 5000 об/мин в течение пяти минут и отбирают надосадочную жидкость, полученный препарат энтерокиназы добавляется к плазме крови в следующих соотношениях, мл:
| Плазма крови | 2,0-3,0 |
| Препарат энтерокиназы | 0,1-0,2 |
содержимое пробирки в количестве 0,1 мл инкубируют субстратом в течение 5 минут, результат учитывают при фотометрии с длиной волны 450 нм по количеству гидролизованного субстрата ферментативной реакции и расчету протеолитической активности.