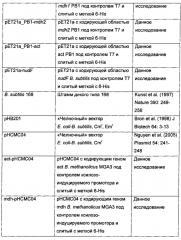
Новые ферменты метанолдегидрогеназы из bacillus
Иллюстрации
Показать всеИзобретение относится к области биохимии, генной инженерии и биотехнологии, в частности к новым полипептидам из Bacillus methanolicus, обладающим активностью алкогольдегидрогеназы, в том числе метанолдегидрогеназы. Указанные полипептиды характеризуются аминокислотными последовательностями, представленными в SEQ ID NO: 2, 4, 6. Настоящее изобретение также относится к молекулам нуклеиновой кислоты, кодирующим эти полипептиды. Нуклеотидные последовательности указанных молекул нуклеиновой кислоты представлены в SEQ ID NO: 1, 3, 5. Изобретение относится к векторам экспрессии, содержащим эти молекулы нуклеиновой кислоты. Изобретение также относится к прокариотическим микроорганизмам-хозяинам для экспрессии указанных полипептидов алкогольдегидрогеназ. Настоящее изобретение позволяет получать новые полипептиды из Bacillus methanolicus с активностью алкогольдегидрогеназы, в том числе метанолдегидрогеназы. 4 н. и 5 з.п. ф-лы,13 ил., 3 табл., 18 пр.
Реферат
Настоящее изобретение относится к ранее неизвестным ферментам метанолдегидрогеназам (MDH), идентифицированным в метилотрофных бактериях, и в частности касается новых MDH-кодирующих генов, идентифицированных в Bacillus methanolicus MGA3 и Bacillus methanolicus РВ1. Изобретение основано на неожиданном открытии того, что в этих штаммах В.methanolicus встречается множество изоформ MDH, которые отличаются своими биохимическими свойствами. Такие новые гены, кодирующие ранее неизвестные изоформы MDH, можно использовать в генной инженерии микроогранизмов-хозяев, например в контексте использования метанола и/или других С1-соединений в качестве субстрата для роста. Таким образом, новые гены/ферменты можно использовать для введения или модификации, например активации/усиления, активности MDH в микроорганизме-хозяине.
Метилотрофные микроорганизмы могут использовать одноуглеродные (С1) источники, такие как метан и метанол, в качестве своих единственных источников энергии и образования биомассы, и существует ряд различных ферментов и путей С1-метаболизма среди метилотрофов. Был выделен ряд грамположительных термостойких бацилл со способностью роста на метаноле при температурах вплоть до 60°С, которых классифицировали как Bacillus methanolicus. В.methanolicus представляет собой так называемый ограниченный метилотроф, что означает, что он может использовать незначительное число многоуглеродных источников энергии и роста. Научный интерес к этим организмам главным образом был сфокусирован на их потенциале в качестве клеточных фабрик для промышленного производства аминокислот, особенно L-лизина и L-глутамата, из метанола при повышенных температурах, но также предполагалось их возможное применение в качестве хозяев для продуцирования других полезных продуктов, включая витамины, цитохромы, коферменты и рекомбинантные белки.
В.methanolicus MGA3 (АТСС53907) был первоначально выделен из образцов почвы в Миннесоте (Schendel, Bremmon et al. (1990) Appl Environ Microbiol 56(4): 963-970), и он представлял собой главный модельный штамм, применяемый в метаболической инженерии этой бактерии (Brautaset, Jakobsen et al. (2007) Appl Microbiol Biotechnol 74(1): 22-34; Jakobsen, Brautaset et al. (2009) Appl Environ Microbiol 75(3): 652-661; Brautaset, Jakobsen et al. (2010) Appl Microbiol Biotechnol 87(3): 951-964). B. methanolicus имеет несколько уникальных особенностей, включая НАД(никотинамидадениндинуклеотид)-зависимую метанолдегидрогеназу (MDH) для окисления метанола (de Vries, Arfman et al. (1992) J Bacteriol 174(16): 5346-5353; Arfman, Hektor et al. (1997) Eur J Biochem 244(2): 426-433; Hektor, Kloosterman et al. (2002) J Biol Chem 277(49): 46966-46973). Активность метанолдегидрогеназы (MDH) является ключевой характеристикой метилотрофного роста и вовлечена в первую стадию ферментации метанола, а именно окисление метанола до формальдегида. Формальдегид представляет собой промежуточное соединение в метаболизме метанола, и следовательно детоксикация этого токсичного для клеток метаболита является очень важной. Формальдегид можно ассимилировать с помощью РМФ(рибулозомонофосфатного)-пути. Для непосредственного превращения формальдегида в CO2 также предполагался линейный диссимиляционный путь. Предполагают, что диссимиляционные пути являются важными для полного генерирования энергии в клетках при росте на метаноле. Вместе с РМФ-путем диссимиляционные пути могут также играть роль в поддержании количества формальдегида ниже токсических уровней в клетках. Поэтому эффективное окисление метанола и сопутствующая ассимиляция формальдегида имеет решающее значение для роста и потока энергии в первичном метаболизме и для продуцирования желаемых продуктов. Кроме того, все это должно быть тщательно сбалансировано для того, чтобы обеспечить эффективное превращение метанола и в то же время избежать токсической аккумуляции формальдегида в клетках. В этом смысле, MDH играет важную роль в бактериальной метилотрофии.
Бактериальные MDH можно разделить на группы согласно механизмам их взаимодействия и использования кофактора(ов). Наиболее изученной является состоящий из двух субъединиц пирролохинолинхинон(PQQ)-зависимый хинопротеин MDH, широко распространенный в грамотрицательных метилотрофных бактериях. Грамположительные метилотрофы обычно кодируют НАД(Ф)+-зависимые метанолдегидрогеназы, и в дополнение к MDH из штамма MGA3, рассмотренного выше, НАД+-зависимая MDH была идентифицирована в другом штамме В.methanolicus, штамме С1 (Vonck, Arfman et al. (1991) J Biol Chem 266(6): 3949-3954; de Vries, Arfman et al. (1992) J Bacteriol 174(16): 5346-5353). MDH В.methanolicus демонстрирует сходство первичной последовательности с железосодержащими алкогольдегидрогеназами и поэтому отнесена к семейству III НАД-зависимых алкогольдегидрогеназ. Фермент состоит из десяти идентичных субъединиц, каждая из которых содержит прочно, но нековалентно, связанную молекулу НАД(Н) в дополнении к иону Zn2+ и 1-2 ионам Mg2+.
Было обнаружено, что метилотрофия в В.methanolicus является плазмидозависимой и вовлекает согласованный набор как плазмидных, так и хромосомных генов. В результате работы с В.methanolicus MGA3 была идентифицирована природная плазмида рВМ19, несущая mdh и пять генов РМФ-пути; потеря рВМ19 приводит к утрате способности роста на метаноле. В работе, предшествовавшей настоящему изобретению, о которой ранее не сообщалось, была показана соответствующая аналогичная плазмида, обозначенная рВМ20, в физиологически очень непохожем альтернативном модельном штамме РВ1 (NCIMB 13113).
Было показано, что НАД-зависимые ферменты MDH каталитически активируются активаторным белком Act, который относят к семейству nudix гидролаз.
Окисление метанола является основным критическим элементом в попытках конструировать метилотрофию в микроорганизмах-хозяевах. Действительно, даже в контексте организмов-хозяев, которые представляют собой природные метилотрофы, например В.methanolicus, модификация активности или экспрессии MDH может быть выгодной для улучшения роста и/или выхода желаемых продуктов. Поэтому сохраняется потребность в ферментах MDH, и в частности в новых генах mdh, которые можно использовать в генетической инженерии организмов, особенно таких генах, которые кодируют новые ферменты, обладающие измененными или улучшенными свойствами относительно ферментов MDH из данной области техники, например улучшенной активностью или стабильностью, или которые могут так или иначе быть выгодными для применения в генетической модификации желаемых хозяев.
В целях лучшего понимания физиологии метилотрофной клетки-хозяина В.methanolicus авторы настоящего изобретения секвенировали геном MGA3 и альтернативного штамма дикого типа РВ1. В процессе этого секвенирования было неожиданно обнаружено, что оба штамма имеют множество изоформ MDH; в обоих штаммах были идентифицированы три гена, кодирующие три обособленных белка НАД-зависимой MDH. Таким образом, в В.methanolicus MGA3, в дополнение к описанному ранее кодируемому плазмидой гену mdh-MGA3, были идентифицированы два новых гена, обозначенных в данном описании изобретения mdh2-MGA3 и mdh3-MGA3. Интересно, что эти новые гены mdh локализованы в хромосомах. В В.methanolicus РВ1 были идентифицированы три новых гена, обозначенных в данном описании изобретения mdh-PB1, mdh1-PB1 и mdh2-PB1, где первый из них несет плазмида (плазмида рВМ20), а последние два являются хромосомными. Все эти гены были экспрессированы рекомбинантным путем, очищены и охарактеризованы биохимически in vitro. Несмотря на проявление некоторых сходств, становится ясно, что эти разные ферменты MDH могут иметь разные свойства, включая их активность. На основе этих исследований, и в частности анализа последовательностей, было идентифицировано два различных подсемейства MDH.
Первое подсемейство включает ранее описанный ген mdh, который несет плазмида, штамма MGA3 (mdh-MGA3) и два гена из штамма РВ1, mdh-PB1 и mdh1-РВ1 (mdn-PB1 несет плазмида, а mhd1-ΡΒ1 является хромосомным) и определено в данном описании изобретения как "семейство mdh/mdh1-типа". Второе подсемейство включает новые хромосомные гены mdh2-MGA3, mdh3-MGA3 и mdn2-PB1 и определено в данном описании изобретения как "семейство mdh2/mdh3-типа". Именно это последнее семейство образует объект настоящего изобретения.
Члены семейства mdh2/mdh3-типа обладают по меньшей мере 90%-ной идентичностью последовательности друг к другу на уровне ДНК (см. Фиг. 1) и на уровне аминокислотной последовательности относительно кодируемых белков (см. Фиг. 2). В частности, кодирующие последовательности mdn2-MGA3 (SEQ ID NO: 1) и mdh3-MGA3 (SEQ ID NO: 3) имеют 96%-ную идентичность последовательности ДНК, а предсказанные полипептиды Mdh2-MGA3 (SEQ ID NO: 2) и Mdh3-MGA3 (SEQ ID NO: 4) имеют 96%-ную идентичность аминокислот (см. Фиг. 2В). Предсказанный полипептид Mdh2-PB1 (SEQ ID NO: 6) на 91% идентичен предсказанному полипептиду Mdh2-MGA3 (SEQ ID NO: 2) и на 92% идентичен предсказанному полипептиду Mdh3-MGA3 (SEQ ID NO: 4) (см. Фиг. 2В).
С другой стороны, идентичность последовательности между членами двух разных подсемейств значительно ниже, приблизительно 60-66%. Например, кодирующая последовательность mdh2-MGA3 (SEQ ID NO: 1) на 65% идентична кодирующей последовательности mdh-MGA3 (SEQ ID NO: 7), a предсказанный полипептид Mdh2-MGA3 (SEQ ID NO: 2) на 61% идентичен предсказанному полипептиду Mdh-MGA3 (SEQ ID NO: 8). Кодирующая последовательность гена mdh3-MGA3 (SEQ ID NO: 3) на 66% идентична кодирующей последовательности mdh-MGA3 (SEQ ID NO: 7), а предсказанный полипептид Mdh3 (SEQ ID NO: 4) на 62% идентичен Mdh-MGA3 (SEQ ID NO: 8).
Как уже отмечалось, исследования биохимических характеристик выявили различия между ферментами MDH семейств mdh2/mdh3- и mdh/mdh1-типов. Например, Mdh3-MGA3 (SEQ ID NO: 4) и Mdh2-PB1 (SEQ ID NO: 6) обладают улучшенной термостабильностью. Также обнаружены различия в субстратной специфичности и уровне активности на субстратах различных спиртов. Это открывает возможность для применения таких ферментов в окислении разных спиртов (например этанола или пропанола), а не только метанола.
Также были выполнены исследования по гетерологичной экспрессии генов в различных неметилотрофных хозяевах. Эти исследования установили полезность новых последовательностей по изобретению семейства mdh2/mdh3-типа в генетической инженерии ряда различных клеток-хозяев для введения активности MDH и тем самым дают возможность использования метанола. Предполагается, что настоящее изобретение имеет широкую применимость, поскольку имеет отношение к разным клеткам-хозяевам, и в исследованиях, описанных в данном описании изобретения, были использованы два биотехнологически хорошо охарактеризованных и филогенетически очень различных бактериальных штамма-хозяина, т.е. грамотрицательная Escherichia coli и грамположительная Bacillus subtilis, и было показано, что каждый генетически модифицированный микроорганизм-хозяин демонстрирует повышенную активность MDH при модификации для экспрессии новых ферментов MDH по настоящему изобретению, особенно ферментов из семейства mdh2/mdh3-типа из В.methanolicus MGA3 и В.methanolicus РВ1.
В особенности, результаты, представленные в данном описании изобретения, показывают, что разные конкретные ферменты могут проявлять улучшенную активность в различных хозяевах. Например, для экспрессии активности MDH в хозяине Е.coli наилучшие результаты дает Mdh2-MGA3 (SEQ ID NO: 1). Выбор фермента MDH может также зависеть от условий экспрессии и точной природы клетки-хозяина и/или условий культивирования, например от того, коэкспрессируется ли ген act, и если да, то какой конкретно. Таким образом, новые ферменты по изобретению и их кодирующие последовательности преимущественно предоставляют новый и расширенный спектр ферментов MDH и кодирующих молекул нуклеиновой кислоты для применения в окислении спиртов, включая метанол, и в частности для применения в генетической модификации клеток-хозяев (например для продуцирования рекомбинантных клеток-хозяев), например для введения или модификации активности алкогольдегидрогеназы в клетку(е)-хозяина(е), особенно активности MDH, или для введения метилотрофии в клетку-хозяина. Как дополнительно описано ниже, молекулы нуклеиновой кислоты, кодирующие новые ферменты по настоящему изобретению, можно применять по отдельности или в комбинации.
Таким образом, в первом аспекте настоящего изобретения предложена молекула нуклеиновой кислоты, конкретно выделенная молекула нуклеиновой кислоты, которая кодирует полипептид (или белок), обладающий активностью алкогольдегидрогеназы, в частности активностью метанолдегидрогеназы, содержащая или имеющая (например состоящая из) нуклеотидную последовательность, выбранную из группы, состоящей из:
1) нуклеотидной последовательности, представленной в любой из SEQ ID NO: 1 (mdh2-MGA3), 3 (mdh3-MGA3) или 5 (mdh2-PB1);
2) нуклеотидной последовательности, обладающей по меньшей мере 90%-ной идентичностью последовательности, более конкретно по меньшей мере 91, 92, 93, 94, 95, 96, 97, 98 или 99%-ной идентичностью последовательности с нуклеотидной последовательностью, представленной в любой из SEQ ID NO: 1, 3 или 5;
3) нуклеотидной последовательности, которая является вырожденной по отношению к любой нуклеотидной последовательности из SEQ ID NO: 1, 3 или 5;
4) нуклеотидной последовательности, которая представляет собой часть нуклеотидной последовательности любой из SEQ ID NO: 1, 3 или 5 или нуклеотидной последовательности, которая является вырожденной по отношению к последовательности SEQ ID NO: 1, 3 или 5;
5) нуклеотидной последовательности, кодирующей весь полипептид или часть полипептида, аминокислотная последовательность которого представлена в любой из SEQ ID NO: 2 (Mdh2-MGA3), 4 (Mdh3-MGA3) или 6 (Mdh2-PB1); и
6) нуклеотидной последовательности, кодирующей весь полипептид или часть полипептида, который имеет аминокислотную последовательность, обладающую по меньшей мере 90%-ной идентичностью последовательности, предпочтительно по меньшей мере 91, 92, 93, 94, 95, 96, 97, 98 или 99%-ной идентичностью последовательности с аминокислотной последовательностью, представленной в любой из SEQ ID NO: 2, 4 или 6;
или молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности любой из (1)-(6).
В еще одном аспекте в настоящем изобретении предложен полипептид, обладающий активностью алкогольдегидрогеназы, в частности активностью метанолдегидрогеназы, и содержащий или имеющий (например, состоящий из) аминокислотную последовательность, выбранную из группы, состоящей из:
1) всей или части аминокислотной последовательности, представленной в любой из SEQ ID NO: 2, 4 или 6; и
2) всей или части аминокислотной последовательности, обладающей по меньшей мере 90%-ной идентичностью последовательности, предпочтительно по меньшей мере 91, 92, 93, 94, 95, 96, 97, 98 или 99%-ной идентичностью последовательности с аминокислотной последовательностью, представленной в любой из SEQ ID NO: 2, 4 или 6.
Молекулы нуклеиновой кислоты по настоящему изобретению преимущественно дают возможность для введения или модификации активности алкогольдегидрогеназы, и в частности MDH, в организм(е)-хозяина(е). Это может быть достигнуто путем модификации организма для экспрессии одной или более чем одной молекулы нуклеиновой кислоты по изобретению. Как отмечено выше, указанные молекулы нуклеиновой кислоты могут быть получены или иметь происхождение из генов mdh штаммов В.methanolicus, в частности штаммов MGA3 и РВ1. В конкретном воплощении молекулы нуклеиновой кислоты, кодирующие различные ферменты MDH (например, различные изоферменты или ферменты из различных штаммов или различные варианты полипептидов и т.д.) или имеющие происхождение из молекул нуклеиновой кислоты, кодирующих различные ферменты MDH, можно использовать в комбинации. Таким образом, можно коэкспрессировать две или более различных молекул нуклеиновой кислоты.
Таким образом, в настоящем изобретении предложен способ введения или модификации активности MDH в организме-хозяине путем экспрессирования в указанном организме одной или более чем одной молекулы нуклеиновой кислоты по изобретению. В частности, молекула нуклеиновой кислоты может быть гетерологичной или ненативной по отношению к организму-хозяину. Ее можно экспрессировать под контролем нативного или ненативного промотора.
Соответственно, в еще одном аспекте настоящего изобретения предложен способ введения или модификации активности алкогольдегидрогеназы, и в частности активности MDH, в организм(е)-хозяина(е), включающий введение в указанный организм молекулы нуклеиновой кислоты по изобретению, как определено выше в данном описании изобретения, и выращивание (или культивирование) указанного организма в условиях, при которых указанная молекула нуклеиновой кислоты экспрессируется.
Легко заметить, что в этом аспекте в изобретении также может быть предложен способ продуцирования полипептида(ов), обладающего(их) активностью алкогольдегидрогеназы, и в частности активностью MDH, включающий введение в организм-хозяина молекулы нуклеиновой кислоты по изобретению, как определено выше в данном описании изобретения, и выращивание (или культивирование) указанного организма в условиях, при которых указанный(ые) полипептид(ы) продуцируе(ю)тся. Организм-хозяин может представлять собой организм, который изначально (например, в его диком типе) не обладает активностью MDH (т.е. не имеет или не обладает эндогенной MDH), и следовательно в таком воплощении изобретения предусмотрено введение активности MDH в хозяина. С альтернативной точки зрения в таком воплощении хозяина можно модифицировать для введения способности превращать метанол в формальдегид или, другими словами, модифицировать хозяина для обеспечения исходной стадии использования С1-углеродного источника, конкретно использования метанола.
В альтернативном воплощении организм-хозяин может иметь или обладать эндогенным ферментом MDH, и поэтому способ по изобретению может включать модификацию активности MDH в таком хозяине путем введения молекулы нуклеиновой кислоты, кодирующей еще один или дополнительный фермент MDH, который, например, может быть гетерологичным хозяину. Также охвачена сверхэкспрессия активности MDH в организме-хозяине путем введения в указанный организм молекулы нуклеиновой кислоты, кодирующей нативный фермент MDH (т.е. в котором введенная молекула нуклеиновой кислоты кодирует эндогенный фермент MDH).
Модифицированный организм-хозяин можно культивировать или выращивать, используя любой желаемый источник углерода в качестве субстрата, включая метанол или высший спирт, но не ограничиваясь ими. Таким образом, в одном воплощении способ по изобретению может включать культивирование или выращивание организма-хозяина, который содержит одну или более чум одну MDH-кодирующую молекулу нуклеиновой кислоты, введенную экзогенно, как определено в данном описании изобретения.
В другом аспекте настоящего изобретения предложен организм-хозяин, который модифицирован для введения молекулы нуклеиновой кислоты по изобретению, как определено выше в данном описании изобретения.
В частности, в этом аспекте изобретения молекула нуклеиновой кислоты, которую вводят, содержит нуклеотидную последовательность, которая гетерологична организму-хозяину. Гетерологичная последовательность может представлять собой нуклеотидную последовательность, кодирующую полипептид алкогольдегидрогеназу (например, MDH), или она может представлять собой гетерологичную последовательность контроля экспрессии или некоторую другую последовательность (например вектор или маркерная последовательность). В случае организма-хозяина, который эндогенно экспрессирует фермент алкогольдегидрогеназу, модифицированный хозяин может отличаться от немодифицированного организма-хозяина содержанием дополнительной копии молекулы нуклеиновой кислоты, кодирующей полипептид алкогольдегидрогеназу. Другими словами, он может содержать больше копий кодирующей нуклеотидной последовательности, чем немодифицированный хозяин.
Как отмечалось выше, молекулы нуклеиновой кислоты, кодирующие новые ферменты MDH по настоящему изобретению, могут быть получены, например выделены или клонированы, из В.methanolicus, в частности из штаммов MGA3 и РВ1. Таким образом, фермент MDH может представлять собой Mdh2 или Mdh3 из MGA3 (SEQ ID NO: 2 или 4, соответственно) либо Mdh2 из РВ1 (SEQ ID NO: 6). Однако, в дополнение к конкретным нативным ("дикого типа") последовательностям, указанным выше, также включены варианты этих последовательностей, которые обладают по меньшей мере 90%-ной идентичностью нуклеотидной последовательности с ними и которые сохраняют активность алкогольдегидрогеназы, и конкретно MDH. Такие варианты могут включать природные варианты, например различные варианты, которые могут встречаться в штаммах в природе или которые могут быть получены из других штаммов В.methanolicus и которые кодируют полипептиды MDH, функционально эквивалентные полипептидам MDH SEQ ID NO: 2, 4 или 6. Альтернативно, варианты могут представлять собой синтетические или искусственные варианты, например полученные или имеющие происхождение путем модификации (например мутации) аминокислотных последовательностей SEQ ID NO: 2, 4 или 6 или нуклеотидных последовательностей SEQ ID NO: 1, 3 или 5. Как отмечено выше, можно использовать комбинации двух или более различных молекул нуклеиновой кислоты по изобретению. Альтернативно, молекула нуклеиновой кислоты по изобретению может содержать две или более различных нуклеотидных последовательностей, кодирующих полипептид, обладающий активностью алкогольдегидрогеназы, как определено в данном описании изобретения, или их комплемент. Модификации могут быть выбраны исходя из улучшенной активности метанолдегидрогеназы соответствующего варианта или, альтернативно, могут быть сконструированы исходя из алгоритмов проектирования белка, используя молекулярные структуры или модели для предсказания улучшенной ферментативной активности.
Полипептид MDH по настоящему изобретению может также включать полипептид, кодируемый фрагментом (частью) нуклеотидной последовательности SEQ ID NO: 1, 3 или 5, или может содержать или состоять из фрагмента (или части) аминокислотной последовательности SEQ ID NO: 2, 4 или 6. "Часть" нуклеотидной или аминокислотной последовательности по изобретению может включать или содержать по меньшей мере 50, 55, 60, 65, 70, 75, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% или более смежных нуклеотидов или аминокислот последовательности.
Организм-хозяин может представлять собой любой подходящий организм-хозяин, но, в частности, будет представлять собой микробный организм-хозяин (т.е. микроорганизм). Он может представлять собой любой прокариотический организм, но, конкретно, будет представлять собой бактерию. Можно использовать любую грамположительную или грамотрицательную бактерию, но конкретно упомянуть можно следующие классы или роды: Escherichia, Corynebacterium и Bacillus. Типичные организмы-хозяева включают Е.coli, В.subtilis и С.glutamicum. Как отмечено выше, можно также использовать В.methanolicus или другие метилотрофные организмы-хозяева, например Methylomonas, Methylobacillus, Methylobacterium, Methylophilus или Methylococcus. Однако настоящее изобретение не ограничивается этими организмами и распространяется на любого микробного хозяина.
С.glutamicum представляет собой палочковидную непатогенную и грамположительную почвенную бактерию. Он растет в аэробных и анаэробных условиях и является ауксотрофом по биотину. С.glutamicum способен к росту на ряде субстратов в виде единственных или комбинированных источников углерода и энергии. Среди субстратов метаболизируемыми являются сахара, как глюкоза, фруктоза или сахароза, и органические кислоты, такие как L-лактат и ацетат. Кроме того, С.glutamicum способен к росту на этаноле в качестве единственного источника углерода. Его широко используют для крупномасштабного промышленного производства аминокислот L-глутамата и L-лизина. Недавние исследования в метаболической инженерии показали, что С.glutamicum также способен продуцировать ряд других интересных с коммерческой точки зрения соединений, например другие L-аминокислоты, D-аминокислоты, диамины, такие как кадаверин или путресцин, органические кислоты, такие как сукцинат, и биотопливо, такое как этанол или изобутанол.
Согласно настоящему изобретению одну или более чем одну молекулу нуклеиновой кислоты по изобретению можно экспрессировать в организме-хозяине, включая, в частности, по меньшей мере одну гетерологичную молекулу нуклеиновой кислоты (т.е. молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая является гетерологичной хозяину), и в частности содержащую гетерологичную последовательность, кодирующую полипептид MDH. Таким образом, организм-хозяин может быть модифицирован для экспрессии одной или более чем одной копии молекулы нуклеиновой кислоты или, альтернативно, может быть модифицирован для экспрессии одной или более чем одной копии ряда различных молекул нуклеиновой кислоты по изобретению.
Таким образом, микроорганизм, который модифицируют (или "конструируют") для экспрессии MDH согласно настоящему изобретению, будет содержать MDH-кодирующую молекулу нуклеиновой кислоты, введенную экзогенно, как определено в данном описании изобретения. Другими словами, организм можно трансформировать при помощи такой MDH-кодирующей молекулы нуклеиновой кислоты и его можно рассматривать как трансгенный или рекомбинантный организм. Как отмечено выше, молекула нуклеиновой кислоты может кодировать фермент MDH, который является гомологичным или гетерологичным (т.е. нативным или ненативным) этому хозяину. Таким образом, может быть введена еще одна (или более чем одна) копия гена, который является нативным хозяину. Молекула нуклеиновой кислоты, которую вводят, может содержать нуклеотидную последовательность, имеющую происхождение из нативного гена или из другого источника.
MDH можно экспрессировать в комбинации с другими ферментами, чтобы предоставить организму новые свойства.
"Экспрессия" при использовании в данном описании изобретения относится к транскрипции нуклеотидной последовательности в мРНК и последующей трансляции указанной мРНК в полипептидный продукт.
Как изложено в данном описании изобретения, "сверхэкспрессия" означает, что экспрессия нуклеотидной последовательности повышена по сравнению с или относительно уровнем(я) экспрессии, имеющем(го) место в организме, который не был модифицирован согласно изобретению. Экспрессию можно рассматривать в пересчете на количество продуцируемого полипептидного продукта (например фермента MDH), которое может быть определено посредством любого подходящего способа, известного в данной области техники. Например, экспрессию можно определять путем измерения активности белка (т.е. активности экспрессируемого полипептида MDH). Альтернативно, количество продуцируемого белка можно измерять для определения уровня экспрессии, например, вестерн-блоттингом или другими системами обнаружения антител или, действительно, посредством любого способа оценки или количественного определения белка. Можно также использовать ПЦР (полимеразную цепную реакцию) в реальном времени. Анализ может представлять собой анализ in vivo или in vitro.
Активность может быть определена путем анализа на активность алкогольдегидрогеназы посредством способов, известных в данной области техники и описанных в литературе, например, как подробно изложено в Примерах ниже. Активность MDH кодируемого белка может, например, катализировать превращение метанола в формальдегид, и указанную активность определяют в данном описании изобретения как количество фермента, необходимого для продуцирования 1 мкмоль НАДН в минуту, для которого можно использовать в качестве субстрата различные спирты, например этанол, метанол, пропанол, бутанол, пентанол, гексанол, изопропанол и 1,3-пропандиол. Активности алкогольдегидрогеназ можно измерять спектрофотометрически, как описано ранее в Hektor et al. (2002; Chem 277(49): 46966-46973).
Полипептид алкогольдегидрогеназу можно экспрессировать или сверхэкспрессировать посредством любого способа, известного в данной области техники, такого как введение молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид MDH, например копии нативного гена, например, экспрессирующейся из более сильного или нерегулируемого промотора относительно нативного гена, и/или введение множества копий MDH-кодирующей молекулы нуклеиновой кислоты.
Организм можно также конструировать для введения дополнительных или альтернативных регуляторных элементов.
В конкретном воплощении MDH-кодирующая молекула нуклеиновой кислоты может быть экспрессирована из ненативного или гетерологичного промотора (т.е. промотора, который является гетерологичным MDH-кодирующей нуклеотидной последовательности, т.е. не является нативным промотором гена MDH), и в частности сильного, ненативного или гетерологичного промотора. Таким образом, в конкретном воплощении MDH-кодирующий ген не применяют с его нативным промотором. Можно вводить MDH-кодирующий ген, который находится под контролем ненативного промотора. Как изложено в данном описании изобретения, сильный промотор представляет собой промотор, который экспрессирует ген с высоким уровнем или по меньшей мере с более высоким уровнем, чем под действием его нативного промотора. Термин "сильный промотор" представляет собой термин, хорошо известный и широко используемый в данной области техники, и множество сильных промоторов известно в данной области техники или может быть идентифицировано путем рутинного экспериментирования. Альтернативно, промотор представляет собой промотор mdh В.methanolicus. Однако выбор промотора конкретно не ограничен.
Альтернативно, ген MDH можно экспрессировать, используя нативный промотор. Изобретение охватывает применение микроорганизма, который может эндогенно экспрессировать ген mdh или который не делает этого. В первом случае, может быть введена одна или более чем одна дополнительная копия нативного гена или его варианта либо другой MDH или кодирующей молекулы нуклеиновой кислоты, и они могут быть введены под контролем нативного или ненативного промотора. С нативным промотором можно использовать, например, многокопийный вектор. Во втором случае, вводят MDH (или кодирующую молекулу нуклеиновой кислоты), которая является гетерологичной этому хозяину, но которая может находиться под контролем промотора, который является нативным или ненативным гену MDH, из которого имеет происхождение кодирующая молекула нуклеиновой кислоты.
Способы введения генов или молекул нуклеиновой кислоты хорошо известны в данной области техники и широко описаны в литературе, и можно использовать любой желаемый способ. Таким образом, ген (молекулу нуклеиновой кислоты) можно вводить, используя вектор, который может представлять собой автономно реплицирующийся вектор или вектор, который позволяет гену (молекуле нуклеиновой кислоте) интегрироваться в геном хозяина (например, хромосому). Таким образом, ген (молекулу нуклеиновой кислоты), подлежащий экспрессии, можно вводить в экспрессионный вектор и затем экспрессионный вектор можно вводить в клетку-хозяина. Способы конструирования экспрессионных векторов и введения их в клетки-хозяева хорошо известны в данной области техники. Подходящим образом, можно вводить ген, кодирующий MDH, используя плазмидный вектор, и микроорганизм-хозяина можно трансформировать при помощи плазмиды, например путем электропорации. Выбор способа может зависеть от используемого микроорганизма. Способы введения нуклеиновых кислот и векторов в микроорганизмы хорошо известны и широко описаны в литературе.
Молекула нуклеиновой кислоты предпочтительно кодирует полипептид или белок, представляющий собой MDH или ее часть, обладающую активностью MDH.
Предпочтительно, молекула нуклеиновой кислоты, как она определена в частях (1)-(6) выше, кодирует полипептид или белок, имеющий или сохраняющий функцию или активность или свойства полипептида MDH, как определено аминокислотными последовательностями любой из SEQ ID NO: 2, 4 или 6.
Термины "полипептид" и "белок" используют взаимозаменяемо в данном описании изобретения и включают аминокислотную цепь любой длины (т.е. любой полимер или олигомер аминокислот).
Как отмечено выше, изобретение распространяется на части или функциональные фрагменты нуклеотидных последовательностей, определенных выше, посредством чего подразумевают части или фрагменты, которые кодируют белок или полипептид, который имеет такую же или по существу такую же активность, что и полноразмерный белок, как определено выше. Тесты для определения того, имеет ли белок/полипептид, кодируемый такой частью или фрагментом, такую же или по существу такую же активность (например, каталитическую или ферментативную активность), что и полноразмерный полипептид/белок, как определено выше, включают тесты, рассмотренные выше. Обычно части или функциональные фрагменты молекул нуклеиновой кислоты имеют только небольшие делеции относительно полноразмерной молекулы нуклеиновой кислоты, например делеции менее 50, 40, 30, 20 или 10 нуклеотидов, например на 5'-конце, кодирующем N-конец белка, на 3'-конце, кодирующем С-конец белка, или внутри кодирующей области, хотя более значительные делеции, например по меньшей мере 60, 70, 80, 90, 100, 150, 200, 300, 400, 500, 600 или 700 нуклеотидов, или делеции менее 60, 70, 80, 90, 100, 150, 200, 300, 400, 500, 600 или 700 нуклеотидов также могут быть осуществлены, если фрагмент имеет такую же или по существу такую же активность (например, каталитическую или ферментативную активность), что и полноразмерный белок, как определено выше. Активность кодируемого полипептида или белка можно легко протестировать, чтобы определить, имеет ли он такую же активность, что и полноразмерный полипептид или белок, например как изложено выше.
Типичные части или фрагменты могут содержать по меньшей мере 50% и предпочтительно по меньшей мере 60, 70, 75, 80, 85, 90 или 95% смежных нуклеотидов нуклеотидной последовательности, представленной в SEQ ID NO: 1, 3 или 5. Типичные размеры части или фрагмента включают по меньшей мере 620, 700, 800, 850, 900, 950, 1000, 1050, 1100 и 1150 нуклеотидов.
Более короткие фрагменты молекулы нуклеиновой кислоты по изобретению можно использовать в качестве зондов, например для ПЦР или протоколов гибридизации. Более короткие фрагменты могут составлять, например, 10-30, 20-25 нуклеотидов в длину. Такие зонды полезны в протоколах идентификации дополнительных молекул нуклеиновой кислоты, которые имеют гомологию с молекулами нуклеиновой кислоты по изобретению.
Термин "молекула нуклеиновой кислоты" при использовании в данном описании изобретения относится к полимеру РНК или ДНК, который является одно- или двухцепочечным, возможно содержащему синтетические, неприродные или измененные нуклеотидные основания. Примеры таких полинуклеотидов включают среди прочего кДНК, геномную ДНК и дцРНК (двухцепочечную РНК). Предпочтительно, молекула нуклеиновой кислоты представляет собой ДНК.
Хотя последовательности нуклеиновой кислоты, относящиеся к данному описанию изобретения, содержат нуклеотид тимидин ("t"), понятно, что изобретение также относится к соответствующим последовательностям, где тимидин замещен уридином ("u").
Как отмечено выше, данное изобретение включает молекулы нуклеиновой кислоты, которые представляют собой варианты молекул нуклеиновой кислоты SEQ ID NO: 1, 3 или 5, конкретно функционально эквивалентные варианты. Таким образом, "вариантные" молекулы нуклеиновой кислоты могут иметь одно или множество нуклеотидных изменений по сравнению с молекулами нуклеиновой кислоты SEQ ID NO: 1, 3 или 5. Например, варианты могут иметь 1, 2, 3, 4 или 5 или более добавлений, замен, вставок или делеций нуклеотидов.
В еще одном аспекте изобретения предложен белок (или полипептид), обладающий активностью алкогольдегидрогеназы, конкретно MDH, как определено выше в данном описании изобретения.
Белок или полипептид предпочтительно представляет собой MDH или ее часть, обладающую активностью MDH. Более конкретно, эта часть сохраняет функцию или активность свойств MDH, из которой она имеет происхождение (как определено посредством ссылки на аминокислотную последовательность SEQ ID NO: 2, 4 или 6).
Белок или полипептид может быть альтернативно определен при помощи ссылки на кодирующие последовательности нуклеиновой кислоты, и как таковой белок или полипептид по изобретению может быть кодирован любыми молекулами нуклеиновой кислоты по изобретению, как описано выше.
Изобретение распространяется на функциональные части или фрагменты полноразмерных молекул белка, под которыми подразумевают части или фрагменты, которые обладают такой же или по существу такой же акти