Амид 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты, обладающий противовирусной активностью, и способ его получения
Иллюстрации
Показать всеИзобретение относится к амиду 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты, обладающему избирательной противовирусной активностью в отношении вируса гриппа А и вируса герпеса простого первого типа, имеющего структурную формулу
.
Изобретение также относится к способу получения амида. Технический результат: получено новое соединение, обладающее противовирусной активностью. 2 н.п. ф-лы, 2 ил., 3 пр.
Реферат
Изобретение относится к биоорганической химии, в частности способу получения производных 1,2,4-триазол-3-карбоксамида, обладающих противовирусной активностью. Изобретение может быть использовано для лечения вирусных инфекций человека, а также в химико-фармацевтической промышленности.
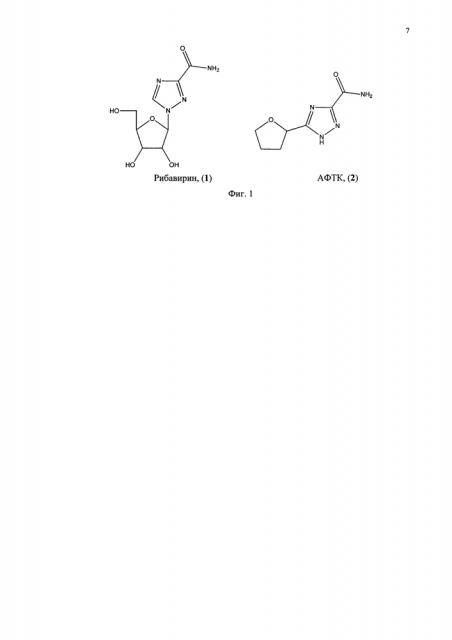
В современной лечебной практике активно используется препарат рибавирин (1-бета-D-рибофуранозил-1,2,4-триазол-3-карбоксамид, соединение 1, фиг. 1) в терапии респираторно-синцитиальной вирусной инфекции, геморрагической лихорадки с почечным синдромом, а также при гриппе А- и В-типов и комплексной терапии гепатита С [Combination antiviral therapy for respiratory virus infections. Hayden F. G. Antiviral Research. 1996. No. 29. P. 45-48; The broad-spectrum antiviral ribonucleoside ribavirin is an RNA virus mutagen. Crotty S., Maag D., Arnold J. J., Zhong W., Lau J. Y., Hong Z., Andino R., and Cameron С.E. Nature Medicine. 2000. V. 6. P. 1375-1379; Mechanisms of action of ribavirin in antiviral therapies. Tarn R. C, Lau J. Y, Hong, Z. Antiviral Chemistry and Chemotherapy. 2001. V. 12. P. 261-272; Ribavirin for patients with Crimean-Congo haemorrhagic fever: a systematic review and meta-analysis. Ascioglu S., Leblebicioglu H., Vahaboglu H., Chan K.A. J. Antimicrob Chemother 2011, vol. 66, pp. 1215-1222; Early addition of ribavirin to interferon in chronic hepatitis с not responsive to interferon monotherapy. Bellobuono A., Monadazzi L., Tempini S., Chiodo F., Magliano E., Furione L., Ideo G. J. Hepatol. 2000. V. 33. P. 463-468.]. Одним из побочных эффектов при применении рибавирина является дозозависимая гемолитическая анемия. Также рибавирин обладает тератогенным эффектом. Работы по получению новых соединений на основе 1,2,4-триазол-3-карбоксамида, обладающих низкой системной токсичностью и высокой противовирусной активностью носят крайне актуальный характер.
Предметом изобретения является амид 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты (АФТК, соединение 2, фиг. 1). При полном отсутствии цитотоксичности (>1000 мкг/мл) в экспериментах in vitro АФТК обладает избирательной противовирусной активностью в отношении инфекции, вызванной высоко патогенным вариантом вируса гриппа А птиц/H5N1 in vitro: способен сохранять клетки жизнеспособными при введении его непосредственно после инфицирования клеток СПЭВ (ингибирующая доза 50 (ИД50) для АФТК составляет 75.0 мкг/мл). Также показано, что АФТК достоверно селективно подавляет репродукцию вируса герпеса простого первого типа в клетках Vero Е6, в концентрациях, в 2.5 меньших, чем ИД50 противовирусного препарата рибавирина (Sigma), используемого в качестве препарата сравнения.
Известен наиболее близкий к заявленному способ проведения реакции получения 5-замещенных 1,2,4-производных триазола конденсацией β-N-ациламидразонов под действием хлорангидридов соответствующих карбоновых кислот (М.В. Чудинов. Новые подходы к синтезу низкомолекулярных производных 1,2,4-триазола // М.В. Чудинов, А.В. Матвеев, Н.И. Журило, В.В. Простакова, В.И. Швец, Вестник МИТХТ им. М.В. Ломоносова, 2011, т. 6, №2, с. 66-70.; Chudinov M.V. An Efficient Route to Ethyl 5-Alkyl- (Aryl)-1H-1,2,4-triazole-3-carboxylates, Journal of Heterocyclic Chemistry / Chudinov M.V., Matveev A.V., Zhurilo N.I., Prutkov A.N. and Shvets V.I. // Journal of Heterocyclic Chemistry. - 2015. - V. 52. - p. 1273-1277.). Однако этот подход для получения 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоксамида не использовался.
Изобретение решает задачу разработки эффективного способа получения соединения АФТК (соединение 2, фиг. 1) - производного 1,2,4-триазол-3-карбоксамида с тетрагидрофурановым заместителем по С5-положению. АФТК синтезирован впервые, в литературе в открытой печати не описан.
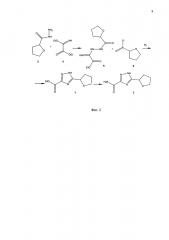
Поставленная задача решается посредством замыкания 1,2,4-триазольного цикла взаимодействием этил имино[2-(тетрагидрофуран-2-илкарбонил)-гидразино]ацетата с хлорангидридом тетрагидрофуран-2-карбоновой кислоты при нагревании до кипения в пиридине. Схема синтеза представлена на фиг. 2.
Технический результат достигается следующим образом:
1) На первом этапе синтеза гидразид тетрагидрофуранил-2-карбоновой кислоты (соединение 3, фиг. 2) конденсируют с диэтиловым эфиром карбонилформимидной кислоты (соединение 4, фиг. 2),
2) Полученный этил имино[2-(тетрагидрофуран-2-илкарбонил)гидразино]ацетат (соединение 5, фиг. 2) обрабатывают хлорангидридом тетрагидрофуран-2-карбоновой кислоты (соединение 6, фиг. 2).
3) На последнем этапе проводят аммонолиз этилового эфира 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты (соединение 7, фиг. 2) и получают целевое соединение - амид 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты (соединение 2, фиг. 2).
Соединение 2 (АФТК) может входить в эффективной терапевтической дозе в качестве действующего вещества в состав фармацевтической композиции для использования в виде лекарственного средства, обладающего активностью против вируса гриппа А и вируса простого герпеса первого типа.
Изобретение иллюстрируют графические изображения.
Фиг. 1. Структура рибавирина и амида 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты (АФТК).
Фиг. 2. Схема синтеза АФТК.
Схема получения соединения АФТК состоит из трех этапов. Первый этап синтеза включает конденсацию гидразида тетрагидрофуранил-2-карбоновой кислоты (3) с диэтиловым эфиром карбонилформимидной кислоты (4). На втором этапе полученный этил имино[2-(тетрагидрофуран-2-илкарбонил)гидразино]ацетат (5) обрабатывают хлорангидридом тетрагидрофуран-2-карбоновой кислоты (6). Заключительный этап - аммонолиз этилового эфира 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты (7) с получением целевого соединения - амида 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты (АФТК).
Изобретение иллюстрируют примеры.
Пример 1
Этил имино[2-(тетрагидрофуран-2-илкарбонил)гидразино]ацетат (соединение 5, фиг. 2)
Раствор 3.25 г (25 ммоль) гидразида тетрагидрофуранил-2-карбоновой кислоты (соед. 3) в этиловом спирте (10 мл) добавляют к суспензии 4.54 г (25 ммоль) гидрохлорида диэтилового эфира карбонилформимидной кислоты (4) в том же растворителе (10 мл). После 24 часов перемешивания к образовавшейся суспензии добавляют водный раствор гидрокарбоната натрия (10 мл 4М). Растворитель из реакционной массы частично удаляют на роторном испарителе (20 мм рт.ст.). Выпавшие кристаллы отделяют фильтрованием, промывают на фильтре водой (1 мл), высушивают на воздухе и используют без дальнейшей очистки. Выход 4.87 г сырого продукта (соединение 5, фиг. 2).
Пример 2
Этиловый эфир 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты (соединение 7, фиг. 2)
К суспензии 0.98 г (4.24 ммоль) соединения (5) в 10 мл абсолютного пиридина при перемешивании прибавляют по каплям 0.65 г (4.85 ммоль) хлорангидрида тетрагидрофуран-2-карбоновой кислоты (соединение 6, фиг. 2). Реакционную массу нагревают до кипения с обратным холодильником и продолжают кипячение в течение 4 часов. Ход реакции контролируют по ТСХ в системе хлороформ - метанол (5%). После окончания реакции растворитель удаляют на роторном испарителе (20 мм рт.ст.). Образующееся масло растворяют в 25 мл этилацетата и промывают 10 мл 1М раствора хлороводорода, а затем 10 мл 1М раствора гидрокарбоната натрия. Органическую фазу сушат безводным сульфатом натрия. Осушитель отфильтровывают, растворитель из фильтрата удаляют на роторном испарителе (20 мм рт.ст.), полученную смесь очищают посредством колоночной хроматографии на силикагеле в системе хлороформ - метанол (с градиентом метанола от 0 до 2%). Фракции, содержащие целевой продукт объединяют и растворитель удаляют на роторном испарителе (20 мм рт.ст.). Конечный продукт получают перекристаллизацией остатка после колоночной хроматографии из 2 мл толуола. Выпавший осадок отфильтровывают и промывают небольшим количеством толуола. Выход 0.41 г (41%).
1Н ЯМР-спектр (CDCl3) (δ, м.д., J, Гц): 1.38 (3Н, т, J=7.14, СН3 Et); 1.89-2.08 (2Н, м, 4'-СН2); 2.17-2.30 (1H, м, 3'-СН2); 2.37-2.49 (1Н, м, 4'-СН2); 3.89-4.05 (2Н, м, 5'-СН2); 4.44 (2Н, кв, J=7.1, СН2 Et); 5.19 (1Н, дд, J1=7.66, J2=5.88, 2'-СН).
13С ЯМР-спектр (CDCl3) δ м.д.: 14.10 (СН3 Et); 25.57 (С4'); 31.75 (С3'); 61.97 (СН2 Et); 69.28 (С5'); 73.67 (С2'); 154.40 (С3); 159.75 (С5); 160.35 (COOEt).
Пример 3
Амид 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты (соединение 2, фиг. 2)
Раствор 0.40 г (1.93 ммоль) этилового эфира 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты (соединение 7, фиг. 2) в 3 мл 10 М раствора аммиака в метаноле нагревают с обратным холодильником до 50°С при постоянном перемешивании и выдерживают при данной температуре в течение 96 часов, каждые 12 часов добавляя по 0.5 мл 30% водного аммиака. Ход реакции контролируют по ТСХ в системе хлороформ - метанол (10%). После окончания реакции растворитель удаляют в вакууме. Остаток перекристаллизовывают из 3 мл этилацетата. Выпавшие кристаллы отфильтровывают и промывают небольшим количеством этилацетата. Выход 0.29 г (85%).
1Н ЯМР-спектр (ДМСО-d6) (δ, м.д., J, Гц): 6.57-6.60 и 6.63-6.65 (1Н, м, 4'-СН); 6.89 и 6.97 (1Н, 2 д, J=3.29 и J=3.34, 3'-СН); 7.74 (1Н, с, NH2); 7.82 (1Н, д, 5'-СН); 8.02 (1H, 1c, NH2).
13С ЯМР-спектр (ДМСО-d6) δ м.д.: 108.36 и 109.43 (С4'); 111.49 и 111.84 (С3'); 143.15 и 143.96 (С5'); 145.29 и 147.18 (С2'); 152.34 и 153.85 (С3), 153.37 и 155.04 (С5), 159.65 и 159.94 (CONH2).
m/z для молекулярного иона [C7H6N4O2+H]+ вычислено 179.0564; найдено 179.0560.
1. Амид 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты, обладающий избирательной противовирусной активностью в отношении вируса гриппа А и вируса герпеса простого первого типа, имеющий структурную формулу:
2. Способ получения соединения по п. 1, основанный на конденсации гидразида тетрагидрофуранил-2-карбоновой кислоты с диэтиловым эфиром карбонилформимидной кислоты с получением этила имино[2-(тетрагидрофуран-2-илкарбонил)гидразино]ацетата, который обрабатывают хлорангидридом тетрагидрофуран-2-карбоновой кислоты при нагревании до кипения в пиридине. Полученный этиловый эфир 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты подвергают аммонолизу с образованием амида 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты.