Бета-шпилечный полипептид, обладающий антимикробной активностью
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к пептидной химии, и может быть использовано в медицине. Получены синтетические пептиды на основе бета-шпилечных полипептидов. Изобретение обеспечивает получение пептидов с высокой антимикробной активностью в отношении грамположительных и грамотрицательных бактерий. 5 ил., 1 табл., 5 пр.
Реферат
Изобретение относится к области биотехнологии и может быть использовано в медицине и ветеринарии.
Открытие антибиотиков в XX веке произвело революцию в области лечения и профилактики инфекционных заболеваний различной этиологии. Тем не менее, за годы, прошедшие со времени открытия первых антибиотиков, бесконтрольное применение этих веществ привело к распространению устойчивых штаммов бактерий. Зарегистрированы случаи множественной устойчивости к традиционным антибиотикам ряда ключевых патогенов человека [Breithaupt Н. The new antibiotics // Nat Biotechnol. - 1999. - Vol. 17. - P. 1165-1169]. Попытки преодоления сложившейся ситуации путем модификации химической структуры применяемых антибиотиков дают лишь временный эффект. В связи с непрерывным ростом устойчивости, увеличивающимся в последние годы, внутрибольничные бактериальные инфекции все чаще становятся причиной смерти пациентов, подвергающихся инвазивным процедурам, а дальнейшее лечение вновь зараженных пациентов создает серьезную нагрузку для системы здравоохранения в целом. Даже в экономически развитых странах наблюдается высокий уровень смертности после инфицирования внутрибольничными инфекциями, при этом более половины случаев связано с грамотрицательными микроорганизмами [Gaynes R., Edwards J.R. Overview of nosocomial infections caused by gram-negative bacilli // Clinical Infectious Diseases. - 2005. - Vol. 41. - P. 848-54], физиология которых зачастую обуславливает высокую толерантность к антибиотикотерапии. В течение последних 45 лет в клиническую практику были введены пять новых классов антибиотиков, однако все они эффективны лишь в отношении грамположительных бактерий [Butler M.S., Blaskovich М.В., Cooper M.A. Antibiotics in the clinical pipeline in 2013 // The Journal of Antibiotics. - 2013. - Vol. 66. - P. 571-591]. Существование проблем мульти- и кроссрезистентности делает необходимым поиск антимикробных препаратов с принципиально новыми механизмами действия.
В последние годы внимание исследователей и фармацевтических компаний привлекает возможность использования в этих целях препаратов на основе эндогенных антимикробных пептидов (АМП) животного происхождения. Как показали исследования второй половины XX века, АМП, вырабатываемые клетками иммунной системы и эпителиальных тканей и выполняющие как прямую эффекторную (антибиотическую), так и регуляторную (иммуномодуляторную) функцию, являются ключевыми компонентами врожденного иммунитета [Jenssen Н., Hamill P., Hancock R.E.W. Peptide Antimicrobial Agents // Clin. Microbiol. Rev. - 2006. - Vol. 19(3). - P. 491-511]. Эффекторная функция антимикробных пептидов объясняется мембранотропными свойствами, обусловленными амфифильной катионной структурой их молекул, а в ряде случаев - наличием внутриклеточных мишеней. Такой механизм действия и способность быстро уничтожать клетки-мишени сводит к минимуму вероятность развития резистентности со стороны микроорганизмов. Развитие резистентности патогенов к АМП менее вероятно, поскольку требует внесения существенных изменений в структуру и электрофизиологические свойства клеточной мембраны.
Фундаментальные структурно-функциональные исследования АМП тесно связаны с прикладными разработками: природные пептиды могут стать прототипами новых антибиотиков широкого спектра действия, способных решить проблему резистентности к существующим антимикробным средствам [Seo M.D., Won H.S., Kim J.H., Mishig-Ochir Т., Lee B.J. Antimicrobial peptides for therapeutic applications: a review // Molecules. - 2012. - Vol. 17(10). - P. 12276-86]. К числу наиболее активных и устойчивых к действию протеаз АМП животного происхождения относятся молекулы, образующие стабилизированную дисульфидными связями β-шпилечную структуру [Panteleev P.V., Bolosov I.A., Balandin S.V., Ovchinnikova T.V. Structure and biological functions of β-hairpin antimicrobial peptides // Acta Naturae. - 2015. - Vol. 7. - P. 100-110]. Благодаря стабильности пространственной структуры, АМП этой группы сохраняют свою активность в присутствии физиологических концентраций солей [Tarn J.P., Lu Y.A., Yang J.L. Design of salt-insensitive glycine-rich antimicrobial peptides with cyclic tricystine structures // Biochemistry. - 2000. - Vol. 39(24). - P. 7159-69]. Меньшие размеры молекулы и более простая пространственная организация, чем у большинства других цистеинсодержащих АМП (таких как дефенсины), упрощают задачу биотехнологического получения этих пептидов. Однако сравнительно высокая цитотоксичность природных пептидов ограничивает их применение в медицине. Недостатки АМП могут быть устранены, полностью или частично, путем модификации структуры природных пептидов и получения более стабильных, селективных и более дешевых в производстве модифицированных аналогов [Brogden N.K., Brogden K.А. Will new generations of modified antimicrobial peptides improve their potential as pharmaceuticals? // Int. J. Antimicrob. Agents. - 2011. - Vol. 38(3). - P. 217-25]. Особенностью бета-шпилечных АМП является высокая гидрофобность, которая негативно влияет на мембранную селективность, способствуя взаимодействию с цвиттерионными фосфолипидами, и, таким образом, обуславливает токсичность в отношении нормальных клеток млекопитающих. Как было показано, ранее в ходе структурно-функциональных исследований протегринов, терапевтический индекс АМП может быть повышен, в первую очередь, за счет снижения токсичности в отношении клеток организма-хозяина [Ostberg N., Kaznessis Y. Protegrin structure-activity relationships: using homology models of synthetic sequences to determine structural characteristics important for activity // Peptides. - 2005. - Vol. 26(2). - P. 197-206], которая, как правило, оценивается с помощью гемолитического теста.
Наиболее близким аналогом заявляемого изобретения являются ранее открытые представители семейства бета-шпилечных антимикробных пептидов [Panteleev P.V., Bolosov I.A., Balandin S.V., Ovchinnikova T.V. Structure and biological functions of β-hairpin antimicrobial peptides // Acta Naturae. - 2015. - Vol. 7. - P. 100-110]. Недостатком данных пептидов является сравнительно высокая цитотоксичность в отношении нормальных клеток млекопитающих.
Изобретение решает задачу расширения ассортимента полипептидов с высокой антимикробной активностью в отношении грамположительных и грамотрицательных бактерий за счет семейства искусственных аналогов природных бета-шпилечных антимикробных пептидов, имеющих аминокислотную последовательность SEQ ID NO: 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15.
Заявляемые полипептиды проявляют антибактериальную активность в отношении ряда грамположительных (Staphylococcus aureus) и грамотрицательных (Escherichia coli, Pseudomonas aeruginosa) бактерий, причем бактерицидный эффект in vitro достигается при действии в микромолярных концентрациях. Большинство заявленных полипептидов характеризуются низкими показателями гемолитического эффекта (<10%) при концентрации 50 мкМ. Техническим результатом изобретения является высокая антибактериальная активность заявляемых полипептидов в отношении грамположительных и грамотрицательных бактерий in vitro. Заявляемые полипептиды состоят из 17-21 аминокислотного остатка, содержат одну или две дисульфидные связи и не требуют осуществления ферментативных посттрансляционных модификаций, что делает предпочтительным их биотехнологическое получение в бактериальной системе. Заявляемые полипептиды могут быть получены путем гетерологической экспрессии в бактериальной системе на основе Е. coli, а также с помощью химического синтеза. Заявляемые полипептиды являются гомологами и проявляют схожую биологическую активность.
Изобретение иллюстрируют графические материалы.
Фиг. 1. Физическая карта плазмидного вектора для экспрессии бета-шпилечных полипептидов: NdeI, EcoRI, XhoI - сайты рестрикции; pBR322 origin - участок инициации репликации плазмиды; AmpR - ген устойчивости к β-лактамным антибиотикам; Т7 Promoter - промотор транскрипции; Т7 terminator - терминатор транскрипции; RBS - сайт связывания рибосомы; TrxA M37L - последовательность, кодирующая модифицированный тиоредоксин; His8 - последовательность, кодирующая восемь остатков гистидина; ALP1 - последовательность, кодирующая полипептид.
Фиг. 2. Электрофореграмма клеточного лизата, содержащего гибридный белок His8-TrxL-ALP2: 1 - стандарт молекулярных масс; 2 - суммарный клеточный белок до индукции IPTG; 3 - суммарный клеточный белок после индукции IPTG. Стрелкой указан гибридный белок His8-TrxL-ALP2.
Фиг. 3. Хроматограмма очистки рекомбинантного полипептида ALP2 (SEQ ID No. 2) методом обращенно-фазовой ВЭЖХ (1 - пик, соответствующий целевому полипептиду).
Фиг. 4. MALDI масс-спектр полипептида ALP9 (SEQ ID No. 9), полученного генно-инженерным способом.
Фиг. 5. Цитотоксическое действие бета-шпилечных полипептидов на человеческие эритроциты.
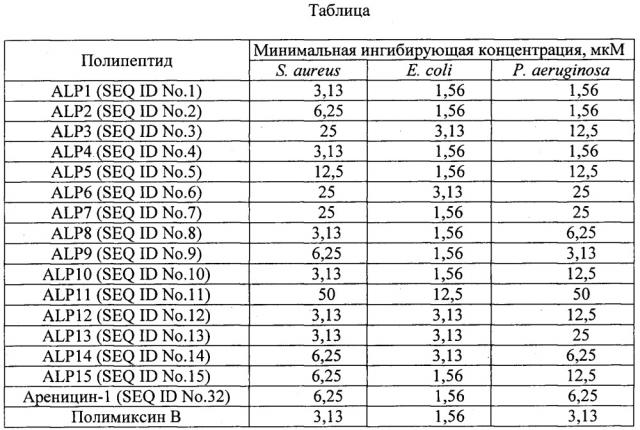
Таблица. Антибактериальная активность бета-шпилечных полипептидов.
Изобретение иллюстрируют примеры.
Пример 1.
Получение плазмидных конструкций для гетерологической экспрессии полипептидов в составе гибридных белков
Нуклеотидные последовательности SEQ ID No. 16 - No. 30, кодирующие полипептиды SEQ ID No. 1 - No. 15 получают химико-ферментативным синтезом с помощью ПЦР.
Олигонуклеотиды, используемые в ПЦР, синтезируют твердофазным фосфоамидитным методом с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфамидитов - 5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-О-β-цианэтилдиизопропиламино)-фосфитов, активированных тетразолом. Синтез с помощью ПЦР проводят таким образом, чтобы целевая последовательность фланкировалась с 5'-конца сайтом узнавания рестриктазы BglII и остатком метионина, необходимым для расщепления гибридного белка His8-TrxL-ALP бромцианом, а с 3'-конца стоп-кодоном ТАА и сайтом узнавания рестриктазы EcoRI.
Для получения экспрессирующей конструкции используют плазмидный вектор (SEQ ID No. 31), получаемый следующим образом. Плазмиду pET31b (Novagen) гидролизуют рестриктазами NdeI и XhoI, очищают электрофорезом в 0,8% агарозном геле и по сайтам узнавания рестриктаз NdeI и XhoI лигируют с фрагментом, кодирующим последовательно связанные гистидиновый октамер, тиоредоксин с заменой M37L и полилинкер, включающий сайты BamHI и EcoRI. Фрагмент, кодирующий модифицированный белок-носитель тиоредоксин (M37L), получают методом ПЦР-амплификации и направленного мутагенеза с помощью ген-специфических праймеров, используя в качестве исходной матрицы плазмиду рЕТ32а(+), содержащую ген тиоредоксина. Остальные участки последовательности фрагмента получают путем последовательного отжига и элонгации взаимно перекрывающихся олигонуклеотидов, а также отжига, элонгации и амплификации промежуточных продуктов синтеза. Плазмиду обрабатывают рестриктазами BamHI и EcoRI, получая линеаризованный вектор (SEQ ID No. 31).
На завершающей стадии синтеза каждую из последовательностей SEQ ID No. 16 - No. 30, фланкированных сайтами узнавания рестриктаз BglII и EcoRI, гидролизуют данными рестриктазами и лигируют с полученным вектором (SEQ ID No. 31), гидролизованным рестриктазами BamHI и EcoRI. В результате лигазной реакции получают кольцевую ковалентно замкнутую ДНК размером 4 тыс.п.н. (Фиг. 1). Продуктами лигазной реакции трансформируют компетентные клетки Escherichia coli DH10B, приготовленные с помощью 0,1 М хлорида кальция. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 1 ч при 37°С и высевают на чашки Петри с LB-агаром, содержащим 50 мкг/мл ампициллина.
Первичный отбор клонов, содержащих нужную плазмиду, осуществляют методом «ПЦР с клонов» с использованием праймеров, специфичных к области Т7 терминатора и вставке. Отобранные клоны подращивают в жидкой питательной среде и выделяют плазмидную ДНК, которую анализируют на наличие вставки с помощью рестрикционного анализа. Окончательное строение плазмид, содержащих требуемый фрагмент, подтверждают определением нуклеотидной последовательности с помощью секвенирования по Сэнгеру. По данным секвенирования отбирают плазмиды со вставками, нуклеотидные последовательности которых полностью соответствует запланированным (SEQ ID No. 16 - No. 30).
Пример 2.
Получение рекомбинантных бета-шпилечных полипептидов
Проводят трансформацию компетентных клеток Escherichia coli BL21(DE3), приготовленных с помощью 0,1М хлорида кальция, плазмидами, описанными в примере 1. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 1 ч при 37°С и высевают на чашки Петри с LB-агаром, содержащим 100 мкг/мл ампициллина и 0,02 М глюкозы. Чашки инкубируют при 37°С в течение 18 ч.
Бактериологической петлей переносят выросшие колонии в 10 мл жидкой среды LB, содержащей 150 мкг/мл ампициллина, растят в течение 18 ч на термостатируемой качалке со скоростью вращения 220 об⋅мин-1 при температуре 37°С. Полученную культуру засевают в жидкую питательную среду LB, содержащую 0,02 М глюкозы, 100 мкг/мл ампициллина, 1 мМ MgSO4, при этом начальная OD600 составляет 0,05. Индукцию биосинтеза гибридного белка осуществляют путем добавления изопропилтио-β-D-галактопиранозида (IPTG) к культуре клеток с оптической плотностью 0,8 до конечной концентрации 0,2 мМ. Культуру растят в течение 5 ч при температуре 30°С на термостатируемой качалке со скоростью вращения 220 об⋅мин-1. Контроль за уровнем экспрессии гибридного белка осуществляют методом денатурирующего SDS-электрофореза в полиакриламидном геле. В ходе экспериментов достигается высокий уровень экспрессии гибридного белка His8-TrxL-ALP, причем для различных полипептидов он варьируется от 20 до 30%. Расчетные молекулярные массы гибридных белков составляют от 15,3 до 16 кДа (Фиг. 2).
После экспрессии клетки осаждают центрифугированием, ресуспендируют в фосфатном буфере (рН 7.8) с добавлением 6М гуанидин гидрохлорида и 20 мМ имидазола при помощи стеклянного гомогенизатора Поттера и разрушают путем ультразвуковой обработки. Лизат клеток центрифугируют при 25000 g в течение 20 мин. Все работы по получению осветленного лизата проводят при температуре 4°С. Очистку гибридного белка, содержащего в качестве аффинной метки октагистидиновую последовательность, осуществляют с помощью металлохелатной хроматографии на препаративной колонке с Ni-NTA агарозой в денатурирующих условиях. Элюцию проводят повышением концентрации имидазола в буфере до 0,5 М. Собранную после очистки с помощью металлохелатной хроматографии фракцию, содержащую белок, титруют концентрированной соляной кислотой до значения рН 1,0, после чего добавляют равную массу бромциана (1 г бромциана на 1 г белка) и выдерживают при температуре 25°С в защищенном от света месте в течение 18 ч. Реакцию останавливают добавлением пятикратного объема деионизированной воды, после чего упаривают образцы на вакуумной центрифуге до исходного объема раствора и титруют до нейтральных значений рН. Превращение N-концевого остатка глутамина (Q) в структуре полипептидов в пироглутаминовую кислоту (Z, pGlu) осуществляют путем инкубации смеси после удаления бромциана в течение двух суток в условиях рН 1,0 и температуре 25°С.
Финальную стадию очистки полипептидов проводят методом обращенно-фазовой ВЭЖХ (ОФ-ВЭЖХ) на колонке Reprosil-Pur C18-AQ в системе водных буферов, содержащих ацетонитрил и 0,1% ТФУ. Разделение происходит в градиенте от 5% до 80% ацетонитрила. Выход полипептидов детектируют по изменению оптического поглощения при длине волны 214 нм (Фиг. 3). Концентрацию водных растворов очищенных полипептидов определяют методом спектрофотометрии по поглощению при 280 нм и расчетным коэффициентам экстинкции.
Пример 3.
Определение молекулярной массы бета-шпилечных полипептидов
Соответствие относительных молекулярных масс полученных рекомбинантных полипептидов расчетным значениям, а также индивидуальность очищенных веществ подтверждают с помощью масс-спектрометрического анализа на приборе Reflex III (Bruker Daltonics), оснащенном УФ-лазером с длиной волны 336 нм, с регистрацией положительных ионов в рефлекторном режиме. В качестве матрицы используют 2,5-дигидроксибензойную кислоту в смеси, содержащей 20% ацетонитрил и 0,1% трифторуксусную кислоту. Пик с m/z 2175,6 (Фиг. 4) соответствует молекулярному иону полипептида ALP9 (SEQ ID No. 9) (расчетная молекулярная масса 2175,2), что свидетельствует об образовании двух дисульфидных связей. По аналогичной схеме анализируют остальные полипептиды. Значения молекулярных масс, полученных в результате масс-спектрометрического анализа, совпадают с расчетными значениями.
Пример 4.
Установление антибактериальных свойств бета-шпилечных полипептидов
Антибактериальную активность полипептидов определяют методом двукратных серийных разведений в 96-луночных планшетах в жидкой питательной среде LB/2 и инкубации с грамположительными (Staphylococcus aureus 209Р) и грамотрицательными (Escherichia coli С600, Pseudomonas aeruginosa PAOl) тестовыми культурами. В качестве антибактериальных соединений сравнения используют бета-шпилечный антимикробный пептид ареницин-1 (SEQ ID No. 32), который имеют сходную первичную структуру молекулы, а также антибиотик полимиксин В. Тест-культуры высевают из консерва в 10 мл жидкой среды LB без антибиотика и растят в течение 18 ч при 37°С и 220 об⋅мин-1. После этого аликвоту культуры объемом 300 мкл добавляют к 6 мл среды LB/2 и инкубируют в термостатируемой качалке при 37°С до достижения культурой оптической плотности OD600 1,0. Далее методом последовательных разведений в питательной среде LB титруют тестовые культуры до концентрации 2×105 КОЕ/мл в случае грамотрицательных бактерий и 2×106 КОЕ/мл в случае грамположительных бактерий. Аликвоты тест-культуры объемом 50 мкл добавляют к 50 мкл растворов полипептидов, предварительно разведенных от 50 до 0,4 мкМ в пересчете на конечную концентрацию в лунке. После добавления культуры планшет инкубируют в течение 24 ч при 37°С и интенсивном перемешивании (1000 об⋅мин-1). Значения минимальных ингибирующих концентраций (МИК) определяются визуально и спектрофотометрически как минимальная концентрация полипептида, при которой отсутствует рост культуры. Эксперименты проводятся в течение трех раз в трехкратной повторности, причем итоговый МИК рассчитывается как медиана девяти полученных значений. Полученные данные представлены в Таблице. Большинство приведенных в примере полипептидов обладают сопоставимой (значение МИК не превышает таковое для пептида сравнения более чем в 2 раза) антибактериальной активностью с ареницином-1 (SEQ ID No. 32).
Пример 5.
Тестирование гемолитической активности бета-шпилечных полипептидов
Для тестирования гемолитической активности полипептидов использовались свежевыделенные человеческие эритроциты. Для предотвращения свертывания к цельной крови добавляли цитратный буфер. Кровь центрифугируют в растворе фиколла и урографина, плотностью 1,077 г/мл, в течение 15 мин при 1500 об⋅мин-1. Фракцию эритроцитов отбирают со дна и трижды промывают двадцатью объемами изотонического натрий-фосфатного буфера (рН 7,4), последовательным осаждением эритроцитов путем центрифугирования при 2000 об⋅мин-1 в течение 10 мин. После отмывки готовят 8% суспензию эритроцитов в изотоническом натрий-фосфатном буфере.
Для теста в 96-луночном планшете готовят серии двойных разведений исследуемых полипептидов от 50 до 1,56 мкМ (в пересчете на конечную концентрацию) объемом 50 мкл. После этого к растворам полипептидов добавляют по 50 мкл 8% суспензии эритроцитов. Планшет инкубируют в течение 1,5 ч при 37°С и перемешивании 1000 об⋅мин-1. После инкубации, планшеты центрифугируют в течение 15 мин при 3000 об⋅мин-1 для осаждения интактных эритроцитов. Далее аликвоты супернатанта переносят в другой планшет для измерения количества свободного гемоглобина. Оценку количества гемоглобина в растворе осуществляют по поглощению раствора при 405 нм. В качестве отрицательного контроля (K-) используют супернатант, полученный после центрифугирования эритроцитов, инкубировавшихся в растворе натрий-фосфатного буфера без добавления полипептидов. В качестве положительного контроля (K+) используют супернатант, полученный после центрифугирования эритроцитов, инкубировавшихся в 0,1% водном растворе неионогенного детергента Triton Х-100, вызывающего их полный лизис. Эксперименты проводят в течение двух раз с кровью одного и того же человека в трехкратной повторности.
Процент гемолиза рассчитывают по формуле
Гемолиз (%)=(OD405 пробы - OD405 «K-»)×100/(OD405 «K+» - OD405 «K-»).
Полученные зависимости гемолиза от концентрации полипептидов представлены на Фиг 5. Все приведенные в примере полипептиды обладают пониженной гемолитической активностью по сравнению с ареницином-1 (SEQ ID No. 32).
Бета-шпилечный полипептид с высокой антимикробной активностью в отношении грамположительных и грамотрицательных бактерий, имеющий аминокислотную последовательность SEQ ID NO: 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15.