Гликозилированные полипептиды и лекарственные композиции, содержащие данные полипептиды
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению гликозилированных полипептидов, обладающих сродством к соматостатиновым рецепторам, и может быть использовано в медицине для лечения или профилактики связанных с соматостатином заболеваний. Гликозилированные полипептиды SRIF14 и SRIF28 получают путем гликозилирования Asn или Cys. Изобретение обеспечивает получение гликозилированных полипептидов, обладающих сродством к соматостатиновым рецепторам и лучшей стабильностью в крови по сравнению с соматостатином. 8 н. и 6 з.п. ф-лы, 19 ил., 10 табл., 88 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение имеет отношение к гликозилированным полипептидам и фармацевтическим композициям, содержащим данные полипептиды.
УРОВЕНЬ ТЕХНИКИ
Соматостатин - это циклический пептид, который присутствует и в центральной нервной системе, и в окружающей ткани. Соматостатин был впервые выделен из гипоталамуса млекопитающих и идентифицирован из передней доли гипофиза как важный ингибитор секреции гормона роста. Этот пептид широко распространен, напр., в гипоталамусе, поджелудочной железе и в желудочно-кишечном тракте, а его действие осуществляется посредством связывания с рецептором соматостатина. Кроме того, известно, что соматостатин подавляет секрецию гормона роста (GH) и тиреотропного гормона (TSH) в гипофизе, а также подавляет секрецию различных гормонов, таких как гастрин, селектин, холецистокинин (CCK) и VIP (вазоактивный кишечный полипептид) в желудочно-кишечном тракте и глюкагон и инсулин в поджелудочной железе. Также известно, что он обладает способностью подавлять подвижность желудочно-кишечного тракта.
Природный соматостатин, имеющий структурную формулу: Ala-Gly-Cys-Lys-Asn-Phe-Phe-Trp-Lys-Thr-Phe-Thr-Ser-Cys (SEQ ID NO. 1) (также известный как фактор, ингибирующий высвобождение соматотропина (SRIF)), был впервые выделен Guillemin и соавт. Данный соматостатин проявляет свое действие при взаимодействии с семейством рецепторов. Соматостатиновые рецепторы (SSTR) подразделяются на 5 подтипов (SSTR1-SSTR5), из которых SSTR2 распространен в каждой из тканей секретирующей GH аденомы гипофиза человека, центральной нервной системы, передней доли гипофиза, сетчатки, мозгового вещества надпочечников, желудка, слизистой двенадцатиперстной кишки, тонкого кишечника и толстой кишки, а также в секретирующих глюкагон А-клетках островков поджелудочной железы. Каждый из этих рецепторов также экспрессируется в различных опухолях. Например, сообщалось, что SSTR1 и SSTR5 экспрессируются в функциональной аденоме гипофиза, а SSTR2, равно как SSTR1 и SSTR3, экспрессируются в опухолях желудочно-кишечного тракта, SSTR3 экспрессируется в феохромоцитоме, SSTR1 и SSTR5 экспрессируются в опухолях простаты, а SSTR5 экспрессируется при колоректальном раке (непатентный документ 1). Кроме того, в отношении SSTR4 известно, что он функционирует как рецептор, обладающий антагонистическим модулирующим действием, и существует возможность его применения при лечении связанных с глаукомой заболеваний (непатентный документ 2). Таким образом, соматостатин и его аналоги являются потенциально полезными лечебными препаратами для связанных с соматостатином заболеваний или различных типов опухолей.
Между тем, поскольку природный соматостатин имеет короткий период полужизни в крови - всего 2-3 мин, он обладает двумя нежелательными свойствами: низкой биодоступностью и короткой продолжительности действия, поэтому его применение в качестве лечебного препарата ограничено. По этой причине были разработаны различные аналоги соматостатина с тем, чтобы найти аналог соматостатина, превосходящий его по эффективности, биостабильности, продолжительности действия или по избирательности в отношении подавления высвобождения гормона роста, инсулина или глюкагона.
Сообщалось, что октреотид (патентные документы 1 и 2) является первым утвержденным аналогом соматостатина, который может применяться в клинике, причем этот октреотид обладает сродством к соматостатиновым рецепторам SSTR2, SSTR3 и SSTR5.
Октреотид был разработан как циклический пептид, состоящий из 8 аминокислот, содержащий последовательность из 4 аминокислот (Phe-Trp-Lys-Thr), которая важна для проявления биологической активности соматостатина, Cys, который образует дисульфидную (S-S) связь на двух концах последовательности, а также D-Phe и Thr(ol) снаружи от Cys на двух концах. Этот октреотид может оказывать продолжительное действие путем улучшения времени полужизни в крови по своей аминокислотной последовательности, а также обладает большей избирательностью к гормону роста (GH), чем соматостатин, что способствует усилению его действия.
Такие аналоги соматостатина, в том числе октреотид, могут применяться для лечения пациентов с секретирующими гормоны и зависящими от гормонов опухолями. В настоящее время с помощью октреотида лечатся симптомы, связанные с метастатическими карциноидными опухолями, которые являются опухолями нейроэндокринной системы (приливы, диарея, заболевания сердечных клапанов и боли в животе), и симптомы, связанные с секретирующей вазоактивный интестинальный пептид (VIP) аденомой (водянистая диарея).
Например, при карциноидных и VIP-продуцирующих опухолях октреотид ингибирует и секрецию, и действие своего активного фактора. Соответственно, при VIP-продуцирующих опухолях, характеризующейся обильной диареей, аналог соматостатина может уменьшить диарею путем ингибирования секреции VIP, а также непосредственным воздействием на кишечную секрецию.
Однако, с другой стороны, многие эндокринные опухоли обладают устойчивостью к таким аналогам соматостатина, как октреотид (непатентный документ 3). Более того, хотя октреотид применяется при лечении акромегалии, сообщалось, что он не оказывает действия примерно на треть больных акромегалией. Далее, отмечено, что у большинства пациентов с карциноидными опухолями октреотид оказывает действие только во время первоначального применения и вызывает тахифилаксию при увеличении продолжительности введения. Также сообщалось, что октреотид не оказывает никакого эффекта на подавление продукции адренокортикотропного гормона (АСТН) у больных на ранней стадии болезни Кушинга.
В свете вышеизложенных проблем, требуется разработать такие аналоги соматостатина, которые бы связывались с несколькими подтипами рецепторов с высоким сродством, подобно природному соматостатину, для опухолей, экспрессирующих множественные рецепторы соматостатина, и предполагается, что аналог соматостатина, обладающий таким сродством к рецепторам соматостатина, мог бы оказывать действие на таких пациентов, у которых последние аналоги соматостатина оказались терапевтически неэффективными, или же устойчивых к ним (непатентный документ 4).
Соответственно, нужно разработать аналог соматостатина, имеющий структуру, близкую природному соматостатину, обладающий аналогичным сродством к рецепторам соматостатина и обладающий большим временем полужизни в крови по сравнению с соматостатином.
Между тем, становится ясно, что сахаридные цепочки отвечают за различные роли in vivo, и уже предложен способ присоединения сахаридных цепочек к октреотиду с тем, чтобы увеличить его время полужизни в крови (как-то патентный документ 3).
Однако исследования задерживаются вследствие сложности или разнообразия его структуры и нельзя сказать, что тип сахаридной цепочки или положение для вставки сахаридной цепочки всегда оптимальны. Еще не было сообщений о гликозилированном полипептиде, который бы преодолел проблемы последних аналогов соматостатина.
Список цитирования
Патентные документы
Патентный документ 1: U.S. Patent No. 4,310,518.
Патентный документ 2: U.S. Patent No. 4,235,886.
Патентный документ 3: Japanese Published Unexamined Patent Application Publication No. Hei 03 (1991)-014599.
Непатентные документы
Непатентный документ 1: Currrent Opinion in Pharmacology, 2004, Vol.4, pp. 608-
Непатентный документ 2: J. Med. Chem., 2003, Vol. 46, pp. 5587-5596.
Непатентный документ 3: Mol. Endocrinol., 2010, Vol. 24 (1), pp. 240-249.
Непатентный документ 4: Molecular and Cellular Endocrinology, 2008, Vol. 286, pp. 69-74.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задачи, поставленные перед изобретением
Целью настоящего изобретения является получение гликозилированных полипептидов, обладающих сродством к рецепторам соматостатина и лучшей стабильностью в крови по сравнению с соматостатином.
Средства для решения задач
В результате многократных исследований для решения вышеуказанных проблем авторы настоящего изобретения обнаружили гликозилированные полипептиды, которые сохраняют сродство к рецепторам соматостатина и обладают лучшей стабильностью в крови.
Иными словами, настоящее изобретение имеет отношение к гликозилированным полипептидам, выбранным из группы, состоящей из: (A) SRIF14, состоящего из аминокислотной последовательности, представленной SEQ ID NO. 1; (B) полипептидов, у которых одна или несколько аминокислот подверглись делеции, замене или вставке по сравнению со SRIF14, состоящим из аминокислотной последовательности, представленной SEQ ID NO. 1; (С) аналогов SRIF14; (D) полипептидов, на 80% или больше гомологичных SRIF14, состоящему из аминокислотной последовательности, представленной SEQ ID NO. 1; (E) полипептидов, дополнительно содержащих N аминокислот (где N означает целое число от 1 или больше до 20 или меньше) на N-концевой стороне (А)-(D); и (F) полипептидов, дополнительно содержащих M аминокислот (где М означает целое число от 1 или больше до 6 или меньше) на C-концевой стороне (A)-(D); которые отличаются тем, что у них по меньшей мере одна аминокислота заменена на гликозилированную аминокислоту, а полипептид обладает сродством к соматостатиновым рецепторам.
При этом одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что у них по меньшей мере одна из аминокислот, замененных на гликозилированные аминокислоты, представлена аминокислотой, соответствующей положению 19 у SRIF14.
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что у данного полипептида (E) по меньшей мере одна аминокислота заменена на гликозилированную аминокислоту, причем по меньшей мере одна из аминокислот, замененных на гликозилированные аминокислоты, приходится на какую-либо из указанных N аминокислот на N-концевой стороне данного полипептида (E).
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что у данного полипептида (F) по меньшей мере одна аминокислота заменена на гликозилированную аминокислоту, причем по меньшей мере одна из аминокислот, замененных на гликозилированные аминокислоты, приходится на какую-либо из указанных М аминокислот на N-концевой стороне данного полипептида (F).
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что у данного полипептида (E) по меньшей мере одна аминокислота заменена на гликозилированную аминокислоту, а также последовательность из указанных N аминокислот, добавленных с N-концевой стороны, представлена X-Y-, где X означает последовательность из любых L аминокислот (где L означает целое число от 1 или больше до 6 или меньше), а Y означает аминокислот подверглись делеции, замене или вставке по сравнению с вышеприведенными последовательностями (2)-(14).
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что по меньшей мере одна из аминокислот, замененных на гликозилированные аминокислоты, приходится на какую-либо из L аминокислот, обозначенных как X в X-Y-, представляющем последовательность из N аминокислот, добавленных с N-концевой стороны полипептида (E).
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что N аминокислот, добавленных с N-концевой стороны, соединяются с N-концевой стороной через линкер.
Далее, в другом воплощении гликозилированных полипептидов настоящего изобретения полипептид выбран из группы, состоящей из: (A) SRIF28, состоящего из аминокислотной последовательности, представленной SEQ ID NO. 2; (B) полипептидов, у которых одна или несколько аминокислот подверглись делеции, замене или вставке по сравнению со SRIF24, состоящим из аминокислотной последовательности, представленной SEQ ID NO. 2; (C) аналогов SRIF28; (D) полипептидов, на 80% или больше гомологичных SRIF28, состоящему из аминокислотной последовательности, представленной SEQ ID NO. 2; (E) полипептидов, дополнительно содержащих J аминокислот (где J означает целое число от 1 или больше до 15 или меньше) на N-концевой стороне (A)-(D); и (F) полипептидов, дополнительно содержащих K аминокислот (где K означает целое число от 1 или больше до 6 или меньше) на C-концевой стороне (A)-(D); которые отличаются тем, что у них по меньшей мере одна аминокислота заменена на гликозилированную аминокислоту, а полипептид обладает сродством к соматостатиновым рецепторам.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что по меньшей мере одна из аминокислот, замененных на гликозилированные аминокислоты, представлена по меньшей мере одной аминокислотой, выбранной из группы, состоящей из аминокислоты, соответствующей положению 1, аминокислоты, соответствующей положению 5, аминокислоты, соответствующей положению 9, аминокислоты, соответствующей положению 12, аминокислоты, соответствующей положению 13, аминокислоты, соответствующей положению 14, и аминокислоты, соответствующей положению 19 у SRIF28.
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что у данного полипептида (E) по меньшей мере одна аминокислота заменена на гликозилированную аминокислоту, причем по меньшей мере одна из аминокислот, замененных на гликозилированные аминокислоты, приходится на указанные J аминокислот на N-концевой стороне данного полипептида (E).
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что у данного полипептида (F) по меньшей мере одна аминокислота заменена на гликозилированную аминокислоту, причем по меньшей мере одна из аминокислот, замененных на гликозилированные аминокислоты, приходится на указанные K аминокислот на N-концевой стороне данного полипептида (F).
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что по сродству к соматостатиновым рецепторам они обладают сродством по меньшей мере к двум или нескольким рецепторам, выбранным из группы, состоящей из SSTR1, SSTR2, SSTR3, SSTR4 и SSTR5.
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что они обладают сродством по меньшей мере к одному из SSTR1 и SSTR4.
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что они обладают сродством и к SSTR1, и к SSTR4.
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что они обладают сродством ко всем из SSTR1, SSTR2, SSTR3, SSTR4 и SSTR5.
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что они обладают повышенной стабильностью в крови по сравнению со SRIF28.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что каждая из гликозилированных аминокислот представлена гликозилированным Asn или гликозилированным Cys.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что у каждой из гликозилированных аминокислот сахаридная цепочка соединяется с аминокислотой без линкера.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что у каждой из гликозилированных аминокислот сахаридная цепочка состоит из 4 или больше сахаридов.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что у каждой из гликозилированных аминокислот сахаридная цепочка представлена биантеннальной сахаридной цепочкой комплексного типа, триантеннальной сахаридной цепочкой комплексного типа или тетраантеннальной сахаридной цепочкой комплексного типа.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что у каждой из гликозилированных аминокислот сахаридная цепочка представлена биантеннальной сахаридной цепочкой комплексного типа.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что биантеннальная сахаридная цепочка комплексного типа представлена сахаридной цепочкой, выбранной из группы, состоящей из дисиалосахаридной цепочки, моносиалосахаридной цепочки, асиалосахаридной цепочки, диGlcNAc-сахаридной цепочки и диманнозосахаридной цепочки.
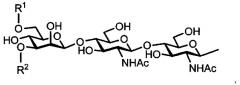
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что у каждой из гликозилированных аминокислот сахаридная цепочка представлена следующей формулой:
[химическая формула 1]
где R1 и R2 одинаковы или различны и означают:
[химическая формула 2]
а Ac означает ацетил.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что сахаридная цепочка содержит по меньшей мере одну сиаловую кислоту на невосстанавливающем конце, а карбоксигруппа данной сиаловой кислоты модифицирована алкиламиногруппой, бензилом, аминогруппой или аминоэтиламино-группой, содержащей 1-30 атомов углерода.
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что они содержат несколько гликозилированных аминокислот, причем сахаридные цепочки на каждой из гликозилированных аминокислот все одинаковы.
Далее, в одном воплощении гликозилированных полипептидов настоящего изобретения такие гликозилированные полипептиды отличаются тем, что они содержат Cys в положениях, соответствующих Cys в положении 17 и Cys в положении 28 у SRIF28, причем эти Cys связаны друг с другом дисульфидной связью.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что С-конец у таких гликозилированных полипептидов амидирован.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что на N-конце таких гликозилированных полипептидов вставлена азидогруппа.
Далее, одно воплощение гликозилированных полипептидов настоящего изобретения отличается тем, что они помечены меткой.
Далее, следующий аспект настоящего изобретения касается фармацевтических композиций, отличающихся тем, что они содержат (I) гликозилированный полипептид, описанный выше, и/или его фармацевтически приемлемую соль, и (II) фармацевтически приемлемый носитель.
Далее, одно воплощение фармацевтических композиций настоящего изобретения отличается тем, что сахаридные цепочки у данного гликозилированного полипептида практически одинаковы.
Далее, одно воплощение фармацевтических композиций настоящего изобретения отличается тем, что они применяются для лечения или профилактики связанных с соматостатином заболеваний.
Далее, одно воплощение фармацевтических композиций настоящего изобретения отличается тем, что связанное с соматостатином заболевание представляет собой по меньшей мере одно заболевание, выбранное из группы, состоящей из акромегалии, гигантизма, болезни Альцгеймера и других форм деменции, рака, продуцирующих гормоны опухолей, эндокринных опухолей, карциноидов, VIРомы, инсулиномы, глюкагономы, болезни Кушинга, нарушений секреции гормонов, диабета и его осложнений, болей, артрита, диареи, язвы желудка, воспалительной болезни кишечника, синдрома раздраженного кишечника, желудочно-кишечной непроходимости, непроходимости кишечника, послеоперационного рестеноза, радиационного повреждения, глазных заболеваний, сухости глаз, глаукомы, интерстициального кератита, ирита, катаракты и конъюнктивита.
Далее, следующий аспект настоящего изобретения касается способа лечения или профилактики связанных с соматостатином заболеваний, который отличается введением эффективного количества описанных выше гликозилированных полипептидов.
Далее, одно воплощение способа лечения или профилактики настоящего изобретения отличается тем, что связанное с соматостатином заболевание представлено по меньшей мере одним заболеванием, выбранным из группы, состоящей из акромегалии, гигантизма, болезни Альцгеймера и других форм деменции, рака, продуцирующих гормоны опухолей, эндокринных опухолей, карциноидов, VIРомы, инсулиномы, глюкагономы, болезни Кушинга, нарушений секреции гормонов, диабета и его осложнений, болей, артрита, диареи, язвы желудка, воспалительной болезни кишечника, синдрома раздраженного кишечника, желудочно-кишечной непроходимости, непроходимости кишечника, послеоперационного рестеноза, радиационного повреждения, глазных заболеваний, сухости глаз, глаукомы, интерстициального кератита, ирита, катаракты и конъюнктивита
Эффекты изобретения
Гликозилированные полипептиды настоящего изобретения обладают сродством к соматостатиновым рецепторам и обладают улучшенной стабильностью в крови по сравнению с соматостатином. Кроме того, гликозилированные полипептиды настоящего изобретения могут применяться для лечения связанных с соматостатином заболеваний в силу вышеприведенных характеристик.
Далее, поскольку сахаридные цепочки, вставленные в гликозилированный соматостатин настоящего изобретения, легко разрушаются in vivo, то не возникает никаких вызванных препаратом проблем при их накоплении в живом организме.
Далее, часть или все сахаридные цепочки, вставленные в гликозилированный соматостатин настоящего изобретения, представлены сахаридами, присутствующими в живом организме, напр., млекопитающих и птиц, в том числе и людей, или же их модифицированными вариантами, то возможность проявления побочных эффектов или антигенности при введении in vivo низка. Существует меньше опасений по поводу, напр., появления аллергических реакций или выработки антител и тем самым потери эффекта препарата.
Кроме того, поскольку многие сахаридные цепочки, используемые при этом, относительно коротки, то можно получить цепочки с однородной структурой, минуя сложные производственные операции. Соответственно, можно стабильно получать в больших масштабах высококачественные гликозилированные полипептиды фармацевтического уровня, обладающие активностью соматостатина.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1A-1D представлены названия каждого соединения гликозилированных полипептидов из воплощений настоящего изобретения и информация об аминокислотной последовательности гликозилированных полипептидов с указанием названия соединения. Далее, на фиг. 1E представлен график, на котором приведены значения IC50 в отношении подавления продукции цАМФ (агонистической активности) при обработке экспрессирующих соматостатиновые рецепторы клеток SRIF14, SRIF28 и гликозилированными полипептидами из воплощений настоящего изобретения.
На фиг. 2 представлены графики изменения концентрации в плазме каждого полипептида при внутривенном или подкожном введении крысам SRIF28 и S1C(дисиало)-SRIF28. На фиг. 2 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 3 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам SRIF28, S1C(дисиало)-SRIF28, N5C(дисиало)-SRIF28 и S1C(дисиало)⋅N5C(дисиало)-SRIF28. На фиг. 3 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 4 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам SRIF28, S1C(дисиало)-SRIF28, S1C(дисиало)-R13C(дисиало)-SRIF28 и S1C(дисиало)⋅N5C(дисиало)⋅A9C(дисиало)-SRIF28. На фиг. 4 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 5 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(дисиало)-SRIF28, N5C(дисиало)-SRIF28, A9C(дисиало)-SRIF28, S1C(дисиало)⋅N5C(дисиало)-SRIF28, N5C(дисиало)⋅A9C(дисиало)-SRIF28 и S1C(дисиало)⋅N5C(дисиало)⋅A9C(дисиало)-SRIF28. На фиг. 5 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 6 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(дисиало)-SRIF28, S1-2С(дисиало)-SRIF2 и S1-3С(дисиало)-SRIF28. На фиг. 6 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 7 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(дисиало)-SRIF28, S1C(дисиало(амид))-SRIF28 и S1C(дисиало(аминоэтиламид))-SRIF28. На фиг. 7 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 8 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(дисиало)-SRIF28, SD1C(дисиало)-D-Trp22-SRIF28 и S1C(дисиало(Bn))-SRIF28. На фиг. 8 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 9 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(дисиало)-SRIF28, R13C(дисиало)-SRIF28 и K14C(дисиало)-SRIF28. На фиг. 9 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 10 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(дисиало)-SRIF28, E12C(дисиало)-SRIF28, N19C(дисиало)-SRIF28, 29C(дисиало)-SRIF28, S1C(моносиалo)-SRIF28 и S1C(асиало)-SRIF28. На фиг. 10 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 11 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(дисиало)-SRIF28, К14С(дисиало)-SRIF28 и C(дисиало)-SRIF14. На фиг. 11 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 12 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам C(дисиало)-SRIF14, C(дисиало)-линкер C12-SRIF14 и C(дисиало)-линкер PEG-SRIF14. На фиг. 12 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 13 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам SRIF28, S1C(дисиало)-SRIF28, S1C(асиало)-SRIF28, S1C(диGlcNAc)-SRIF28, S1C(диMan)-SRIF28 и S1C(GlcNAc)-SRIF28. На фиг. 13 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 14 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(дисиало)-SRIF28, S1C(трисиало)-SRIF28, S1C(тетрасиало)-SRIF28, S1-2C(дисиало)-SRIF28 и S1C(Asn(дисиало))-SRIF28. На фиг. 14 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 15 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам SRIF28, S1C(дисиало)-SRIF28, S1-2С(дисиало)-SRIF28, S1-3C(дисиало)-SRIF28 и S1-4С(дисиало)-SRIF28. На фиг. 15 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 16 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам SRIF14, C(дисиало)-SRIF14, C(дисиало)-K-SRIF14, C(дисиало)-R-K-SRIF14, 2C(дисиало)-R-K-SRIF14 и 3C(дисиало)-R-K-SRIF14. На фиг. 16 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 17 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(асиало)-SRIF28, S1-2C(асиало)-SRIF28 и S1-3C(асиало)-SRIF28. На фиг. 17 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 18 представлены графики изменения концентрации в плазме при внутривенном или подкожном введении крысам S1C(дисиало)-SRIF28, S1-2C(дисиало)-SRIF28, S1-2C(асиало)-SRIF28, S1-2C(дисиало(амид))-SRIF28, S1-2C(дисиало(Bn))-SRIF28 и С(дисиало(аминоэтиламид))-S1C(дисиало)-SRIF28. На фиг. 18 слева представлены изменения концентрации в плазме каждого полипептида при внутривенном введении, а справа представлены изменения концентрации в плазме каждого полипептида при подкожном введении.
На фиг. 19 представлен график, на котором приведены результаты теста на стабильность в плазме при использовании плазмы крыс для гликозилированных полипептидов из воплощений настоящего изобретения.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
"Соматостатин" в настоящем изобретении означает SRIF14, состоящий из последовательности в 14 аминокислот, или SRIF28, состоящий из последовательности в 28 аминокислот.
В настоящем описании в качестве положения 1 принимается N-концевой Ser в аминокислотной последовательности SRIF28, а в качестве положения 28 - C-концевой Cys. SRIF14 абсолютно совпадает по аминокислотной последовательности в положениях 15-28 с аминокислотной последовательностью SRIF28. Следует отметить, что положение 15 в аминокислотной последовательности SRIF28 занимает Ala, а N-концевой Ala принят в качестве положения 15 в аминокислотной последовательности SRIF14 (SEQ ID NO. 1) в соответствии с положением 15 у SRIF28. SRIF14 и SRIF28 содержат дисульфидную связь по Cys в положении 17 и Cys в положении 28.
SRIF14 имеет приведенную ниже аминокислотную последовательность (SEQ ID NO. 1). В нижеприведенной аминокислотной последовательности 15 у "Ala15" означает Ala в положении 15:
SRIF28 имеет приведенную ниже аминокислотную последовательность (SEQ ID NO. 2):
"Аминокислота" в настоящем изобретении применяется в самом широком смысле и включает не только природные аминокислоты, но и не встречающиеся в природе аминокислоты, как-то варианты и производные аминокислот. Специалистам в свете этого широкого определения должно быть понятно, что примеры аминокислот в настоящем изобретении включают, напр., встречающиеся в природных белках L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, как-то варианты и производные аминокислот; не встречающиеся в природных белках аминокислоты, такие как норлейцин, β-аланин и орнитин; и химически синтезированные соединения, обладающие хорошо известными характерными свойствами аминокислот. Примеры не встречающихся в природе аминокислот включают α-метиламинокислоты (как-то α-метилаланин), D-аминокислоты, аминокислоты типа гистидина (как-то 2-аминогистидин, β-гидроксигистидин, гомогистидин, α-фторметилгистидин и α-метилгистидин), аминокислоты с добавлением метилена в боковой цепи ("гомо"-аминокислоты), и аминокислоты, у которых карбоксильная функциональная группа в боковой цепи аминокислоты замещена сульфонатом (типа цистеиновой кислоты). Как известно, некоторые из аналогов соматостатина, обладающих сродством к соматостатиновым рецепторам, содержат не встречающиеся в природе аминокислоты. В предпочтительном аспекте аминокислоты, содержащиеся в соединениях настоящего изобретения, состоят только из природных аминокислот.
В настоящем изобретении, если одна из аминокислот или несколько аминокислот подвергаются делеции, замене или вставке, то количество аминокислот при этом не имеет особых ограничений, если только сохраняется сродство к соматостатиновым рецепторам, причем оно составляет 1-9, предпочтительно 1-5 и более предпочтительно 1-3 аминокислоты, или же 20% или меньше, а предпочтительно 10% или меньше от всей длины. Аминокислоты, подлежащие замене или вставке, могут представлять собой природные аминокислоты, не встречающиеся в природе аминокислоты или аналоги аминокислот, предпочтительно природные аминокислоты. Примеры пептидов соматостатина, у которых одна из аминокислот или несколько аминокислот подверглись делеции, замене или вставке, включают, напр., пептиды соматостатина, у которых Trp в положении 22 заменен на D-форму Trp (D-Trp), Asn в положении 19 подвергнут делеции (J. Med. Chem., 2001, 44, 2238-2246), Phe в положении 25 заменен на Tyr, а Met в положении 8 заменен на Leu (Endocrinology, 1982, 10:1049-1051).
"Аналог SRIF14 или SRIF28" в настоящем изобретении означает полипептид, который по структуре близок к соматостатину, и/или полипептид, структура которого перекрывается со структурой соматостатина, напр., полипептид, у которого одна из аминокислот или несколько аминокислот соматостатина подверглись консервативной замене, модифицированный соматостатин, фрагмент соматостатина, обладающий сродством к соматостатиновым рецепторам, или удлиненный соматостатин, обладающий сродством к соматостатиновым рецепторам.
"У которого одна из аминокислот или несколько аминокислот соматостатина подверглись консервативной замене" в настоящем изобретении означает такие замены аминокислот, при которых показатели гидрофильности и/или гидрофобности остаются близкими между исходной аминокислотой и заменяющей ее аминокислотой, при этом не происходит явного снижения или уменьшения сродства к соматостатиновым рецепторам до и после такой замены.
"Модифицированный соматостатин" в настоящем изобретении означает модифицированный вариант соматостатина, включая природные варианты соматостатина или искусственно модифицированные соединения соматостатина. Примеры таких модификаций включают, напр., алкилирование, ацилирование (как-то ацетилирование), амидирование, карбоксилирование, образование сложных эфиров, образование дисульфидных связей, гликозилирование, липидирование, фосфорилирование, гидроксилирование и присоединение меченых компонентов к остаткам одной или нескольких аминокислот соматостатина.
"Фрагмент соматостатина, обладающий сродством к соматостатиновым рецепторам" в настоящем изобретении означает пептид, у которого произошла делеция одной или нескольких аминокислот из N- и/или C-конца соматостатина, но сохраняется сродство к соматостатиновым рецепторам.
"Удлиненный соматостатин, обладающий сродством к соматостатиновым рецепторам" в настоящем изобретении означает пептид, у которого произошла вставка одной или нескольких аминокислот к N- и/или C-концу SRIF28 или SRIF14, но сохраняется сродство к соматостатиновым рецепторам.
Гликозилированные полипептиды настоящего изобретения включают гликозилированные полипептиды, состоящие из аминокислотной последовательности, которая на 80% или больше гомологична аминокислотной последовательности, представленной SEQ ID NO. 1; полипептиды, состоящие из аминокислотной последовательности, которая на 80% или больше гомологична аминокислотной последовательности, представленной SEQ ID NO. 2; или полипептиды со вставкой дополнительных аминокислот к N- или С-концу этих полипептид