Способ получения безмаркерных трансгенных растений каланхоэ перистого, экспрессирующих ген цекропина р1
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу получения безмаркерных трансгенных растений каланхоэ, экспрессирующих ген цекропина P1. Изобретение позволяет создавать биобезопасные лекарственные растения каланхоэ с высоким уровнем накопления целевого продукта и в сокращенные по времени сроки. 6 з.п. ф-лы, 6 ил., 2 табл., 10 пр.
Реферат
Изобретение относится к области биотехнологии растений, к разработке способа получения безмаркерных трансгенных растений каланхоэ перистого экспрессирующих ген цекропина Р1.
Каланхоэ - род лекарственных растений, по данным NCBI GenBank насчитывающий 56 видов и дополнительно несколько изолятов, не относящихся ни к одному из известных видов. Сок многих видов каланхоэ, прежде всего, К. pinnata, К. daigremontiana и К. blossfeldiana используют для лечения ожогов, кожных ран, язв и как биостимулятор при пересадке кожи. В соке каланхоэ содержатся биологически активные вещества: флавоноиды, таннины, витамины, органические кислоты, полисахариды, антиоксиданты и микроэлементы [Сажина Н.Н., Лапшин П.В., Загоскина Н.В., Короткова Е.И., Мисин В.М. // Химия растительного сырья. 2013. №3. С. 113-119]. Каланхоэ стимулирует некоторые реакции, протекающие с участием иммунной системы человека. Экспрессия в растениях генов гетерологичных антимикробных пептидов (АМП) перспективна для повышения лечебных и бактерицидных свойств каланхоэ.
В настоящее время АМП рассматривают как эффективную альтернативу классическим антибиотикам. Микроорганизмы не обладают механизмами устойчивости против АМП в отличие от возможности приобретения резистентности к распространенным антибиотикам бактериального и грибного происхождения. В настоящее время установлена структура более 800 индивидуальных АМП. В концентрации 0,1-5 мкМ они проявляют литическую активность по отношению к различным микроорганизмам, включая как бактерии, там и патогенные грибы, но, как правило, не действуют на клетки животных и растений [Martemyanov К.А., Shirokov V.A., Kurnasov O.V., Gudkov A.T., Spirin A.S. Cell-free production of biologically active polypeptides: application to the synthesis of antibacterial peptide cecropin // Prot. Expr. Purif. 2001. V. 21. P. 456-461].
Трансгенные растения имеют преимущества в качестве «биофабрик» по производству белков медицинского назначения по сравнению с другими способами их получения [Kumar G.В.S., Ganapathl Т.R., Revathi С, J., Srinivas V.A., Bapat V.A. Expression of hepatitis В surface antigen in transgenic banana plants // Planta. 2005. V. 222. P. 484-493]. Как продуценты фармакологической субстанции, растения более безопасны, чем бактерии и грибы, так как многие из них полностью свободны от эндотоксинов, и их экстракты не нуждаются в очистке, а могут быть использованы в нативном виде. Себестоимость АМП, выделенных из трансгенных растений, в 20-30 раз ниже по сравнению с другими методами их получения (твердофазный синтез, получение из других источников). Кроме того, растения, как правило, не чувствительны к цитотоксическому действию АМП, что позволяет добиваться устойчивой продукции ими целевой субстанции как в течение жизни индивидуального растения, так и в ряду поколений.
Имеются единичные публикации по трансформации некоторых видов каланхоэ.
Получены трансгенные растения каланхоэ вида Kalanchoe daigremontiana, содержащие ген 6-фосфофрукто-2-киназу (35S/6-PF-2-K), клонированный в бинарный вектор pBin19 в штамме агробактерий Agrobacterium tumefaciens LBA4404 (pAL4404). Трансформация растений этим геном приводила к увеличению концентрации Fru2,6-P2 в листьях и, как следствие, к повышению устойчивости растений к стрессовым условиям [Truesdale M.R., Toldi О., Scott P. The effect of elevated concentrations of fructose 2.6 bisphosphate on carbon metabolism during deacidification in the crassulacean acid metabolism plant Kalanchoe daigremontiana // Plant physiology. 1999. V. 121. P. 957-964].
Этот способ трансформации имеет недостатки - длительность процедуры получения трансгенных растений - более 12 недель, а также в способе отсутствует органогенез и применена стадия каллусообразования, что повышает вероятность сомаклональной изменчивости, низкая эффективность трансформации - до 3%.
Известен способ получения трансгенных растений каланхоэ вида Блосфельдиана (Kalanchoe blossfeldiana) с уменьшенной чувствительностью к растительному гормону этилену, за счет экспрессии мутантного рецептора гена etr1-1 из арабидопсиса {Arabidopsis thaliana) под контролем цвето-специфичного промотора fbp1 из петунии {Petunia). Трансгенные растения обладали замедленной скоростью старения. [Sanikhani М., Mibus Н., Stummann В.М., Serek М. Kalanchoe blossfeldiana plants expressing the Arabidopsis etr1-1 allele show reduced ethylene sensitivity. Plant Cell Rep.2008. V. 27. P. 729-737]. В этой работе генетическую трансформацию каланхоэ проводили с помощью агробактерий Agrobacterium tumefaciens AGL0 с бинарным вектором рВЕО210:: etr1-1. Регенерацию листовых эксплантов проводили на селективной среде: 0.45 мкМ тидиазурон (ТДЗ), 0.57 мМ ИУК и антибиотики: 100 мг/л канамицин (Км) и 300 мг/л цефотаксим. Субкультивацию проводили через каждые 3 недели. Через 4 месяца побеги пересаживали на среду, содержащую 0.57 мМ гибберелловой кислоты (ГА) и 0.57 мМ нафтилуксусной кислоты (НУК) для элонгации и укоренения побегов. Через 3 месяца отдельные укорененные растения высаживали в почву.
Недостатком этого способа является длительность получения трансгенных растений - более 6 месяцев, причем растения содержали нежелательный селективный маркерный ген неомицинфосфотрансферазы II (nptII), низкая эффективность трансформации - до 3%.
Известен способ трансформации каланхоэ вида ласиниата (Kalanchoe laciniata). Листовые экспланты каланхоэ кокультивировали с агробактериальными штаммами Agrobacterium tumefaciens A208SE, Agrobacterium tumefaciens GV3111SE, Agrobacterium tumefaciens EHA101, несущими бинарный вектор pRDA93. Вектор содержал маркерные гены nptII (неомицинфосфотрансферазы II) и gus (β-глюкуронидазы) [Jia S-R., Yang M-Z., Ott R., Chua N-H. High frequency transformation of Kalanchoe laciniata // Plant Cell Reports. 1989. V. 8. P. 336-340]. Для получения трансгенных побегов использовали 3 стадии культивирования: 1-я стадия включала индукцию побегов на среде МС, содержащей 1 мг/л БА и 0.2 мг/л ИУК (индолилуксусной кислоты); 2-я стадия - элонгацию побегов на среде МС, содержащей 0.5 мг/л КТ и 0.1 мг/л ИУК. 3-я стадия - укоренение побегов - включала культивирование растений на среде, содержащей солей МС и 0.2 мг/л ИУК.
Перенос генов антимикробных пептидов в растения перспективно для повышения лечебных и бактерицидных свойств лекарственных растений, в частности каланхоэ.
Цекропин Р1 из паразитических кишечных нематод (прежде всего, из Ascaris suum) относится к группе линейных α-спиральных пептидов, не содержащих цистеина.
Цекропин Р1 в микромолярных концентрациях активен против патогенных грамотрицательных и грамположительных бактерий, фитопатогенных грибов и возбудителей микозов человека [Pillai A., Ueno S., Zhang Н., Lee J., Kato Y. Cecropin PI and novel nematode cecropins: a bacteria-inducible antimicrobial peptide family in the nematode Ascaris suum // Biochem. J. 2005. V. 390. P. 207-214].
Создание технологии биосинтеза цекропина P1 в безмаркерных растениях каланхоэ перистого представляется актуальным для его фармацевтического и медицинского использования.
В настоящее время актуальной задачей, решение которой обусловливает практическое внедрение в практику продуцентов АМП на основе каланхоэ, является получение растений с улучшенной биологической безопасностью, не содержащих селективных маркерных генов устойчивости к антибиотикам и гербицидам, которые традиционно служат для отбора трансгенных растений. Полученные с помощью селективных маркеров трансгенные растения представляют потенциальную биологическую опасность, связанную с риском неконтролируемого переноса находящихся в их геноме генов лекарственной устойчивости в сорные и культурные растения и микроорганизмы, включая патогенные для человека, животных и растений.
Описаны предпосылки создания безмаркерных трансгенных растений, лишенных этих недостатков, и обладающих повышенной безопасностью по сравнению с существующим поколением трансгенных растений:
- у полученных растений изначально нет селективных генов, которые требуется дополнительно вырезать в других способах создания безмаркерных трансгенных растений, а это трудоемкий процесс;
- трансформанты не подвергаются селективному стрессу, который может вызвать гиперметилирование ДНК и вследствие этого «замолкание» целевых генов;
- в геноме трансформантов меньше генетического мусора, а чем меньше генетическая конструкция переносимая в растения, тем выше вероятность экспрессии целевого гена;
- ускорен процесс получения растений с целевым геном, причем возможно сразу отбирать линии с высоким уровнем экспрессии трансгена [Рукавцова Е.Б., Лебедева А.А., Захарченко Н.С., Бурьянов Я.И. Пути создания биобезопасных трансгенных безмаркерных растений // Физиология растений. 2013. Т. 60. №1. С. 17-30].
Для получения биобезопасных безмаркерных растений необходимы специальные высокоэффективные методы трансформации, позволяющие полностью отказаться от селективных маркерных генов устойчивости к антибиотикам и гербицидам при отборе трансформированных проростков.
Известен способ трансформации путем вакуумной агроинфильтрации с культурой агробактерий. Под действием сниженного атмосферного давления агробактерий эффективнее проникают в растительную ткань, где обеспечивают перенос Т-ДНК во все типы клеток. Описан способ вакуумной инфильтрации для получения трансгенных растений сахарного тростника с применением агробактериальной трансформации [Mayavan S, Subramanyam К, Arun М, Rajesh М, Kapil Dev G, Sivanandhan G, Jaganath B, Manickavasagam M, Selvaraj N, Ganapathi A. Agrobacterium tumefaciens-mediated in planta seed transformation strategy in sugarcane // Plant Cell Rep.2013. V. 32. №10. P. 1557-1574]. Авторы использовали для выполнения модельных экспериментов штамм A. tumefaciens ЕНА105, несущий вектор pCAMBIA 1304-bar с клонированными генами GUS и GFP, в качестве селективного гена использовался ген nptII. Отсутствие необходимости в регенерации первичных трансформантов в этом способе позволяет в короткий срок проводить генотипический или фенотипический скрининг большого объема первичных клонов. Процедура вакуумной инфильтрации в этой работе включала 12 часовое предварительное проращивание семян, в присутствии суспензии агробактерий 10 минутную обработку ультразвуком и 3 минутную обработку вакуумом в растворе 100 мкМ ацетосирингона и 0,1% Silwett L-77 (organosilicone, используемый в качестве агента сокращения поверхностного натяжения). Кокультивирование семян с агробактериями длилось 72 часа. Методика была апробирована на пяти различных сортах сахарного тростника и показала сходные результаты для четырех из них. Эффективность трансформации составляла 45,4% в расчете на число взятых в эксперимент семян. Описанная методика позволила получить морфологически полноценные трансгенные растения через 2 месяца после начала эксперимента.
Недостатком этого способа является получение маркерных растений с нежелательным геном nptII.
Известен способ использования вакуумной инфильтрации для получения трансгенного редиса (Raphanus sativus) [Park B.-J., Liu Z., Kanno A., Kameya T. Transformation of radish (Raphanus sativus L.) via sonication and vacuum infiltration of germinated seeds with Agrobacterium harboring a group 3 LEA gene from B. napus // Plant Cell Rep.2005. V. 24. P. 494-500]. Авторы комбинировали обработку ультразвуком и вакуум-инфильтрацию для повышения эффективности внедрения в растительную ткань штамма A. tumefaciens LBA4404, несущего бинарный вектор pBI121-LEA с геном группы 3 позднего эмбрионального развития из рапса масличного (Brassica napus) и селективным маркерным геном nptII. В качестве растительного материала для трансформации использовали проростки длиной 1-2 см. Было установлено, что наилучший результат достигается при обработке ультразвуком и вакуумом в течение 5 мин.
Недостатком этого способа является также получение маркерных растений с нежелательным геном nptII.
Применение вакуум-инфильтрации для трансформации лекарственных растений описано в заявке на патент [WO 2014055659 Al, А01Н 5/00 (2006.01), А01Н 4/00 (2006.01), C12N 15/82,10 апр 2014. приоритет 3 окт 2012] Проводили трансформацию для родов Hydrastis (желтокорень канадский), Echinacea (эхинацея), Thymus (чабрец) и Calendula (календула) с целью получения рекомбинантных белков медицинского назначения: вироцидные пептиды циановирин (cyanovirin) или сцитовирин (scytovirin) из сине-зеленых водорослей Nostoc и Scytonema, соответственно, липопротеин В5 вируса осповакцины (vaccinia virus) или синтетическое антитело против сибиреязвенного токсина. Авторы описывают процедуру вакуум-инфильтрации эксплантов желтокорня канадского, каланхоэ и эхинацеи с целью повышения эффективности инокуляции ткани агробактериями, однако, не описывают применения этого приема в отношении семян растений каланхоэ.
Ранее авторами предлагаемого изобретения разработан способ получения генетически модифицированных маркерных растений каланхоэ перстого (Kalanchoe pinnata), экспрессирующих ген цекропина Р1 и обладающих антимикробной активностью против бактерий видов Staphylococcus aureus, Pseudomonas aeruginosa, Bacillus subtilis с помощью бинарного вектора pGA482 методом кокультивации листовых эксплантов с агробактериями [патент РФ 2445768. А01Н 1/00,27.03.2012]
Указанный способ включает сокультивирование эксплантов растений, выбранных из ряда растений вида Kalanchoe daigremontiana, Kalanchoe laciniata, Kalanchoe blossfeldiana, Kalanchoe pinnata, со штаммом бактерий Agrobacterium tumefaciens GV3101(pMP90RK), содержащим плазмиду pGA482, несущую ген пептида цекропина P1-СР1 и маркерный ген неомицинфосфотрансферазы II (nptII). После сокультивации экспланты помещают на питательную среду для элиминации агробактерий и прямой регенерации до фертильных трансгенных растений, имеющих внесенные гены и признаки исходного сорта. Для регенерации растений используют питательную среду МС, содержащую 6-бензиламинопурин (БАП) в количестве 0.5-1.0 мг/л и нафтилуксусную кислоту (НУК) в количестве 0.07-0.1 мг/л, для селекции используют антибиотик канамицин, а для элиминации агробактерий используют антибиотик тикарциллин и стимулирующую морфогенез добавку - банановый порошок.
Недостатком этого способа является получение канамицин-устойчивых трансгенных растений К. pinnata, содержащих в своем геноме маркерный ген неомицинфосфотрансферазы II (nptII) бактериального происхождения, который придает растениям устойчивость к канамицину. Поскольку селективный отбор регенерантов идет на питательной среде с высоким содержанием канамицина (50 мг/л), то регенерация сопровождается продолжительной антибиотической стрессовой нагрузкой на растение, что приводит к гиперметилированию ДНК и может вызывать снижение экспрессии или «замолкание» перенесенного целевого гена. Уровень экспрессии в данном способе составляет не более 0,002% от общего растворимого белка (ОРБ).
Наиболее близким к предлагаемому является ранее разработанный авторами прелагаемого изобретения способ получения безмаркерных трансгенных растений каланхоэ перистого (Kalanchoe pinnata), экспрессирующих ген антимикробного пептида цекропина Р1, включающий вакуумную инфильтрацию семян растений каланхоэ перистого (Kalanchoe pinnata L.) в присутствии агробактерий Agrobacterium tumefaciens СВЕ21 с использованием вектора рВМ, содержащего ген цекропина Р1. Для этого стерильные семена помещают в суспензию агробактерий СВЕ21 (рВМ::сесР1). В камере с сосудом с семенами создают вакуум 0,8 атм на 5 минут. После процесса агроинфильтрации семена проращивают на твердой питательной среде, а затем для элиминации агробактерий их перекладывают на среду МС, содержащую антибиотик цефотаксим [Захарченко Н.С., Бурьянов Я.И., Получение биобезопасных безмаркерных трансгенных растений каланхоэ перистого {Kalanchoe pinnata L.) с повышенной устойчивостью к биотическим стрессовым факторам. Всероссийская научная конференция «Факторы устойчивости растений в экстремальных природных условиях и техногенной среде». Иркутск. СИФИБР. 10-13 июня 2013 г. С. 89-92]. Трансгенную природу полученных первичных проростков определяют вестерн-блот анализом с антителами, специфичными к гену, кодирующему цекропин Р1 (СР1), антибиотический анализ индивидуальных растений проводят на штамме Erwinia carotovora.
Недостатком данного способа является то, что используемый в описанном способе антибиотик цефатоксим значительно ингибирует образование корней и снижает вследствие стрессового воздействия экспрессию целевого гена, которая в данном случае не превышает 0,005% от ОРБ.
Задачей настоящего изобретения является создание способа получения безмаркерных трансгенных растений каланхоэ перистого (Kalanchoe pinnata), экспрессирующих ген цекропина Р1 и пригодных для медицины и фармакологии.
Эта задача решается предлагаемым способом получения трансформированных растений, включающим обработку семян каланхое перистого (Kalanchoe pinnata) в условиях вакуумной инфильтрации в суспензии штамма агробактерий, выбранного из ряда Agrobacterium tumefaciens СВЕ21, A. tumefaciens GV3101(pMP90RK), A. tumefaciens LBA4404 (pAL4404), содержащего безмаркерную плазмиду рВМ, которая несет ген СР1, кодирующий цекропин Р1, и свободна от селективных маркерных генов устойчивости к антибиотикам, с последующей инкубацией семян на твердой питательной среде
При этом суспензию агробактерий предварительно активируют ацетосирингоном, семена каланхоэ перистого преинкубируют в течение 36-60 часов на твердой среде МС. обрабатывают семена в условиях вакуума глубиной (-0,01)-(-1,0) атм. в течение 1-15 минут в присутствии суспензии штамма агробактерий, с последующей инкубацией семян на твердой питательной среде в течение 36-60 часов без антибиотика. После этого проводят элиминацию агробактерий путем инкубации обработанных семян на твердой среде с антибиотиком из ряда тикарциллин, цефатоксим, ванкомицин (сначала 500 мг/л, а через 4 недели 250 мг/л) (Tr), в среду добавляют банановый порошок (30 мг/л) (БП) или растительный экстракт табака для улучшения морфогенеза.
Использование в качестве объекта для высокоэффективной трансформации семян К. pinnata является оправданным в виду их небольшого размера: диаметр 0,3-0,5 мм. Малый размер семян, с одной стороны, увеличивает эффективность проникновения агробактерий в зародышевую ткань, с другой - позволяет размещать большое количество первично трансформированного материала на единице площади плотной среды при выполнении процедуры кокультивации с агробактериями, удаления агробактерий и регенерации. На стандартной чашке Петри диаметром 90 мм можно разместить до 300 обработанных семян.
Важным преимуществом семян в качестве объекта для трансформации по сравнению с эксплантами является их высокая естественная способность к формированию морфологически полноценных растений из небольшого по размеру конгломерата клеток. При этом не требуется использовать сложные схемы гормонального воздействия.
В качестве целевого гена для трансформации используют синтетический ген антимикробного пептида цекропина P1 (СР1), кодирующий 31-членную аминокислотную последовательность: SWLSKTAKKLENSAKKRISEGIAIAIQGGPR [Martemyanov К.А., Shirokov V.A., Kurnasov O.V., Gudkov A.T., Spirin A.S. Cell-free production of biologically active polypeptides: application to the synthesis of antibacterial peptide cecropin P1 // Prot. Expr. Purif. 2001. V. 21. P. 456-461].
В качестве вектора для трансформации используют показанную на Фиг. 1 сконструированную при участии авторов предлагаемого изобретения плазмиду рВМ [патент РФ 2410433, C12N 15/82, 27.01.2011] При этом в состав кассеты экспрессии плазмиды рВМ входят следующие генетические элементы: промотор CaMV 35S - ген СР1- терминатор pACaMV.
Инфильтрацию семян каланхоэ агробактериями (процесс трансформации) предпочтительно осуществляют в условиях вакуума (- 0,01) - (-1,0) атм, в течение 1-15 мин при 24±2°C. При этом для проращивания семян используют среду МС, содержащую тикарциллин (500 или 250 мг/мл) ("Duchefa Biochemien", Германия) (Tr) и банановый порошок (30 мг/л) (Banana powder, "Sigma", США) (БП).
Устройство, в котором осуществляется вакуум-инфильтрация включает в себя эксикатор, вакуумметр и насос для создания вакуума (Фис. 2).
Частоту трансформации определяют как число отдельных трансформантов при пересчете на число исходных инокулированных семян (Табл. 1).
Исследуют зависимость эффективности трансформации каланхоэ от свойств используемого штамма агробактерий (Табл. 2)
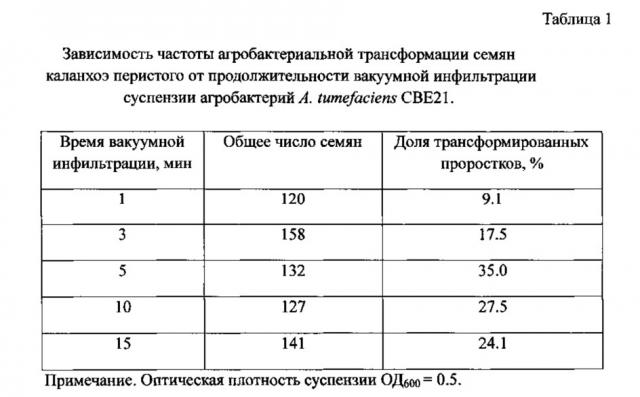
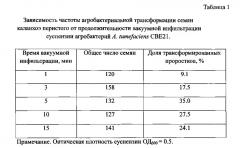
Прямой скрининг растений - продуцентов СР1 проводят на неселективной среде анализом антибактериальной активности растительных экстрактов с помощью тестовых культур Е. carotovora (Фиг. 3) и Е. coli D22 (Фиг. 4).
Анализ природы трансформированных растений с целью изучения встраивания Т-ДНК бинарного вектора рВМ-CP1 в геном исследуемых линий, полученных трансформацией, проводят посредством полимеразной цепной реакции (ПЦР) с праймерами, специфичными для гена СР1 (Фиг. 5). Для выделения геномной ДНК и белковых экстрактов используют материал как in vitro, так и in vivo. Для анализа ДНК растений, молодые побеги возраста 3-4 недели, растирают в жидком азоте и выделяют с применением СТАБ-буфера [Doyle J.J., Doyle J.L. Isolation of plant DNA from fresh tissue // Focus. 1990. V. 12. P. 13-15].
Трансгенные растения каланхоэ по морфологическим признакам не отличались от контрольных (не трансформированных), что видно из сведений, указанных на Фиг. 6.
Краткое описание изображений
На Фиг. 1 представлена схема плазмиды рВМ-CP1. CaMV 35S - промотор 35S РНК вируса мозаики цветной капусты; pACaMV - сигнал полиаденилирования вируса мозаики цветной капусты; СР1 - ген цекропина P1; KmR - ген устойчивости к антибиотику канамицину для поддержания конструкции в бактериях (не входит в состав Т-элемента и не переносится в растения); oriV - начало репликации; LB, RB - левая и правая границы Т-ДНК; ColE1 - начало репликации плазмиды ColE1; R, К, Sm, В, SI - сайты рестрикции EcoRI, KpnI, SmaI, BamHI, SalI.
На Фиг. 2 показано устройство для вакуумной инфильтрации семян каланхоэ перистого (К. pinnata).
В таблице 1 показана зависимость частоты агробактериальной трансформации семян каланхоэ К. pinnata от продолжительности вакуумной инфильтрации суспензии агробактерий A tumefaciens СВЕ21.
В таблице 2 показана зависимость эффективности трансформации Kalanchoe pinnata (К. pinnata) от вида используемого штамма агробактерий.
На Фиг. 3 показан анализ экспрессии трансгена в растениях каланхоэ перистого (К. pinnata), полученных методом трансформации с применением культуры A. tumefaciens СВЕ21, несущих безмаркерную конструкцию рВМ::СР1, предназначенную для экспрессии гена антимикробного пептида цекропина Р1 в растениях в условиях вакуумной инфильтрации семян. Результаты определения антимикробной активности смеси растительных экстрактов каланхоэ перистого (внесено 10 образцов из разных растений в одной лунке агарового блока) в отношении бактериального фитопатогена Е. carotovora методом радиальной диффузии. Отсутствие зоны роста бактерий вокруг лунки свидетельствует об антибактериальной активности растительных экстрактов.
На Фиг. 4 представлены результаты влияния растительных экстрактов из индивидуальных трансформированных растений каланхоэ на рост бактерий Е. coli D22. Лунки: 1, 3, 5 - экстракты трансформированных растений (линии 4, 3, 5); 4-синтетический цекропин Р1, 340 нг; 2 - экстракт не трансформированного растения;
На Фиг. 5 представлены результаты ПЦР-анализа ДНК трансгенных растений К. pinnata, содержащих ген СР1 под контролем промотора 35S РНК вируса мозаики цветной капусты: М - маркер молекулярного веса; 1 - ДНК нетрансформированного растения; 2-ДНК плазмиды, содержащей ген СР1; 3-7 - ДНК трансгенных растений К. pinnata; 8 - вода.
На Фиг. 6 показаны трансгенные растения К. pinnata, полученные методом вакуумной инфильтрации семян с применением культуры A. tumefaciens СВЕ21, несущих безмаркерную конструкцию рВМ::СР1, предназначенную для экспрессии гена антимикробного пептида цекропина Р1 в растениях. 1 - контрольное растение; 2-5 трансформированные растения.
Возможность осуществления предлагаемого способа подтверждается предоставленными примерами, но не ограничивается ими.
Пример 1. Стерилизация и проращивание и семян.
Семена перед проведением трансформации стерилизуют 1,5 мин в 70%-ном этаноле, затем 2 мин в 1%-ном растворе гипохлорита натрия и промывают 3 раза по 10 мин в стерильной дистиллированной воде.
Семена переносят на среду Мурасиге-Скуга (МС) [Murashige Т., Skoog F. A revised medium for rapid growth and bioassays with tobacco cultures // Physiol. Plant. 1962. V. 15. P. 473-497], содержащую 7 г/л агара, 30 г/л сахарозы (рН 5.8) и стандартный набор солей. Семена прекультивируют 48 часов при температуре 22-24°С, 16-часовом дне и освещенности 2 клк. Для эксперимента берут 100-500 семян на одну чашку Петри.
Пример 2. Получение культуры агробактерий A. tumefaciens СВЕ21, несущих безмаркерную конструкцию рВМ::СР1.
Для генетической трансформации используют клетки A. tumefaciens СВЕ21 (pTiBo542), несущие вектор рВМ::СР1 с геном антимикробного пептида цекропина Р1.
Для индукции vir-функции штамм агробактерий предварительно индуцируют ацетосирингоном. Для этого ночную культуру бактерий выращивают на качалке (150 об/мин) при 26°С в жидкой среде YEP (г/л): бакто-триптон - 10, бакто-дрожжевой экстракт -10, NaCl - 0,5, рН 7,0, с добавлением 50 мкг/мл канамицина и 15 мкг/мл рифампицина. Перед инокуляцией эксплантов суспензию клеток центрифугируют при 6000 g в течение 5 минут. Суспендированный осадок промывают в 50 мл жидкой среды МС, содержащей 12,5 мМ фосфорнокислый натрий, рН 5,5, до оптической плотности OD600=0,05. После 5 часов культивирования в клеточную суспензию добавляют ацетосирингон 100 мкМ [Schafer W., Gorz А., Kahl G. T-DNA integration and expression in a monocot crop plant afte induction of Agrobacterium. // Nature. 1987. V. 327. N. 6122. P. 529-532] и продолжают культивировать в течение 12-18 часов. После этого агробактериальную культуру используют для трансформации.
Пример 3. Получение культуры агробактерий A. tumefaciens GV3101(pMP90RK), несущих безмаркерную конструкцию рВМ::СР1.
Получение культуры агробактерий A. tumefaciens GV3101(pMP90RK), несущих безмаркерную конструкцию рВМ::СР1 проводят по методу, описанному в примере 2.
Пример 4. Получение культуры агробактерий A. tumefaciens LBA4404 (pAL4404), несущих безмаркерную конструкцию рВМ::СР1.
Получение культуры агробактерий A. tumefaciens LBA4404 (pAL4404), несущих безмаркерную конструкцию рВМ::СР1 проводят по методу, описанному в примере 2.
Пример 5. Проведение вакуумной инфильтрации с суспензией агробактерий А. tumefaciens СВЕ21 (pTiBo542, рВМ::СР1).
Стерильные семена, предварительно прекультивированные 48 часа на среде МС, погружают в колбу с суспензией агробактерий A. tumefaciens СВЕ21 (pTiBo542, рВМ::СР1) (109 кл/мл) (100 мл). Колбу с семенами помещают в вакуумный эксикатор на 1 мин, 3 мин, 5 мин, 10 мин, 15 мин при отрицательном давлении - 0,8 атм. После прерывания вакуума семена перекладывают на стерильную фильтровальную бумагу для удаления избытка влаги и переносят на агаризованную среду МС, содержащую 7 г/л агара, 30 г/л сахарозы (рН 5.8) и стандартный набор солей.
Через двое суток семена перекладывают на свежую среду МС, содержащую 500 мг/л антибиотика тикарциллина (Tr) для элиминации агробактерий и 30 г/л бананового порошка (БП) для оптимизации морфогенеза. Семена проращивают 4 недели до длины проростков 3-5 см и используют для анализа. Дальнейшее культивирование растений in vitro проводят на среде МС с добавлением Tr 250 мг/л.
Для получения семян растения пересаживают в теплицу.
Пример 6. Проведение вакуумной инфильтрации с суспензией агробактерий А. tumefaciens GV3101(pMP90RK, рВМ::СР1).
Вакуумную инфильтрацию проводят по методу, описанному в примере 5.
Пример 7. Проведение вакуумной инфильтрации с суспензией агробактерий А. tumefaciens LBA4404 (pAL4404, рВМ::СР1).
Вакуумную инфильтрацию проводят по методу, описанному в примере 5.
Пример 8. Определение активности трансгена в растениях прямым методом по бактерицидной активности в отношении фитопатогена Е. carotovora.
Антибактериальную активность, связанную с присутствием трансгена (цекропина Р1) в растительных экстрактах, определяют методом радиальной диффузии в агаровых блоках [Ohshima М., Mitruhara I., Okamoto М., Sawano S., Nishiyama К., Kaku H., Natori S., Ohashi Y. Enhanced resistance to bacterial diseases of transgenic tobacco plants overexpressing sarcotoxin IA, a bactericidal peptide of insect // J. Biochem. 1999. V. 125. P. 431-435].
В качестве тестового фитопатогенного штамма используют: бактерии Е. carotovora subsp. carotovora В15 (Horticulture Centre, Канада).
Для экстракции белков из растительной биомассы используют буфер следующего состава: 10% глицерина, 40 мМ ЭДТА, 150 мМ NaCl, 100 мМ NH4Cl, 4 мМ фенилметилсульфонилфторида, 10,0 мМ трис-HCl, рН 7,5; 3,0 мг/мл дитиотрейтола, 0,2 мг/мл лейпептина, 0,2 мг/мл ингибитора трипсина; 2 мг/мл бычьего сывороточного альбумина.
Концентрацию общего белка определяют по стандартному методу Бредфорд [Bradford М.М. A rapid and sensitive method of the quantitation of microgram quantities of protein utilizing the principle of protein dye binding //Anal. Biochem 1976. V. 72. P. 248-254].
Влияние антимикробной активности экстрактов каланхоэ перистого на рост клеток бактерий Е. carotovora определяют методом радиальной диффузии в 1,5% LB-агаровых блоках 12 мм высоты с бактериями (109 клеток/мл). В качестве положительного контроля используют синтетический пептид цекропин P1 (Sigma, США).
Исходные образцы экстрактов получают из объединенных приблизительно равных по весу (около 150 мг) листовых эксплантов от 500 отдельных растений-регенерантов. Для поиска трансгенных растений из массы регенератов их объединяют в группы по 10 штук (всего 50 групп) и используют для приготовления исходных тестируемых образцов растительного экстракта. В эксперименте исследуют 100-500 растений.
Сконцентрированные экстракты, содержащие около 1 мг общего белка (объем 150 мкл), вносят в лунки в LB-агаре. Агаровые блоки инкубируют 8 ч при 4°C для диффузии экстрактов в агар, затем блоки инкубируют при 25°C и через сутки локализуют стерильные зоны вокруг лунок. Активность исследуемого экстракта оценивают по наличию зоны отсутствия роста бактерий Е. carotovora на агаризованной среде вокруг лунок. В эксперименте в 9 группах из 50 была обнаружена антибактериальная активность (Фиг. 3).
Пример 9. Прямой поиск в группах каланхоэ перистого индивидуальных растений, несущих ген цекропина Р1, методом радиальной диффузии в отношении штамма Е. coli D22.
Антибактериальную активность индивидуальных растений отобранных линий, связанную с присутствием цекропина Р1 в растительных экстрактах, дополнительно исследуют методом радиальной диффузии в агаровых блоках на стандартной тестовой культуре Е. coli D22. При этом выявили три линии трансгенных CP1-растений, обладающих наиболее высоким уровнем антибактериальной активности. Экстракты контрольных растений практически не обладали антибактериальной активностью. На Фиг. 4 приведены результаты анализа антибиотической активности синтетического пептида цекропина Р1 340 нг (лунка 4), контрольного растения (лунка 2) и трех линий трансформированных растений, несущих ген CP1, №1, №2 и №3 (лунки 1, 3, 5).
Радиус зоны отсутствия бактериального роста вокруг лунок с экстрактами трансгенных растений составляет от 2 до 12 мм. Эксперименты с добавлением к экстрактам контрольных растений заведомо известных количеств синтетического цекропина Р1 позволяют установить содержание этого пептида в разных линиях трансгенных растений, составившее от 0,001 до 0,02% от общего растворимого белка.
Пример 10. Оценка эффективности процедуры инфильтрации, анализ растений методом ПЦР.
Анализ ДНК растений проводят в 25 мкл реакционной смеси, содержащей 0.1 мкг ДНК-матрицы, 20 пмоль каждого праймера, 0.2 мМ каждого дезоксинуклеозид-трифосфата, 2.5 мМ MgCl2, 1 ед. ДНК-полимеразы Taq в буфере производителя (Евроген, Россия). Реакция амплификации состоит из 30 циклов, каждый из которых включает в себя после начальной денатурации в течение 5 мин при 94°C следующие пункты: денатурация при 94°C (1 мин), отжиг праймеров при 55°C (30 с), синтез новой цепи при 72°C (30 с), затем 72°С (30 с). Амплификацию проводят на приборе «MJ-Mini Personal thermal Cycler (Bio-Rad, USA)».
Для подтверждения наличия целевого гена СР1 (фрагмент 102 п.н.) проводят ПЦР-анализ с праймерами, специфичными к гену СР1: CGGGATCCATGGGCTCTTG-(f) и CGAGATCTCTACTTAGCGCGGC-(r) («Евроген», Москва).
Плазмидную ДНК рВМ::СР1 используют в качестве положительного контроля и ДНК листьев нетрансгенных растений К. pinnata используют в качестве отрицательного контроля. Продукты ПЦР разделяют электрофорезом в 6%-ном полиакриламидном геле (ПААГ). Гели окрашивают в растворе бромистого этидия (5 мкг/мл).
На Фиг. 5 представлена электрофореграмма ПЦР-продуктов амплификации ДНК трансгенных растений каланхоэ, содержащих ген СР1 под контролем промотора 35S РНК вируса мозаики цветной капусты: М - маркер молекулярного веса; 1 - ДНК нетрансформированного растения; 2- ДНК плазмиды, содержащей ген СР1; 3-7 - ДНК трансгенных растений К. pinnata; 8 - вода.
В реакции ПЦР ДНК всех CP 1-содержащих линий растений показала присутствие соответствующего гена.
При разделении продуктов ПЦР ДНК трансгенных растений методом электрофореза, как и ожидалось, была обнаружена полоса 102 п. н., соответствующая гену СР1 (дорожки 3-7).
Частота трансформации является важным показателем эффективности способа генетической трансформации. Она складывается из эффективностей отдельных этапов, начиная с подготовки среды, вида агробактерий и заканчивая подготовкой эксплантов.
Полученные в примерах 2 и 5 данные приводятся в Таблице 1.
Из данных таблицы видно, что используемый способ трансформации - инфильтрации семян каланхоэ в течение 5 минут агробактериями с безмаркерным вектором и добавлением в питательную среду ацетосирингона повышает частоту трансформации до 35% по сравнению с другими способами (способ кокультивации с листовыми эксплантами - 23% [патент РФ 2445768, А01Н 1/00, 27.03. 2012], способ каллусного органогенеза - 3% [Truesdale M.R., Toldi О., Scott P. The effect of elevated concentrations of fructose 2.6 bisphosphate on carbon metabolism during deacidification in the crassulacean acid metabolism plant Kalanchoe daigremontiana // Plant physiology. 1999. V. 121. P. 957-964]. При уменьшении и увеличении времени воздействия вакуума наблюдают снижение частоты трансформации и снижение последующей всхожести вакуумируемых семян. Оценку эффективности процедуры получения трансгенных растений каланхоэ (частота генетической трансформации) определяют как отношение числа побегов, образовавшихся из семян на бесселективной среде и давших в прямой детекции положительные цекропин Р1-сигналы, к общему числу культивируемых эксплантов.
Повышение частоты генетической трансформации происходит за счет снижения продолжительной антибиотической стрессовой нагрузки на растения и сокращения сроков получения генетически модифицированных безмаркерных растений, обладающих повышенной биобезопасностью и пригодных для использования в фармацевтике как продуцента цекропина Р1 и лечебного сока.
Полученные в примерах 2-7 данные приводятся в Таблице 2.
Из этих данных видно, что больший процент трансформации проявил штамм агробактерий A. tumefaciens СВЕ21 (35%). Уровень экспрессии цекропина Р1 при трансформации - вакуумной агроинфильтрации семян с использованием безмаркерного вектора составляет от 0.01 до 0.03% от ОРБ.
Из приведенных данных ясно, уровень экспрессии полученных нами по предлагаемому способу в 2-6 раз выше, чем в предыдущей работе авторов предлагаемого изобретения, где экспрессия целевого гена случае не превышает 0,005% от общего растворимого белка [Захарченко Н.С., Бурьянов Я.И., Получение биобезопасных безмаркерных трансгенных растений каланхоэ перистого (Kalanchoe pinnata L.) с повышенной устойчивостью к биотическим стрессовым факторам. Всероссийская научная конференция «Факторы устойчивости растений в экстремальных природных условиях и техногенной среде». Иркутск. СИФИБР. 10-13 июня 2013 г. С. 89-92].
Трансгенные растения по морфологическим признакам не отличаются от контрольных растений (Фиг. 6).
Укорененные растения выращиваются в теплице до получения семян.
Таким образом при использовании предлагаемого способа получения трансформированных растений, включающим обработку семян каланхое перистого (Kalanchoe pinnata) в условиях вакуумной инфильтрации в суспензии штамма агробактерий, содержащего безмаркерную плазмиду рВМ, несущую кодирующий цекропин Р1 ген СР1 и свободную от селективных маркерных генов устойчивости к антибиотикам, получены безмаркерные биобезопасные трансгенные растения каланхоэ перистого К. pinnata, экспрессирующие ген антимикробного пептида цекропина Р1 на высоком уровне и обладающие антимикробными свойствами для применения в медицине и фармакологии.
Технический эффект от использования предлагаемого способа, пригодного для создания биобезопасных лекарственных растений каланхоэ, - сокращение времени и трудозатрат при его осуществлении, а главное - повышение уровня накопления целевого продукта (не менее 0,02% от общего растворимого белка), что сделает нативный сок трансгенного растения пригодным для наружного применения в фармацевтике.
Технический результат изобретения достигается тем, что
1) предложенная стадия обработки семян растений K.pinnata обеспечивает их стерилизацию без потери жизнеспособности;
2) используемая стадия сокультивирования, предварительно обработанных семян каланхоэ перистого, с активизированной ацетосирингоном культурой агробактерий А. tumefaciens СВЕ21, несущей безмаркерную конструкцию рВМ-CP1, обеспечивает высокую экспрессию гена антимикробного пептида цекропина Р1 в растениях;
3) стадия первичной выборки растений, подвергнутых трансформации, и процедура отбора трансформантов, обладающих необходимым генотипом и фенотипом, сокращает время получения трансгенных растений.
4) стадия отбора целевых растений позволяет в короткий срок получать большие выборки трансформантов с целью их дальнейшего использования при скрининге вариант