Фармацевтическая композиция, содержащая тетрагидрофолиевую кислоту
Иллюстрации
Показать всеИзобретение относится к области фармацевтики, в частности к пероральным противозачаточным средствам, и раскрывает способ приготовления твердой пероральной дозированной формы. Способ характеризуется тем, что пероральная дозированная форма содержит прогестоген, эстроген, 5-метил-(6S)-тетрагидрофолиевую кислоту или его фармацевтически приемлемую соль, а также по меньшей мере один фармацевтически приемлемый эксципиент или носитель, и включает гранулирование прогестогена и эстрогена и по меньшей мере одного фармацевтически приемлемого эксципиента в псевдоожиженном слое, смешивание 5-метил-(6S)-тетрагидрофолиевой кислоты или ее фармацевтически приемлемой соли с гранулами и продолжение гранулирования путем поддержания псевдоожиженного слоя и формирование из гранул твердой оральной лекарственной формы. Композиции по изобретению обеспечивают хорошую стабильность тетрагидрофолиевой кислоты при хранении и в то же время обеспечивают быстрое высвобождение эстрогена и прогестогена, находящихся в композиции. 13 з.п. ф-лы, 3 ил., 5 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к твердым фармацевтическим композициям, в частности к пероральным противозачаточным средствам, содержащим тетрагидрофолиевую кислоту, таким как 5-метил-(6S)-тетрагидрофолат кальция. Композиции, предоставляемые в настоящем изобретении, позволяют обеспечить хорошую стабильность тетрагидрофолиевой кислоты при хранении, и при этом они обеспечивают быстрое и достоверное высвобождение эстрогена и прогестогена, присутствующих в композиции.
Предпосылки создания изобретения
У беременных женщин, корректирование низких уровней фосфатов в сыворотке крови происходит по меньшей мере в течение двух месяцев и может сохраняться всего несколько недель. Следовательно, в соответствии с рекомендациями Министерства здравоохранения, все женщины, которые могут забеременеть, должны потреблять 400 мкг/сутки фолиевой кислоты для уменьшения рисков врожденных пороков развития (MMWR Morb. Mortal. Wkly. Rep.1992; 41(RR-14):1-7). Пополнение запасов фолиевой кислоты сразу после отмены применения пероральных контрацептивов, или сразу после получения положительного теста на беременность, может быть недостаточно для оптимальной защиты развивающегося плода. Дополнительно, в различных исследованиях, проведенных на женщинах, применяющих пероральные контрацептивы, было показано снижение уровней фолата в сыворотке по сравнению с негативными контролями. Предполагаемые механизмы, описанные для этого явления, включают снижение абсорбции полиглутаматов, повышение экскреции фолиевых кислот, повышение продукции белков, связывающих фолаты, и индукцию фолат-зависимых микросомальных ферментов в печени. Таким образом, снижение уровней фолата в сыворотке крови является дополнительным фактором риска для тех потребителей, которые забеременивают в течение трех - шести месяцев после отмены применения.
Следовательно, фолиевая кислота в идеале должна быть додана к пероральным противозачаточным средствам, так как недостаточное поступление фолиевой кислоты в периконцептуальный период помогает защитить от различных врожденных пороков развития, включая дефекты мозговой трубки, такие как расщепление позвоночника (неполное закрытие спинного мозга и позвоночника), анэнцефалия (тяжелое недоразвитие головного мозга) и грыжа головного мозга (где ткань головного мозга выступает на поверхность кожи из аномального отверстия в черепе). Все эти дефекты происходят в течение первых 28 дней беременности - обычно до того, когда женщина узнает о беременности.
Тем не менее, включение фолиевой кислоты в пероральные противозачаточные средства может являться серьезным фактором риска для здоровья человека, поскольку она буде подавлять симптомы дефицита витамина В12, такие как анемия. Например, фолиевая кислота может корректировать анемию, связанную с дефицитом витамина В12, но, к сожалению, фолиевая кислота не будет корректировать изменения нервной системы, которые развиваются вследствие дефицита витамина В12. Следовательно, могут происходить долговременные изменения в нервной системе, если не лечить дефицит витамина В12. Таким образом, изобретатель настоящего изобретения полагает, что включение тетрагидрофолиевой кислоты, такой как производного природной фолиевой кислоты, 5-метил-(6S)-фолиевой кислоты, которое образуется в весьма сложном катаболическом пути пролекарства фолиевой кислоты, в пероральном противозачаточном средстве. Включение тетрагидрофолиевых кислот, таких как as 5-метил-(6S)-тетрагидрофолиевая кислота, в пероральное противозачаточное средство может обеспечивать все положительные действия, связанные с фолиевой кислотой, но без потенциального неблагоприятного действия маскирования анемии вследствие дефицита витамина В12.
Однако тетрагидрофолиевые кислоты являются очень нестабильными и чрезвычайно чувствительны к окислению и влажности. Следовательно, включение тетрагидрофолиевой кислоты в твердые пероральные лекарственные средства, такие как пероральные противозачаточные средства, является очень сложной задачей с точки зрения приготовления лекарственных средств. Полагают, что полученная твердая фармацевтическая композиция не только должна проявлять достаточную стабильность (по отношению к тетрагидрофолиевой кислоте) при хранении, но и само приготовление композиции может быть проблематичным вследствие воздействия окислительных наполнителей, влажности и/или доступа воздуха, и эти факторы могут вызывать разложение тетрагидрофолиевой кислоты и поэтому их следует избегать. Следовательно, и как будет показано в примерах, приведенных в настоящем изобретении, проблема стабилизации тетрагидрофолиевой кислоты не может быть решена отдельно, так как оказывается, что стабилизация тетрагидрофолиевой кислоты во многих случаях неожиданно вызывает недостаточное высвобождение других активных компонентов композиции.
Кроме того, в пероральном противозачаточном средстве тетрагидрофолиевая кислота рассматривается как активный компонент. Следовательно, стандартные методы определения стабилизации, которые обычно используются в продуктах с витаминными добавками, такими как передозировка и более широкий допустимый предел, непригодны для пероральных противозачаточных средств. Обычно передозировку в продуктах с витаминными добавками осуществляют вплоть до 25% и доза Metafolin® в некоторых продуктах с витаминными добавками является выше на 0,6-5,6 мг по сравнению с рекомендованной суточной дозой (0,45 мг). Поскольку проблемы стабильности являются более выраженными при включении в фармацевтические композиции в низких концентрациях, то приготовление стабильных фармацевтических композиций, содержащих тетрагидрофолиевую кислоту в низких дозах, являются чрезвычайно важной задачей.
Несмотря на это, изобретатель настоящего изобретения неожиданно, с помощью осторожного отбора определяющих наполнителей и/или процессов приготовления, добился успеха в получении пероральных противозачаточных средств, которые, с одной стороны, проявляют достаточную стабильность по отношению к тетрагидрофолиевой кислоты, а, с другой стороны, все же отвечают необходимым требованиям по отношению к высвобождению, и, следовательно, биодоступности эстрогена и прогестогена, которые содержатся в композиции.
В заявке WO 03/070255 описаны наборы для контрацепции и гормонозаместительной терапии, которые содержат один или несколько стероидов, таких как эстрогены и прогестогены; один или несколько тетрагидрофолатных компонентов; и витамин В12.
В US 6,190,693 описаны фармацевтические композиции, подходящие в качестве перорального противозачаточного средства или для гормонозаместительной терапии, содержащие фолиевую кислоту.
US 6,011,040 относится к применению тетрагидрофолатов для влияния на уровень гомоцистеина, в особенности для содействия повторному метилированию гомоцистеина.
В US 6,441,168 описаны стабильные кристаллические соли 5-метилтетрагидрофолиевой кислоты.
Сущность изобретения
В первом аспекте, настоящее изобретение относится к твердой фармацевтической композиции, содержащей прогестоген, эстроген, тетрагидрофолиевую кислоту или ее соль, и по меньшей мере один фармацевтически приемлемый наполнитель или носитель.
В другом аспекте, настоящее изобретение относится к твердой лекарственной форме для перорального применения, содержащей композицию в соответствии с изобретением.
Другие аспекты настоящего изобретения станут понятными из нижеприведенного описания и приложенных пунктов формулы изобретения.
Краткое описание чертежей
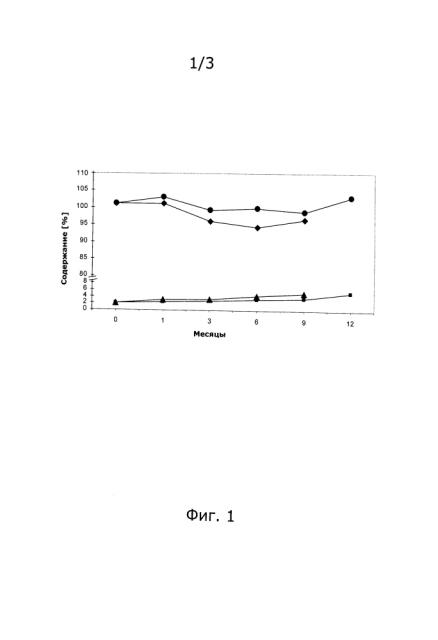
На фигуре 1 показано стабильность 5-метил-(6S)-тетрагидрофолата кальция в таблетке, приготовленной, как описано в примере 1. На оси Y указано % 5-метил-(6S)-тетрагидрофолата кальция, оставшегося после хранения, а также сумму продуктов распада. На оси X указано время хранения в месяцах. ● 25°С/60% ОВ (закрытый контейнер); ◆ 40°С/75% ОВ (закрытый контейнер); ■ 25°С/60% ОВ (закрытый контейнер); ▲ 40°С/75% ОВ (закрытый контейнер).
На фигуре 2 показано растворение дроспиренона, этинилэстрадиола и 5-метил-(6S)-тетрагидрофолата кальция из таблеток, приготовленных в примере 1. На оси Y указано растворенное количество, а на оси X указано время исследования растворимости в минутах. ▲ дроспиренон; ■ этинилэстрадиол; ◆ 5-метил-(6S)-тетрагидрофолат кальция.
На фигуре 3 показано растворение дроспиренона из таблеток, приготовленных в примерах. На оси Y указано растворенное количество, а на оси X указано время исследования растворимости в минутах. ◆ пример 1; ■ пример 4; ▲ пример 5; X пример 6; △ Yasmin®; □ Yaz®.
Подробное описание изобретение
Термин "эстроген" охватывает все соединения (природные или синтетические, стероидные или нестероидные соединения), которые проявляют эстрогенную активность. Такие соединения охватывают, в частности, конъюгированные эстрогены, специфические агонисты рецептора эстрогена и нестероидные соединения, которые проявляют эстрогенную активность. Этот термин дополнительно охватывает все изомерные и физические формы эстрогенов, включая гидраты, сольваты, соли и комплексы, такие как комплексы с циклодекстринами. Более предпочтительно, эстроген может быть выбран из группы, включающей этинилэстрадиол, эстрадиол, эстрадиола сульфаматы, эстрадиола валерат, эстрадиола бензоат, эстрон, местранол, эстриол, эстриола сукцинат и конъюгированные эстрогены, включая конъюгированные конские эстрогены, такие как эстрона сульфат, 17β-эстрадиол сульфат, 17α-эстрадиол сульфат, эквилин сульфат, 17β-дигидроэквилин сульфат, 17α-дигидроэквилин сульфат, эквиленин сульфат, 17β-дигидроэквиленин сульфат и 17α-дигидроэквиленин сульфат. Эстрогены, которые представляют особый интерес, выбраны из группы, включающей этинилэстрадиол, эстрадиол, эстрадиола сульфаматы, эстрадиола валерат, эстрадиола бензоат, эстрон, местранол и эстрона сульфат. Более предпочтительно, эстроген выбирают из группы, включающей этинилэстрадиол, эстрадиол и местранол. Наиболее предпочтительным эстрогеном является этинилэстрадиол.
В контексте настоящего изобретения, термин "прогестоген" (также в некоторых местах обозначается как "гестаген") охватывает синтетические гормональные соединения, которая проявляют анти-эстрогенные (противодействуют эффектам эстрогенов в организме) и анти-гонадотропными (ингибируют продукцию половых стероидов и гонад) свойствами. Специфическими примерами прогестогенов являются, но не ограничиваясь только ими, прогестогены, выбранные из группы, включающей лево-норгестрел, норгестрел, норэтиндрон (норэтистерон), диеногест, норэтиндрон (норэтистерон) ацетат, этинодиол диацетат, дидрогестерон, медроксипрогестерон ацетат, норэтинодрел, аллилэстренол, линестренол, хингестанол ацетат, медрогестон, норгестриенон, диметистерон, этистерон, хлормадинон ацетат, мегестрол, промегестон, дезогестрел, 3-кето-дезогестрел, норгестимат, гестоден, тиболон, ципротерон ацетат и дроспиренон. Особенно предпочтительным прогестогеном является дроспиренон.
Термин "терапевтически эквивалентное количество этинилэстрадиола", обозначает, что другие эстрогены вводят в количествах, которые вызывают такое же терапевтическое действие, что и указанное количество этинилэстрадиола. Аналогично, термин "терапевтически эквивалентное количество дроспиренона" обозначает, что другие прогестогены вводят в количествах, которые вызывают такое же терапевтическое действие, что и указанное количество дроспиренона. Средний специалист в данной области техники легко может определить терапевтически эквивалентные количества или дозы таких других и/или прогестогенов, если известна эффективная доза этинилэстрадиола и/или дроспиренона. Например, в статье Timmer и Geurts приведены указания для определения эквивалентных доз (см. "Bioequivalence assessment of three different estradiol formulations in postmenopausal women in an open, randomised, single-dose, 3-way cross-over" в European Journal of Drug Metabolism and Pharmacokinetics, 24(1):47-53,1999). Кроме того, можно сослаться на ЕР 1 253 607, в котором приведено подробное описание терапевтически эквивалентных количеств этинилэстрадиола и эстрадиола с одной стороны, и различных прогестогенов с другой стороны. Дополнительные детали относительно определения дозовых эквивалентов для различных эстрогенов и прогестогенов, можно привести ссылку на "Probleme der Dosisfindung: Sexualhormone" [Problems of Dose-Finding: Sex Hormones]; F. Neumann и др. в "Arzneimittelforschung" (Pharmaceutical Agent Research) 27, 2a, 296-318 (1977), а также "Aktuelle Entwicklungen in der hormonalen Kontrazeption" [Current Developments in Hormonal Contraception]; H. Kuhl в Gynäkologe" [Gynecologist] 25: 231-240 (1992).
Как используется в настоящем изобретении, термин "микронизированный" обозначает распределение частиц по размерам таким образом, что по меньшей мере 90% частиц имеет диаметр частицы меньше, чем 30 мкм (рассчитанный согласно кривой объемного распределения для допущенных сферических частиц), то есть значение d90 в большинства составляет 30 мкм. Следовательно, важно отметить, что всякий раз, когда в настоящем изобретении используются термины "распределение частиц по размерам", "диаметр частицы", "d90", и т.д., то следует понимать, что конкретные значения или диапазоны, используемые в связи с вышеизложенным, всегда определяются согласно кривой объемного распределения для допущенных сферических частиц.
Из описания настоящего изобретения станет понятным, включая примеры, приведенные в настоящем изобретении, что чрезвычайно важным является высвобождение эстрогена, а также прогестогена быстрым и достоверным образом в нейтральных или кислотных условиях. Таким образом, в контексте настоящего изобретения, термин "быстрое высвобождение" или "незамедлительное высвобождение", когда они используются применительно к термину эстроген, означает, что по меньшей мере 70% эстрогена, например, этинилэстрадиола, растворяется из композиции в течение 30 минут, как это определено в соответствии с описанным в Фармакопее США XXIX лопастным методом II, используя воду, или 0,1 н. HCl, при 37°С в качестве среды для растворения и при скорости перемешивания 50 об/мин. В предпочтительном варианте осуществления изобретения по меньшей мере 75%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 85% эстрогена, например, этинилэстрадиола, растворяется из композиции в течение 30 минут, при проведении исследования, как описано выше.
Аналогично, всякий раз, когда термин "быстрое высвобождение" или "незамедлительное высвобождение" используется применительно к термину прогестоген, то это обозначает, что по меньшей мере 70% прогестогена, например, дроспиренона, растворяется из композиции в течение 30 минут, как это определено в соответствии с описанным в Фармакопее США XXIX лопастным методом II, используя воду, или 0,1 н. HCl, при 37°С в качестве среды для растворения и при скорости перемешивания 50 об/мин. В предпочтительном варианте осуществления изобретения по меньшей мере 75%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 85% прогестогена, например, дроспиренона, растворяется из композиции в течение 30 минут, при проведении исследования, как описано выше.
Аналогичным образом, всякий раз, когда термин "быстрое высвобождение" или "незамедлительное высвобождение" используется применительно к термину тетрагидрофолиевая кислота, то это обозначает, что по меньшей мере 70% тетрагидрофолиевой кислоты, например, 5-метил-(6S)-тетрагидрофолата кальция, растворяется из композиции в течение 30 минут, как это определено в соответствии с описанным в Фармакопее США XXIX лопастным методом II, используя 0,03% водный раствор аскорбиновой кислоты (доведенный до рН 3,5 с помощью 0,05 М фосфатного буфера) при 37°С в качестве среды для растворения и при скорости перемешивания 50 об/мин. В предпочтительном варианте осуществления изобретения по меньшей мере 75%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 85% или по меньшей мере 90% тетрагидрофолиевой кислоты, например, 5-метил-(6S)-тетрагидрофолат кальция, растворяется из композиции в течение 30 минут, при проведении исследования, как описано выше.
Термин "гранулированная композиция" относится к композиции порошка, где размер частиц порошка или повышается путем обработки с жидкостью или путем прессования. Жидкостью может быть подходящие водные или органические растворителю любого типа, или их смеси, необязательно дополнительно содержащие связующее. Таким образом, термин "гранулированная композиция" охватывает гранулы, пеллеты и спрессованный порошок или любые частицы, образованные путем грануляции, пеллетирования или прессования порошка таким образом, чтобы образовывались частицы со среднем размером (d50) по меньшей мере приблизительно 100 мкм.
Под терминами "грануляция" и "гранулирование" понимают механический процесс, при котором порошок, содержащий активный (е) компонент (ы) и наполнители частично агломерируют в частицы и/или гранулы, имеющие больший размер частиц, чем необработанный порошок. В одном варианте осуществления, порошкообразную смесь вводят в контакт с грануляционной жидкостью, которая может содержать связующее, набухшее, частично растворенное или полностью растворенное в грануляционной жидкости. Грануляционной жидкостью может быть любой подходящий растворитель, но обычно применимы водные растворы или только вода. В одном варианте осуществления, порошкообразную смесь вводят в контакт с грануляционной жидкостью, используя подходящее оборудование для влажной грануляции, такое как оборудование для грануляции в пседоожиженном слое. Кроме того, вместо грануляции в пседоожиженном слое можно использовать грануляцию с большим усилием сдвига.
Термин "комплекс эстроген-циклодекстрин" или "эстроген в комплексе с циклодекстрином" обозначает комплекс между эстрогеном и циклодекстрином, в котором молекула эстрогена по меньшей мере частично вставлена в полость молекулы циклодекстрина. Молярное отношение между эстрогеном и циклодекстрином может быть доведено до любого желательного значения. В представляющих интерес вариантах осуществления изобретения, молярное отношение между эстрогеном и циклодекстрином представляет собой приблизительно от 2:1 до 1:10, предпочтительно приблизительно от 1:1 до 1:5, наиболее предпочтительно приблизительно от 1:1 до 1:3, такое как 1:1 или 1:2. Кроме того, молекула эстрогена может по меньшей мере частично вставлена в полость двух или более молекул циклодекстрина, например, одна молекула эстрогена может быть вставлена в две молекулы циклодекстрина с получением соотношения 2:1 между циклодекстрином и эстрогеном. Подобным образом, комплекс может содержать больше одной молекулы эстрогена, которая по меньшей мере частично вставлена в одну молекулу циклодекстрина, например, две молекулы эстрогена могут быть по меньшей мере частично вставлены в одну молекулу циклодекстрина с получением соотношения 1:2 между циклодекстрином и эстрогеном. Комплексы между эстрогенами и циклодекстринами могут быть получены с помощью методов, известных в данной области, например, как описано в US 5,798,338 и ЕР 1 353 700.
Термин "комплекс этинилэстрадиол-β-циклодекстрин" обозначает комплекс, в любом молярном отношении, между этинилэстрадиолом и β-циклодекстрином. Однако, комплекс этинилэстрадиол-β-циклодекстрин, описанный в данной заявке, обычно представляет собой комплекс между одной молекулой этинилэстрадиола и двумя молекулами β-циклодекстрина, то есть комплекс 1:2 этинилэстрадиол-β-циклодекстрин.
Термин "комплекс прогестоген-циклодекстрин" или "прогестоген в комплексе с циклодекстрином" обозначает комплекс между прогестогеном и циклодекстрином, в котором молекула прогестогена по меньшей мере частично вставлена в полость молекулы циклодекстрина. Молярное отношение между прогестогеном и циклодекстрином может быть доведено до любого желательного значения. В представляющих интерес вариантах осуществления изобретения, молярное отношение между прогестогеном и циклодекстрином представляет собой приблизительно от 2:1 до 1:10, предпочтительно приблизительно от 1:1 до 1:5, наиболее предпочтительно приблизительно от 1:1 до 1:3. Кроме того, молекула прогестогена может быть по меньшей мере частично вставлена в полость двух или более молекул циклодекстрина, например, одна молекула прогестогена может быть вставлена в две молекулы циклодекстрина с получением соотношения 2:1 между циклодекстрином и прогестогеном. Подобным образом, комплекс может содержать больше одной молекулы прогестогена, по меньшей мере частично вставленной в одну молекулу циклодекстрина, например, две молекулы прогестогена могут быть по меньшей мере частично вставлены в одну молекулу циклодекстрина с получением соотношения 1:2 между циклодекстрином и прогестогеном. Комплексы между прогестогенами и циклодекстринами могут быть получены с помощью методов, известных в данной области, например, как описано в US 6,610,670 и ссылках, приведенных в этом патенте.
Термин "комплекс дроспиренон-β-циклодекстрин" обозначает комплекс, в любом молярном отношении, между дроспиреноном и β-циклодекстрином, как описано в US 6,610,670. Однако, комплекс дроспиренон-β-циклодекстрин обычно представляет собой комплекс между одной молекулой дроспиренона и тремя молекулами β-циклодекстрина, то есть комплекс 1:3 дроспиренон-β-циклодекстрин.
Термин "циклодекстрин" обозначает циклодекстрин или его производное, а также смеси различных циклодекстринов, смеси различных производных циклодекстринов и смеси различных циклодекстринов и их производных. Циклодекстрин может быть выбран из группы, включающей α- циклодекстрин, β-циклодекстрин, γ-циклодекстрин и их производные. Циклодекстрин может быть модифицирован таким образом, что несколько или все из первичных или вторичных гидроксильных групп макроцикла алкилированы или ацилированы. Методы модификации этих гидроксильных групп хорошо известны специалисту в данной области техники и многие такие модифицированные циклодекстрины коммерчески доступны. Таким образом, некоторые или все из гидроксильных групп циклодекстрина могут быть замещены О-R группой или O-C(O)-R группой, где R представляет собой необязательно замещенную C1-6 алкильную, необязательно замещенную С2-6 алкенильную, необязательно замещенную С2-6 алкинильную, необязательно замещенную арильную или гетероарильную группу. Таким образом, R может представлять собой метильную, этильную, пропильную, бутильную, пентильную, или гексильную группу, то есть O-C(O)-R может представлять собой ацетат. Кроме того, гидроксильные группы могут быть пер-бензилированы, пер-бензоилированы, бензилированы или бензоилированы только на одной стороне макроцикла, то есть только 1, 2, 3, 4, 5 или 6 гидроксильные группы являются бензилированными или бензоилированными. Естественно, гидроксильные группы также могут быть пер-алкилированы или пер-ацилированы, такие как пер-метилированы или пер-ацетилированы, алкилированы или ацилированы, такие как метилированы или ацетилированы, только на одной стороне макроцикла, то есть только 1, 2, 3, 4, 5 или 6 гидроксильные группы являются алкилированными или ацетилированными, такие как метилированные или ацетилированные.
Подразумевается, что твердая композиция по изобретению содержит по меньшей мере один, такой как один эстроген, как описано выше. Эстроген может быть выбран из группы, включающей этинилэстрадиол, эстрадиол, эстрадиола сульфаматы, эстрадиола валерат, эстрадиола бензоат, эстрон, местранол и эстрона сульфат, включая их микронизированные формы. В чрезвычайно предпочтительном варианте осуществления изобретения, эстроген представляет собой этинилэстрадиол, в особенности микронизированный этинилэстрадиол. В одном варианте осуществления изобретения, эстроген, в особенности этинилэстрадиол образует комплекс с циклодекстрином, например, как описано в ЕР 1 353 700. Циклодекстрин обычно вибирают из группы, включающей α-циклодекстрин, β-циклодекстрин, γ-циклодекстрин и их производные. В варианте осуществления изобретения, который представляет особый интерес, циклодекстрин представляет собой β-циклодекстрин или их производные. Эстроген-циклодекстрин комплекс благоприятно может находиться в микронизированной формы.
Дополнительно, твердая композиция по изобретению содержит по меньшей мере один, такой как один прогестоген, как описано выше. Прогестоген может быть выбран из группы, включающей лево-норгестрел, норгестрел, норэтиндрон (норэтистерон), норэтиндрон (норэтистерон) ацетат, диеногест, этинодиол диацетат, дидрогестерон, медроксипрогестерон ацетат, норэтинодрел, аллилэстренол, линестренол, хингестанол ацетат, медрогестон, норгестриенон, диметистерон, этистерон, хлормадинон ацетат, мегестрол, промегестон, дезогестрел, 3-кето-дезогестрел, норгестимат, гестоден, тиболон, ципротерон ацетат и дроспиренон. В предпочтительном варианте осуществления изобретения прогестоген выбирают из группы, включающей лево-норгестрел, норгестрел, норэтиндрон (норэтистерон), норэтиндрон (норэтистерон) ацетат, диеногест, этинодиол диацетат, дезогестрел, норгестимат, гестоден, ципротерон ацетат и дроспиренон. В чрезвычайно предпочтительном варианте осуществления изобретения, прогестоген представляет собой дроспиренон, в особенности микронизированный дроспиренон.
Таким образом, в предпочтительном варианте осуществления изобретения композиция содержит лево-норгестрел и этинилэстрадиол, норгестрел и этинилэстрадиол, норэтиндрон (норэтистерон) и этинилэстрадиол, норэтиндрон (норэтистерон) ацетат и этинилэстрадиол, диеногест и этинилэстрадиол, этинодиол диацетат и этинилэстрадиол, дезогестрел и этинилэстрадиол, норгестимат и этинилэстрадиол, гестоден и этинилэстрадиол, ципротерон ацетат и этинилэстрадиол, и дроспиренон и этинилэстрадиол. В чрезвычайно предпочтительном варианте осуществления изобретения, композиция содержит дроспиренон и этинилэстрадиол, более предпочтительно микронизированный дроспиренон и микронизированный этинилэстрадиол, например, микронизированный дроспиренон и комплекс микронизированный этинилэстрадиол-циклодекстрин, такой как микронизированный дроспиренон и комплекс микронизированный этинилэстрадиол-β-циклодекстрин.
Дополнительно к эстрогену и прогестогену, композиция по изобретению дополнительно содержит тетрагидрофолиевую кислоту или ее соль. Конкретными примерами тетрагидрофолиевой кислоты являются 5-метил-(6S)-тетрагидрофолиевая кислота, (6S)-тетрагидрофолиевая кислота, 5-формил-(6S)-тетрагидрофолиевая кислота, 10-формил-(6R)-тетрагидрофолиевая кислота, 5,10-метилен-(6R)-тетрагидрофолиевая кислота, 5,10-метенил-(6R)-тетрагидрофолиевая кислота, 5-форимино-(6S)-тетрагидрофолиевая кислота, включая фармацевтически приемлемые соли этих тетрагидрофолиевых кислот и глутамильные производные этих тетрагидрофолиевых кислот. В предпочтительном варианте осуществления изобретения, тетрагидрофолиевая кислота представляет собой 5-метил-(6S)-тетрагидрофолиевую кислоту или его фармацевтически приемлемую соль. В более предпочтительном варианте осуществления изобретения соль 5-метил-(6S)-тетрагидрофолиевой кислоты представляет собой соль щелочноземельного металла, в особенности кальциевую соль. Соль, такая как кальциевая соль, 5-метил-(6S)-тетрагидрофолиевой кислоты предпочтительно должна находиться в кристаллической форме, такая как кристаллическая форма I типа, описанная в US 6,441,168. Кристаллическая форма I типа 5-метил-(6S)-тетрагидрофолата кальция коммерчески доступна от Merck KGaA под торговой маркой Metafolin®. Является предпочтительным, если композиция по изобретению не содержит других витаминов, в частности, если композиция по изобретению не содержит витамина В, такого как витамин В6 и/или витамин В12. Следовательно, в предпочтительном варианте осуществления изобретения, композиция содержит тетрагидрофолиевую кислоту в виде единственного витаминового компонента.
Твердая фармацевтическая композиция по изобретению содержит один или несколько фармацевтически приемлемых наполнителей. Этими наполнителями могут являться, например:
- инертные наполнители или разбавители,
такие как сахароза, сорбит, сахара, маннит, микрокристаллическая целлюлоза, крахмалы, хлорид натрия, фосфат натрия, карбонат кальция, фосфат кальция, сульфат кальция, лактозу, например, моногидрат лактозы, или их комбинацию. Инертный разбавитель или наполнитель обычно присутствует в количестве 10-99% по весу композиции. Предпочтительно, инертный разбавитель или наполнитель присутствует в количестве 50-99% по весу композиции, более предпочтительно в количестве 75-99% по весу композиции, еще более предпочтительно в количестве 80-97% по весу композиции, наиболее предпочтительно в количестве 85-97% по весу композиции. Как очевидно из примеров, приведенных в настоящем изобретении, чрезвычайно предпочтительными наполнителями является лактоза, в особенности моногидрат лактозы, и микрокристаллическая целлюлоза.
Таким образом, в предпочтительном варианте осуществления композиция по изобретению содержит моногидрат лактозы, микрокристаллическую целлюлозу или комбинацию моногидрата лактозы и микрокристаллической целлюлозы в количествах, указанных выше. Таким образом, в одном представляющем интерес варианте осуществления изобретения, композиция содержит микрокристаллическую целлюлозу. Микрокристаллическая целлюлоза обычно присутствует в количестве 10-99% по весу композиции, предпочтительно в количестве 50-99% по весу композиции, более предпочтительно в количестве 75-99% по весу композиции, еще более предпочтительно в количестве 80-97% по весу композиции, наиболее предпочтительно в количестве 85-97% по весу композиции. Микрокристаллическая целлюлоза может быть только или единственным наполнителем, который присутствует в композиции, то есть композиция по изобретению может не содержать других наполнителей, отличных от микрокристаллической целлюлозы. В другом представляющем интерес варианте осуществления изобретения, композиция содержит моногидрат лактозы. Моногидрат лактозы обычно присутствует в количестве 10-99% по весу композиции, предпочтительно в количестве 50-99% по весу композиции, более предпочтительно в количестве 75-99% по весу композиции, еще более предпочтительно в количестве 80-97% по весу композиции, наиболее предпочтительно в количестве 85-97% по весу композиции. Моногидрат лактозы может быть только или единственным наполнителем, который присутствует в композиции, то есть композиция по изобретению может не содержать других наполнителей, отличных от моногидрата лактозы. В чрезвычайно предпочтительном варианте осуществления изобретения, композиция содержит микрокристаллическую целлюлозу и моногидрат лактозы. Микрокристаллическая целлюлоза обычно присутствует в количестве 20-80% по весу композиции и моногидрат лактозы в количестве 20-80% по весу композиции. В одном варианте осуществления этого аспекта изобретения микрокристаллическая целлюлоза составляет основную часть системы наполнителей микрокристаллическая целлюлоза-моногидрат лактозы, то есть композиция содержит моногидрат лактозы в количестве 20-60% по весу композиции и микрокристаллическую целлюлозу в количестве 40-80% по весу композиции, например, моногидрат лактозы в количестве 20-45% по весу композиции и микрокристаллическую целлюлозу в количестве 40-70% по весу композиции, например, моногидрат лактозы в количестве 25-36% по весу композиции и микрокристаллическую целлюлозу в количестве 52-63% по весу композиции. Микрокристаллическая целлюлоза и моногидрат лактозы могут быть единственными наполнителями, которые содержатся в композиции, то есть композиция по изобретению может не содержать других наполнителей, отличных от микрокристаллической целлюлозы и моногидрата лактозы. В другом и особенно предпочтительно варианте этого аспекта изобретения моногидрат лактозы составляет основную часть системы наполнителей микрокристаллическая целлюлоза-моногидрат лактозы, то есть композиция содержит микрокристаллическую целлюлозу в количестве 20-60% по весу композиции и моногидрат лактозы в количестве 40-80% по весу композиции. Более предпочтительно, композиция содержит микрокристаллическую целлюлозу в количестве 20-45% по весу композиции и моногидрат лактозы в количестве 40-70% по весу композиции. Наиболее предпочтительно, композиция содержит микрокристаллическую целлюлозу в количестве 25-36% по весу композиции и моногидрат лактозы в количестве 52-63% по весу композиции. Микрокристаллическая целлюлоза и моногидрат лактозы могут быть единственными наполнителями, которые содержатся в композиции, то есть композиция по изобретению может не содержать других наполнителей, отличных от микрокристаллической целлюлозы и моногидрата лактозы.
Микрокристаллическая целлюлоза является коммерчески доступной с различными размерами частиц и степенями влажности. Примерами коммерчески доступных препаратов микрокристаллической целлюлозы являются Avicel® РН-серий от FMC Biopolymer, Emcocel® М-серий от Penwest Pharmaceuticals Со. и Vivapur®-серий от Rettenmaier & Söhne GmbH. Особенно предпочтительным коммерческим продуктом для использования для целей, описанных в настоящей заявке, является Avicel® РН-101. Подобным образом, коммерчески доступны различные типы моногидрата лактозы, которые имеют различные физические свойства, такие распределение частиц по размерам и характеристики текучести. Тип моногидрата лактозы может существенно зависеть от конкретной дозированной формы, которую нужно приготовить. Например, типы моногидрата лактозы прямого прессования, такие как Tablettose® (агломерированный) или типы для порошковых смесей, такие как Pharmatose® DCL 11 (высушенный распылением), имеют улучшенные свойства текучести и являются более сжимаемыми, чем порошкообразный или кристаллический моногидрат лактозы. Такие препараты моногидрата лактозы не являются особенно предпочтительными для целей, раскрытых в настоящем изобретении. До некоторой степени, предпочтительными являются более тонкоизмельченный моногидрат лактозы, такой как порошкообразный или кристаллический моногидрат лактозы, в особенности кристаллический моногидрат лактозы, в котором 90% частиц имеют диаметр меньше, чем 0,1 мм.
- Связующие,
такие как сахароза, глюкоза, сорбит, гуммиарабик, альгиновая кислота, альгинат натрия, желатин, крахмал, желатинированный крахмал, алюмосиликат магния, карбоксиметилцеллюлоза натрия (CMC натрия), метил целлюлоза, этилцеллюлоза, гидроксипропилметил-целлюлоза (НРМС), гидроксипропилцеллюлоза (НРС), поливинилацетат или полиэтилен гликоль. Связующее обычно присутствует в количестве 0,1-10% по весу композиции. Предпочтительно, связующее присутствует в количестве 0,2-5% по весу композиции, например, 0,5-5% по весу композиции, более предпочтительно в количестве 1-3% по весу композиции. В предпочтительном варианте осуществления изобретения, связующее представляет собой НРС. Следует принять во внимание, что тогда как поливинилпирролидон (ПВП) во многих случаях является "лучшим связующим", в особенности в связи с процессами влажного гранулирования, но включение ПВП в композицию по изобретению не является желательным в связи с возможным окислением этого наполнителя. Действительно, изобретателем настоящего изобретения было обнаружено, что ПВП ускоряет распад 5-метил-(6Б)-тетрагидрофолиевой кислоты (данные не показаны).
Таким образом, вследствие распада чувствительной к окислению тетрагидрофолиевой кислоты, количество ПВП в композиции по изобретению следует поддерживать на чрезвычайно минимальном уровне и предпочтительно его следует исключать. Таким образом, композиция по изобретению обычно содержит меньше, чем 2% ПВП по весу композиции, предпочтительно меньше, чем 1% ПВП по весу композиции, более предпочтительно меньше, чем 0,5% ПВП по весу композиции. Наиболее предпочтительно, композиция по изобретению по существу не содержит ПВП.
- Замасливатели, включая вещества, способствующие скольжению, и антиадгезивы,
такие как стеарат магния, стеарат цинка, стеариновая кислота, диоксиды кремния, гидрогенизированные растительные масла или тальк. Замасливатель обычно присутствует в количестве 0,1-10% по весу композиции. Предпочтительно, замасливатель присутствует в количестве 0,2-5% по весу композиции, например, 0,5-5% по весу композиции, более предпочтительно в количестве 1-3% по весу композиции. В