Способ интраоперационной дифференциальной диагностики объемных образований щитовидной железы
Иллюстрации
Показать всеИзобретение относится к медицине, хирургии, интраоперационной дифференциальной диагностике объемных образований щитовидной железы (ЩЖ). В режиме реального времени проводят конфокальную лазерную микроскопию ткани ЩЖ. При получении изображения в виде сетки с ячейками округлой или полигональной формы диаметром 20-200 мкм с перегородкой толщиной 0,2 мкм диагностируют отсутствие объемных образований ЩЖ. При регистрации сетчатого изображения с диаметром ячеек более 200 мкм диагностируют узловой коллоидный зоб. При получении изображения с ячейками диаметром 20-200 мкм с толщиной перегородки 10-30мкм и участками фиброза диагностируют аденому ЩЖ. При регистрации изображения с бесструктурными массами с неровными изъеденными краями по всему полю зрения с просветлениями, расположенными в хаотичном порядке, диагностируют рак ЩЖ. Способ обеспечивает быструю и точную диагностику образований ЩЖ в режиме реального времени, интраоперационно. 1 з.п. ф-лы, 3 ил.
Реферат
Область техники:
Изобретение относится к области медицины, к хирургии, конкретно к способам интраоперационной дифференциальной диагностики объемных образований щитовидной железы.
В настоящее время морфологическая диагностика заболеваний щитовидной железы состоит из нескольких этапов: дооперационного - тонкоигольная аспирационная биопсия (ТАБ), интраоперационного - срочное цитологическое и гистологическое исследование, послеоперационного - плановое гистологическое исследование. Наибольшую значимость для определения тактики лечения и объема оперативного вмешательства имеют данные ТАБ до операции и срочных исследований во время хирургического вмешательства. В настоящее время появилась новая методика - прижизненная конфокальная лазерная микроскопия (КЛМ) в режиме реального времени, которая уже применяется для диагностики заболеваний желудочно-кишечного тракта, бронхо-легочной системы и заболеваний кожи. Эта методика позволяет поставить точный морфологический диагноз непосредственно во время процедуры КЛМ с осмотром тканей, что определяет преимущества перед другими визуализирующими диагностическими технологиями и представляет бесспорный интерес для клинического применения [1, 2]. Опыт применения данной технологии для исследования щитовидной железы не зафиксирован ни в отечественной, ни в иностранной литературе. В связи с вышеизложенным авторами впервые представлена возможность применения КЛМ для интраоперационной диагностики заболеваний щитовидной железы.
Задачей настоящего изобретения является разработка методики исследования объемных образований щитовидной железы с помощью методики КЛМ, применение которой позволит получить более быстрый результат и позволит исследовать все интересующие участки как самого объемного образования, так и прилегающей ткани щитовидной железы.
Технический результат достигается тем, что после операции на щитовидной железе удаленная ткань вместе с объемным образованием исследуется как через капсулу, так и на разрезе с помощью установки для КЛМ в режиме реального времени. Полученные изображения анализируются с помощью разработанных критериев, на основании которых проводится дифференциальная диагностика объемных образований щитовидной железы. Технический результат достигается следующим образом: Метод КЛМ основан на принципе конфокальной флюоресцентной микроскопии [3]. Лазер с длинной волны 488 нм, расположенный в рабочей станции, генерирует лазерный луч и передает его с помощью систем зеркал, качающихся во взаимоперпендикулярных направлениях. На выходе из рабочей станции лазерный луч проходит через многоволоконный фиброоптический зонд и попадает на поверхность исследуемой ткани. Часть света поглощается, а другая часть индуцирует флюоресценцию тканей, которая регистрируется конфокальным микроскопом и обрабатывается компьютером, позволяя получить динамическое монохромное изображение на мониторе [4]. Таким образом, при КЛМ можно достигнуть визуализации только тех структур, которые обладают эффектом аутофлюоресценции. К основным эндогенным флуорофорам биологических тканей относятся флавины, протеины и порфирины. Каждый флуорофор имеет характерные спектры поглощения и эмиссии [5, 6]. При использовании монохроматического света с длиной волны 488 нм возникает свечение биологических субстанций, богатых NADH, липопигментами, а также коллагена и эластина [7], которые входят в состав базальной мембраны фолликулов и многочисленных сосудов микроциркуляторного русла, находящихся в соединительнотканной капсуле. Прослойки последней направляются вглубь и разделяют орган на дольки.
Основными структурными компонентами паренхимы железы являются фолликулы - замкнутые шаровидные образования с полостью внутри, диаметром 20-200 мкм. Стенка фолликулов толщиной до 0,2 мкм образована одним слоем эпителиальных клеток - фолликулярных тироцитов. Фолликулы разделяются тонкими прослойками рыхлой волокнистой соединительной ткани с многочисленными кровеносными и лимфатическими капиллярами, оплетающими фолликулы, а также тучными клетками и лимфоцитами.
При опухолевых процессах ее строма обеспечивает саму опухоль структурной организацией, кровеносными сосудами и интерстициальной соединительной тканью, отличаясь от нормальной интерстициальной соединительной ткани [8, 9, 10]. В строме опухоли активно происходит деградация уже существующих сосудов базальных мембран и образование новых капиллярных сетей [11]. Синтез фибрина в опухоли повышен [12, 13], вследствие чего происходят массивные процессы склероза [14, 15]. Основу соединительной ткани интерстициальной опухолевой стромы составляют интерстициальные коллагены (главным образом типа I и III), фибрин, фибронектин, эластин и ламинин, и глюкозаминогликаны [16].
По сравнению с доброкачественными образованиями при злокачественных более выражены процессы склероза, а также наиболее выражена структурная дезорганизация, на основании чего проводится дифференциальная диагностика между доброкачественными и злокачественными образованиями.
Процедура КЛМ проводится с помощью прибора Cellvizio®, выпущенного компанией Mauna Kea Technologies (Париж, Франция). Для исследования щитовидной железы специализированных зондов пока не производится, поэтому для ее исследования применялись зонды Demo и Gastoflex, разрешающая способность которых достигает 50 и 20 мкм соответственно, что сопоставимо с размерами фолликулов щитовидной железы, глубина исследования - 0-60 мкм, поле зрения от 240 до 600 мкм. Перед проведением КЛМ важно осуществить настройку Cellvizio® в соответствии с предписанием, выполнить калибровку зонда, подготовить его к работе.
КЛМ проводится после удаления щитовидной железы. Из удаленного препарата готовятся срезы, которые проходят через здоровую ткань и объемные образования. Затем минизонд подводится к исследуемому участку. Это сопровождается появлением на экране динамически меняющейся монохромной микроскопической картины, которая записывается. В дальнейшем полученные записи анализируются и сравниваются с изображениями, получаемыми при световой микроскопии гистологических препаратов. В ходе анализа определены признаки, которые характерны для нормальной ткани щитовидной железы, аденомы и тиреоидной карциномы.
При исследовании нормальной ткани щитовидной железы регистрируется изображение, напоминающее сетку с ячейками одинакового размера, округлой или полигональной формы, диаметром 20-200 мкм с толщиной перегородки 0,2 мкм, что соответствует размеру нормального фолликула и толщине базальной мембраны.
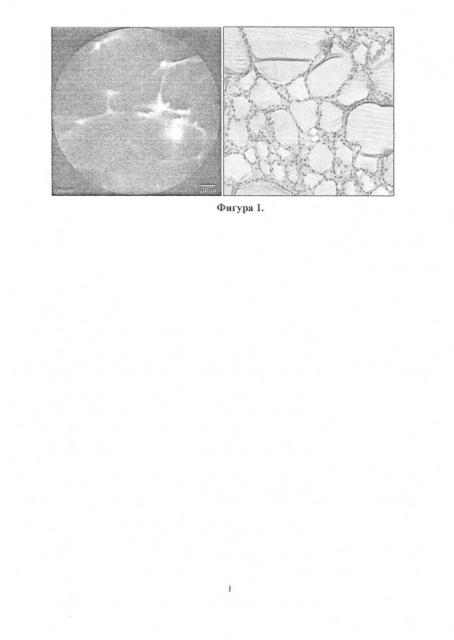
При узловом коллоидном зобе также регистрируется сетчатое изображение, однако диаметр ячеек более 200 мкм и могут превышать 1000 мкм (Фиг. 1).
При аденоме щитовидной железы на некоторых участках сохранено строение, напоминающее сеть с ячейками диаметром 20-200 мкм, чаще 30-60 мкм, однако толщина соединительнотканной перегородки составляет 10-30 мкм. При этом встречаются участки фиброза различной толщины и протяженности (Фиг. 2).
При раке сетчатого рисунка не наблюдается, практически все поле зрения замещено грубой бесструктурной фиброзной тканью, где периодически встречаются просветления неправильной формы разного размера, местами сливающиеся, расположенные в хаотичном порядке. За пределами узлового образования макроскопически неизмененная ткань щитовидной железы при исследовании зондом чаще всего имеет характерную картину щитовидной железы (Фиг. 3).
Перечень фигур, поясняющих материалы.
Фиг. 1. Демонстрирует изображения, полученные с помощью КЛМ в режиме реального времени и стандартным световым микроскопом при плановом гистологическом исследовании у пациента с многоузловым нетоксическим коллоидным зобом.
Фиг. 2. Иллюстрирует изображения, полученные с помощью КЛМ в режиме реального времени и стандартным световым микроскопом при плановом гистологическом исследовании у пациентки с аденомой щитовидной железы.
Фиг. 3. Демонстрирует изображения, полученные с помощью КЛМ в режиме реального времени и стандартным световым микроскопом при плановом гистологическом исследовании у пациента с тиреоидной карциномой.
Эффективность предложенного способа и практическая применимость исследовалась на группе, состоящей из 34 пациентов, находившихся в ГКБ им С.П. Боткина в период с декабря 2014 г по февраль 2015 г. с объемными образованиями щитовидной железы. По нозологическим формам пациенты распределились следующим образом: многоузловой зоб - 10, аденома щитовидной железы - 4, папиллярная карцинома - 4. После удаления ткани щитовидной железы, настройки КЛМ и калибровки зонда исследовалась тиреоидная ткань вместе с объемным образованием. Из удаленного препарата готовились срезы, которые проходили через макроскопически неизмененную ткань и узловые образования. Всем пациентам с помощью микрозондов было выполнено последовательное исследование ткани щитовидной железы, осуществлены видеозаписи и фотографирование. Это сопровождалось появлением на экране динамически меняющейся монохромной микроскопической картины. Далее с помощью разработанных критериев изображение КЛМ анализировалось.
На основании полученных данных судили о характере объемных образований. В результате объемные образования были распределены по следующим нозологическим формам: многоузловой коллоидный зоб - 11, аденома щитовидной железы - 3, папиллярная карцинома - 4. В последующем все препараты исследовались с помощью стандартного гистологического исследования и сравнивались с заключением КЛМ. Сравнительный анализ показал, что при КЛМ в режиме реального времени во всех случаях были заподозрены аденома и рак щитовидной железы.
Используемая литература
1. Meining A. Confocal endomicroscopy // Gastrointestinal Endoscopy Clinics of North America - 2009. - Vol. 19. - N. 4. - P. 629-635.
2. Neumann H., Kiesslich R., Wallace M.B. et al. Confocal laser endomicroscopy: technical advances and clinical applications // Gastroenterology. - 2010. - N. 139. - P. 388-392.
3. Cameron A.J. Epidemiology of columnarlined esophagus adenocarcinoma // Gastroenterol. Clin. North Amer. - 1997. - Vol. 26. - P. 487-494.
4. Thiberville L., Salahn M., Lachkar S., Dominique S., Moreno (Swirc S., Vever (Bizet C, Bourg (Heckly G. Human in vivo fluorescence microimaging of the alve (olar ducts and sacs during bronchoscopy // Eur Respir J 2009; 33: 974 (985).
5. Gabrecht T, Andrejevic(Blant S, WagniPres G. Blue(violet excited autofluorescence spectroscopy and imaging of normal and cancerous human bronchial tis (sue after formalin fixation. Photochem Photobiol 2007; 83: 450 (458.
6. Matthieu Zellweger. Fluorescence spectroscopy of exogenous, exogenously-induced and endogenous fluorofores for the photodetection and photodynamic therapy of cancer. Lausanne, Fevrier 2000.
7. Sundberg, C, Branting, M., Gerdin, В., and Rubin, K. Tumor cell and connective tissue cell interactions in human colorectal adenocarcinoma. Transfer of platelet-derived growth factor-AB/BB to stromal cells. Am J Pathol, 151: 479-492, 1997.
8. Paku, S. and Paweletz, N. First steps of tumor-related angiogenesis. Lab Invest, 65: 334-346, 1991. 56. Bosman, F. Т., de Bruine, A., Flohil, C, van der Wurff, A., ten Kate, J., and Dinjens, W. W. Epithelial-stromal interactions in colon cancer. Int J Dev Biol, 37: 203-211, 1993.
9. Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med, 1: 27-31, 1995.
10. Dano, К., Andreasen, P. A., Grondahl-Hansen, J., Kristensen, P., Nielsen, L. S., and Skriver, L. Plasminogen activators, tissue degradation, and cancer. Adv Cancer Res, 44: 139-266, 1985.
11. Dvorak, H. F., Harvey, V. S., and McDonagh, J. Quantitation of fibrinogen influx and fibrin deposition and turnover in line 1 and line 10 guinea pig carcinomas. Cancer Res, 44: 3348-3354, 1984 cross-linked.
12. Rosai J, Carcangui ML, DeLellis RA. Tumors of the Thyroid Gland. Atlas of Tumor Pathology, Fascicle 5. Armed Forces Institute of Pathology: Washington, DC, 1992.
13. Baloch Z, LiVolsi VA. Pathology of the thyroid gland. In: Livolsi VA, Asa S (eds). Endocrine Pathology. Churchill Livingston: Philadelphia, PA, 2002, pp 61-88.
14. Carcangui ML, Zampi G, Pupi A, et al. Papillary carcinoma of the thyroid: a Clinico-pathologic study of 241 cases treated at the University of Florence, Italy. Cancer 1985; 55: 805-828. /23. Article /PubMed / ChemPort.
15. Dvorak, H. F., Nagy, J. A., Dvorak, J. Т., and Dvorak, A. M. Identification and characterization of the blood vessels of solid tumors that are leaky to circulating macromolecules. Am J Pathol, 133: 95-109, 1988.
16. Barsky, S. H., Rao, C. N., Grotendorst, G. R., and Liotta, L. A. Increased content of Type V Collagen in desmoplasia of human breast carcinoma. Am J Pathol, 108: 276-283, 1982.
1. Способ интраоперационной дифференциальной диагностики объемных образований щитовидной железы, отличающийся тем, что в режиме реального времени проводят конфокальную лазерную микроскопию ткани щитовидной железы и при получении изображения в виде сетки с ячейками округлой или полигональной формы диаметром 20-200 мкм с перегородкой толщиной 0,2 мкм диагностируют отсутствие объемных образований щитовидной железы; при регистрации сетчатого изображения с диаметром ячеек более 200 мкм диагностируют узловой коллоидный зоб; при получении изображения с ячейками диаметром 20-200 мкм с толщиной перегородки 10-30 мкм и участками фиброза диагностируют аденому щитовидной железы; при регистрации изображения с бесструктурными массами с неровными изъеденными краями по всему полю зрения с просветлениями, расположенными в хаотичном порядке, диагностируют рак щитовидной железы.
2. Способ по п. 1, отличающийся тем, что преимущественно размер ячеек на полученном изображении при аденоме щитовидной железы составляет 30-60 мкм.