Бис(метоксибензиламиноалкил)амины, обладающие кардиотропной активностью
Иллюстрации
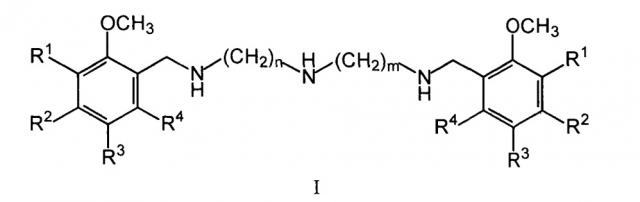
Показать всеИзобретение относится к новым бис(метоксибензиламиноалкил)аминам общей формулы (I) и их физиологически приемлемым солям, обладающим кардиотропной активностью. Соединения проявляют антиишемическое и антиаритмическое, в частности противофибрилляторное, действие. По своей острой токсичности (LD50) соединения относятся к III и IV классам токсичности. В общей формуле (I).
R1, R2, R3, R4 могут быть двумя или тремя водородами, или одной или двумя метоксигруппами, n и m могут быть одинаковыми и иметь значения 2 или 3 или разными и иметь значения n=2 и m=3. В качестве фармацевтически приемлемых солей бис(метоксибензиламиноалкил)аминов общей формулы I предпочтительны их тригидрохлориды общей формулы II (I⋅3HCl). Наиболее предпочтительными являются тригидрохлориды, выбранные из тригидрохлорида N1-(2,5-диметоксибензил)-N2-{2-[(2,5-диметоксибензил)амино]-этил}-1,2-этандиамина (IIв), тригидрохлорид N1-(2,3,4-триметоксибензил)-N2-{2-[(2,3,4-триметоксибензил)-амино]этил}-1,2-этандиамина (IIг) и тригидрохлорид N1-(2,4-диметоксибензил)-N3-{3-[(2,4-диметоксибензил)амино]-пропил}-1,3-пропандиамина (IIе). 11 н. и 3 з.п. ф-лы, 5 табл., 14 пр.
Реферат
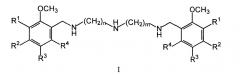
Изобретение относится к области биологически активных соединений, конкретно к новой группе бис(метоксибензиламиноалкил)аминов общей формулы (I)
где R1, R2, R3, R4 могут быть двумя или тремя водородами, или одной или двумя метоксигруппами, n и m могут быть одинаковыми и иметь значения 2 или 3, или разными и иметь значения n=2 и m=3, а также к их физиологически приемлемым солям, предпочтительно к тригидрохлоридам общей формулы II (I⋅3HCl).
Заявляемые соединения обладают антиишемической и антиаритмической, в частности антифибрилляторной активностями.
Создание и внедрение в клиническую практику новых высокоэффективных кардиотропных лекарственных средств, сочетающих в себе антиишемические и антиаритмические свойства, является одной из наиболее приоритетных задач, стоящих перед современной кардиофармакологией. В последние годы все больший интерес вызывают лекарственные средства негемодинамического действия, механизм действия которых связан с оптимизацией метаболических процессов, протекающих как в ишемизированной, так и в условно-интактной сердечной мышце (McComick L.M. et al., Cardiovasc. Hematol. Agents Med. Chem., 2012, 10(4):319-324; Grossman A.N. et al., Circulation, 2013, 127(9):1040-1048; Олесова В.М. и др., Кардиология, 2013, 53(1):66-71* и др.). В этом плане особый интерес вызывают лекарственные средства, обладающие способностью модулировать в миокарде метаболизм свободных жирных кислот (Lopaschuk G.D. et al., Physiol. Rev., 2010, 90(1):207-258; Lionetti V. et al., Cardiovasc. Res., 2011, 90(2):202-209; Jaswai J.S. et al., Biochim. Biophys. Acta, 2011, 1813(7):1333-1350). Это связано с тем, что нарушение окисления свободных жирных кислот в ишемизированных кардиомиоцитах ответственно за формирование ишемической/постишемической дисфункции левого желудочка и/или развитие злокачественных нарушений сердечного ритма (Ingwall J.S., Cardiovasc Res., 2009, 81(3):412-419). Известно, что дефицит кислорода, сопутствующий практически всем заболеваниям сердца, влечет за собой изменение метаболизма кардиомиоцитов. При этом основным источником АТФ становится анаэробный гликолиз, а аэробный синтез АТФ, осуществляемый за счет β-окисления свободных жирных кислот, снижается, что влечет за собой увеличение содержания недоокисленных свободных жирных кислот в зоне неадекватного кровоснабжения сердечной мышцы. Этот процесс получил название, метаболического ремоделирования миокарда (van Bilsen M. et al., Cardiovasc. Res., 2004, 61(2):218-226). Имеющиеся данные о механизмах, лежащих в основе метаболического ремоделирования миокарда, позволили сформулировать теоретические подходы к медикаментозной миокардиальной цитопротекции - восстановление нормального метаболического потенциала клеток сердца, находящихся в зоне ишемии миокарда посредством подавления аномального метаболизма свободных жирных кислот в ишемизированных кардиомиоцитах (Bhandari В., Subramanian L., Recent Pat. Cardiovasc. Drug Discov., 2007, 2(1):35-39; Fang Y.H. et al., J. Mol. Med. (Berl.), 2012, 90(1):31-43). Лекарственные препараты, обладающие такой активностью, получили название парциальные ингибиторы окисления жирных кислот - p-FOX ингибиторы (partial fatty acid oxidation ingibitorse).
В настоящее время в клинике применяются два p-FOX ингибитора первого поколения - препарат триметазидин (1-[(2,3,4-триметоксифенил)метил] пиперазин), блокирующий активность фермента 3-кето-ацил коэнзим А-тиолазы и тем самым подавляющий 4 фазу окисления свободных жирных кислот, и препарат ранолазин ((±)-N-(2,6-диметилфенил-4[2-гидрокси-3(2-метоксифенокси)-пропил]-1-пиперазин ацетамид) - обратимый ингибитор NADH-дегидрогеназы митохондрий. Доклиническое изучение проходит p-FOX ингибитор второго поколения - соединение CVT-4325 [(R)-1-(2-метилбензо[d]тиазол-5-илокси)-3(4-((5-(4-(трифлуорометил)фенил)-1,2,4-оксадиазол-3-ил)метил)-пиперазин-1-ил)пропан-2-ол], блокирующий окисление свободных жирных кислот в митохондриях кардиомиоцитов (Imai M. et al., Cardiovasc. Drygs Ther., 2007, 21(1):9-15; Partownavid P. et al., Crit. Care Med., 2012, 40(8):24312437).
Результаты клинического применения триметазидина и ранолазина свидетельствуют о том, что эти препараты проявляют высокую антиишемическую и антиаритмическую активность у пациентов, страдающих ишемической болезнью сердца, хронической сердечной недостаточностью, метаболическим синдромом, алкогольной кардиомиопатией и т.д. (Fragasso G. Et al., Curr. Pharm. Des., 2009, 15(8):857-862; Hu В. et al., Clin. Cardiol., 2011, 34(6):395-400; Zhang L. et al., J. Am. Coll. Cardiol., 2012, 59(10):913-922; Vizzardi E. et al., J. Cardiovasc. Pharmacol. Ther., 2012, 17(4):353-356; Sossalla S., Maier L.S., Pharmacol. Ther., 2012, 133(3):311-323).
Исходя из изложенного, представляется своевременным и актуальным поиск лекарственных средств, потенциально обладающих свойствами pFOX-ингибиторов.
Одним из возможных подходов к решению этой проблемы является поиск кардиотропных средств в ряду новых представителей бис(метоксибензиламиноалкил)аминов общей формулы (I), представляющих собой комбинацию структурных элементов препаратов тиметазидина, ранолазина и верапамила.
В связи с указанным, в основу настоящего изобретения положена задача получения новых соединений с высокой антиишемической, антиаритмической, в частности антифибрилляторной активностью, и большой широтой терапевтического действия.
Наиболее близкими прототипами по химическому строению являются: N1-(4-метоксибензил)-N2-{2-[(4-метоксибензил)амино]этил}-1,2-этилендиамин [L. Xue-Ting, X. Yong-Shu, L. Qing-Liang, Synthesis and Reactivity in Inorganic, Metal-Organic and Nano-Metal Chemistry, 35, 459 (2005)], N1(3,4-метоксибензил)-N2-{2[(2-метоксибензил)амино]этил}-1,2-этилендиамин [G.A. Vedage, J.J. Burdeniuc, A.R. Arnold, J.D. Tobias, Crosslinkers for improving stability of polyurethane foams, US Patent 8552078 B2 (2013)] N1-(3,4-диметоксибензил)-N2-{2-[(3,4-диметоксибензил)амино]этил}-1,2-этилендиамин [P. D. Beer, C.G. Crane, J.P. Dfnks, P.A. Gale, J.F. McAleer, Journal of Organometallic Chemistry, 490, 143 (1995)] и N1-(3,4,5-триметоксибензил)-N2-{2-[3,4,5-триметоксибензил)амино]этил}-1,2-этилеидиамин [J.-B. Galey, S. Genard, Derivatives of N,N-di(carboxyalkyl)alkylene di - or triamine, US Patent 5929112 (1999)].
Приведенные прототипы использовались в качестве добавок к полимерным смолам либо в качестве промежуточных веществ для дальнейшего синтеза. Их физиологическая активность не описана. Они отличаются от заявляемых веществ общей структуры I положением метоксигрупп в бензольных кольцах молекул.
В основу настоящего изобретения положена задача получения новых соединений, относящихся к группе бис(метоксибензиламиноалкил)аминов с высокой антиишмеической, антиаритмической и антифибрилляторной эффективностью и большой широтой терапевтического действия с целью нахождения препарата для лечения коронарной болезни сердца и нарушений сердечного ритма.
В соответствии с настоящим изобретением такими веществами являются бис(метоксибензиламиноалкил)амины (I) и их физиологически приемлемые соли, предпочтительно тригидрохлориды общей формулы II.
Соединения общей формулы I в специальной и патентной литературе не описаны. В качестве примеров соединений формулы I настоящего изобретения следует назвать:
N1-(2,3-диметоксибензил)-N2-{2-[(2,3-диметоксибензил)амино]этил}-1,2-этандиамин (Ia),
N1-(2,4-диметоксибензил)-N2-{2-[(2,4-диметоксибензил)амино]этил}-1,2-этандиамин (Iб),
Nl-(2,5-диметоксибензил)-N2-{2-[(2,5-диметоксибензил)амино]этил}-1,2-этандиамин (Iв),
Nl-(2,3,4-триметоксибензил)-N2-{2-[(2,3,4-триметоксибензил)амино]этил}-l,2-этандиамин (Iг),
N1-(2,3-диметоксибензил)-N3-{3-[(2,3-диметоксибензил)амино]пропил}-1,3-пропандиамин (Iд),
N1-(2,4-диметоксибензил)-N3-{3-[(2,4-диметоксибензил)амино]пропил}-1,3-пропандиамин (Ie),
N1-(2,3,4-триметоксибензил)-N3-{3-[(2,3,4-триметоксибензил)амино]пропил}-1,3пропандиамин (Iж),
N1-(2,3,4-триметоксибензил)-N3-{3-[(2,3,4-триметоксибензил)амино]этил}-1,3-пропандиамин (Iз).
N1-(2,4,5-триметоксибензил)-N2-{2-[(2,4,5-триметоксибензил)амино]этил}-1,2-этандиамин (1и),
N1-(2,4,6-триметоксибензил)-N2-{2-[2,4.6-триметоксибензил)амино]этил}-1,2-этан-диамина (1к).
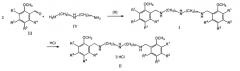
В соответствии с настоящим изобретением соединения общей формулы I и II можно получить по следующей общей схеме:
где R1, R2, R3, R4 могут быть двумя или тремя водородами, или одной или двумя метоксигруппами, n и m могут быть одинаковыми и иметь значения n=m=2, или n=m=3, или разными и иметь значения n=2 и m=3.
Целевые бис(мет6ксибензиламиноалкил)амины (I) могут быть получены путем каталитического гидрирования продуктов взаимодействия замещенных бензальдегидов (III) с диалкилентриаминами (IV) в соотношении 2:1 соответственно в растворах низших спиртов с использованием катализаторов гидрирования, таких как палладий, платина, никель Ренея. В качестве другого способа получения бис(метоксибензиламиноалкил)аминов (I) может быть использовано восстановление продуктов взаимодействия бензальдегидов (III) с диалкилентриаминами (ГУ) в соотношении 2:1 соответственно в растворах низших спиртов с помощью комплексных гидридов, таких как боргидрид натрия. В качестве спиртов в обоих случаях могут быть использованы метанол, этанол, изопропанол.
Для получения физиологически приемлемых солей присоединения кислот II бис(метоксибензиламиноалкил)амины (I) можно вводить во взаимодействие с неорганическими или органическими кислотами, предпочтительно с соляной кислотой.
Соединения I представляют собой густые масла, растворимые в органических растворителях. Тригидрохлориды (II) представляют собой высокоплавкие белые кристаллические вещества, хорошо растворимые в воде и нерастворимые в эфирах, например в диэтиловом эфире, и ароматических растворителях, например в бензоле, толуоле.
Строение веществ общей формулы I и II подтверждено данными спектров ЯМР 1H, а их чистота - данными элементного анализа.
Пример 1: Тригидрохлорид N1-(2,3-диметоксибензил)-N2-{2-[(2,3-диметоксибензил)амино]этил}-1,2-этандиамина (IIa)
Смесь 8,31 г (50 ммоль) 2,3-диметоксибензальдегида и 2,58 г (25 ммоль) диэтилентриамина в 90 мл этанола выдерживали при комнатной температуре сутки. К раствору прибавляли 0,5 г палладиевого катализатора (PdO/C, 10% Pd) и гидрировали при перемешивании при атмосферном давлении и комнатной температуре до полного поглощения водорода. Катализатор отфильтровывали, фильтрат упаривали досуха. К остатку прибавляли 25 мл воды и продукт экстрагировали бензолом. Бензольный раствор промывали водой и упаривали досуха. Маслообразный остаток растворяли в 180 мл ацетона и к раствору прибавляли концентрированную соляную кислоту до кислой реакции. Осадок отфильтровывали и перекристаллизовывали из спирта. Выход 7,1 г (55,2%). Т.пл. 182-184°С (из спирта). Найдено %: С 51,76; Н 7,08; N 8,30; Cl 20,86. C22H36Cl3N3O4. Вычислено %: С 51,52; Н 7,07; N 8,19; Cl 20,74. Спектр ЯМР 1H (DMSO, δ, м.д.): 3.29-3.46 (м, 8 Н, ((CH2)2)2N); 3.82, 3.83 (оба с, по 6 Н, 4 ОМе); 4.18 (с, 4 Н, 2 CH2Ar); 7.10-7.23(м, 6Н, ArH).
Пример 2: Тригидрохлорид N1(2,4-диметоксибензил)-N2-{2-2,4-диметоксибензил)амино]этил}-1,2-этандиамина (IIб)
Получен из 8,31 г (50 ммоль) 2,4-диметоксибензальдегида и 2,58 г (25 ммоль) диэтилентриамина по описанному в примере 1 методу. Выход 5,5 г (42,9%). Т.пл. 200-202°С (из спирта). Найдено %: С 49,79; Н 7,31; N 8.05; Cl 20,02. C22H36N3 Cl3O4⋅H2O. Вычислено %: С 49,77; Н 7,21; N 7,91; Cl 20,03. Спектр ЯМР 1Н (DMSO, δ, м.д., J/Гц): 3.22-3.43 (м, 8 Н, ((CH2)2)2N); 3.78, 3.83 (оба с, по 6 Н, 4 ОМе); 4.07 (с, 4 Н, 2 CH2Ar); 6.57 (д, 2 Н, 2 ArH(5), J3=8.5); 6.62 (с, 2 Н, 2 ArH(3)); 7.40 (д, 2 Н, 2 ArH(6), J3=8.5).
Пример 3: Тригидрохлорид N1-(2,5-диметоксибензил)-N2-{2-[2,5-диметоксибензил)амино]этил}-1,2-этандиамина (IIв)
Получен из 8,31 г (50 ммоль) 2,5-диметоксибензальдегида и 2,58 г (25 ммоль) диэтилентриамина по описанному в примере 1 методу. Выход 9,0 г (70%). Т.пл. 109-110°С. Найдено %: С 50,63; Н 7,16, N 8,11; Cl 20,70. C22H36N3Cl3O4⋅0,5⋅H2O Вычислено %: С 50,63; Н 7,15; N 8,05; Cl 20,38. Спектр ЯМР 1H (DMSO, δ, м.д.): 3.27-3.42 (м, 8 Н, ((CH2)2)2N); 3.72, 3.79 (оба с, по 6 Н, 4 ОМе); 4.15 (с, 4 Н, 2 CH2Ar); 6.93-7.05 (м, 4 Н, 2 ArH(3), 2 ArH(4)); 7.19 (м, 2 Н, 2 ArH(6)).
Пример 4: Тригидрохлорид Nl-(2,3,4-триметоксибензил)-N2-{2-[(2,3,4-триметоксибензил)амино]этил}-1,2-этандиамина (IIг)
Получен из 9,8 г (50 ммоль) 2,3,4-триметоксибензальдегида и 2,58 г (25 ммоль) диэтилентриамина по описанному в примере 1 методу. Выход 8,7 г (60,8%). Т.пл. 176-178°С (из спирта). Найдено %: C 48,81; Н 7,22; N 7,12; Cl 18,23. C24H40Cl3N3O6⋅H2O. Вычислено %: С 48,78; Н 7,16; N 7,11; Cl 18,00. Спектр ЯМР 1H (DMSO+CF3COOD, δ, м.д., J/Гц): 3.21-3.45 (м, 8 Н, ((CH2)2)2N); 3.76, 3.80, 3.89 (три с, по 6 Н, 6 ОМе); 4.12 (с, 4 Н, 2 CH2Ar); 6.84 и 7.26 (оба д, по 2 Н, 4 ArH, J3=8.7).
Пример 5: Тригидрохлорид N1-(2,3,4-триметоксибензил)-N2-{2-[(2,3,4-триметоксибензил)амино]этил}-1,2-этандиамина (IIг)
Смесь 10,8 г (55 ммоль) 2,3,4-триметоксибензальдегида и 2,58 г (25 ммоль) диэтилентриамина в 60 мл этанола выдерживали при комнатной температуре сутки, и полученный раствор прибавляли порциями к раствору 2,83 г (75 ммоль) боргидрида натрия в 60 мл этанола при температуре 30-40°С при перемешивании. Реакционную смесь выдерживали при комнатной температуре 12 часов, прибавляли к ней 20 мл концентрированной соляной кислоты и упаривали досуха. Остаток растворяли в 20 мл воды и подщелачивали гидроксидом натрия. Продукт экстрагировали толуолом. Толуольный раствор промывали водой и упаривали досуха. Маслообразный остаток растворяли в 180 мл ацетона, и к раствору прибавляли концентрированную соляную кислоту до кислой реакции. Осадок отфильтровывали и перекристаллизовывали из этанола. Выход 6,5 г (44%). Т.пл. 176-178°С. Спектр ЯМР 1H идентичен веществу, полученному в примере 4.
Пример 6: Тригидрохлорид N1-(2,3-диметоксибензил)-N3-{3-[(2,3диметоксибензил)амино]пропил}-1,3-пропандиамина (IIд)
Смесь 8,3 г (50 ммоль) 2,3-диметоксибензальдегида и 3,28 г (25 ммоль) N-(3-аминопропил)-1,3-пропандиамина в 90 мл этанола выдерживали при комнатной температуре сутки. К раствору прибавляли 0,5 г палладиевого катализатора (PdO/C, 10% Pd) и гидрировали при перемешивании при атмосферном давлении и комнатной температуре до полного поглощения водорода. Катализатор отфильтровывали, фильтрат упаривали досуха. К остатку прибавляли 25 мл воды, и продукт экстрагировали бензолом. Бензольный раствор промывали водой и упаривали досуха. Маслообразный остаток растворяли в 200 мл ацетона, и к раствору прибавляли концентрированную соляную кислоту до кислой реакции. Осадок отфильтровывали и перекристаллизовывали из спирта. Выход 7,8 г (55,8%). Т.пл. 188-190°С (из этанола). Найдено %: С 51,43; Н 7,65; N 7,41; Cl 18,97. C24H40Cl3N3O4⋅H2O. Вычислено %: С 51,57%; Н 7,57; N 7,52; Cl 19,03. Спектр ЯМР 1H (DMSO+CF3COOD, δ, м.д.): 2.00 (м, 4 Н, 2 CH2CH2NH); 2.98 (м, 8 Н, 2 CH2CH2CH2NH); 3.78, 3.79 (оба с, по 6 Н, 4 ОМе); 4.09 (с, 4 Н, 2 СН2Аr); 6.97-7.10 (м, 6 Н, АrН).
Пример 7: Тригидрохлорид N1(2,4-диметоксибензил)-N3-{3-[2,4-диметоксибензил)амино]пропил}-1,3-пропандиамина (IIe)
Получен из 8,3 г (50 ммоль) 2,4-диметоксибензальдегида и 3,28 г (25 ммоль) N-(3-аминопропил)-1,3-пропандиамина по описанному в примере 6 методу. Выход 7,2 г (51,5%). Т.пл. 211-213°С (из спирта). Найдено %: С 51,21; Н 7,52; N 7,87; Cl 18,63. C24H40Cl3N3O4⋅H2O. Вычислено %: С 51,57; Н 7,57; N 7,52; Cl 19,00. Спектр ЯМР 1Н (DMSO, δ, м.д., J/Гц): 2.00-2.18 (м, 4 Н, 2 CH2CH2NH); 2.97 (м, 8 Н, 2 CH2CH2CH2NH); 3.78, 3.83 (оба с, 12 Н, 4 ОМе); 4.00 (с, 4 Н, 2 CH2Ar); 6.57 (д, 2 Н, 2 ArH(5), J3=8.5); 6.63 (с, 2 Н, 2 ArH(3)); 7.39 (д, 2 Н, 2 ArH(6), J3=8.5).
Пример 8: Тригидрохлорид Nl-(2,3,4-триметоксибензил)-N3-{3-[(2,3,4-триметоксибензил)амино]пропил}-1,3-пропандиамина (IIж)
Получен из 9,8 г (50 ммоль) 2,3,4-триметоксибензальдегида и 3,28 г (25 ммоль) N-(3-аминопропил)-1,3-пропандиамина по описанному в примере 6 методу. Выход 8,2 г (53,8%). Т.пл. 210-212°С (из спирта). Найдено %: С 51,08; Н 7,45; N 7,11; Cl 17,35. C26H44Cl3N3O6⋅0,5H2O. Вычислено %: С 51,19; Н 7,44; N 6,89; Cl 17,44. Спектр ЯМР 1Н (DMSO+CF3COOD, δ, м.д., J/Гц): 2.02 (м, 4 Н, 2 CH2CH2NH); 2.96 (м, 8 Н, 2 CH2CH2CH2NH); 3.72, 3.74, 3.84 (три с, 18 Н, 6 ОМе); 3.99 (с, 4 Н, 2 CH2Ar); 6.72 (д, 2 Н, 2 ArH(5), J3=8.6); 7.09 (д, 2 Н, 2 ArH(6), J3=8.6).
Пример 9: Тригидрохлорид N1-(2,3,4-триметоксибензил)-N3-{3-[2,3,4-триметоксибензил)амино]этил}-1,3-пропандиамина (IIз)
Смесь 9,8 г (50 ммоль) 2,3,4-триметоксибензальдегида и 2,93 г (25 ммоль) N-(2-аминоэтил)-1,3-пропандиамина в 90 мл этанола выдерживали при комнатной температуре сутки. К раствору прибавляли 0,5 г палладиевого катализатора (PdO/C, 10% Pd) и гидрировали при перемешивании при атмосферном давлении и комнатной температуре до полного поглощения водорода. Катализатор отфильтровывали, фильтрат упаривали досуха. К остатку прибавляли 25 мл воды, и продукт экстрагировали бензолом. Бензольный раствор промывали водой упаривали досуха. Маслообразный остаток растворяли в 200 мл ацетона, и к раствору прибавляли концентрированную соляную кислоту до кислой реакции. Осадок отфильтровывали и перекристаллизовывали из спирта. Выход 7,9 г (52,2%). Т.пл. 203-205°С. Найдено %: С 49,69; Н 7,45; N 7,14; Cl 17,25. C25H42Cl3N3O6⋅H2O. Вычислено %: С 49,63; Н 7,33; N 6,96; Cl 17,58. Спектр ЯМР 1H (DMSO+CF3COOD, δ, м.д., J/Гц): 2.10 (м, 2 Н, 2 CH2CH2NH); 3.04 (м, 4 Н, CH2CH2CH2NH); 3.32 (м, 4 Н, NHCH2CH2NH); 3.76, 3.81, 3.88, 3.89 (четыре с, 6 Н, 6 Н, 3 Н, 3 Н, 6 ОМе); 4.02, 4.10 (оба с, по 2 Н, 2 CH2Ar); 6.85 (д, 2 Н, 2 ArH(5), J3=8.8); 7.26, 7.29 (оба д, по 1 Н, 2 ArH(6), J3=8.8).
Пример 10. Тригидрохлорид N1-(2,4,5-триметоксибензил)-N2-{2-[(2,4,5-триметоксибензил)амино]этил}-1,2-этандиамина (11и)
Получен из 9,8 г (50 ммоль) 2,4,5-триметоксибензальдегида и 2,58 г (25 ммоль) диэтилентриамина по описанному в примере 1 методу. Выход 10,1 г (66,4%). Т. пл. 147-149°С (из спирта).
Найдено %: С 47,41; Н 7,42; N 7,01; Cl 17,52; H2O 6,24. C24H40Cl3N3O6 2H2O.
Вычислено %: С 47.33; Н 7,28; N 6,90; Cl 17,46; H2O 5,92. Спектр ЯМР 1Н (ДМSO, δ, м.д.): 3.28-3.42 (м, 8 Н, ((CH2)2)2N); 3.73; 3.80, 3.83 (три с, по 6 Н, 6 ОСН3); 4.09 (с, 4 Н, 2 CH2Ar); 6.74 и 7.25 (оба с, по 2 Н, ArH)
Пример 11. Тригидрохлорид Nl-(2,4,6-триметоксибензил)-N2-{2-[2,4,6-триметоксибензил)амино]этил}-1,2-этандиамина (11к)
Получен из 9,8 г (50 ммоль) 2,4,6-триметоксибензальдегида и 2,58 г (25 ммоль) диэтилентриамина по описанному в примере 1 методу. Выход 7,5 г (49,3%). Т.пл 152-155°С (из спирта). Найдено %: С 47,35; Н 7,36; N 7,19; Cl 17,52; Н2О 6,33. C24H40Cl3N3O6 2H2O.
Вычислено %: С 47,33; Н 7,28; N 6,90; Cl 17,46; H2O 5,92. Спектр ЯМР 1Н (ДМSО, δ, м.д.): 3.21-3.35 (м, 8 Н, ((CH2)2)2N); 3.80, 3.83 (оба с, 12 и 6 Н, 6 ОСН3); 4.02 (с, 4 Н, 2 CH2Ar), 6,29 (с, 4 Н, 4 ArH).
Фармакологические свойства заявляемых соединений
Пример 1. Определение острой токсичности (LD50) заявляемых соединений
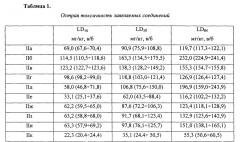
Острую токсичность заявляемых соединений изучали в опытах на беспородных мышах-самцах массой тела 21-24 г. Животных в виварии содержали в соответствии с приказом МЗ РФ №267 от 09.06.2003 «Об учреждении правил лабораторной практики». Заявляемые соединения вводили внутрибрюшинно. В качестве растворителя использовали апирогенную воду для инъекций. Острую токсичность каждого соединения определяли как минимум в пяти различных дозах, количество животных в каждой серии 6. Летальность животных оценивали через 24 часа после введения заявляемых соединений. По методу Литчфилда-Уилкоксона рассчитывали LD16, LD50 и LD84 с их доверительными 95% интервалами.
Как следует из полученных данных, наибольшей токсичностью обладают соединения IIк, IIe, IIж, IIa, IIз и IIи - III класс токсичности. Остальные заявляемые соединения относятся к IV классу токсичности, т.е. к малотоксичным веществам (табл. 1).
Пример 2. Результаты исследования антиишемической активности заявляемых соединений
Опыты проводили на белых беспородных крысах-самцах массой 250-300 г, наркотизированных уретаном (1300 мг/кг, в/б). Животных в виварии содержали в соответствии с приказом МЗ РФ №267 от 09.06.2003 «Об учреждении правил лабораторной практики». Острую эндокардиальную ишемию миокарда вызывали по методу, описанному S. Yamamoto с соавторами [Yamamoto S. et al. J. Cardiovasc. Pharmacol. 2002. V. 39 (2). P. 234-241]. Для этой цели животным с помощью инъектора «Линеомат» (Россия) внутривенно со скоростью 20 мкг/кг/мин вводили неселективный агонист β-адренорецепторов изопротеренол. Об интенсивности ишемического повреждения судили по величине депрессии сегмента ST на ЭКГ (II стандартное отведение) через 5 минут от момента начала инфузии изопротеренола. В качестве регистратора использовали компьютерный электрокардиограф «Полиспектр 8/ЕХ» (Нейрософт, Россия).
Животные были рандомизированы на 9 групп: 1-я - контроль (n=16); 2-я - соединение IIa (n=7); 3-я - соединение IIб (n=9); 4-я - соединение IIв (n=7); 5-я - соединение IIг (n=7); 6-я - соединение IIд (n=7); 7-я - соединение IIe (n=5); 8-я - соединение IIж (n=6) и 9-я - соединение IIз (n=5).
Животным контрольной группы за 2 минуты до начала инфузии изопротеренола внутривенно вводили эквивалентный объем (0,2 мл) физиологического раствора, а животные основных групп по аналогичной схеме получали заявляемые соединения (1 мг/кг, в/в).
Полученные результаты обрабатывали статистически. Нормальность распределения, оценивали с помощью критерия Шапиро-Уилка. Статистическую значимость различий между группами определяли с помощью однофакторного дисперсионного анализа с дальнейшей обработкой по критерию Стьюдента с поправкой Бонферрони. Значимость различий по сравнению с исходным уровнем рассчитывали с помощью t-критерия Стьюдента для связанных выборок. Различия считали значимыми при Р≤0,05, критерий двухсторонний. Полученные результаты выражали в виде среднего арифметического и его стандартной ошибки.
Как следует из полученных данных, наибольшую антиишемическую активность на данной модели проявляет соединение IIг. Следует отметить, что это соединение по своей антиишемической активности, как минимум, не уступает эталонному для этой модели антагонисту ионов кальция верапамилу. Помимо соединения IIг выраженной антиишемической активностью обладают и соединения IIв, IIe и IIз (табл. 2).
Пример 3. Результаты исследования антиаритмической активности изучаемых соединений
3.1. Исследование антиаритмической активности заявляемых соединений на модели аконитиновой аритмии.
Опыты проводили на беспородных наркотизированных (уретан 1300 мг/кг, в/б) крысах-самцах массой тела 160-180 г. Животных в виварии содержали в соответствии с приказом МЗ РФ №267 от 09.06.2003 «Об учреждении правил лабораторной практики». Животных интубировали и переводили на искусственное дыхание кислородно-воздушной смесью. Регистрировали ЭКГ во II стандартном отведении. В качестве регистратора использовали Mingograf-82 фирмы Elema-Siemens (Швеция). Визуальный контроль регистрируемых параметров в течение всего эксперимента производили при помощи 8-канального осциллоскопа фирмы Nihon Konden (Япония). Животных рандомизировали на 9 групп: 1-я - контроль (n=11); 2-я - соединение IIa (n=6); 3-я - соединение IIб (n=6); 4-я - соединение Ив (n=6); 5-я - соединение IIг (n=8); 6-я - соединение IIд (n=6); 7-я - соединение IIe (n=6); 8-я - соединение IIж (n=6) и 9-я - соединение IIз (n=6). В контрольной серии экспериментов определяли минимальную дозу аконитина, вызывающую фатальные нарушения ритма сердца в первые 5 минут от момента его внутривенного введения. Животным опытных групп за 2 минуты до инъекции аконитина вводили заявляемые соединения (4 мг/кг, в/в). В каждой опытной группе оценивали количество погибших животных в первые 5 минут после введения аконитина. Статистическую обработку проводили по методу точной вероятности Фишера.
Как следует из полученных данных (табл. 3), выраженную антиаритмическую активность на данной модели, патогомоничной для антиаритмиков I класса по классификации Vaughan Williams, проявляют соединения IIa, IIв и IIг.
3.2. Исследование антиаритмической активности заявляемых соединений на модели хлоридкальциевой аритмии.
Опыты проводили на беспородных наркотизированных (уретан 1300 мг/кг, в/б) крысах-самцах массой тела 250-300 г. Животных в виварии содержали в соответствии с приказом МЗ РФ №267 от 09.06.2003 «Об учреждении правил лабораторной практики». Животных интубировали и переводили на искусственное дыхание кислородно-воздушной смесью. Регистрировали ЭКГ во II стандартном отведении. В качестве регистратора использовали Mingograf-82 фирмы Elema-Siemens (Швеция). Визуальный контроль регистрируемых параметров в течение всего эксперимента производили при помощи 8-канального осциллоскопа фирмы Nihon Konden (Япония). Животные были рандомизированы на 9 групп: 1-я - контроль (n=10); 2-я - соединение IIa (n=6); 3-я - соединение IIб (n=6); 4-я - соединение IIв (n=6); 5-я - соединение IIг (n=6); 6-я - соединение IIд (n=6); 7-я - соединение IIe (n=6); 8-я - соединение IIж (n=6) и 9-я - соединение IIз (n=6). В контрольной серии экспериментов определяли минимальную дозу кальция хлорида, вызывающую фатальные нарушения ритма сердца в первые 5 минут от момента его внутривенного введения. Животным опытных групп за 2 минуты до инъекции кальция хлорида вводили заявляемые соединения (1 мг/кг, в/в). В каждой опытной группе оценивали количество погибших животных в первые 5 минут после введения кальция хлорида. Статистическую обработку проводили по методу точной вероятности Фишера.
Как следует из полученных данных (табл. 4), выраженную антиаритмическую активность на данной модели, патогомоничной для антиаритмиков III класса по классификации Vaughan Williams, проявляют соединения IIг, IIe и IIж.
3.3. Исследование антифибрилляторной активности заявляемых соединений на модели электрической фибрилляции желудочков сердца.
Опыты проводили на анестезированных (уретан, 1300 мг/кг, в/б) беспородных крысах-самцах массой тела 380-420 г. Животных в виварии содержали в соответствии с приказом МЗ РФ №267 от 09.06.2003 «Об учреждении правил лабораторной практики». После интубации животных переводили на искусственное дыхание кислородно-воздушной смесью; производили стернэктомию и перикардотомию. В миокард левого желудочка сердца на расстоянии 3-5 мм друг от друга имплантировали два позолоченных электрода. Порог электрической фибрилляции сердца определяли сканированием уязвимого периода серией из 20 прямоугольных импульсов постоянного тока увеличивающейся интенсивности (длительность импульса 4 мс, частота 50 имп/с) до возникновения фибрилляции. За порог фибрилляции принимали минимальную силу тока, стабильно вызывающую фибрилляцию желудочков при повторной стимуляции. В опыт отбирали только тех животных, у которых фибрилляция желудочков наступала при силе тока не более 6 мА.
В работе использовали электростимулятор HSE Stimulator II (Hugo Sach Electronik, Германия). В течение всего эксперимента регистрировали ЭКГ (II стандартное отведение) В качестве регистратора использовали электрокардиограф ЭК 4Т-02 (Россия). Визуальный контроль регистрируемых параметров в течение всего эксперимента производили при помощи 4-канального осциллоскопа фирмы Elema-Simiens (Швеция).
Животных рандомизировали на 11 групп: 1-я - контроль (n=6); 2-я - соединение IIa (n=6); 3-я - соединение IIб (n=6); 4-я - соединение IIв (n=6); 5-я - соединение IIг (n=6); 6-я - соединение IIд (n=6); 7-я - соединение IIe (n=6); 8-я - соединение IIж (n=6) и 9-я - соединение IIз (n=6); 10-я - соединение IIи (n=6); 11-я - соединение IIк (n=6).
Заявляемые соединения (1 мг/кг, в/в) вводили за 5 минут до определения порога электрической фибрилляции желудочков сердца. Статистическую обработку полученных данных осуществляли с использованием знаково-рангового критерия Уилкоксона.
Как следует из полученных данных (табл. 5), антифибрилляторную активность на данной модели проявляют соединения IIa, IIв, IIд, IIг, IIк.
1. Бис(метоксибензиламиноалкил)амины общей формулы I
где R1, R2, R3, R4 могут быть двумя или тремя водородами, или одной, или двумя метоксигруппами, n и m могут быть одинаковыми и иметь значения 2 или 3, или разными и иметь значения n=2 и m=3, а также их физиологически приемлемые соли.
2. Бис(метоксибензиламиноалкил)амины общей формулы I по п. 1 в виде тригидрохлоридов общей формулы II (I⋅3HCl).
3. Тригидрохлорид N1-(2,3-диметоксибензил)-N2-{2-[(2,3-диметоксибензил)амино]-этил}-1,2-этандиамина (IIa), обладающий кардиотропной активностью.
4. Тригидрохлорид N1-(2,4-диметоксибензил)-N2-{2-[(2,4-диметоксибензил)амино]-этил}-1,2-этандиамина (IIб), обладающий кардиотропной активностью.
5. Тригидрохлорид N1-(2,5-диметоксибензил)-N2-{2-[(2,5-диметоксибензил)амино]-этил}-1,2-этандиамина (IIв), обладающий кардиотропной активностью.
6. Тригидрохлорид N1-(2,3,4-триметоксибензил)-N2-{2-[(2,3,4-триметоксибензил)-амино]этил}-1,2-этандиамина (IIг), обладающий кардиотропной активностью.
7. Тригидрохлорид N1-(2,3-диметоксибензил)-N3-{3-[(2,3-диметоксибензил)амино]-пропил}-1,3-пропандиамина (IIд), обладающий кардиотропной активностью.
8. Тригидрохлорид N1-(2,4-диметоксибензил)-N3-{3-[(2,4-диметоксибензил)амино]-пропил}-1,3-пропандиамина (IIе), обладающий кардиотропной активностью.
9. Тригидрохлорид N1-(2,3,4-триметоксибензил)-N3-{3-[(2,3,4-триметоксибензил)-амино]пропил}-1,3-пропандиамина (IIж), обладающий кардиотропной активностью.
10. Тригидрохлорид N1-(2,3,4-триметоксибензил)-N3-{3-[(2,3,4-триметоксибензил)-амино]этил}-1,3-пропандиамина (IIз), обладающий кардиотропной активностью.
11. Применение соединений по пп. 1-10 в качестве веществ, обладающих кардиотропной активностью.
12. Применение соединений по п. 11 в качестве веществ, обладающих антиишемической, антиаритмической, в частности антифибрилляторной активностью.
13. Метод лечения сердечно-сосудистых заболеваний путем введения эффективного количества соединения по любому из пп. 1-10.
14. Метод по п. 13, согласно которому вводят эффективное количество соединений по любому из пп. 5, 6, 8.