Хинолиновые производные как ингибиторы фермента pde10a
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к гетероциклическим соединениям, выбранным из 7-[2-(5,8-диметил-[1,2,4]триазоло[1,5-а]пиразин-2-ил)-этил]-2,3-дигидро-[1,4]диоксино[2,3-g]хинолина и 6-[2-(5,8-диметил-[1,2,4]триазоло[1,5-а]пиразин-2-ил)-этил]-[1,3]диоксоло[4,5-g]хинолина, а также к их фармацевтически приемлемым солям. Также изобретение относится к фармацевтической композиции на основе одного из указанных соединений и применению указанных соединений. Технический результат: получены новые гетероциклические соединения, полезные при лечении нейродегенеративного или психического расстройства. 3 н. и 7 з.п. ф-лы, 1 табл., 2 пр.
Реферат
Область изобретения
Настоящее изобретение относится к хинолиновым производным, которые являются ингибиторами фермента PDE10A и как таковые применимы для лечения нейродегенеративных и психических расстройств. В частности, настоящее изобретение относится к соединениям, которые являются высоко селективными по отношению к PDE10 по сравнению с другими подтипами PDE. Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединения в соответствии с настоящим изобретением, и к способам лечения расстройств с использованием соединений в соответствии с настоящим изобретением.
Предпосылки изобретения
Циклические нуклеотиды, циклический аденозинмонофосфат (cAMP) и циклический гуанозинмонофосфат (cGMP) функционируют как внутриклеточные вторичные мессенджеры, регулирующие обширный ряд процессов в нейронах. Внутриклеточные cAMP и cGMP образуются аденил - и гуанилциклазами, а разрушаются фасфодиэстеразами (PDE) циклических нуклеотидов путем гидролиза циклических нуклеотидов в соответствующие им нуклеотидмонофосфаты.
Фосфодиэстераза 10A (PDE10A) является фосфодиэстеразой с двойной специфичностью, которая может превращать и сАМР в AMP, и cGMP в GMP (Soderling, S. et al. Proc. Natl. Acad. Sci. 1999, 96, 7071-7076). PDE10A первоначально экспрессируется в нейронах в полосатом теле, прилежащем ядре и в обонятельном бугорке (Kotera, J. et al. Biochem. Biophys. Res. Comm. 1999, 261, 551-557, и Seeger, T.F. et al. Brain Research, 2003, 985, 113-126).
Исследования показывают, что в головном мозге PDE10 экспрессируется на высоких уровнях срединными шипиковыми нейронами (MSN) хвостатого ядра, прилежащего ядра и соответствующими нейронами обонятельного бугорка. MSN экспрессирует два функциональных класса нейронов: класс экспрессирующий дофаминовые рецепторы D1, и класс D2, экспрессирующий дофаминовые рецепторы D2. Класс D1 нейронов является частью "прямого" стриарного пути выхода, который в целом функционирует с облегчением поведенческих реакций. Класс D2 нейронов является частью "непрямого" стриарного пути выхода, который функционирует с подавлением поведенческих реакций, которые конкурируют с реакциями, облегчаемыми "прямым" путем.
Антагонизм дофаминовых рецепторов D2 хорошо доказан при лечении шизофрении. С 1950-х годов антагонизм дофаминовых рецепторов D2 является основным в лечении психозов, и все эффективные антипсихотические лекарственные средства антагонизируют рецепторы D2. Действия D2, вероятно, опосредуются, прежде всего, нейронами в полосатом теле, прилежащем ядре и в обонятельном бугорке, поскольку эти зоны получают плотные дофаминергические проекции и характеризуются сильнейшей экспрессией рецепторов D2 (Konradi, С. and Heckers, S. Society of Biological Psychiatry, 2001, 50, 729-742).
Поскольку PDE10A в данном контексте характеризуется желаемым профилем экспрессии с высокой и относительно специфичной экспрессией в нейронах в полосатом теле, прилежащем ядре и в обонятельном бугорке, ингибирование PDE10A, вероятно, характеризуется эффектами, подобными антагонизму рецепторов D2, и поэтому обладает антипсихотическими эффектами.
Тогда как предполагается, что ингибирование PDE10A отчасти имитирует антагонизм рецепторов D2, ожидается, что оно характеризуется другим профилем. Рецептор D2 содержит компоненты передачи сигнала кроме cAMP (Neve, К.A. et al. Journal of Receptors and Signal Transduction 2004, 24, 165-205), в связи с чем взаимодействие с сАМР посредством ингибирования PDE10A может снижать риск экстрапирамидальных побочных эффектов, которые заметны при сильном антагонизме D2. И наоборот, ингибирование PDE10A может обладать некоторыми эффектами, не заметными при антагонизме рецепторов D2. Также PDE10A экспрессируется в стриарных нейронах, экспрессирующих рецепторы D1 (Seeger, Т.F. et al. Brain Research, 2003, 985, 113-126).
Кроме того, поскольку агонизм рецепторов D1 приводит к стимуляции аденилатциклазы и к повышению в результате уровней сАМР, ингибирование PDE10A, вероятно, также характеризуется эффектами, которые имитируют агонизм рецепторов D1.
Наконец, ингибирование PDE10A будет не только повышать уровни сАМР в клетках, но также, как предполагается, может повышать уровни cGMP, поскольку PDE10A является фосфодиэстеразой с двойной специфичностью. cGMP активирует ряд целевых белков в клетках, подобно сАМР, а также взаимодействует с путями передачи сигнала сАМР.
В заключение, ингибирование PDE10A, вероятно, отчасти имитирует антагонизм рецептора D2 и поэтому обладает антипсихотическим эффектом, но профиль может отличаться от профиля, наблюдаемого с классическими антагонистами рецепторов D2.
Ингибитор PDE10A папаверин, как показано, является активным в нескольких антипсихотических моделях. Папаверин потенциировал каталептический эффект антагониста рецептора D2 галоперидола у крыс, но сам по себе не вызывал каталепсии (WO 03/093499). Папаверин снижал гиперактивность у крыс, индуцированную PCP, тогда как снижение индуцированной амфетамином гиперактивности было незначительным (WO 03/093499). Эти модели подтверждают, что ингибирование PDE10A обладает классическим антипсихотическим потенциалом, который можно было бы предположить из вышеприведенных теоретических соображений. Кроме того, в WO 03/093499 раскрывается применение селективных ингибиторов PDE10 для лечения ассоциированных неврологических и психических расстройств. Более того, ингибирование PDE10A отменяет субхронические индуцированые PCP дефициты в сдвиге внимания у крыс (Rodefer et al. Eur. J. Neurosci. 2005, 4, 1070-1076). Эта модель подтверждает, что ингибирование PDE10A может облегчать когнитивные дефициты, ассоциированные с шизофренией.
Тканевое распределение PDE10A показывает, что ингибиторы PDE10A можно использовать для повышения уровней сАМР и/или cGMP в клетках, которые экспрессируют фермент PDE10A, особенно, в нейронах, которые составляют базальные ганглии, и поэтому ингибиторы PDE10A в соответствии с настоящим изобретением будут применимыми в лечении ряда ассоциированных нейропсихических состояний, вовлекающих базальные ганглии, таких как неврологические и психические расстройства, шизофрения, биполярное расстройство, психоз, обсессивно-компульсивное расстройство и зависимость, и может обладать преимуществом, заключающимся в отсутствии нежелательных побочных эффектов, которые ассоциированы с имеющимися на рынке терапевтическими средствами.
Кроме того, последние публикации (WO 2005/120514, WO 2005012485, Cantin et al, Bioorganic & Medicinal Chemistry Letters 17 (2007) 2869-2873) подтверждают, что ингибиторами PDE10A могут быть применимыми для лечения ожирения и инсулинонезависимого сахарного диабета.
Кроме того, последние публикации подтверждают, что ингибиторы PDE10A могут быть применимыми для лечения болезни Хантингтона (Giampa et al. PLoS One 2010, 5(10), Giampa et al. Neurobiology of Disease (2009), 34(3), 450-456, Hebb et al. Current Opinion in Pharmacology 2007, 7(1), 86-92.)
Пирролодигидроизохинолины и их варианты раскрываются как ингибиторы PDE10 в WO 05/03129 и WO 05/02579. Замещенные пиперидинилом хиназолины и изохинолины, которые служат ингибиторами PDE10, раскрываются в WO 05/82883. В WO 06/11040 раскрываются замещенные хиназолиновые и изохинолиновые соединения, которые служат ингибиторами PDE10. В US 20050182079 раскрываются замещенные тетрагидроизохинолиниловые производные хиназолина и изохинолина, которые служат эффективными ингибиторами фосфодиэстеразы (PDE). В частности, US 20050182079 относится к указанным соединениям, которые являются селективными ингибиторами PDE10. Аналогичным образом, в US 20060019975 раскрываются пиперидиновые производные хиназолина и изохинолина, которые служат эффективными ингибиторами фосфодиэстеразы (PDE). Также US 20060019975 относится к соединениям, которые являются селективными ингибиторами PDE10. В WO 06/028957 раскрываются циннолиновые производные как ингибиторы PDE10 для лечения психических и неврологических синдромов. В WO 09/152825 раскрываются фенилимидазольные производные как соединения, которые служат ингибиторами PDE10.
Однако, эти раскрытия не имеют отношения к соединениям в соответствии с настоящим изобретением, которые структурно не являются родственными каким-либо из известных ингибиторов PDE10 (Kehler, J. et al. Expert Opin. Ther. Patents 2007, 17, 147-158), и которые, как было обнаружено авторами настоящего изобретения, являются высоко активными и селективными ингибиторами фермента PDE10A.
Настоящее изобретение относится к соединениям, которые являются ингибиторами фермента PDE10A и, таким образом, применимы для лечения нейродегенеративных и/или психических расстройств, которое не является эффективным для всех пациентов. Однако сохраняется потребность в альтернативных способах лечения.
Краткое описание изобретения
Цель настоящего изобретения заключается в обеспечении соединений, которые являются селективными ингибиторами фермента PDE10A.
Следующая цель настоящего изобретения заключается в обеспечении соединений, которые обладают такой активностью и которые обладают улучшенной растворимостью, метаболической стабильностью и/или биодоступностью по сравнению с известными из уровня техники соединениями.
Другая цель настоящего изобретения заключается в обеспечении эффективного лечения, в частности, долговременного лечения, пациентов-людей без возникновения побочных эффектов, как правило, ассоциированных с имеющимися терапевтическими средствами против неврологических и психических расстройств.
Следующие цели настоящего изобретения станут понятны при прочтении данного описания.
Подробное описание изобретения
Варианты осуществления настоящего изобретения
В первом варианте осуществления (E1) настоящее изобретение относится к соединениям формулы I:
где R1, R2, R3, R4, R5 и R6 по отдельности выбраны из группы, состоящей из водорода, гидроксила, циано, C1-C6алкила; C1-C6алкокси, галогена, метилендиокси, дифторметилендиокси и этилендиокси;
где -L- представляет собой линкер, выбранный из -CH2-CH2- и -CH=CH-;
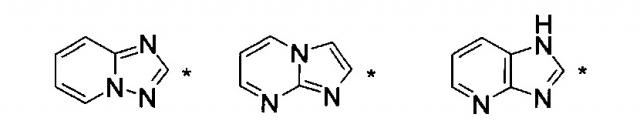
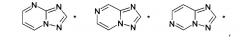
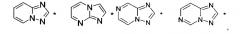
где НЕТ выбран из группы, состоящей из
где один или несколько связанных с углеродом водородов в НЕТ необязательно могут быть замещены не более чем тремя заместителями R7, R8 и R9, по отдельности выбранными из C1-C6алкила; галогена; циано, галоген(C1-C6)алкила; арила, алкокси и C1-C6гидроксиалкила;
и где * означает точку присоединения,
а также к их таутомерам и фармацевтически приемлемым солям и их полиморфным формам.
В варианте осуществления (E2) варианта осуществления (E1) один или несколько из R1-R6 выбраны из группы, состоящей из C1-C3алкила, замещенного одним или несколькими F, и незамещенного C1-C3алкила.
В варианте осуществления (E3) варианта осуществления (E1) или (E2) один или несколько из R1-R6 выбраны из группы, состоящей из метила, этила, пропила, изопропила, монофторметила, дифторметила и трифторметила.
В варианте осуществления (E4) варианта осуществления (E1) один или несколько из R1-R6 выбраны из группы, состоящей из метокси, дифторметокси и трифторметокси.
В варианте осуществления (E5) варианта осуществления (E1) один или несколько из R1-R6 выбраны из группы, состоящей из фтора и хлора.
В варианте осуществления (E6) какого-либо из вариантов осуществления (E1) - (E5) -L- представляет собой -CH2-CH2-.
В варианте осуществления (E7) какого-либо из вариантов осуществления (E1) - (E5) -L- представляет собой -CH=CH-.
В варианте осуществления (E8) какого-либо из вариантов осуществления (E1) - (E7) НЕТ выбран из группы, состоящей из
где НЕТ необязательно замещен одним или несколькими из R7-R9, и
где * означает точку присоединения.
В варианте осуществления (E9) какого-либо из вариантов осуществления (E1) - (E8) НЕТ замещен одним заместителем R7, выбранным из группы, состоящей из C1-C6алкила, такого как метил; галогена, такого как хлор или бром; циано; галоген(C1-C6)алкила, такого как трифторметил; арила, такого как фенил; и C1-C6гидроксиалкила, такого как CH2CH2OH.
В варианте осуществления (E10) какого-либо из вариантов осуществления (E1) - (E8) НЕТ замещен двумя заместителями R7 и R8, по отдельности выбранными из C1-C6алкила, такого как метил; галогена, такого как хлор или бром; циано; галоген(C1-C6)алкила, такого как трифторметил; арила, такого как фенил; и C1-C6гидроксиалкила, такого как CH2CH2OH.
В варианте осуществления (E11) какого-либо из вариантов осуществления (E1) - (E8) НЕТ замещен тремя заместителями R7, R8 и R9, по отдельности выбранными из C1-C6алкила, такого как метил; галогена, такого как хлор или бром; циано; галоген(C1-C6)алкила, такого как трифторметил; арила, такого как фенил; и C1-C6гидроксиалкила, такого как CH2CH2OH.
В варианте осуществления (E12) какого-либо из вариантов осуществления (E1) - (E8) НЕТ является незамещенным.
В варианте осуществления (E13) какого-либо из вариантов осуществления (E1), (E9), (E10) и (E11) НЕТ замещен по меньшей мере одним C1-C6алкилом, таким как метил.
В варианте осуществления (E14) какого-либо из вариантов осуществления (E1) - (E11) НЕТ выбран из группы, состоящей из (5,7-диметил-имидазо[1,2-a]пиримидин-2-ила), (5,7-диметил-[1,2,4]триазоло[1,5-a]пиримидин-2-ила), (5,8-диметил-[1,2,4]триазоло[1,5-a]пиразин-2-ила), (8-метокси-5-метил-[1,2,4]триазоло[1,5-a]пиридин-2-ила) и (5,8-диметил-[1,2,4]триазоло[1,5-a]пиридин-2-ила).
В конкретном варианте осуществления (E15) варианта осуществления (E1) соединение выбрано из группы соединений, приведенных в таблице 1.
В варианте осуществления (E16) какого-либо из вариантов осуществления (E1) - (E15) настоящее изобретение относится к соединению формулы I или к его фармацевтически приемлемой соли для применения в качестве медицинского препарата.
В варианте осуществления (E17) какого-либо из вариантов осуществления (E1) - (E15) настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель, разбавитель или наполнитель.
В варианте осуществления (E18) какого-либо из вариантов осуществления (E1) - (E15) настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли для получения медицинского препарата для лечения нейродегенеративного или психического расстройства.
Кроме того, в варианте осуществления (E19) какого-либо из вариантов осуществления (E1) - (E15) настоящее изобретение относится к способу лечения субъекта, страдающего от нейродегенеративного расстройства, предусматривающему введение субъекту терапевтически эффективного количества соединения формулы I.
В варианте осуществления (E20) какого-либо из вариантов осуществления (E1) - (E15) настоящее изобретение относится к способу лечения субъекта, страдающего от психического расстройства, предусматривающему введение субъекту терапевтически эффективного количества соединения формулы I.
В варианте осуществления (E21) какого-либо из вариантов осуществления (E1) - (E15) настоящее изобретение относится к способу лечения субъекта, страдающего от наркотической зависимости, такой как алкогольная, амфетаминовая, кокаиновая или опиатная зависимость.
В варианте осуществления (E22) настоящее изобретение относится к соединениям формулы I:
где R1-R6 и НЕТ описаны в каком-либо из предыдущих вариантов осуществления (E1) - (E14), и -L- представляет собой линкер,
выбранный из -S-CH2-, -CH2-S- и .
Определение заместителей
Используемые в контексте настоящего изобретения термины "галогено" и "галоген" используются взаимозаменяемо и относятся к фтору, хлору, брому или йоду.
Термин "C1-C6алкил" относится к насыщенному углеводороду с прямой или разветвленной цепью, содержащему от одного до шести атомов углерода включительно. Примеры таких групп включают без ограничения метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2-метил-1-бутил и н-гексил. Выражение "C1-C6гидроксиалкил" относится к C1-C6 алкильной группе, определенной выше, которая замещается одной гидроксигруппой. Термин "галоген(C1-C6)алкил" относится к C1-C6 алкильной группе, определенной выше, которая замещается не более чем тремя атомами галогена, такой как трифторметил.
Выражение "C1-C6алкокси" относится к насыщенной алкоксигруппе с прямой или разветвленной цепью, содержащей от одного до шести атомов углерода включительно, с открытой валентностью на кислороде. Примеры таких групп включают без ограничения метокси, этокси, н-бутокси, 2-метил-пентокси и н-гексилокси. Алкокси необязательно может быть замещен не более чем тремя атомами галогена, например, трифторметокси.
Термин "C3-C8циклоалкил", как правило, относится к циклопропилу, циклобутилу, циклопентилу, циклогексилу, циклогептилу или циклооктилу. Выражение "C1-C6алкил(C3-C8)циклоалкил" относится к C3-C8циклоалкилу, определенному выше, который замещается C1-C6алкилом с прямой или разветвленной цепью. Примеры таких групп включают без ограничения циклопропилметил.
Термин "гетероциклоалкил" относится к четырех-восьмичленному кольцу, содержащему атомы углерода и до трех атомов N, О или S, при условии, что четырех-восьмичленное кольцо не содержит соседние атомы О или соседние атомы S. Открытая валентность находится либо на гетероатоме, либо на атоме углерода. Примеры таких групп включают без ограничения азетидинил, оксетанил, пиперазинил, морфолинил, тиоморфолинил и [1,4]диазепанил. Термин "гидроксигетероциклоалкил" относится к гетероциклоалкилу, определенному выше, который замещается одной гидроксигруппой. Термин "C1-C6алкил-гетероциклоалкил" относится к гетероциклоалкилу, определенному выше, который замещается C1-C6 алкильной группой. Примеры таких групп включают без ограничения тетрагидропиран-4-ил-метил и 2-морфолин-4-ил-этил.
Термин "арил" относится к фенильному кольцу, необязательно замещенному галогеном, C1-C6алкилом, C1-C6алкокси или галоген(C1-C6)алкилом, определенными выше. Примеры таких групп включают без ограничения фенил и 4-хлорфенил.
Термин "C1-C6арилалкил" относится к арилу, определенному выше, который замещается C1-C6алкилом с прямой или разветвленной цепью. Примеры таких групп включают без ограничения бензил и 4-хлорбензил.
В следующем варианте осуществления один или несколько атомов водорода соединения формулы I были замещены дейтерием.
Следует учитывать, что в контексте настоящей заявки значения "R1 - R6", "от R1 до R6" и "R1, R2, R3, R4, R5 и R6" являются одинаковыми.
Кроме того, настоящее изобретение также относится к определенным вариантам осуществления настоящего изобретения, которые описываются ниже.
В отдельных вариантах осуществления настоящего изобретения соединение формулы I выбрано из следующих конкретных соединений, приведенных в таблице 1, в форме свободного основания, одного или нескольких их таутомеров или их фармацевтически приемлемой соли. В таблице 1 приводятся соединения в соответствии с настоящим изобретением и соответствующие значения IC50, определенные как описано в разделе "Анализ ингибирования PDE10A". Каждое из соединений представляет собой отдельный вариант осуществления настоящего изобретения.
Следует понимать, что различные аспекты, варианты осуществления, реализации и признаки настоящего изобретения, упомянутые в данном документе, могут быть заявлены отдельно или в любом сочетании, как иллюстрируется следующими неограничивающими примерами.
В конкретном варианте осуществления настоящего изобретения соединения в соответствии с настоящим изобретением имеют значение IC50 меньше 50 нМ, например, в диапазоне 0,2-20 нМ, в частности, в диапазоне 0,2-10 нМ, например, в диапазоне 0,2-5 нМ.
Фармацевтически приемлемые соли
Настоящее изобретение также относится к солям соединений, как правило, фармацевтически приемлемым солям. Такие соли включают фармацевтически приемлемые кислотно-аддитивные соли. Кислотно-аддитивные соли включают соли неорганических кислот, а также органических кислот.
Типичные примеры подходящих неорганических кислот включают хлористоводородную, бромистоводородную, йодистоводородную, фосфорную, серную, сульфаминовую, азотную кислоты и т.п. Типичные примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, оксалиновую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, EDTA, гликолевую, п-аминобензойную, глутаминовую, бензолсульфоновую, п-толуолсульфоновую кислоты, теофиллин-уксусные кислоты, а также 8-галогентеофиллины, например, 8-бромтеофиллин и т.п. Следующие примеры фармацевтически приемлемых неорганических или органических кислотно-аддитивных солей включают фармацевтически приемлемые соли, приведенные в Berge, S.M. et al., J. Pharm. Sci. 1977, 66, 2, содержание которой тем самым включено в настоящий документ посредством ссылки.
Кроме того, соединения в соответствии с настоящим изобретением может существовать в несольватированной, а также в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Как правило, сольватированные формы считаются эквивалентными несольватированным формам для целей настоящего изобретения.
Фармацевтические композиции
Настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель или разбавитель. Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество одного из конкретных соединений, раскрытых в экспериментальном разделе в настоящем документе, и фармацевтически приемлемый носитель или разбавитель.
Соединения в соответствии с настоящим изобретением можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями, разбавителями или наполнителями либо одной, либо несколькими дозами. Фармацевтические композиции в соответствии с настоящим изобретением можно составлять с фармацевтически приемлемыми носителями или разбавителями, а также любыми другими известными вспомогательными средствами и наполнителями согласно традиционным методикам, таким как раскрытые в Remington: The Science and Practice of Pharmacy, 19th Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995.
Фармацевтические композиции можно специально составлять для введения любым подходящим путем, таким как пероральный, ректальный, назальный, легочный, местный (в том числе буккальный и подъязычный), чрескожный, интрацистернальный, интраперитонеальный, вагинальный и парентеральный (в том числе подкожный, внутримышечный, интратекальный, внутривенный и внутрикожный) пути. Очевидно, что путь будет зависеть от общего состояния и возраста подлежащего лечению субъекта, природы подлежащего лечению состояния и активного ингредиента.
Фармацевтические композиции для перорального введения включают твердые дозированные формы, такие как капсулы, таблетки, драже, пилюли, пастилки, порошки и гранулы. При необходимости композиции можно получать с покрытиями, такими как энтеросолюбильные покрытия, или же их можно составлять с обеспечением контролированного высвобождения активного ингредиента, такого как замедленное или пролонгированное высвобождение, согласно способам, хорошо известным в данной области. Жидкие дозированные формы для перорального введения включают растворы, эмульсии, суспензии, сиропы и эликсиры.
Фармацевтические композиции для парентерального введения включают стерильные водные и неводные инъекционные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки, подлежащие восстановлению в стерильных инъекционных растворах или дисперсиях перед применением. Другие подходящие формы введения включают без ограничения суппозитории, аэрозоли, мази, кремы, гели, ингаляторы, кожные пластыри и имплантаты.
Типичные пероральные дозировки варьируют от приблизительно 0,001 до приблизительно 100 мг/кг массы тела в сутки. Типичные пероральные дозировки также варьируют от приблизительно 0,01 до приблизительно 50 мг/кг массы тела в сутки. Типичные пероральные дозировки далее варьируют от приблизительно 0,05 до приблизительно 10 мг/кг массы тела в сутки. Пероральные дозировки обычно вводят одной или несколькими дозировками, как правило, одной - тремя дозировками в сутки. Точная дозировка будет зависеть от частоты и способа введения, пола, возраста, массы и общего состояния принимающего лечение субъекта, природы и тяжести подлежащего лечению состояния и каких-либо сопутствующих подлежащих лечению заболеваний, а также других факторов, очевидных специалистам в данной области.
Составы также могут быть представлены в форме единичной дозировки с помощью способов, известных специалистам в данной области. В качестве примера типичная форма единичной дозировки для перорального введения может содержать от приблизительно 0,01 до приблизительно 1000 мг, от приблизительно 0,05 до приблизительно 500 мг или от приблизительно 0,5 мг до приблизительно 200 мг.
В случае парентеральных путей, таких как внутривенное, интратекальное, внутримышечное и подобное введение, типичные дозы составляют порядка половины дозы, используемой для перорального введения.
Настоящее изобретение также относится к способу получения фармацевтической композиции, предусматривающему смешивание терапевтически эффективного количества соединения формулы I и по меньшей мере одного фармацевтически приемлемого носителя или разбавителя. В варианте осуществления в соответствии с настоящим изобретением соединение, используемое в вышеупомянутом способе, является одним из конкретных соединений, раскрытых в экспериментальном разделе в настоящем документе.
Соединения в соответствии с настоящим изобретением обычно используют как свободное вещество или как его фармацевтически приемлемую соль. Одним примером является кислотно-аддитивная соль соединения, что характеризуется применимостью свободного основания. Если соединение формулы I содержит свободное основание, то такие соли получают традиционным способом путем обработки раствора или суспензии свободного основания формулы I молярным эквивалентом фармацевтически приемлемой кислоты. Выше описаны типичные примеры подходящих органических и неорганических кислот.
Для парентерального введения можно использовать растворы соединений формулы I в стерильном водном растворе, водном пропиленгликоле, водном витамине E или кунжутном или арахисовом масле. Такие водные растворы должны быть подходящим образом забуферены, если необходимо, а жидкий разбавитель сначала делают изотоническим с помощью достаточного количества солевого раствора или глюкозы. Водные растворы являются особенно подходящими для внутривенного, внутримышечного, подкожного и внутриперитонеального введения. Соединения формулы I можно легко включить в известную стерильную водную среду с использованием стандартных методик, известных специалистам в данной области.
Подходящие фармацевтические носители включают инертные твердые разбавители или заполнители, стерильные водные растворы и различные органические растворители. Примеры твердых носителей включают лактозу, сульфат кальция, сахарозу, циклодекстрин, тальк, желатин, агар, пектин, аравийскую камедь, стеарат магния, стеариновую кислоту и низшие алкиловые эфиры целлюлозы. Примеры жидких носителей включают без ограничения сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и воду. Подобным образом, носитель или разбавитель может включать любые материалы для замедленного высвобождения, известные в данной области, такие как глицерилмоностеарат или глицерилдистеарат, отдельно или смешанные с воском. Затем фармацевтические композиции, образованные путем объединения соединений формулы I с фармацевтически приемлемым носителем, легко вводят множеством дозированных форм, подходящих для раскрытых путей введения. При помощи известных в области фармацевтики способов, составы для удобства могут быть представлены в форме единичной дозировки.
Подходящие для перорального введения составы в соответствии с настоящим изобретением могут быть представлены в виде отдельных единиц, таких как капсулы или таблетки, каждая из которых содержит предварительно заданное количество активного ингредиента и необязательно подходящий наполнитель. Кроме того, перорально доступные составы могут иметь форму порошка или гранул, раствора или суспензии в водной или неводной жидкости или жидкой эмульсии масло-в-воде или вода-в-масле.
Если для перорального введения используется твердый носитель, то препарат может быть таблетированным, помещенным в твердую желатиновую капсулу в форме порошка или пеллеты, или же он может быть в форме лепешки или пастилки. Количество твердого носителя будет существенно варьировать, но находиться в диапазоне от приблизительно 25 мг до приблизительно 1 г на дозированную единицу. Если используется жидкий носитель, то препарат может иметь форму сиропа, эмульсии, мягкой желатиновой капсулы или стерильной инъекционной жидкости, такой как водная или неводная жидкая суспензия или раствор.
Фармацевтические композиции в соответствии с настоящим изобретением можно получать традиционными известными в данной области способами. Например, таблетки можно получать путем смешивания активного ингредиента со стандартными вспомогательными средствами и/или разбавителями, а затем прессования смеси в традиционной таблеточной машине. Примеры вспомогательных средств или разбавителей включают кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и т.п. Можно использовать любые другие вспомогательные средства или добавки, обычно применяемые для таких целей, такие как красители, ароматизаторы, консерванты и т.п., при условии, что они совместимы с активными ингредиентами.
Терапевтически эффективное количество
В данном контексте термин "терапевтически эффективное количество" соединения означает количество, достаточное для излечения, облегчения или частично остановки клинических проявлений данного заболевания и его осложнений при терапевтическом вмешательстве, предусматривающем введение указанного соединения. Количество, адекватное для осуществления этого, определяется как "терапевтически эффективное количество". Эффективные количества для такой цели будут зависеть от тяжести заболевания или повреждения, а также от массы и общего состояния субъекта. Следует понимать, что определения соответствующей дозировки можно достигнуть с использованием общепринятого эксперимента, путем построения матрицы значений и тестирования различных точек в матрице, что находится в компетенции квалифицированного врача.
В данном контексте термины "лечение" и "обработка" означают контроль и уход за пациентом с целью борьбы с состоянием, таким как заболевание или расстройство. Термин предназначен для включения полного спектра видов лечения данного состояния, от которого страдает пациент, таких как введение активного соединения для облегчения симптомов или осложнений, для приостановки развития заболевания, расстройства или состояния, для облегчения или смягчения симптомов и осложнений и/или для излечения или устранения заболевания, расстройства или состояния, а также для предотвращения состояния, при этом предотвращение следует понимать как контроль и наблюдение пациента с целью борьбы с заболеванием, состоянием или расстройством, и он предусматривает введение активных соединений для предотвращения появления симптомов или осложнений. При этом профилактический (превентивный) и терапевтический (клинический) виды лечения являются двумя отдельными аспектами в соответствии с настоящим изобретением. Подлежащим лечению пациентом предпочтительно является млекопитающее, в частности человек.
Лечение расстройств
Как упоминалось выше, соединения формулы I являются ингибиторами фермента PDE10A и как таковые применимы для лечения ассоциированных неврологических и психических расстройств.
Таким образом, настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой кислотно-аддитивной соли, а также к фармацевтической композиции, содержащей такое соединение, для применения в лечении нейродегенеративного расстройства, психического расстройства или наркозависимости у людей.
В одном варианте осуществления в соответствии с настоящим изобретением нейродегенеративное расстройство или состояние включает нейродегенерацию стриарных средних шипиковых нейронов у человека. В конкретном варианте осуществления в соответствии с настоящим изобретением нейродегенеративным расстройством или состоянием является болезнь Хантингтона. В следующем варианте осуществления расстройством является дискинезия, ассоциированная с терапией дофаминомиметическим препаратом.
В варианте осуществления психическое расстройство выбрано из группы, состоящей из шизофрении, например, параноидного типа, тяжелой формы шизофрении, кататонического, недифференцированного или резидуального типа; шизофрениформного расстройства; шизоаффективного расстройства, например, бредового типа или депрессивного типа; бредового расстройства; индуцированного веществами психического расстройства, например, психоза, индуцированного алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, средствами для ингаляции, опиоидами или фенциклидином; расстройства личности параноидного типа и расстройства личности шизоидного типа.
Настоящее изобретение, кроме того, относится к способу лечения у человека наркозависимости, например, алкогольной, амфетаминовой, кокаиновой или опиатной зависимости, при этом способ предусматривает введение указанному человеку эффективного для лечения зависимости, такой как наркозависимость, количества соединения формулы I.
Термин "наркозависимость", как используется в настоящем документе, означает патологическое желание наркотического средства и, как правило, характеризуется нарушениями мотивационной сферы, такими как компульсивное побуждение принять желаемое наркотическое средство и эпизоды непреодолимого влечения к нему.
Другими расстройствами, которые можно лечить в соответствии с настоящим изобретением, являются обсессивно/компульсивные расстройства, инсулинонезависимый сахарный диабет (NIDDM), синдром Туретта и другие тиковые расстройства, а также синдром дефицита внимания с гиперактивностью (ADHD).
Соединения формулы I или их фармацевтически приемлемые соли можно использовать в комбинации с одним или несколькими другими лекарственными средствами (в том числе типичным и атипичным антипсихотическим средством) в лечении заболеваний или состояний, при которых полезны соединения в соответствии с настоящим изобретением, при этом объединение лекарственных средств вместе является более безопасным или более эффективным, нежели каждое лекарственное средство отдельно. Кроме того, соединения в соответствии с настоящим изобретением можно использовать в комбинации с одним или несколькими другими лекарственными средствами, которые леч