Антиалкогольное средство
Иллюстрации
Показать всеИзобретение относится к медицине и касается антиалкогольного средства, содержащего пептид молекулярной массой 6734 Да, созданный путем генно-инженерной (плазмидной) технологии. Изобретение обеспечивает снижение алкогольной мотивации и подкрепляющих свойств этанола за счет блокады специфических рецепторов орексина А в головном мозге. 3 пр., 2 ил., 3 табл.
Реферат
Изобретение относится к медицине, к лекарственным средствам для лечения алкогольной зависимости.
Введение. Одной из важнейших социально значимых проблем современной медицины является разработка способов лечения алкогольной зависимости на основе определения патофизиологических и молекулярно-биологических основ ее развития. Возможность решения этой сложной задачи появилась с открытием полипептида орексина и системы орексин-содержащих нейронов, играющих важную роль в механизмах развития химической зависимости. Блокада восприятия сигналов, приходящих от орексин-содержащих нейронов к дофаминергическим клеткам вентральной области покрышки головного мозга, препятствует формированию химической зависимости. Разработка и применение новых эффективных препаратов, блокирующих восприятие сигналов, поступающих от орексин-содержащих нейронов, предположительно может подавлять алкогольную зависимость, корригируя патофизиологические механизмы ее развития.
Задачей настоящего исследования явилась разработка и изучение антиалкогольного средства на основе генно-инженерной (плазмидной) технологии.
Структурный анализ рецепторов орексина позволил осуществить сканирование пространственной конформационной структуры рецепторов к орексину A (Ox1) и орексину В (Ох2) с помощью Structural Biology Software Database. Изучена поверхность рецепторов, участвующая в связывании пептидов орексинов. С помощью программы AutoDock (The Scripps Research Institute) было создано несколько теоретических молекулярных пептидных структур, способных связываться с рецепторами ОХ1 и ОХ2 с афинностью, сравнимой с орексинами. С использованием программы 3D PSSM и процедуры Blast (www.ncbi.nlm.nih.gov) была отобрана структура, гомологичная существующим природным белкам и пептидам человека. Отбор структуры осуществлялся с использованием докинга - DockSearch, заключающегося в реализации процедуры геометрической стыковки двух молекул и работы с базой данных трехмерных структур молекул (в данном случае лигандов и рецепторов к орексинам) и програмного обеспечения GROMACS и HyperChem и оценки афинности взаимодействия созданных структур с рецепторами орексинов и их конкурентности с природными орексинами.
Применение генно-инженерной технологии позволило получить кандидатную рекомбинантную молекулу блокатора рецепторов орексина А (1-го типа), которая оказалась активной в отношении подавления алкогольной зависимости.
На фиг. 1 представлена структура заявляемого соединения 1, антагониста рецепторов орексина 1-го типа (OxR1).
Аминокислотная последовательность полученной пептидной структуры (SEQ ID No 1) представлена на фиг. 2.
Молекулярная масса заявляемого соединения составляет 6734 Да.
Фармакологическая часть
Фармакологические эффекты и специфическую активность пептидного антагониста рецепторов орексина А (соединения 1) изучали на крысах и мышах, используя его буферный раствор в форме 0,1%-ного раствора для закапывания в нос.
В экспериментах на крысах и мышах доказана безопасность соединения 1 при однократном и хроническом введении. Соединение 1 в диапазоне доз от 1 до 10 мг/кг, вводимых интраназально, существенно не влияло на поведение интактных крыс и мышей, не меняло их общего состояния, деятельности сердечно-сосудистой, пищеварительной, выделительной и центральной нервной систем. На фоне длительной алкогольной интоксикации (6 мес.) соединение 1 при интраназальном введении в дозе 0,1 мг/кг (20 мкг/крысу) обладало анксиолитическим, противострессорным и антиалкогольным действием, проявлявшимся нормализацией эмоционального и коммуникативного поведения животных, нарушенного хронической алкоголизацией. В методах оценки безусловных (первичных) подкрепляющих свойств (самостимуляции мозга) показано, что соединение 1, вводимое в желудочки мозга или внутриструктурно, проявляет антагонизм по отношению к психомоторным стимуляторам, таким как фенамин, в отличие от других антагонистов рецепторов орексина (SB-408124, классический антагонист рецепторов орексина 1-го типа). Также доказаны антиаддиктивные свойства соединения 1 и в тестах на условное (вторичное) подкрепление, когда интраназальное введение соединения 1 более чем вдвое уменьшает экспрессию и восстановление условной реакции предпочтения места, ассоциируемой с этанолом. Прямым доказательством антиалкогольного действия соединения 1 является уменьшение им потребления алкоголя в тесте свободного выбора между 10%-ным этанолом и водой после длительной (4 мес.) алкоголизации крыс. В качестве механизма антиалкогольного действия соединения 1 рассматривается изменение экспрессии мРНК орексинового рецептора 1-го типа в эмоциогенных структурах головного мозга (в частности, в гиппокампе, ответственном за формирование поведенческой реакции на контекстуальные стимулы, ассоциированные с алкоголем). Эти изменения, по-видимому, лежат в основе условнорефлекторных механизмов поддержания патологического влечения к алкоголю у длительно алкоголизированных животных. Результаты подтверждают перспективность выбора соединения 1 в качестве противоалкогольного средства.
Пример 1. Изучение условных подкрепляющих свойств соединения 1 в условнорефлекторной реакции предпочтения места этанола
Для выработки условной реакции предпочтения места (УРПМ) алкоголя у крыс использовали двухкамерную установку с гладким и решетчатым полами. В отличие от классической методики выработки УРПМ животных не подвергали адаптации к экспериментальной установке в течение нескольких первых дней. Во время выработки УРПМ крыс последовательно помещали в две камеры, разделенные между собой перегородкой на 30 минут с интервалом между посадками 1 ч в течение 4 дней. В течение 1 ч между посадками крысы содержались в общей клетке. Перед посадкой в 1-ую камеру крысы получали внутрибрюшинную инъекцию физиологического раствора, перед посадкой во 2-ую камеру животным внутрибрюшинно вводили этанол в дозах 0,75 г/кг. Контрольной группе во 2-ой камере вводили физиологический раствор. Для исключения влияния текстуры пола на выработку УРПМ на этанол животных одной экспериментальной группы разделяли на две подгруппы. Крысы 1-ой подгруппы первоначально помещались в отсек с решетчатым полом, 2-ой подгруппы - с гладким. Для оценки выработки УРПМ на этанол у животных на 5-й день эксперимента измеряли время нахождения в отсеках с различной текстурой пола в течение 15 минут в условиях беспрепятственного перемещения крыс в двухкамерной установке. Данные выражали как процент времени пребывания в отсеке, ассоциированном с введением алкоголя, к общему времени исследования. В контрольной группе животных за отсек, ассоциированный с введением алкоголя, принимали 2-ую камеру. Время пребывания животных в контрольной группе характеризовалось нормальным распределением и 95,5% величин укладывались в интервал от 30 до 70%. При введении алкоголя у крыс наблюдали значительный разброс времени пребывания в отсеке, ассоциированном с алкоголем, выходящий за пределы 70% и 30%. В последующих экспериментах использовали животных, которые проводили более 70% времени в отсеке, ассоциированном с алкоголем.
Влияние пептидного антагониста орексина соединения 1 на экспрессию (воспроизведение) УПРМ этанола оценивали у крыс на 6-ой день эксперимента, перед посадкой в камеру им интраназально вводили исследуемый антагонист орексина А. У животных определяли время пребывания в каждом из отсеков в течение 15 минут в условиях беспрепятственного перемещения крыс в установке. Влияние соединения 1 также оценивали на восстановление УРПМ этанола после 2-недельного угашения выработанной УРПМ. Для угашения УРПМ животных помещали в двухкамерную установку с беспрепятственным доступом в обе камеры пять раз в течение 2-недельного перерыва. На 15-й день после выработки УРПМ животным внутрибрюшинно вводили этанол в дозе 0,5 г/кг и определяли время нахождения в каждом отсеке в течение 15 минут в условиях беспрепятственного перемещения крыс в установке.
Интраназальное введение пептидного антагониста орексина соединения 1 в дозе 0,1 мг/кг (20 мкг/крысу) достоверно блокировало экспрессию УРПМ этанола на 41% (табл. 1). Восстановление УРПМ этанола после угашения также блокировалось антагонистом орексина соединением 1 0,1 мг/кг на 40%.
Таким образом, пептидный антагонист орексина соединение 1 участвует в механизмах патологического влечения к алкоголю и блокирует экспрессию и восстановление УРПМ этанола.
Пример 2. Влияние соединения 1 на алкогольную мотивацию в тесте свободного выбора между алкоголем и водой
Исследовали влияние интраназального введения соединения 1 в дозе 0,1 мг/кг на потребления 10%-ного алкоголя в тесте свободного выбора между алкоголем и водой у крыс со сформированной алкогольной зависимостью, получавших до этого 15%-ный алкоголь в качестве единственного источника жидкости в течение 4 месяцев. В эксперименте оценивали ежедневное потребление 10%-ного алкоголя, воды и общее потребление жидкости в миллилитрах. Препарат вводили ежедневно утром в дозе 0,1 мг/кг (20 мкг в 20 мкл) в течение 10 дней. Первоначально исследовали потребление алкоголя и воды у экспериментальных животных (10 дней), потом на фоне введения растворителя (контроль, 10 дней), после его отмены (10 дней), на фоне введения соединения 1 (10 дней) и после его отмены (10 дней).
Данные представлены в таблице 2.
Видно, что общее потребление жидкости в разных группах составило 31,5-38 мл (34±2). Длительная алкоголизация (4 мес.) привела к тому, что крысы потребляли 10%-ный этанол и воду приблизительно в равных объемах, тогда как в норме (без алкоголизации) предпочтение этанола, также как и предпочтение воды, регистрируется не чаще, чем в 9-10% случаев. Интересно отметить, что интраназальное введение растворителя (контроль) в течение 10 дней приводило к увеличению потребления воды в сравнении с алкоголем (с 15,74±1,37 мл до 22,90±2,84 мл). После отмены введения растворителя потребление этанола и воды выравнивалось.
Но более значительное уменьшение потребления этанола наблюдали после интраназального введения соединения 1 (0,1 мг/кг 10 дней). В этом случае уровень потребления этанола снизился с 16,32±1,31 мл до 10,16±0,63 мл (р<0,05), а потребление воды возросло с 18,21±2,54 мл до 22,64±1,28 мл.
Таким образом, интраназальное введение соединения 1 в дозе 0,1 мг/кг в течение 10 дней у крыс приводило к снижению потребления этанола в тесте свободного выбора между 10%-ным этанолом и водой.
Пример 3. Изучение влияния длительной алкоголизации и отмены алкоголя на функциональное состояние орексиновой системы в головном мозге (уточнение молекулярной мишени действия антагонистов орексина А)
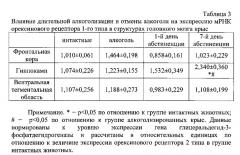
В настоящей работе изучали экспрессию мРНК орексинового рецептора 1-го типа (к орексину А) в структурах мозга у крыс в условиях длительной алкоголизации и отмены алкоголя.
Животных подвергали полунасильственной алкоголизации 15%-ным раствором этанола в качестве единственного источника жидкости при свободном доступе к брикетированному сухому корму в течение 6 месяцев. Контролем служили 10 крыс, содержавшиеся на обычном водном режиме. Крыс декапитировали через 6 месяцев после хронической алкоголизации и на 1-й и 7-й дни после отмены алкоголя. Содержание мРНК орексинового рецептора 1-го типа определяли в фронтальной коре, гиппокампе и вентральной тегментальной области крыс методом обратной транскрипции с последующей полимеразной цепной реакцией в режиме реального времени. Величину экспрессии орексинового рецептора 1-го типа в структурах мозга нормировали к уровню экспрессии гена глицеральдегид-3-фосфатдегидрогеназы и рассчитывали в относительных единицах по отношению к величине экспрессии орексинового рецептора 1-го типа в группе интактных животных. Статистическую обработку полученных данных проводили при помощи метода однофакторного дисперсионного анализа с последующими множественными межгрупповыми сравнениями по критерию Ньюмана-Кейлса.
При хронической алкоголизации в течение 6 месяцев уровень экспрессии мРНК орексинового рецептора 1-го типа в фронтальной коре, гиппокампе и вентральной тегментальной области не изменялся. Отмена алкоголя вызвала изменения в содержании мРНК орексинового рецептора 1-го типа в гиппокампе. Уровень мРНК орексинового рецептора 1-го типа увеличивался в гиппокампе на 7-е сутки после отмены алкоголя по сравнению с контрольной группой и алкоголизированными животными. Уровень мРНК орексинового рецептора 1-го типа в фронтальной коре и вентральной тегментальной области на 1-е и 7-е сутки после отмены алкоголя не изменялся (табл. 3).
Таким образом, полученные данные свидетельствуют, что орексиновая система мозга участвует в формировании патологической зависимости к алкоголю. Увеличение экспрессии мРНК орексинового рецептора 1-го типа после отмены алкоголя в гиппокампе, структуре, ответственной за формирование поведенческой реакции на контекстуальные стимулы, ассоциированные с алкоголем, возможно связано с условнорефлекторными механизмами поддержания патологического влечения к алкоголю у длительно алкоголизированных животных.
Антиалкогольное средство, содержащее пептид молекулярной массой 6734 Да, имеющий аминокислотную последовательность SEQ ID No 1, созданный путем генно-инженерной (плазмидной) технологии.