Способ подготовки пробы для проведения иммунофлюоресцентного исследования при диагностике болезни хейли-хейли
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к дерматологи, и представляет собой способ подготовки пробы для проведения иммунофлюоресцентного исследования при диагностике болезни Хейли-Хейли, включающий размещение на предметном стекле криостатных срезов кожи лабораторного животного, нанесение на них типированной сыворотки больного, инкубацию при температуре 37,2°C во влажной камере в течение 45 мин, промывку срезов, отличающийся тем, что криостатные срезы кожи лабораторного животного предварительно обрабатывают 100% охлажденным ацетоном с температурой 4,0-6,0°C в течение 3-5 мин, затем высушивают в течение 2-3 мин при комнатной температуре, причем промывку срезов осуществляют в течение 3-5 минут. Осуществление изобретения позволяет повысить достоверность результатов диагностики. 3 пр., 4 ил.
Реферат
Изобретение относится к медицине, а именно к дерматологии и может быть использовано при диагностике болезни Хейли-Хейли.
Известен способ диагностики болезни Хейли-Хейли с использованием цитологического анализа мазков-отпечатков дна эрозий или пузырей. Заболевание диагностируется на основании обнаружения акантолитических клеток (Tzanck A. Le citodiagnostic immediate en dermatologic. Ann. Derm. Siph., 1948, 55, 205-218). При микроскопии мазков со свежих поражений кожи больных болезнью Хейли-Хейли, как правило, обнаруживаются акантолитические клетки.
Однако несмотря на достаточно высокую информативность этого метода, обнаружение акантолитических клеток еще не подтверждает диагноза болезни Хейли-Хейли, так как акантолитические клетки могут наблюдаться при аутоиммунной пузырчатке, истинной экземе, фолликулярном дискератозе Дарье и различных вирусных пузырьковых поражениях кожи.
В сомнительных случаях для подтверждения диагноза болезни Хейли-Хейли проводят гистологическое исследование биоптатов пораженной кожи (Ромейс В. Микроскопическая техника, 1954, 48-175). Объекты из патологически измененных тканей иссекают с захватом измененных и нормальных участков. Первым этапом обработки кусочков является фиксация с целью закрепления тканевых структур в том виде, какой они имели в момент иссечения кусочка ткани. Кусочки ткани толщиной 0,5-1,0 см фиксируют в 10-20% растворе формалина в течение 24-48 часов. После фиксации в формалине ткань можно сразу резать на замораживающем микротоме либо подвергать дальнейшей обработке для заливки в целлоидин или парафин. Результаты оцениваются с помощью светового микроскопа. Гистологическим признаком болезни Хейли-Хейли является надбазальный акантолиз с образованием щелей или пузырей, в полости которых находятся акантолитические клетки.
Недостатком при использовании этого метода является его сложность, длительность выполнения и существование сходных изменений при ряде других заболеваний кожи, например аутоиммунной пузырчатке, импетиго, вегетирующей пиодермии, болезни Дарье, многоформной экссудативной эритеме, которые не позволяет выявить исследуемый образец.
Наиболее близким является способ подготовки пробы для проведения иммунофлюоресцентного исследования при диагностике болезни Хейли-Хейли (Болезнь Хейли-Хейли и антитела к антигенам межклеточной связывающей субстанции эпидермиса. Махнева Н.В., Давиденко Е.Б., Черныш Е.С., Белецкая Л.В. VI Международный форум дерматовенерологов и косметологов, Москва, 20-22 марта 2013 г., с. 134), включающий нанесение типированной сыворотки больного на криостатные срезы лабораторного животного с последующей инкубацией при температуре 37,2°C в течение 45 мин во влажной камере, проведение иммунофлюоресцентного исследования для выявления циркулирующих IgG-антител к антигенам межклеточной связывающей субстанции (МСС) эпидермиса. В результате такой обработки выявляют IgG-антитела к антигенам МСС эпидермиса.
Недостатком этого способа является возможность получения недостоверных или отрицательных результатов ввиду вымывания белковых структур (антигенов) или их деградации в процессе проведения иммунологической реакции из исследуемой пробы.
Задачей предлагаемого изобретения является устранение указанных недостатков, повышение достоверности получаемых результатов при проведении исследований за счет выявления циркулирующих IgG-антител к антигенам МСС эпидермиса в ранней и доклинической диагностике путем предварительной обработки криостатных срезов кожи лабораторного животного ацетоном, что способствует стабилизации и демаскировки белкового компонента (антигена) эпидермиса.
Для решения поставленной задачи при подготовке пробы для проведения иммунофлюоресцентного исследования при диагностике болезни Хейли-Хейли, включающей размещение на предметном стекле криостатных срезов кожи лабораторного животного, нанесение на них типированной сыворотки больного, инкубацию при температуре 37,2°C во влажной камере в течение 45 мин, промывку срезов, предложено криостатные срезы кожи лабораторного животного предварительно обрабатывать 100% охлажденным ацетоном с температурой 4,0-6,0°C в течение 3-5 мин, затем высушивать в течение 2-3 мин при комнатной температуре, причем промывку срезов осуществлять в течение 3-5 минут.
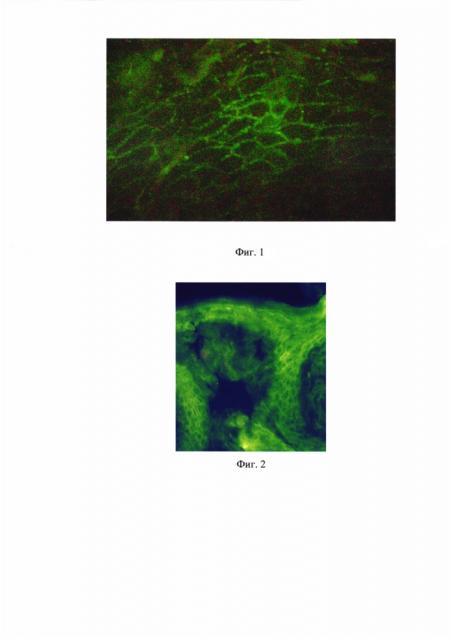
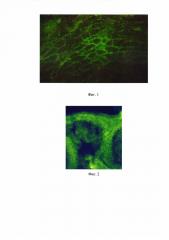
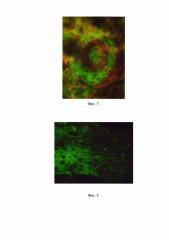
На фиг. 1 представлена картина выявления циркулирующих IgG-антител к антигенам МСС эпидермиса на фиксированных криостатных срезах кожи теленка (пример 1); на фиг. 2 - к антигенам МСС эпидермиса на фиксированных криостатных срезах кожи мыши (пример 2); на фиг. 3 - к антигенам МСС волосяных фолликулов на фиксированных криостатных срезах кожи мыши (пример 2); фиг. 4 - к антигенам МСС эпидермиса на фиксированных криостатных срезах кожи кролика (пример 3).
Предлагаемый способ обеспечивает достоверную иммунофлюоресцентную диагностику болезни Хейли-Хейли. Это происходит за счет того, что при предлагаемой обработке ацетоном, который является химическим стабилизатором, сохраняется морфологическая структура белковых компонентов (антигенов), не происходит их вымывание, маскировка, деградация и другие изменения, которые могут происходить в нефиксированной ткани.
Способ осуществляется следующим образом.
Криостатные срезы кожи лабораторного животного толщиной, преимущественно, 5 мкм предварительно обрабатывали 100% охлажденным ацетоном с температурой 4,0-6,0°C в течение 3-5 мин, затем высушивали в течение 2-3 мин при комнатной температуре. Фиксированные криостатные срезы кожи лабораторного животного тщательно промывали физиологическим раствором с фосфатным буфером (PBS), pH 7,0-7,4, в течение 3-5 мин и наносили типированную сыворотку больного с последующей инкубацией при температуре 37,2°C во влажной камере в течение 45 мин. Далее срезы промывали в течение 3-5 мин PBS (pH 7,0-7,4), обрабатывали меченой сывороткой против IgG человека в течение 30 мин при комнатной температуре, вновь промывали 3-5 мин PBS и заключали под покровное стекло в 60% нейтральный глицерин. В последующем в люминесцентном микроскопе учитывали самое большое разведение, которое давало четкую положительную реакцию.
Наличие циркулирующих IgG-антител к антигенам МСС эпидермиса и/или волосяным фолликулам, гарантированно выявляемых при предлагаемой методике подготовки пробы, позволяло диагностировать болезнь Хейли-Хейли, а при их отсутствии исключить этот диагноз.
Эмпирическим путем установлено, что оптимальное время для проявления реакции является интервал от 3 мин до 5 мин. Использование меньшего времени предварительной обработки приводит к неполной фиксации антигена и его диффузии внутрь клетки и ткани; фиксация больше рекомендуемого времени (более 5 мин) приводит к гиперфиксации и грубым изменениям белковых компонентов (антигенов) ткани кожи. Высушивание фиксированных криостатных срезов менее 2 мин не позволяет достичь полного удаления воды фиксирующей смеси (ацетона) из срезов, более длительное время (более 3 мин) высушивания - полученный эффект не усиливает. С целью удаления избытка антител в тканях и исключения неспецифического свечения промывку фиксированных криостатных срезов PBS осуществляют в течение 3-5 мин. Использовать менее 3 мин нецелесообразно ввиду неполного удаления избытка антител и присутствия неспецифического окрашивания структур ткани, более 5 мин - полученный эффект не усиливает. Результатом такого проведения валидизации является демаскировка с сохранением белковой структуры антигена и получение достоверных диагностически ценных результатов.
Пример 1.
Обследована больная П., 40 лет. Больна около 20 лет (с 20-летнего возраста). Впервые после переохлаждения на коже под молочными железами появились пятна ярко-розового цвета. Высыпания имели тенденцию к слиянию, на поверхности которых возникали пузырьки, при вскрытии которых формировалась мокнущая поверхность. Диагностирован опоясывающий лишай. Проведена местная терапия раствором фукорцина и мазью «Ацикловир» без эффекта. Положительный эффект (полное разрешение высыпаний) достигнут с помощью топической терапии мазью «Лоринден А». Однако на протяжении всего последующего периода (в течение 20 лет) периодически появлялись подобные высыпания в период менструации. В 2006 году процесс принял генерализованный характер с захватом кожи в области боковых поверхностей туловища, спины и задней поверхности шеи. С предварительным диагнозом: распространенная истинная экзема пациентка госпитализирована в кожную клинику.
При поступлении общее состояние больной удовлетворительное. Ведущие жалобы: высыпания на коже, сопровождающиеся зудом. При осмотре: процесс распространенный, подостровоспалительный, симметричный. Локализован на коже лица, задней поверхности шеи с переходом на кожу волосистой части головы, заушной области, спины, в области подмышечных впадин, под молочными железами и в складках живота. На коже лица, шеи, заушной области процесс представлен ярко-красными пятнами диаметром от 1 см до 10 см, без четких границ, неправильной формы. На коже под молочными железами отмечаются бляшки размером от 2,5 см до 10 см в диаметре, покрытые серозно-гнойными корками, на поверхности которых отмечаются глубокие извилистые трещины по типу «мозговых извилин». На коже живота - единичные бляшки ярко-розового цвета, покрытые серозно-гнойными корками, отмечаются очаги экскориации. На коже спины - пятна ярко-розового цвета на месте сдавления бюстгальтера; в области поясницы - крупная бляшка, поверхность которой представлена глубокими извилистыми трещинами, по периферии - мелкие эрозии. Феномены Никольского и Кебнера - отрицательные. Видимые слизистые оболочки интактны. Ногтевые пластины утолщены. Субъективно беспокоят зуд, болезненность в местах высыпаний.
Из анамнеза: наследственность отрицает.
Проводилась дифференциальная диагностика между распространенной истинной экземой, вульгарной пузырчаткой и болезнью Хейли-Хейли.
При цитологическом исследовании в мазках-отпечатках дна эрозий обнаружены акантолитические клетки. При гистологическом исследовании кожи с очага поражения обнаружены внутриэпидермальные супрабазальные пузыри с обилием акантолитических клеток в просвете. Это позволило исключить наличие у больной распространенной истинной экземы, но не позволило дифференцировать вульгарную пузырчатку и болезнь Хейли-Хейли.
Проведено исследование сыворотки больной по предлагаемому способу. При предварительной обработке криостатных срезов кожи лабораторного животного 100% охлажденным ацетоном с температурой 4,0°C в течение 5 мин с последующим высушиванием в течение 3 мин при комнатной температуре и промывкой в течение 5 мин были обнаружены циркулирующие IgG-антитела к антигенам МСС эпидермиса.
На основании полученных данных больной был выставлен диагноз: болезнь Хейли-Хейли.
Проведено лечение: гемодез 200,0 мл в/в капельно, флуконазол 150 мг/нед, ретинола пальмитат 150 тыс. Ед × 1 р/д, наружно: 0,25% раствор нитрата серебра, крем «Тридерм». Лечение с положительным эффектом: высыпания разрешились, сохранялись лишь единичные бляшки на коже в области задней поверхности шеи. В течение последующих 8 лет отмечалось волнообразное течение болезни со сменой периодов активного патологического процесса на его «затихание», применение топических глюкокортикостероидов приводило к положительному клиническому эффекту.
Пример 2.
Обследована больная П., 56 лет. Больна около 18 лет (с 38-летнего возраста). Впервые появились высыпания на коже волосистой части головы, в области подбородка, спины, верхних конечностей, сопровождающиеся зудом. Элементы были представлены пузырьками и пустулами. Неоднократно проводилось амбулаторное и стационарное лечение по месту жительства с диагнозом: себорейный дерматит. Проводимая терапия (антигистаминные и десенсибилизирующие препараты, местно: анилиновые красители) позволяла достичь незначительный положительный эффект. Весной 2008 г. процесс принял генерализованный характер, пациентка госпитализирована в кожную клинику МОНИКИ.
При поступлении общее состояние больной удовлетворительное. Ведущие жалобы: на высыпания на коже, сопровождающиеся зудом. При осмотре: патологический процесс носит распространенный, симметричный, подостровоспалительный характер. Локализован на коже в области спины, шеи, декольте, туловища, верхних конечностей и естественных складок (подмышечные впадины, под молочными железами, паховые складки). На коже спины патологический процесс представлен плоскими папулами розовато-синюшного оттенка, округлых очертаний и плотноватой консистенции. На коже живота отмечаются бляшки розовато-синюшного оттенка, размером от 7 до 20 см в диаметре неправильной формы, фестончатыми очертаниями и резкими границами. Бляшки имеют тенденцию к слиянию. Экскориации в местах расчесов. В области естественных складок - бляшки с эрозиями, мацерированной поверхностью, глубокими извилистыми трещинами и вегетациями между последними в виде низких гребешков, частично покрытых желтоватыми корками. По периферии бляшки окаймлены воспалительным ободком и бахромкой отслаивающегося эпидермиса. Симптом Никольского отрицательный. Феномен Кебнера - положительный. Видимые слизистые оболочки интактны.
Наследственный анамнез: со слов больной подобными высыпаниями страдают мать (с 30-летнего возраста) и родной дядя (родной брат матери).
Проводилась дифференциальная диагностика между аутоиммунной пузырчаткой, вегетирующей пиодермией и болезнью Хейли-Хейли.
При цитологическом исследовании обнаружены акантолитические клетки. При гистологическом исследовании кожи с очага поражения - эпидермис с участками акантолиза и формированием щелевидных пространств в шиповатом слое, в просвете которых - единичные акантолитические клетки и нейтрофильные лейкоциты. Результаты цитологического и гистологического методов исследования не позволили с достоверностью провести дифференциальную диагностику с вышеуказанными заболеваниями.
Проведено исследование сыворотки больной по предлагаемому способу. При предварительной обработке криостатных срезов кожи лабораторного животного 100% ацетоном с температурой 6,0°C в течение 3 мин с последующим высушиванием в течение 2 мин при комнатной температуре и промывкой в течение 3 мин были обнаружены циркулирующие IgG-антитела к антигенам МСС эпидермиса и волосяных фолликулов.
На основании полученных данных больной был выставлен диагноз: болезнь Хейли-Хейли.
Проведено лечение: панангин 5,0 на 100,0 мл физиологического раствора в/в капельно, антигистаминные и седативные лекарственные средства, анилиновые красители и топические глюкокортикостероиды - с положительным клиническим эффектом.
В течение последующих 6 лет отмечалось волнообразное течение болезни со сменой периодов активного патологического процесса и его ремиссии. Учитывая маловыраженный положительный эффект от применение топических глюкокортикостероидов в 2010 году к лечению был присоединен системный глюкокортикостероид: преднизолон в дозе 40 мг/сут с последующим снижением дозы преднизолона до полной отмены. На фоне проводимого лечения отмечено полное разрешение высыпаний, отсутствие свежих высыпаний и зуда. На месте бывших высыпаний - участки гиперпигментации. На протяжении последних двух лет в лечении - масляный раствор ретинола пальмитат 150 тыс. Ед курсами и топическая терапия с применением мазей и кремов, содержащих глюкокортикостероиды, с положительным клиническим эффектом.
Пример 3.
Обследован больной П., 51 года, который является близким родственником (родной брат) больной П., 56 лет (пример 2), страдающей болезнью Хейли-Хейли с 38-летнего возраста. При осмотре (2010 год) жалоб нет, состояние удовлетворительное, кожные покровы и видимые слизистые оболочки свободны от высыпаний.
Проведено исследование сыворотки больного по предлагаемому способу. При предварительной обработки криостатных срезов кожи лабораторного животного 100% ацетоном с температурой 5,0°C в течение 5 мин с последующим высушиванием в течение 2 мин при комнатной температуре и промывкой в течение 4 мин в непрямом методе иммунофлюоресценции были обнаружены циркулирующие IgG-антитела к антигенам МСС эпидермиса.
Спустя 2 года после обследования у пациента появились клинические проявления болезни Хейли-Хейли на коже в области естественных складок (паховые складки и подмышечные впадины) и задней поверхности шеи. Лечение топическими глюкокортикостероидами имеет положительный эффект.
Предлагаемый способ применен у 20 больных, из них 15 больных болезнью Хейли-Хейли и 5 больных в контрольной группе разными кожными болезнями (буллезный пемфигоид, герпетиформный дерматит Дюринга, себорейная экзема, хроническая истинная экзема), а также у 2 здоровых лиц, близких родственников одной больной болезнью Хейли-Хейли. Всем больным болезнью Хейли-Хейли с помощью предлагаемого способа подтвержден диагноз. У здоровых лиц, близких родственников больной болезнью Хейли-Хейли, выявление циркулирующих IgG-антител к антигенам МСС эпидермиса позволило диагностировать доклиническую стадию болезни Хейли-Хейли. Ни в одном случае из контрольной группы присутствие антител к антигенам МСС эпидермиса и волосяных фолликулов не обнаружено.
Данный способ имеет большое значение для диагностики болезни Хейли-Хейли, особенно в случаях отсутствия в анамнезе наследственной предрасположенности и атипичных проявлений болезни с генерализацией патологического процесса по всему кожному покрову. С помощью данной методики подтверждена роль иммунной системы в патогенезе болезни Хейли-Хейли. Это позволяет своевременно провести эффективную адекватную терапию данного заболевания.
Способ подготовки пробы для проведения иммунофлюоресцентного исследования при диагностике болезни Хейли-Хейли, включающий размещение на предметном стекле криостатных срезов кожи лабораторного животного, нанесение на них типированной сыворотки больного, инкубацию при температуре 37,2°C во влажной камере в течение 45 мин, промывку срезов, отличающийся тем, что криостатные срезы кожи лабораторного животного предварительно обрабатывают 100% охлажденным ацетоном с температурой 4,0-6,0°C в течение 3-5 мин, затем высушивают в течение 2-3 мин при комнатной температуре, причем промывку срезов осуществляют в течение 3-5 минут.