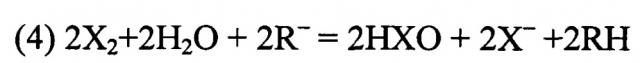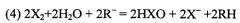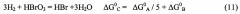Проточная батарея и регенерационная система с улучшенной безопасностью
Иллюстрации
Показать всеИзобретение относится к электрохимическим системам аккумулирования и генерирования энергии, в частности к проточной батарее с разрядной системой, системой регенерации и составу окислительной жидкости. Технический результат применения разрядной системы, системы регенерации и состава окислительной жидкости заключается в достижении высокой плотности энергии, повышении энергетической эффективности и мощности электрохимической проточной батареи при низких затратах на ее производство и эксплуатацию. Указанный технический результат достигается в разрядной системе, включающей в себя, по меньшей мере, одну форму окислительного флюида с водным многоэлектронным окислителем, по меньшей мере, одну форму восстановительного флюида, разрядную единицу со стэком, состоящим из множества электролитических ячеек, каждая из которых включает сборку электролит-электрод, и реактор подкисления. 3 н. и 9 з.п. ф-лы, 41 ил., 22 пр., 5 табл.
Реферат
Область техники
Изобретение относится к электрохимическим системам хранения и генерации энергии, в частности, к разрядной системе, системе регенерации и составу окислительной жидкости.
Уровень техники
Первые широко коммерциализированные автомобили в начале прошлого века были электрические и двигались за счет свинцово-кислотных батарей. Свинцово-кислотные батареи используются в настоящее время в автомобилях в стартерах и устройствах для освещения и зажигания. Стоимость свинцово-кислотных батарей составляет, например, около 170 долларов/кВт⋅ч, т.е. дешевле, чем многие другие из известных перезаряжаемых батарей. Однако плотность энергии свинцово-кислотных батарей довольно низкая и составляет, например, около 35 Вт⋅ч/кг, т.е. примерно 20% от ее теоретического значения. Этот фактор отражается в коротком расстоянии пробега на основе свинцово-кислотных батарей, например, около 30 км в полностью электрических автомобилях. Долгое время перезарядки свинцово-кислотных батарей, например, около 2 часов приводит к необходимости неудобной механической замены разряженной батареи на заряженную.
К 1910 году прогресс в качестве двигателей внутреннего сгорания, создание механической трансмиссии в сочетании с широкой доступностью жидких ископаемых углеводородов привели к вытеснению электрических автомашин бензиновыми на рынке наземного транспорта. Системы с бензиновым двигателем обеспечивают высокую плотность энергии, например, около 4000 Вт/кг, т.е. около 500 км пробега и быструю механическую перезарядку. Эти параметры дают бензиновым двигателям преимущество над батареями с твердыми электроактивными материалами (далее - ТЭАМ). Бензиновые автомобили широко использовались даже во время нефтяных кризисов 1970-х годов, которые подняли вопрос о доступности углеводородных ресурсов и вызвали кратковременный интерес автомобильным двигателям на электрических батареях и водороде.
Наблюдающийся сейчас рост интереса к электрическим автомашинам начался в 1990 г. с закона об автомашинах с нулевым выбросом, принятом Калифорнийским бюро воздушных ресурсов. Никель-металлогидридные батареи, поступившие в продажу примерно в то же время, в течение короткого промежутка времени испытывались для автомобильных приложений. Хотя никель-металлогидридные батареи обладают более высокими качествами по сравнению со свинцово-кислотными (например, их пробег составляет 60 км, удельная энергия примерно от 50 до 80 Вт⋅ч/кг, плотность энергии примерно 200-300 Вт⋅ч/л, удельная мощность около 200 Вт/кг и время электрической перезарядки около 3 ч, хотя и с более высокой стоимостью примерно в 1000 долл./кВт⋅ч), они не представили приемлемой замены бензиновым двигателям с точки зрения потребителя.
К 1990 году лидерство среди источников энергии для электромобилей перешло к водородным топливным элементам с полимер-злектролитной мембраной (далее - ТЭПЭМ), которые первоначально были разработаны в рамках американской и советской космических программ. Интерес к ТЭПЭМ был обусловлен следующими факторами: предполагаемая доступность водородного топлива, высокая удельная энергия, например, около 33,39 кВт⋅ч/кг для низкой теплоты горения водорода (H2), высокая удельная мощность ТЭПЭМ, например, около 0,7 Вт/см2 при 60% эффективности, около 0,35 кВт/кг и около 0,35 Вт/л на уровне стека, конкурентоспособная плотность энергии системы в целом, например, около 1000 Вт⋅ч/л для газа при давлении 700 бар и около 1200 Вт⋅ч/л для жидкого Н2 при давлении в 1 атм., что позволяет совершать пробег в 600 км при хорошей эффективности расходования энергии, например, около 60% для ТЭПЭМ по сравнению с 13% для двигателей внутреннего сгорания.
В течение последующих 20 лет идея водородной экономики и автомобильных топливных элементов получили значительную политическую и экономическую поддержку, которая была обусловлена опасениями из-за роста углекислого газа (СО2) в атмосфере и нестабильности в поставках жидких углеводородов. Это нашло отражение в утверждении президента США Дж.У. Буша в его обращении к нации в 2003 г.: "первая автомашина, которую поведет ребенок рожденный сегодня, будет работать на водороде и не производить никакого загрязнения". В 2004 г. Дженерал Моторс истратила четверть своего годового бюджета для научных исследований на машины с топливными элементами, и Ларри Берне, вице-президент Дженерал Моторс по исследованиям, заявил в феврале 2004 г., что эта компания поставит в продажу коммерчески-приемлемую автомашину на топливных элементах к 2010 г. В 2004 г. штат Калифорния заявил, что в ближайшие годы построит "водородную скоростную дорогу", со станциями перезарядки водорода через каждые 20 миль. Однако несмотря на большие усилия многочисленных ученых и инженеров во всем мире технология ТЭПЭМ так и не привела к рыночному успеху электромобилей по следующим причинам: для требуемой практически удельной мощности на положительном электроде необходимы большие количества платины, что приводит к высокой стоимости ТЭПЭМ, растворение платинового катализатора при положительных потенциалах ограничивает время работы положительного электрода, отсутствие недорогого и долговременного источника чистого водорода, отсутствие инфраструктуры для производства и распределения водорода. Следовательно, необходима технология, которая позволила бы избежать крупномасштабной инфраструктуры для производства и перераспределения водорода и уменьшить количество платины, требуемой для получения электричества во время движения автомобиля.
Несколько революционных изменений произошло и в области батарей с ТЭАМ. В начале 1970-х годов были осознаны преимущества литий-металлического анода, например, низкий эквивалентный вес, очень отрицательный редокс-потенциал, малый размер его катиона, который позволяет ему легко интеркалироваться в катодные материалы. Однако первые литиевые батареи имели плохую циклируемость, поскольку на поверхности металлического лития образуется электронно-изолирующая пленка, приводящая к образованию дендритов электроосаждаемого лития. В 1981 г. исследователи из корпорации Sony продемонстрировали перезаряжаемый литий-ионный аккумулятор (далее - ЛИА) с графитовым интеркаляционным катодом. Это привело за одно десятилетие к коммерциализации литиевых батарей с углеродным анодом для переносных устройств. Поскольку ЛИА имеют высокую плотность энергии (по сравнению с другими коммерциализированными батареями при комнатной температуре), они были использованы с 2010 г. и в коммерческих электромобилях, несмотря на их относительно высокую стоимость, например, около 400 долл./кВт.
Однако полностью электрические автомобили (в отличие от гибридных автомашин) на основе ЛИА не достигли широкого успеха на рынке, прежде всего из-за низкого содержания энергии, а значит, и малого пробега, и из-за высокой суммарной стоимости пользования батареями. Например, Nissan Leaf® фирмы Nissan Jidosha Kabushiki Kaisha DBA Nissan Motor Co. Ltd., имеет батарею, которая весит около 20% от суммарного веса машины при 200 Вт⋅ч/кг, т.е. около 53% от теоретической величины и 230 Вт⋅ч/л, что обеспечивает пробег от 60 до 100 км (в зависимости от использования воздушного кондиционера). Внедорожник большего размера, например, Toyota RAV4®EV фирмы Toyota Jidosha Kabushiki Kaisha ТА Toyota Motor Corporation, демонстрирует сходные показатели. Часто цитируемая статистика, что 60% ежедневных поездок на автомашине в США не превышают 60 км, как очевидно, мало способствует покупке автомашин с ЛИА, поскольку большинству водителей необходимо совершать более длинные переезды. Помимо малого пробега, ЛИА имеют также низкую скорость перезарядки, например, Nissan Leaf® требуется 30 мин для зарядки до 80% ее полной емкости, тогда как создание инфраструктуры для масштабного обмена батарей не оправдано из-за отсутствия рынка таких автомобилей достаточного размера, что подтверждается недавним банкротством фирмы Better Place. Кроме того, необходимо понизить капитальную стоимость ЛИА, например, с 500 до 125 долл./кВт и примерно с 30 до 8 долл./кВт при показателях в 250 Вт⋅ч/кг, 400 Вт⋅ч/л и 2 кВт/кг.
Исследователи Дженерал Моторс (GM) пришли к тому же выводу, а именно, что только небольшие автомашины могут передвигаться за счет электрических батарей, основанных как на современных, так и прогнозируемых технологиях ЛИА, на небольшие расстояния в течении суток ввиду относительно низкого удельной энергии и длительного времени заряда, и что фундаментальные физические принципы в принципе на позволяют полностью электрическим автомобилям на основе ЛИА добиться возможности поездок на дальние расстояния, с быстрыми промежуточными заправками, которые в настоящее время совершаются на современных машинах. Представитель Тойоты Джон Хэнсон заявил: "Мы не думаем, что ЛИА помогут нам в достижении уровня, на котором мы сможем значительно увеличить масштаб выпуска таких машин для массового рынка. Нам необходимо осуществить значительные прорывы, вероятно, с выходом в другие области химии батарей". Йет-Минг Чианг (Массачусетский технологический институт) высказал сходное мнение: "Ясно, что электрификация автомашин на длительном отрезке времени - особенно, если они должны позволять 200-мильные (300 км) пробеги только на электрической энергии - потребует примерно в три раза более высокой плотности энергии при примерно трехкратном понижении стоимости кВт⋅ч по сравнению с ЛИА". Кевин Си, аналитик компании Lux Research (Бостон), заявил: "Не кажется реальным сейчас или в будущем, что автопроизводители смогут значительно понизить стоимость ЛИА. Можно ожидать постепенного улучшения их качества, но мы не верим, что этого будет достаточно, чтобы произошел огромный скачок, которого раньше все ожидали". Тесла Моторс признала, что необходимы новые технологии. По мнению Стива Виско, основателя фирмы Полиплюс: "То, что произошло в последние пару лет, приводит нас постепенно к пониманию, что литий-ионная химия не приведет к полностью электрическим автомашинам для массового пользования. Они слишком дорогие и слишком тяжелые".
Многочисленные попытки в последние 5 лет коммерциализировать ЛИА для их использования в полностью электрических автомашинах провалились, как это убедительно показывает неудача организации их массового производства и очень малые цифры продаж у всех 9 получателей (включая Dow Kokam, Johnson Controls, A123 Systems, Compact Power, EnerDel, General Motors, SAFT America и LG Chem) 1,5-миллиардного (US$) гранта "Electric Vehicle Battery and Component Manufacturing Initiative", врученного в августе 2009 г. Министерством энергетики США, основной целью которой была развитие производства батарей для электромобилей. Отсутствие интереса у массового потребителя к электромобилям заставило администрацию Обамы в январе 2013 г. отказаться от своей амбиционной цели добиться 1 миллиона электромобилей на дорогах США к 2015 г. По мнению Такеши Учиямады, вице-председателя Тойоты, "Существующие возможности электромобилей", основанных на топливных элементах или ЛИА, "не соответствуют потребностям общества в плане длины пробега без перезаправки, стоимости и длительности процесса перезарядки. Из-за этих недостатков (т.е. длины пробега, стоимости и времени перезарядки) электромобили (на топливных элементах или ЛИА) не представляют жизнеспособной замены для современных автомобилей. Нам нужно найти что-то совсем новое". Таким образом, имеется потребность в решении, которое идет в разрез с существующими в настоящее время технологиями батарей для электромобилей, и отличается от них. Другими словами, нужен источник энергии для электромобиля, который сможет обеспечить и более дальний пробег без перезаправки, и более низкую стоимость пользования машиной, и возможность быстрой перезаправки или перезарядки.
История дает примеры случаев, когда после установления причин неудовлетворительного функционирования устройства в нем производилась замена соответствующей части, что делало неработающее устройство работающим, даже если при этом приходилось согласиться с ухудшением каких-то параметров устройства. Так, например, в случае с литиевыми батареями вышеуказанный переход от литий-металлического электрода к литий-ионному с интеркаляцией в графит привел к потере примерно 30% в теоретической плотности энергии, однако создал коммерчески жизнеспособную батарею, имеющую длительный период функционирования. Проточные ячейки, к которым относятся топливные элементы (далее - ТЭ) и проточные редокс-батареи (далее - ПРБ), дают возможность выбирать независимо энергию и мощность устройства, так что они лучше подходят для использования на транспорте, чем батареи ТЭАМ. Другими преимуществами проточных систем по сравнению с ТЭАМ-батареями являются более высокая плотность энергии системы (если реагенты не слишком разбавлены), короткое время перезаправки, внутренний контроль тепловых потоков в жидкости, простое уравновешивание ячеек в стеке. Достоинствами проточных редокс-батарей по сравнению с топливными элементами являются возможность электрической регенерации (которая не требует конструирования дополнительной инфраструктуры по распределению топлива, в частности, для поставок водорода), более высокая энергоэффективность и в общем случае более низкая стоимость. Традиционные проточные редокс-батарей (такие как ванадиевые) имеют низкую плотность энергии (что означает малую длина пробега электромобиля), так как редокс-компоненты имеют низкие растворимости и требуется большое количество растворителя (не нужного для других целей), который приходиться перевозить в машине, чтобы сохранять редокс-компоненты в растворенном состоянии. Именно по этой причине проточные редокс-батарей рассматривались до сих пор только для хранения энергии в стационарных условиях, а не для работы в электромобилях.
Массачусетское малое предприятие, 24М, предложило способ создания проточных редокс-батарей на ТЭАМ, который сохраняет преимущества проточных батарей, одновременно преодолевая недостатки традиционной химии растворов. Он основан на потоках суспензий на основе С6-LiFePO4 системы, ранее предложенной фирмой А123 Systems для твердотельной ТЭАМ батареи. Однако даже такое усовершенствование системы при ее помещении внутрь электромобиля, такого как Nissan Leaf® или Toyota RAV4®, увеличит длину пробега всего с 90 до 150 км, даже при условии достижения батареей 80% эффективности по сравнению с теоретической оценкой. Можно достигнуть еще большего увеличения фактора упаковки (т.е. отношения практической к теоретической плотности энергии), например, за счет использования ТЭАМ без связующего вещества, но с растворенным медиатором или редокс-парой, или батареи с металлсодержащей ионной жидкостью, или с защищенным литий-металлический анод, однако все эти подходы упираются в фундаментальные ограничения из-за того, что собственная (на уровне реагентов) плотность энергии известных батарей недостаточно высока для применения в полностью электрических автомобилях. Кроме того, стоимость таких батарей ожидается выше сформулированный для среднесрочной перспективы уровень около 100 долл./кВт⋅ч и около 30 долл./кВт, а также 2250 долл. за автомашину в 100 л.с. Таким образом, остается без ответа поиск проточных батарей с высоким содержанием энергии и низкой стоимостью, которые могли бы добиться проникновения на рынок полностью электрических машин.
Топливные элементы ТЭПЭМ обладают высокими плотностями энергии и мощности, а также проточным дизайном, который делает их хорошо подходящими для автомобильных применений. Более того, ТЭПЭМ обладают наиболее высокой плотностью энергии, поскольку окислитель (O2) не перевозится в машине. Однако фундаментальные проблемы, связанные с медленностью реакции на кислородном электроде приводят к высокой стоимости и низкой долговечности ТЭПЭМ из-за необходимости высоких загрузок платины при их функционировании около комнатной температуры. Другой проблемой ТЭПЭМ является источник топлива, например, водорода. Следовательно, имеется потребность в разрядной проточной батарее, которая обеспечивала бы высокую плотность энергии, высокую энергоэффективность, генерацию высокой электрической мощности благодаря замене кислорода из воздуха на перевозимый в машине окислитель с высокой плотностью энергии и быстрой электродной кинетикой, который, кроме того, допускал бы регенерацию топлива и окислителя из продуктов реакции.
Проточные батареи функционируют по сходным электрохимическим принципам, что и топливные элементы. В частности, проточные батареи также основаны на текучих реагентах, например, в виде жидкости, газа или суспензии для производства электрической энергии. Однако вместо кислорода или воздуха используется другой окислитель или раствор окислителя. Из-за необходимости перевозить его в машине плотность энергии проточных ячеек имеет более низкую величину, чем топливные элементы. Преимуществами выбора такого окислителя состоят, например, в повышении эффективности преобразования энергии, уменьшение количества катализатора из благородных металлов, возможность изменения рабочей температуры электрохимического силового устройства, улучшенное управление тепловыми потоками, возможность электрической перезарядки и механической перезагрузки и др. По сравнению с батареями на ТЭАМ, например, с литиевыми батареями, проточные батареи дают возможность независимого масштабирования энергии и мощности устройства, высокую величину отношения практической и теоретической плотностей энергии, т.е. фактор упаковки при достаточно длительным временем разряда, возможность быстрой механической перезарядки, внутреннее охлаждение жидкостью и др. Коммерциализированные проточные редокс-батареи, такие как ванадиевые, обладают низкой плотностью энергии из-за использования редокс-пар с низкой растворимостью и низким числом редокс-активных электронов на электроактивный атом. Пол Зигурас, директор развития нового бизнеса в ЕРС Corporation, красноречиво обрисовал существующее в настоящий момент состояние: "Проточные батареи - прекрасная идея, но, к сожалению, сейчас не предложено текучей среды, которая обладала бы достаточным содержанием энергии. Даже в самых лучших из предложенных жидких сред имеется лишь около 1/5 от требуемой плотности энергии. Я бы хотел надеяться, однако остаюсь в сомнениях, что такая жидкость вообще будет найдена".
Водородно-галогенные проточные батареи используют текучие реагенты и продукты, что могло предотвратить указанное выше разбавление плотности энергии растворителем. В серии от фтора к йоду теоретическая плотность энергии уменьшается, тогда как эффективность, катодная мощность и ток обмена возрастают. В результате, фтор обладает плохой циклической эффективностью в сочетании с проблемами совместимости с материалами, тогда как йод имеет низкую плотность энергии в сочетании с низкой растворимостью. Следовательно, только бром и хлор могут представлять интерес для транспортных приложений. Однако хлорная ячейка требует дорогого рутений-содержащего катализатора и дает низкую энергетическую эффективность. Теоретическая плотность энергии водородно-бромной ячейки лишь немного выше, чем у литий-ионных батарей. Плотность энергии становится даже ниже, если бром используется в водном растворе с добавками бромидов для предотвращения переноса окислителя через мембрану благодаря образованию аниона Br3- и для понижения давления паров Br2. Водородно-бромные ячейки поэтому рассматриваются сейчас главным образом как кандидаты для стационарных применений, а не для электрического автотранспорта.
Существует потребность разрешить вышеуказанное ТРИ3-противоречие между плотностью энергии и энергетической эффективностью галогенов, например, вводя новое измерение в выборе окислителей, например, добавляя второе измерение оксосоединений, таких как оксиды и оксокислоты, к одномерному пространству элементов, таких как галогены. Хотя водородно-оксокислотная проточные батареи, такие как Н2-HNO3, уже были рассмотрены в прошлом, эти проточные батареи имеют плохую разрядную эффективность и неудовлетворительные способности как к электрическому разряду, так и регенерации реагентов. Прямое электровосстановление галогеновых оксокислот является крайне необратимым в условиях ТЭПЭМ. Необходимо преодолеть эту проблему, например, посредством медленного восстановления оксосоединения в растворе, т.е. в трехмерном объеме, а не на электроде, т.е. на двумерной поверхности.
Электровосстановление оксоанионов, катализируемое ионами переходных металлов, известно уже более 100 лет. Однако такие реакции не могут быть использованы в целях запасания и преобразования энергии, прежде всего из-за их плохой обратимости. Более полезный способ облегчить электровосстановление галогеновых оксоанионов состоит в использовании предшествующей гомогенной реакции, такой как компропорционирование с галоидным продуктом, как это демонстрируется примером галата по уравнению:
.
.
.
где X=Cl, Br, I.
На практике реакция (3) может предшествовать реакции (1) во время начальной стадии цикла. Более того, при высоких концентрации галогенового оксоаниона и кислоты и при большой толщине диффузионного слоя, стационарной предельный ток, определяемый балансом скорости реакции образования галогенового промежуточного продукта (X2) по реакции компропорционирования (2) и скорости потери галогена в объем раствора, может достигать огромных значений свыше 1 А/см2.
Обычно предполагается, что обратный процесс окисления галогенов следует той же схеме реакций. Например, окисление таких галогенов как йод, бром и хлор при щелочных pH показывает, что обратная к химической реакции, данная уравнением (2), проходит через образование промежуточного гипогалита посредством гомогенного диспропорционирования. Здесь R является основанием:
после которой следует другое гомогенное диспропорционирование:
или комбинируя (4) и (5), получаем:
.
Таким образом, диспропорционирование, например, реакция (6) может быть использована, чтобы регенерировать галогеновый оксоанион из галоида, находящегося в разряженном флюиде, через промежуточный галоген, произведенный одним или несколькими путями окисления галоида.
Существование гомогенных реакций диспропорционирования (4), (5), (6) и реакции компропорционирования (2) облегчает, соответственно, разряд или регенерацию в энергетическом цикле. Наличие этих реакций приводит к высокой мощности, высокой эффективности операций, основанных на быстрой электродной реакции
,
тогда как более медленные стадии, такие как восстановление оксоанионов электрогенерированным галоидом, протекают внутри трехмерного объема раствора, благодаря чему может быть достигнута более высокая скорость реакции, чем при двумерном характере процесса. Хотя использование медиатора должно по теории приводить к понижению энергетической эффективности по сравнению с прямой электродной реакцией, эта термодинамическая потеря энергетической эффективности часто бывает меньше, чем кинетические потери, связанные с перенапряжением на электроде при той же мощности, используя такие окислители, как кислород или непосредственное восстановление оксоанионов.
Химические способы получения галогеновых оксокислот применяются в промышленном масштабе. В случае бромноватой кислоты этот химический способ состоит из диспропорционирования брома в фазе раствора в присутствии Ва(OH)2, за которым следует осаждение Ba2+ серной кислотой и испарение избыточной воды. Однако этот процесс необратимо потребляет Ва(ОН)2, H2SO4 и производит BaSO4 в виде отхода. Кроме того, в этом случае отсутствует возможность одновременного получения стехиометрического количества водорода, который необходим для завершения полного цикла разряда и регенерации. Таким образом, способ, основанный на осаждении, не удовлетворяет требованию полной безотходности. Альтернативный способ получения 40-50% бромноватой кислоты состоит в электроокислении водного раствора брома с использованием диоксида свинца в качестве анода при плотности тока в 10-20 мА/см2 и потенциале от +2.1 до +2.2 В против нормального водородного электрода. Хотя этот способ является химически безотходным, он имеет низкую энергетическую эффективность и низкую производительность.
Солнечный свет представляет чистый источник энергии, не сопровождающийся выделением диоксида углерода (CO2), и солнечная энергия может собираться термически, фотоэлектрически или фотоэлектрохимически. Тогда как суммарная мощность в 120,000 ТВт (тераватт), усредненная в течение года, достигает поверхности Земли, суммарное энергетическое потребление человеческой цивилизации составляет только около 13 ТВт. В настоящее время, несмотря на широкий масштаб использования солнечных технологий, существует ТРИЗ противоречие между стоимостью и эффективностью, свойственной всем коммерциализированным способам преобразования солнечной энергии. Например, фотовольтаические солнечные панели на основе полупроводников, поликристаллические кремниевые фотовольтаические солнечные панели, многослойные фотовольтаические солнечные панели, InxGa(1-x)Se2 и др. являются либо неэффективными, либо слишком дорогими. Фотоэлектрохимическое расщепление воды на водород и кислород, используя наночастицы анатаза TiO2, также страдает от низкой эффективности из-за слишком высокого перенапряжения на кислород-выделяющих центрах. Следовательно, имеется потребность в способе для преобразования энергии солнечных лучей в химическую или электрическую энергию с низкой стоимостью и без создания каких-либо химических отходов.
Таким образом, существует целый ряд неудовлетворенных потребностей в электрохимической проточной батарее, которая обладала бы высокой плотностью энергии, т.е. обеспечивала большую длину пробега без заправки в электромобилях, высокими энергетической эффективностью и мощностью при низкой стоимости как производства, так и использования, и допускала бы перезаправку за короткое время. Более того, имеется потребность в способе и системе, которые допускали бы одновременную генерацию и окислителя, и топлива на основе разряженного флюида, причем в стехиометрических количествах, без потребления дополнительных химических агентов и без получения химических отходов, только с использованием в качестве источника электрической или солнечной энергии. Более того, имеется нужда в электрохимической проточной батарее, которая обладала бы улучшенной безопасностью при функционировании и стабильностью при хранении окислителя при его перевозке или на станции.
Раскрытие изобретения
Технический результат применения заявляемых разрядной системы, системы регенерации и состава окислительной жидкости заключается в достижении высокой плотности энергии, повышении энергетической эффективности и мощности электрохимической проточной батареи при низких затратах на ее производство и эксплуатацию.
Ниже приведено краткое описание концепций, которые затем будут раскрыты в детальном описании изобретения.
Как способ, так и разрядная система, описываемые здесь, связаны со сформулированными выше потребностями в механически перезагружаемой электрохимической проточной батареи, которая обеспечивает высокую плотность энергии, высокую энергетическую эффективность и высокую удельную мощность при ее низкой стоимости, требует короткого времени на перезагрузку, уменьшает или полностью отказывается от использования платины и других дорогостоящих материалов для электродов, а также уменьшает размер или полностью устраняет системы увлажнения. Как способ, так и разрядная система, описываемые здесь, предназначены для производства электрической энергии с помощью двух текучих сред, а именно, восстановительной среды, называемой также "топливо", и окислительной текучей среды, содержащей водный многоэлектронный окислитель (далее - ВМО), причем функционирование системы приводит к образованию одной или большего числа разряженных текучих сред. Окислитель представляет собой химический элемент или соединение, принимающее участие в окислительно-восстановительной реакции, в процессе которой он получает один или больше электронов от другого реагента или электрода. ВМО является окислителем, который (по крайней мере в одной из своих форм, например, в виде кислоты) обладает высокой растворимостью в воде, например, выше 0.5М и который способен принять в ходе редокс-реакции в растворе или электрохимической реакции более 1 моля электронов на 1 моль ВМО. ВМО может присутствовать в различных формах, в том числе в виде соли или кислоты, и, если отсутствует иное указание, термин "ВМО", использованный здесь, относится ко всем этим формам. Восстановитель является химическим элементом или соединением, которое в ходе окислительно-восстановительной реакции способен отдавать один или больше электронов другому реагенту или электроду. Как способы, так и системы, описываемые здесь, используют водный многоэлектронный окислитель, выбранный из оксидов и оксокислот неметаллов, таких как галогены, например, хлор, бром и йод в форме газов, жидкостей, расплавов, твердых тел с низкой температурой плавления, жидких растворов или суспензий.
Более того, способ и регенерационная система, описываемые здесь, предназначены для регенерации водного многоэлектронного окислителя в форме соли или иной форме и восстановителя одновременно из разряженного флюида в форме соли или иной форме одновременно и в стехиометрических количествах, без потребления дополнительных химических веществ и без создания химических отходов. Как используется здесь, термин "разряженный флюид" относится к отработанному флюиду, получаемому в результате электрохимического разрядного процесса, т.е. генерации электрической мощности в проточной батарее или разрядном устройстве. В одном из возможных устройств регенерационная система потребляет, например, электрическую энергию, солнечную энергию, термическую энергию, радиолитическую энергию или любую их комбинацию. В другом возможном устройстве регенерационный процесс реализуется посредством химических процессов. В одном из вариантов реализации способ и регенерационная система, описываемые здесь, регенерируют восстановитель и водный многоэлектронный окислитель в одной или более форм одновременно и в стехиометрических количествах из разряженного флюида посредством, например, электролиза, фотоэлектролиза, гомогенной реакции в растворе, диспропорционирования, изменения pH, ионного обмена, гетерогенного ионного обмена с помощью смол, гомогенного ионного обмена, такого как процесс ортогональной ионной миграции поперек ламинарного потока (далее - ОИМПЛП) и, если требуется, выполнение концентрирования, например, посредством испарения или обратного осмоса. Как используется здесь, термин "ламинарный поток" относится к жидкому течению, в котором направления и амплитуды векторов скоростей жидкости в различных точках внутри жидкости не изменяются хаотично во времени и в пространстве. Также, как используется здесь, термин "миграция" относится к движению электрически заряженного объекта, такого как ион, под действием внешнего электрического поля. Диспропорционирование представляет собой редокс-реакцию, в которой элемент, с свободном виде или в составе соединения, и восстанавливается, и окисляется в той же самой реакции с образованием различных продуктов. Например, элемент в окислительном состоянии А, где не обязательно А=0, после диспропорционирования распределяется между несколькими веществами, содержащими этот элемент в различных состояниях окисления В, С и т.д., которые отличаются от начального окислительного состояния элемента А, так что В>А>С. Как используется здесь, термин "ортогональный" во фразе "ОИМПЛП" означает, что векторы скорости жидкости и электрического поля не параллельны и не антипараллельны. В одном из вариантов реализации способы и системы, описываемые здесь, облегчают конверсию между галогеновым оксоанионом и галоидом в обоих направлениях посредством электрохимических реакций или других реакций, например, pH-зависимых гомогенных реакций. Описывается здесь и полный энергетический цикл, включая и способ генерации электрической мощности и разряженного флюида из одной или нескольких форм водного многоэлектронного окислителя и восстановителя с использованием разрядной системы, а также регенерация водного многоэлектронного окислителя и восстановителя из разряженного флюида с использованием регенерационной системы и с подачей электрической или иной энергии. В способах и системах, описываемых здесь, многоэлектронные редокс-пары с высокой растворимостью реагентов и продуктов используются, чтобы преодолеть проблему низких плотностей энергии известных проточных батарей.
Описывается здесь разрядная система, состоящая из окислительного флюида, сохраняемого в баке для окислительного флюида, восстановительный флюид, сохраняемый в баке для восстановительного флюида, и разрядная ячейка. Разрядная ячейка будет называться также "проточной батареей". Окислительная жидкость представляет собой вещество или смесь веществ, которые принимают электроны в ходе процесса разряда в разрядном режиме функционирования разрядной ячейки. В данном контексте, термин "разрядный режим функционирования" относится к процессу освобождения химической энергии, запасенной в разрядном устройстве, в виде устойчивых величин электрического тока и потенциала. Окислительный флюид в кислотной форме включает в себя: одну или более форм ВМО, воду, буфер в кислотной форме, и может дополнительно включать другие растворители и дополнительную кислоту. Другой растворитель представляет собой, например, другую жидкость, чем вода. ВМО представляет собой одно или несколько веществ из набора: оксид элемента, такого как галоген, оксоанион элемента, такого как галоген, и др. Буфер в кислотной форме представляет собой, например, одно вещество или несколько веществ из набора: фосфорная кислота, дигидрофосфат лития, дигидрофосфат другого катиона, замещенная фосфониевая кислота, буферные агенты такие как Буферы Гуда, а также любая их комбинация, способная поддерживать pH окислительного флюида на значении, благоприятном для диспропорционирования (4)-(6), например, выше 4. В устройстве буфер находится в кислотной форме во время разряда, имея pH<7. Дополнительная кислота представляет собой сильную кислоту, такую как серная кислота, трифторметансульфоновая кислота, другая сульфоновая кислота, галогеновая оксокислота, галогеновая кислота и др. В одном случае кислотная форма ВМО выступает в роли дополнительной кислоты. ВМО может быть заранее смешано с буфером в окислительном флюиде. Внутри устройства ВМО представляет собой оксид или оксокислота элемента, например, азота, ксенона, серы и др. В другом устройстве ВМО выбирается из группы, состоящей их галогенового соединения, такого как оксид галогена, галогеновая оксокислота и др., интергалогеновое соединение, соединение азота, оксид азота, оксокислота азота, оксид ксенона, оксокислота ксенона, оксид халькогена, такие как оксид серы, оксид азота или другого пниктогена, оксокислота азота или другого пниктогена, летучий оксид элемента, жидкий оксид элемента, растворимый оксид элемента и др., а также любая их комбинация.
Способы и системы, описанные здесь, расширяют выбор окислителей от одномерной серии элементов на многомерную матрицу соединений, более конкретно, на оксиды и оксокислоты галогенов, азота и других пниктогенов, серы и других халькогенов, ксенона. Иными словами, способы и системы, описываемые здесь, расширяют одномерный список элементов, таких как галогены, на многомерную матрицу оксосоединений, таких как оксиды и оксокислоты. Оксид представляет собой соединение, содержащее ки